巴西橡膠樹HbGRF基因的克隆、物理定位及表達分析
張宇航 潘冉冉 李飛 陶志強 王英 高和瓊 莊南生


摘 ?要:生長調控因子(growth-regulating factors,GRF)是植物特有的一類轉錄因子,該轉錄因子家族成員數目較多,在植物生長發育過程中發揮著重要作用。以巴西橡膠樹優良品種‘熱研7-33-97為材料,通過RT-PCR方法進行HbGRF基因的克隆;利用生物信息學的方法對其蛋白序列、理化性質、基因結構、進化關系進行分析;利用IS-PCR技術和FISH技術對其進行物理定位分析;采用qRT-PCR對橡膠樹中HbGRF基因的表達模式進行研究。結果表明:在橡膠樹雌花中克隆到3個GRF基因,分別命名為HbGRF1、HbGRF2和HbGRF3,分子量分別為65.663、41.188、52.858 kDa,其編碼的蛋白長度分別為609、384、494 aa,均為不穩定蛋白;3個基因均具有GRF完整的特征結構域WRC和QLQ,分別屬于3個不同亞族。基因物理定位結果表明,HbGRF1、HbGRF2和HbGRF3基因分別位于橡膠樹染色體的第11號長臂、第5號短臂和第9號長臂上,基因到著絲粒的平均百分距離是77.65、42.66和65.27。表達結果顯示,橡膠樹3個HbGRF基因在莖尖、雌花等生長旺盛的組織中表達量較高,用外源赤霉素和脫落酸處理后,發現表達量呈上升趨勢,經過48 h后表達量和初始值基本持平,3個基因在莖尖、雌花中有明顯的表達特異性,可能在橡膠樹花芽分化及雌花的發育過程中起到了重要作用。該結果為研究橡膠樹HbGRF基因的功能及作用機制奠定了理論基礎,為橡膠樹精準育種提供了分子細胞學依據。
關鍵詞:巴西橡膠樹;GRF基因家族;基因定位;表達分析
中圖分類號:S794.1 ? ? ?文獻標識碼:A
Abstract: Growth-regulating factor (GRF) is a plant-specific transcription factor. The transcription factor family has a large number of members and plays an important role in plant growth and development. In this study, the excellent clone ‘Reyan 7-33-97 was used as the experimental material, and the HbGRF genes were cloned by RT-PCR. The bioinformatics method was used to study its gene length, physicochemical properties, basic structure and evolutionary relationship. The physical localization analysis was carried out by in situ PCR and fluorescence in situ hybridization. The expression pattern of HbGRF genes in rubber trees was analyzed by qRT-PCR. Three GRF genes were cloned into the female flowers of rubber trees, named HbGRF1, HbGRF2 and HbGRF3, respectively. The protein length was 609 aa, 384 aa and 494 aa with molecular weight of 65.663 kDa, 41.188 kDa and 52.858 kDa, respectively, and they were all unstable protein. All the three members had the complete characteristic domains WRC and QLQ of GRF gene family. Evolutionary analysis showed that the three genes belonged to three different groups. HbGRF1, HbGRF2 and HbGRF3 were located on the long arm of chromosome 11, the short arm of chromosome 5 and the long arm of chromosome 9, and the average percentage distance between the signal site and the centromere was 77.65, 42.66 and 65.27, respectively. The expression results showed that the three HbGRF genes in rubber trees were highly expressed in the vigorous growth tissues like stem tips and female flowers. Under the treatment of exogenous GA and ABA, the expression levels of the three genes increased first, and the expression levels at 48 h were basically the same as those under the initial conditions. The three genes had obvious expression specificity in stem tips and female flowers, which may play important roles in flower bud differentiation and female flower development. This study would provide a theoretical basis and materials for further exploration of the function of HbGRF, and provide molecular cytology basis for accurate breeding of rubber trees.
Keywords: Hevea brasiliensis; GRF gene family; gene mapping; expression analysis
DOI: 10.3969/j.issn.1000-2561.2020.09.001
巴西橡膠樹(Hevea brasiliensis)屬于大戟科橡膠樹屬[1],其產生的膠乳在工業、國防等領域有著十分重要的作用。橡膠樹喜高溫、高濕的生長環境,易受極端天氣的影響,微弱的生長環境變化就會導致膠乳品質和產量的下降[2]。生長調控因子(growth-regulating factors, GRF)是一類成員數目較多的、植物特有的轉錄因子家族,參與了植物生長發育等過程的調控[3-5]。本研究通過克隆橡膠樹HbGRF基因,并進行了基因定位及表達分析,為研究橡膠樹HbGRF基因的功能及作用機制奠定了理論基礎,也為橡膠樹精準育種提供了理論指導。植物里最先被發現的GRF基因是水稻的OsGRF1,它編碼的蛋白通過調控赤霉素影響莖的伸長[6]。目前,已報道的GRF家族基因在擬南芥和水稻中分別有9個和12個成員[7-8],楊樹中有19個成員[9],番茄中有13個成員[10],陸地棉中有33個成員[11],油菜中有34個成員[12],煙草中有25個成員[13],桃樹中有10個成員[14],茶樹中有11個成員[15],藜麥中有18個成員[16]。該基因家族編碼的蛋白序列的N末端一般含有QLQ(Gln、Leu、Gln)和WRC(Trp、Arg、Cys)2個保守結構域,QLQ結構域與GRF互作因子(GRF-interacting factor, GIF)相互作用形成轉錄激活因子[17],WRC中包含一個與DNA相結合的鋅指結構和核定位信號區域(NLS),它們在基因行使其生物學功能方面起到了重要作用[7]。在植物中,GRF基因家族的成員在發育活躍的部位如花芽、根尖及幼葉中表達量較高,在成熟的部位表達量相對較低[18-19],多種GRF基因在葉和莖的生長、花的發育、胚珠形成等方面發揮了重要的作用,GRF基因還可通過負反饋調節機制在植物滲透脅迫下發揮作用[7]。目前,在楊樹、桃樹、蘋果等許多植物中已對GRF基因家族進行了鑒定及功能分析,上述研究完善了我們對GRF基因家族的認識,但該家族在橡膠樹中的研究及功能分析尚未見報道。本研究經克隆得到HbGRF基因,運用生物信息學和基因表達等方法分析HbGRF及其蛋白的基本信息,初步了解HbGRF在橡膠樹生長發育過程中的生物學功能及作用機制;利用原位PCR和熒光原位雜交技術探究HbGRF與其他功能基因之間的位置關系,這可為橡膠樹精準育種設計提供理論指導。
1 ?材料與方法
1.1 ?材料
本研究以正常生長開割10 a的巴西橡膠樹優良品種‘熱研7-33-97為材料,采集根、莖、莖尖、葉片、樹皮、果實、雌花以及不同發育時期的花序。實驗材料由中國熱帶農業科學院國家橡膠樹種質資源圃提供。
外源赤霉素(GA)和脫落酸(ABA)處理所用材料為1 a的‘熱研7-33-97組培苗,每個處理組設置5棵幼苗。GA處理:對植株噴施濃度為200 ?mol/L的GA,使用過程中以無水乙醇溶解GA后噴施處理植株,并以噴施等濃度乙醇處理的植株為對照,分別采集處理0、0.5、2、6、12、24、48 h植株與對照植株的葉片,ABA處理與GA處理方法相同。以上所有材料取樣后用液氮速凍,保存至-80 ℃冰箱中備用。
1.2 ?方法
1.2.1 ?橡膠樹HbGRF基因的克隆 ?根據GRF家族基因的保守序列,在橡膠樹基因組數據庫(http://hevea.catas.cn)中做同源序列搜索,通過CDS編碼區預測和序列拼接得到橡膠樹HbGRF1、HbGRF2、HbGRF3基因的cDNA序列。運用Primer Primer 5.0軟件進行引物設計(表1)。用反轉錄得到的橡膠樹雌花cDNA為模板,對橡膠樹HbGRF基因家族的HbGRF1、HbGRF2和HbGRF3 3個成員的編碼區進行擴增,PCR反應體系為20 ?L,其中包括Prime STAR Max Premix(2×)10 ?L,cDNA模板1 ?L,上、下游引物各0.4 ?L,滅菌的ddH2O 8.2 ?L。PCR擴增程序為:94 ℃預變性5 min;94 ℃變性30 s,56 ℃退火30 s,72 ℃延伸90 s,共擴增35個循環;最后于72 ℃延伸10 min。使用OMEGA公司的凝膠回收試劑盒對產物進行回收純化后與pMD19-T載體進行連接,轉化至大腸桿菌DH5α中,挑選陽性克隆重組子交華大基因公司測序。
1.2.2 ?橡膠樹HbGRF基因的生物信息學分析 ?HbGRF基因的編碼區序列及氨基酸序列的比對和預測分析是通過NCBI中的BLAST軟件和ORF Finder軟件完成,其所編碼蛋白的理化特性通過ExPASy ProtParam在線分析[20]。HbGRF蛋白的亞細胞定位、信號肽、編碼蛋白的跨膜區段及功能結構域預測,分別采用PSORT、SignalP、TMpred及SMART軟件進行分析。使用PredictProtein軟件對HbGRF基因家族編碼蛋白的二級結構進行預測分析。使用DNAMAN 6.0軟件對近源物種的HbGRF蛋白的氨基酸序列進行多重比對分析。使用MEGA 7.0軟件對HbGRF蛋白進行系統進化樹分析。
1.2.3 ?橡膠樹HbGRF基因在染色體上的物理定位
(1)染色體標本的制備:參照高和瓊等[21]、李懋學等[22]和張志丹等[23]的實驗方法,選取古銅期幼葉進行染色體標本的制備,于-20 ℃冰箱中保存備用。
(2)特異性引物的合成與篩選:依據克隆得到的測序結果,對序列片段進行分析,參照代素珍等[24]的方法對HbGRF基因進行合成與篩選,將PCR的退火溫度調整為45~65 ℃,通過凝膠電泳對PCR產物進行檢測,選取條帶單一、明亮的產物交華大基因公司測序,將測序結果與基因序列比對,共篩選出3對符合條件的特異性引物(表1)。
(3)原位PCR:參照官錦燕等[25]的原位PCR方法進行改進,對HbGRF1和HbGRF2基因進行檢測。
(4)熒光原位雜交:將PCR擴增得到的HbGRF3基因的擴增產物回收純化后,用地高辛切口平移試劑盒DIG-Nick Translation Mix將其標記成探針,信號位點呈現綠色;標記好的探針溶于100%去離子甲酰胺溶液中,且終濃度為50 ng/?L;將標記好的探針置于-20 ℃冰箱中避光保存備用。熒光原位雜交的方法參照本課題組邱海燕[26]報道的方法進行檢測。
(5)鏡檢與分析:將40 ?L含有DAPI染料的抗褪色劑滴加至染色體標本上進行封片,在黑暗環境中放置60 min后,使用Leica DM5000顯微鏡進行觀察與拍照;用Photoshop軟件對所拍照片進行處理,使用Image J軟件對染色體長度及信號位點距著絲粒的距離進行測量,并利用擴增信號位點百分距離的計算方法[27],結合‘熱研7-33-97的核型分析參數[28],分析和確定信號位點在染色體上的位置。
擴增信號位點的百分距離=?×100
1.2.4 ?橡膠樹HbGRF基因的表達分析 ?依據橡膠樹HbGRF基因的ORF區設計熒光定量引物,使用TIANGEN試劑盒提取RNA,用TaKaRa的反轉錄試劑盒合成cDNA第1條鏈,以各樣品的cDNA為模板,濃度統一稀釋為100 ng/?L,進行定量PCR擴增。設計熒光定量特異性引物見表1,對HbGRF基因在不同組織、不同發育時期及不同外源激素處理后的表達情況進行qRT-PCR分析,以巴西橡膠樹18S rRNA為內參,采用2ΔΔCT法進行定量分析,每個試驗設置3次重復,定量數據使用SAS 9.1.3軟件進行統計分析[29]。
2 ?結果與分析
2.1 ?橡膠樹HbGRF基因的克隆和蛋白序列分析
以巴西橡膠樹‘熱研7-33-97雌花cDNA為模板,使用特異性引物克隆得到3個片段大小分別為1830、1155、1485 bp的基因。測序后發現這3個基因片段和轉錄組測序后的序列一致,將這3個基因分別命名為HbGRF1、HbGRF2和HbGRF3,其登錄號分別為:MN396751、MN396752和MN396753。
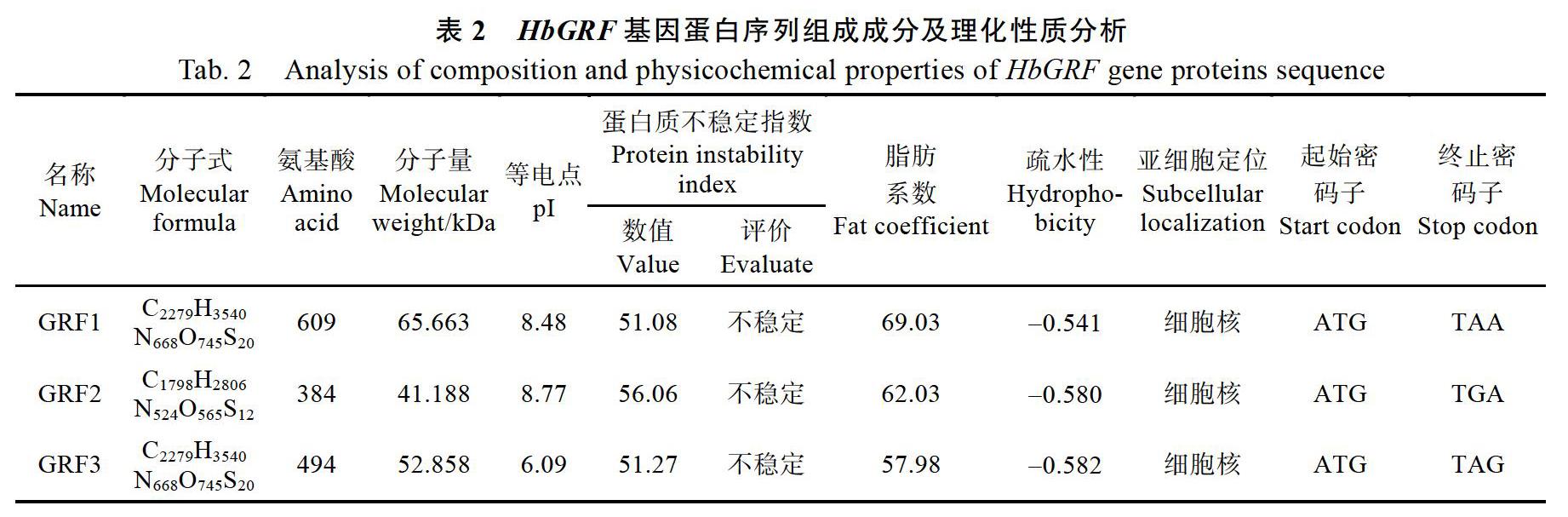
運用生物信息學方法對巴西橡膠樹3個HbGRF基因進行分析,分析結果表明其編碼384~609個氨基酸,分子量大小范圍為41.188~ 65.663 kDa,等電點為6.09~8.77,蛋白質不穩定指數為51.08~56.06,均為不穩定蛋白,脂肪系數為57.98~69.03,疏水性平均系數范圍為0.541~ 0.582(表2)。對HbGRF蛋白進行亞細胞定位分析,發現GRF蛋白均處在細胞核內,與轉錄因子的特征相符合。
通過Predict Protein在線軟件對HbGRF1、HbGRF2、HbGRF3蛋白的二級結構進行預測,結果顯示這3個蛋白都含有DNA結合區和多個蛋白結合區域(圖1),說明它們可能在轉錄過程中發揮作用。
紅色條帶:螺旋結構;藍色條帶:鏈;黃色條帶:隱藏結構;綠色條帶:無規律結構;紅色小方塊:蛋白結合區;黃色小圓圈:DNA結合區;紫色小圓圈:RNA結合區;灰色小圓圈:核苷酸結合區。
2.2 ?橡膠樹HbGRF蛋白的多重比對及進化分析
對HbGRF的蛋白序列和近緣物種如木薯(Manihot esculenta)、可可樹(Theobroma cacao)以及麻風樹(Jatropha curcas)的GRF蛋白序列進行比對。結果表明,橡膠中的3個HbGRF基因家族成員均含有QLQ和WRC保守結構域,QLQ結構域的序列是QX3LX2Q,WRC結構域的序列是CX9CX10CX2H,在橡膠HbGRF家族的3個成員中,WRC結構域比QLQ結構域更為保守(圖2),表明這3個橡膠樹HbGRF蛋白均含有特有的GRF結構域。
進一步選取木薯、可可樹、水稻、擬南芥、麻風樹等已知的GRF家族基因使用MEGA 6.1軟件構建系統進化樹。結果顯示,在植物中GRF家族基因可以分成5個亞族(Ⅰ~Ⅴ)(圖3)。其中橡膠樹的HbGRF1、HbGRF2、HbGRF3基因分別屬于Ⅰ亞族、Ⅱ亞族、Ⅳ亞族,且HbGRF1與HbGRF3基因親緣關系略近。
2.3 ?HbGRF1、HbGRF2和HbGRF3基因的物理定位分析
分別用HbGRF1和HbGRF2基因定位的特異引物與Digoxigenin-11-dUTP等配制成擴增液,在制備好的染色體標本上進行原位PCR反應和熒光檢測。在有絲分裂的間、前、中期的染色體上均能觀察到2個綠色熒光信號點(圖4,圖5)。陰性對照組中不加入Taq酶,其細胞染色體上均未出現信號(圖4D,圖5D)。對信號位點所在的中期細胞進行核型分析,得到信號位點與染色體的對應關系,以及信號位點在核型模式圖上的位置關系。結果表明,HbGRF1和HbGRF2基因分別位于第11號染色體長臂和第5號染色體短臂上,基因到著絲粒的平均百分距離分別是77.65和42.66。
用地高辛對HbGRF3基因的擴增純化產物標記為探針,隨后采用熒光原位雜交進行檢測,在有絲分裂的間、前、中期的染色體上均能觀察到2個綠色熒光信號點(圖6),陰性對照組中不加入探針,其細胞染色體上均未出現信號(圖6D)。對信號位點所在的中期細胞進行核型分析,得到信號位點與染色體的對應關系,以及信號位點在核型模式圖上的位置關系(圖7)。結果表明,HbGRF3位于第9號染色體長臂上,基因到著絲粒的平均百分距離是65.27。
2.4 ?橡膠樹HbGRF基因的表達分析
2.4.1 ?橡膠樹HbGRF基因在不同組織中的表達分析 ?為進一步研究橡膠樹HbGRF基因在生長發育過程中的作用,本研究使用qRT-PCR技術對橡膠樹根、莖、莖尖等8個組織或器官中HbGRF基因的相對表達量進行分析。由圖8可知,HbGRF1、HbGRF2和HbGRF3基因在植株8個不同部位中表達量有差異。其中,HbGRF1基因在莖尖、雌花中高調表達,在其他部位表達量較低。HbGRF2和HbGRF3基因在莖尖中顯著高調表達,在雌花中的表達量也比別的部位高。由此推測HbGRF1、HbGRF2和HbGRF3基因可能參與橡膠樹花芽分化及雌花的發育過程。
2.4.2 ?橡膠樹HbGRF基因在不同發育時期花序中的表達分析 ?對橡膠樹HbGRF基因在花蕾期(花序長度約為3 cm)、伸展期(花序長度約為6 cm)、盛花期(花序長度約為9 cm)和開花末期(花序長度約為12 cm)等4個花序發育階段的表達情況進行分析,結果表明,在伸展期,HbGRF1、HbGRF2和HbGRF3基因的表達量最高,由此推測HbGRF基因在生長發育較為活躍的部位表達較強(圖9)。
2.4.3 ?橡膠樹HbGRF基因在外源激素處理下的表達分析 ?使用外源赤霉素對橡膠樹幼葉進行處理后,HbGRF1和HbGRF2在處理后0.5 h、HbGRF3在處理后6 h時,其表達量最高;使用外源脫落酸處理時發現,3個基因均在處理后0.5 h時,表達量達到了最高值。當2種外源激素處理后48 h時,3個基因的表達量和初始條件下的表達量基本相同(圖10)。
3 ?討論
GRF基因家族是一類成員數目較多的轉錄因子家族,該轉錄因子對植物的生長發育過程具有重要的調控作用。目前,GRF基因家族在水稻、擬南芥、楊樹、番茄、陸地棉、油菜、煙草、桃樹、茶樹、藜麥等多種植物中已有研究,但對于具有重要戰略意義的橡膠樹GRF基因的相關研究仍缺乏進一步的報道。本研究從橡膠樹中克隆到3個HbGRF基因,首先對其進行生物信息學與表達模式等分析,再使用原位PCR技術和熒光原位雜交技術對基因進行了物理定位分析,試圖從分子生物學及細胞學的角度對功能基因進行較為全面的研究。
伴隨基因組測序技術的發展與完善,Livak等[29]對橡膠樹‘熱研7-33-97的全基因組進行了測序,這對橡膠樹基因家族的分析與鑒定、功能基因的挖掘與研究都提供了很多便利,預測了43 792個蛋白編碼基因,其中包括7個預測的橡膠樹GRF基因,較為符合一般植物中GRF基因家族含有8~20個成員的規律。本研究根據擬南芥GRF的2個保守序列QLQ和WRC,在橡膠數據庫搜索到7個基團,然后設計引物,以橡膠樹總cDNA為模板進行擴增,結果顯示,只擴增出3個基因,推測可能是其他基因的豐度比較低等原因造成。將本研究中擴增的3個HbGRF基因和預測的7個橡膠樹GRF基因的序列比對,結果發現HbGRF1配對序列的一致性為99.84%,其余均完全比對,說明該比對結果與Tang等[30]的預測結果一致。
對3個HbGRF基因的氨基酸序列進行分析,結果發現3個成員均含有QLQ和WRC 2個保守結構域,且WRC結構域的特異性較高,這與藜麥、茶樹等植物中的研究相一致。對橡膠樹與其他植物GRF的系統進化分析表明,可將GRF分為5個亞族,其中HbGRF1與MeGRF1、HbGRF2與JcGRF3、HbGRF3與AtGRF8親緣關系較近,基因之間的親緣關系越接近,其功能可能也越類似。如擬南芥中的AtGRF8基因在花的發育中具有重要的調控作用,尤其是在花器官發育后期。HbGRF3基因在橡膠樹雌花中的表達量相對較高,由此推測橡膠樹HbGRF3基因在花的發育過程中起重要的調控作用。
前人研究結果表明,GRF基因家族的成員在發育活躍的器官或組織中表達量較高,在成熟的組織或器官中表達量相對較低。在茶樹中CsGRF在生長比較旺盛的組織尤其是芽葉中起到了重要的調控作用[15]。在油菜中BnGRF可調控花器官的發育[31]。本研究對3個HbGRF基因在不同部位的表達情況分析發現,它們在莖尖及雌花中的表達量相對較高,推測這3個基因參與了調控橡膠樹花芽分化以及雌花發育的過程。對HbGRF在花序不同發育時期的表達量進行分析發現,其在伸展期表達量最高,符合GRF轉錄因子的特點,但在開花末期,3個基因的表達量也相對較高,出現這一現象的原因及機制尚不明確,需要進行更深入的研究。在實際生產實踐過程中,橡膠樹座果率較低,一般為5%~8%,最高不超過10%,這是橡膠樹常規育種工作效率較低的原因之一。赤霉素信號途徑在調控植物株高、開花方面有著重要的作用,脫落酸信號途徑在植物多種生理反應及基因的脅迫應答方面具有重要的調控作用。前人的研究發現,蘋果樹MdGRF基因可能在外源激素作用下調控蘋果樹的生長,在調控嫁接到矮化砧木上接穗的生長以及2個品種節間伸長等過程中有著重要的作用[32]。本研究用外源赤霉素和外源脫落酸對橡膠樹進行處理后發現,其表達量在處理后0.5~6 h內達到最高,在外源激素處理后48 h時,3個基因的表達量回落到初始水平,表明HbGRF1、HbGRF2和HbGRF3受赤霉素和脫落酸處理的調控。
基因定位的結果表明,HbGRF1、HbGRF2和HbGRF3定位在3條不同的染色體上,它們之間可能相互獨立,結合本課題組已報道的橡膠樹其他功能基因的定位結果可以得知,HbGRF1與OVP-10390[33]、Hevb7[34]同時位于第11號染色體上;HbGRF2與HbMyb1[35]、HbN1N1[36]、HbNAC1[37]、HbPEPRK2[24]、HblMAC4[38]同時位于第5號染色體上;HbGRF3與HbCPT[39]、HbJAZ5[40]、HbNAC3[37]、HblMYC2、HblMYC5[38]、HbWRKY1、HbWRKY4、HbWRKY5[41]同時位于第9號染色體上。這些定位在相同染色體上的基因間可能存在互為連鎖的關系。研究功能基因之間的相互關系對了解這些基因間可能存在的遺傳關系提供了幫助,這些結果可以為橡膠樹精準育種設計提供理論指導。
參考文獻
[1] 劉少軍, 周廣勝, 房世波.中國橡膠樹種植氣候適宜性區劃[J]. 中國農業科學, 2015, 48(12): 2335-2345.
[2] 劉金河. 巴西橡膠樹的水分狀況與生長和產膠量的關系[J]. 生態學報, 1982(3): 217-224.
[3] Chen Y Z, Cao J. Comparative analysis of Dof transcription factor family in maize[J]. Plant Molecular Biology Reporter, 2015, 33(5): 1245-1258.
[4] Hoe Kim J, Tsukaya H. Regulation of plant growth and development by the GROWTH-REGULATING FACTOR and GRF-INTERACTING FACTOR duo[J]. Journal of Experimental Botany, 2015, 66(20): 6093-6107.
[5] Schwechheimer C, Bevan M. The regulation of transcription factor activity in plants[J]. Trends in Plant Science, 1998, 3(10): 378-383.
[6] Knaap E V D, Kende K H. A novel gibberellin-induced gene from rice and its potential regulatory role in stem growth[J]. Plant Physiology, 2000, 122(3): 695-704.
[7] Kim J H, Choi D, Kende H. The AtGRF family of putative transcription factors is involved in leaf and cotyledon growth in Arabidopsis[J]. The Plant Journal, 2003, 36(1): 94-104.
[8] Dongsu C, Hoe K J, Hans K. Whole genome analysis of the OsGRF gene family encoding plant-specific putative tran-scription activators in rice (Oryza sativa L.)[J]. Plant and Cell Physiology, 2004, 45(7): 897-904.
[9] 周厚君. 楊樹GRF基因家族分析及PtGRF1/2d功能研究[D]. 北京: 中國林業科學研究院, 2016: 26-35.
[10] 袁 ?岐, 張春利, 趙婷婷, 等. 番茄GRF轉錄因子家族的生物信息學分析[J]. 分子植物育種, 2017, 15(8): 2949-2956.
[11] 張書芹, 樂 ?愉, 武 ?斐. 陸地棉GRF基因家族的鑒定和生物信息學分析[J]. 分子植物育種, 2019, 17(12): 3817-3824.
[12] 阮先樂, 王俊生, 劉紅占, 等. 油菜GRF基因家族的鑒定和基本特征分析[J]. 分子植物育種, 2018, 16(8): 2420-2428.
[13] Zhang J, Li Z, Jin J, et al. Genome-wide identification and analysis of the growth-regulating factor family in tobacco (Nicotiana tabacum)[J]. Gene, 2018, 639: 117-127.
[14] 曹 ?珂, 薛靈姿, 王 ?蛟, 等. 桃GRF基因家族的序列及其組織特異性表達分析[J]. 植物遺傳資源學報, 2018, 19(3): 578-586.
[15] 王鵬杰, 鄭玉成, 林 ?浥, 等. 茶樹GRF基因家族的全基因組鑒定及表達分析[J]. 西北植物學報, 2019, 39(3): 413-421.
[16] 時丕彪, 何 ?冰, 費月躍, 等. 藜麥GRF轉錄因子家族的鑒定及表達分析[J]. 作物學報, 2019, 45(12): 1841-1850.
[17] Kim J H, Kende H. A transcriptional coactivator, AtGIF1, is involved in regulating leaf growth and morphology in Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(36): 13374-13379.
[18] Ma J Q, Jian H J, Yang B, et al. Genome-wide analysis and expression profiling of the GRF gene family in oilseed rape (Brassica napus L.)[J]. Gene, 2017, 620: 36-45.
[19] Zheng L W, Zhao C D, Mao J P, et al. Genome-wide identification and expression analysis of brassinosteroid biosynthesis and metabolism genes regulating apple tree shoot and lateral root growth[J]. Journal of Plant Physiology, 2018, 231: 68-85.
[20] Elisabeth G, Alexandre G, Christine H, et al. ExPASy: The proteomics server for in-depth protein knowledge and analysis[J]. Nucleic Acids Research, 2003, 31(13): 3784-3788.
[21] 高和瓊, 王 ?英, 金 ?鴿, 等. 橡膠樹葉片染色體制片方法的優化[J]. 熱帶作物學報, 2009, 30(5): 565-569.
[22] 李懋學, 張贊平. 作物染色體及其研究技術[M]. 北京:中國農業出版社, 1996: 30-34.
[23] 張志丹, 王 ?英, 莊南生, 等. 巴西橡膠樹染色體制片方法的改良及FISH信號檢測[J]. 基因組學與應用生物學, 2019, 38(6): 2713-2717.
[24] 代素珍, 莊南生, 王 ?英, 等. 巴西橡膠樹HbPEPRK基因家族5個成員在染色體上的定位[J]. 基因組學與應用生物學, 2019, 38(7): 3155-3160.
[25] 官錦燕, 王 ?英, 高和瓊, 等. 巴西橡膠樹4個環鋅指蛋白基因(HbRZF)的物理定位[J]. 基因組學與應用生物學, 2014, 33(3): 610-616.
[26] 邱海燕. 巴西橡膠樹REF、RT和SRPP基因物理定位的研究[D]. 海口: 海南大學, 2010.
[27] Song Y C, Gustafson J P J T, Genetics A. The physical location of fourteen RFLP markers in rice (Oryza sativa L.) [J]. Theoretical and Applied Genetics, 1995, 90(1): 113-119.
[28] 高和瓊, 莊南生, 王 ?英, 等. 橡膠樹兩個品種的核型分析[J]. 武漢植物學研究, 2009, 27(5): 537-540.
[29] Livak K J, Schmittgen T D. Analysis of relative gene ex-pression data using real-time quantitative PCR and the 2–CT method[J]. Methods, 2000, 25(4): 402-408.
[30] Tang C R, Yang M, Fang Y J, et al. The rubber tree genome reveals new insights into rubber production and species ad-aptation[J]. Nature Plants, 2016, 2(6): 16073
[31] Ma J Q, Jian H J, Yang B, et al. Genome-wide analysis and expression profiling of the, GRF, gene family in oilseed rape (Brassica napus L.) [J]. Gene, 2017, 620: 36-45.
[32] Zheng L W, Ma J J, Song C H, et al. Genome-wide identification and expression analysis of GRF genes regulating apple tree architecture[J]. Tree Genetics & Genomes, 2018, 14(4): 54-60.
[33] 高和瓊. 巴西橡膠樹HbMyb1基因和OPV-10390連鎖標記原位PCR定位的研究[D]. 海口: 海南大學, 2008: 26-44.
[34] 高佳佳. 巴西橡膠樹幾個與橡膠合成相關基因的物理定位研究[D]. 海口: 海南大學, 2014: 26-28.
[35] 高和瓊, 莊南生, 王 ?英, 等. 巴西橡膠樹HbMyb1基因的原位PCR物理定位[J]. 熱帶亞熱帶植物學報, 2012, 20(4): 365-368.
[36] 高佳佳, 王 ?英, 高和瓊, 等. 巴西橡膠樹膠乳轉化酶HbNIN基因家族物理定位的研究[J]. 熱帶作物學報, 2014, 35(9): 1704-1709.
[37] 楊光涌, 鄭 ?菲, 王 ?英, 等. 巴西橡膠樹NAC基因家族5個成員的熒光原位雜交物理定位[J]. 分子植物育種, 2018, 16(2): 512-517.
[38] 高 ?豫, 莊南生, 王 ?英, 等. MYC基因家族5成員在巴西橡膠樹染色體上的物理定位[J]. 熱帶生物學報, 2018, 9(2): 163-169.
[39] 張新新. 巴西橡膠樹4個膠乳生物合成相關基因的物理定位研究[D]. 海口: 海南大學, 2013: 33-45.
[40] 李曉燕, 蘇莉莉, 高佳佳, 等. JAZ基因家族6個成員在橡膠樹上的物理定位[J]. 分子植物育種, 2017, 15(12): 4992-4999.
[41] 劉正林, 莊南生, 王 ?英, 等. 巴西橡膠樹HbWRKY基因家族10個成員在染色體上的定位[J]. 植物遺傳資源學報, 2018, 19(6): 1170-1179.

