高壓均質對大豆分離蛋白-大豆異黃酮相互作用及其復合物功能性質的影響
王 娜,吳長玲,陳凡凡,李 楊,滕 飛
(東北農業大學食品學院,黑龍江 哈爾濱 150030)
高壓均質是一種非熱能技術,它不僅能夠誘導蛋白質分子的構象發生變化并改變其理化性質,從而導致這些蛋白質的功能性質(如溶解性、乳化性、起泡性和凝膠化性)得到改善,還具有開發食品工業新產品的潛力,因此得到廣泛的應用[1]。李楊等[2]研究了不同處理條件對大豆分離蛋白(soybean protein isolate,SPI)-磷脂酰膽堿相互作用的影響,發現高壓均質具有比超聲更為顯著的效果。大豆蛋白作為植物蛋白的主要來源,可提供良好的營養價值和功能特性。它不僅具有優異的凝膠特性、乳化能力、持水性和持油性,還含有一定的益生成分,可以降低患有高膽固醇、高脂血癥和心血管疾病的風險[3]。大豆異黃酮(soybean isoflavone,SI)作為一種酚類化合物,是大豆的重要食物成分,其已被證明具有降低與年齡相關激素疾病風險,包括癌癥、更年期癥狀和骨質疏松癥的功能[4]。
蛋白質和多酚共存于食品基質中,主要通過疏水相互作用以及氫鍵相互作用締合成復合物[5]。蛋白質-多酚復合物的形成一方面影響蛋白質的結構、功能和營養特性;另一方面,又對食品中酚類化合物的抗氧化能力和生物利用度產生積極的影響。Chen Gang等[6]研究了SPI與茶多酚在不同高壓條件下的相互作用,發現SPI溶解度從0.258 mg/mL提高到0.5 mg/mL,乳化活性是天然SPI的3 倍。Ren Cong等[7]研究了熱處理對SPI-多酚(黑大豆種皮提取物)復合物的影響,結果表明多酚有助于抑制SPI熱聚集,并且形成的復合物顯示出強烈的自由基清除能力。研究發現,SPI和分離的SI用作膳食補充劑有助于緩解骨質疏松癥[8]。近幾年,SI對幾種慢性疾病的治療與預防已成為研究的焦點。然而,關于SPI-SI復合物特有的物理化學和功能特性的應用還有待探索。
因此,本實驗探討不同均質壓力(40、80 MPa和120 MPa)對不同質量比的SPI-SI復合物結構和功能影響,并確定最佳的處理條件,以更好地了解酚類化合物-蛋白質相互作用關系,為SPI-SI復合物在食品開發中的應用提供理論參考。
1 材料與方法
1.1 材料與試劑
SPI(蛋白質量分數89.21%) 黑龍江哈爾濱農業有限責任公司;SI(異黃酮質量分數80%) 上海源葉生物科技有限公司;Lowry法測定溶解度試劑盒上海荔達生物科技有限公司;十二烷基硫酸鈉(sodium dodecyl sulfate,SDS) 北京新光化工試劑廠;其余試劑為分析純。
1.2 儀器與設備
ULTRA-TURRAX UTL2000高壓均質機 上海標本模型有限公司;PHS-3C型pH計 上海儀電科學儀器有限公司;AL204型分析天平 梅特勒-托利多儀器(上海)有限公司;GL-20G-II高速冷凍離心機 上海安亭科學儀器廠;Mastersizer 2000激光粒度儀 英國馬爾文儀器有限公司;ZetaPALS-Zeta電位儀 美國布魯克海文儀器公司;F2000熒光光譜儀 日本日立公司;MAGNA-IR560傅里葉變換紅外光譜(Fourier transform infrared spectrometer,FTIR)儀 美國Thermo儀器股份有限公司。
1.3 方法
1.3.1 高壓均質處理SPI-SI復合體系
準確稱取2 g的SPI以及0.04 g和0.4 g的SI樣品分別分散在100 mL去離子水中,使SPI的質量濃度為20 mg/mL,S I 的質量濃度分別為0.4 m g/m L 和4 m g/m L。2 5 ℃下攪拌2 h 制備S P I 和S I 溶液,4 ℃下過夜以完全水合。將SPI溶液與SI溶液混合,并加入NaN3(0.2 mg/mL)以抑制細菌的生長,pH值調節至7.0,使最終樣品含有10 mg/mL SPI和0.2 mg/mL或2 mg/mL SI。以單獨的SPI(10 mg/mL)作為對照,分別在均質壓力40、80、120 MPa下均質2 次,制備出不同的復合物(表1),置于4 ℃條件下貯藏。將部分溶液凍干,凍干后的樣品置于干燥器中保存。
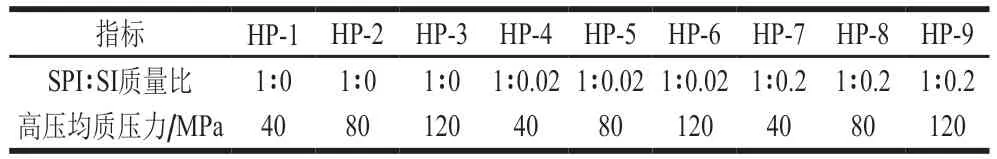
表1 不同處理樣品編號Table 1 Numbers of SPI:SI mixtures subjected to high pressure homogenization at different pressures
1.3.2 粒徑分布的測定
參照文獻[9]的方法,使用動態光散射技術測定復合物的粒度分布。在分析之前,將復合物在磷酸鈉緩沖液中稀釋1 000 倍,以防止多次散射,復合物顆粒的折射率為1.46,分散介質的折射率為1.33,每個樣品重復測定3 次。
1.3.3 Zeta電位的測定
將復合物溶液在0.01 mol/L pH 7.0的磷酸鹽緩沖液中稀釋1 000 倍,之后將其注入ZetaPALS-Zeta電位儀中進行測定,每個樣品重復測定3 次。
1.3.4 FTIR分析
參照文獻[10]的方法進行FTIR分析,將1 mg冷凍干燥樣品與150 mg的KBr粉末混合,壓片后在室溫下記錄FTIR。設定掃描波數范圍400~4 000 cm-1,分辨率設定為4 cm-1,掃描32 次。
1.3.5 紫外光譜分析
參照文獻[11]的方法進行紫外光譜分析,將復合物分別溶于0.01 mol/L pH 7. 0磷酸鹽緩沖液,使蛋白質量濃度為0.2 mg/mL,波長范圍在200~400 nm之間,分辨率為0.5 nm,掃描速率為50 nm/min,重復掃描3 次記錄平均值,經Origin 8.5軟件微分化獲得紫外吸收曲線。
1.3.6 熒光光譜分析
參照文獻[12]的方法,使用熒光分光光度計在25 ℃下進行分析。激發波長為280 nm,發射波長為300~500 nm。激發和發射狹縫寬度均為5 nm。
1.3.7 熒光猝滅分析
參照文獻[13]的方法,在SI質量濃度為0、1、2、3、4、5 μg/mL,恒定的SPI質量濃度(0.5 mg/mL)下分別測定蛋白質內在熒光強度。激發波長為280 nm,發射波長為300~500 nm。激發和發射狹縫寬度均為5 nm。
1.3.8 溶解性的測定
參照文獻[14]測定SPI溶解性,高壓均質處理后,將樣品溶液倒入離心管,然后在25 ℃下12 000×g離心20 min。上清液經適當稀釋后,使用Lowry法測定上清液蛋白質含量,并以牛血清白蛋白作為標準。蛋白質溶解度為上清液中蛋白含量與樣品中總蛋白含量的比例。
1.3.9 表面疏水性的測定
參照文獻[15]的方法,使用ANS作為熒光探針測定復合物的H0。將樣品分散在磷酸鹽緩沖液(0.01 mol/L、pH 7.2)中,稀釋至0.1~1.0 mg/mL。此后,將10.0 μL 8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)(4 mg/mL)加入到4.0 mL稀釋的蛋白質溶液中。使用分光光度計在370 nm的激發波長和470 nm的發射波長下測定熒光強度。通過線性回歸分析計算熒光強度對蛋白質濃度的回歸方程,曲線的初始斜率即為蛋白質的表面疏水性。
1.4 數據統計分析
本實驗數據均平行、重復測定3 次,采用SPSS 22.0軟件中方差分析法進行差異顯著性分析,以P<0.05表示差異顯著,通過Origin 9.1軟件作圖,采用Peak fitting 4.12軟件對紅外吸收曲線進行擬合處理。
2 結果與分析
2.1 高壓均質對SPI-SI復合物粒徑的影響
由圖1可知,對于添加相同質量濃度的SI,復合物粒徑也隨著均質壓力的增加而減小,這是由于較高的壓力導致較高的剪切速率,從而造成粒徑減小。在相同均質壓力下,對于SPI-SI復合物(1∶0.02),具有較小的粒徑且小于單獨的SPI,可能主要是SPI在高壓均質前保持天然狀態,并且大多數疏水結構域埋在核心內,高壓導致蛋白質結構發生解折疊,暴露出疏水氨基酸殘基,并且解開多肽鏈[16],SPI和SI之間的疏水相互作用大大增強,并且產生了更緊湊的復合物,這可以通過FTIR結果進一步證實;對于SPI-SI復合物(1∶0.2),復合物顆粒尺寸較大,且分布范圍寬,這可能是SI的質量濃度過高,使得兩個肽分子形成了SI包被的二聚體,形成的聚集體導致顆粒尺寸輕微增大。O’sullivan等[17]研究乳清蛋白與綠茶多酚復合時發現,復合物顯示尺寸隨著多酚濃度的增加而增加。這種現象可以解釋為多酚可以作為蛋白質分子的橋接劑,隨著多酚濃度的增加,導致形成更大的復合物。
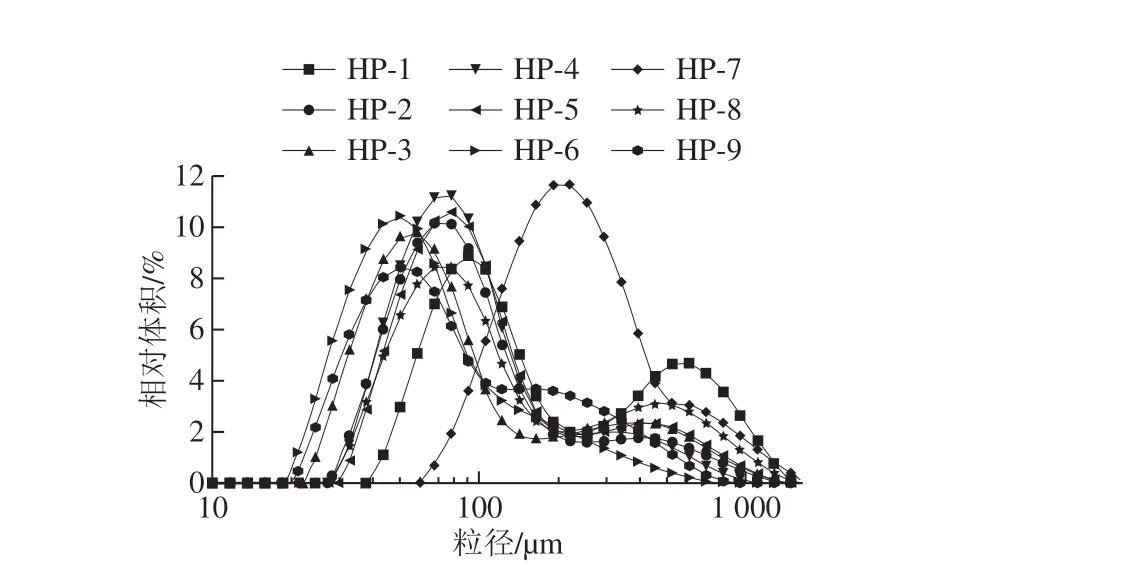
圖1 不同高壓均質條件下SPI和SPI-SI復合物的粒徑分布Fig. 1 Particle size distribution of SPI and SPI-SI complex under different homogenization pressures
圖2為不同高壓均對體積平均粒徑(D[4,3])的影響。隨著均質壓力的增加,樣品粒徑減小,其中HP-6具有最小的D[4,3],為182.8 μm。在相同均質壓力條件下,SPI-SI(1∶0.02)復合物顯示出較小的D[4,3],這與粒徑分布結果一致。
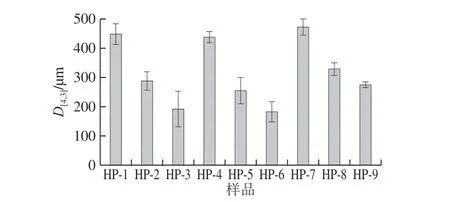
圖2 不同高壓均質條件下SPI和SPI-SI復合物的D[4,3]Fig. 2 D[4,3] of SPI and SPI-SI complexes under different homogenization pressures
2.2 高壓均質對SPI-SI復合物Zeta電位的影響
圖3 不同高壓均質條件下SPI和SPI-SI復合物的Zeta電位Fig. 3 Zeta potential of SPI and SPI-SI compounds under different homogeneous pressures
膠體顆粒表面的電荷是評判懸浮顆粒分散和聚集的重要指標。具有低電位絕對值的聚合物傾向于凝聚或絮凝,而具有高電位絕對值的溶液是穩定的[18]。圖3顯示了不同高壓均質條件下處理SPI和SPI-SI復合物的Zeta電位。對于單獨的SPI,經40 MPa高壓均質處理后,Zeta電位絕對值約為3.24 mV。當壓力增加到120 MPa時,Zeta電位絕對值達到最大值7.51 mV。高壓均質處理SPI Zeta電位絕對值顯著提高,表明具有更大的電負性。
通過添加SI進一步增加了復合物的Zeta電位絕對值。結果表明,SI可能包圍蛋白質分子表面,改變了蛋白質的表面電荷分布,進一步增強了顆粒間的靜電排斥,導致膠體聚集體破壞,防止進一步聚集,提高了分散體的穩定性。在120 MPa下,Zeta電位絕對值降低,可能是由于蛋白質溶解度的降低。當SI質量濃度增加至0.2 mg/mL時,觀察到Zeta電位絕對值出現明顯下降趨勢,這種趨勢可能是由于在均質過程中電荷重排,SPI聚集體的形成引起一些帶電基團可能埋在蛋白質內部并且對表面電荷沒有貢獻[19]。
2.3 復合物FTIR分析結果
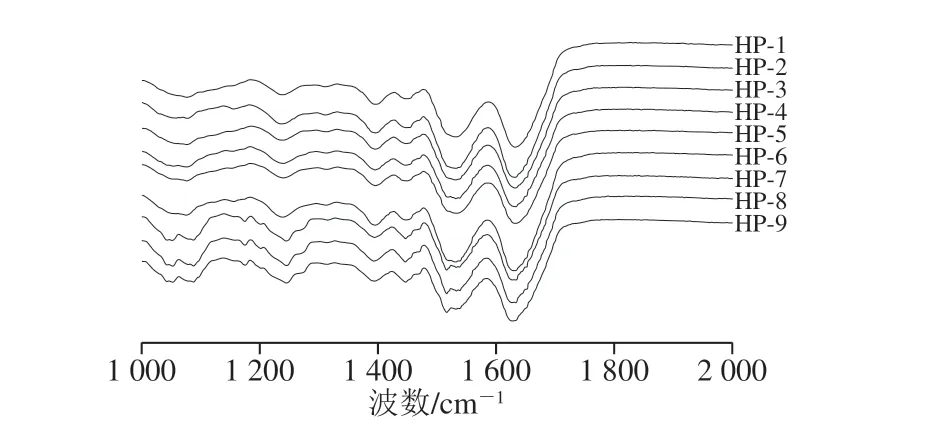
圖4 不同高壓均質條件下SPI和SPI-SI復合物的FTIR圖Fig. 4 FTIR spectra of SPI and SPI-SI complex under differenthomogenization pressures
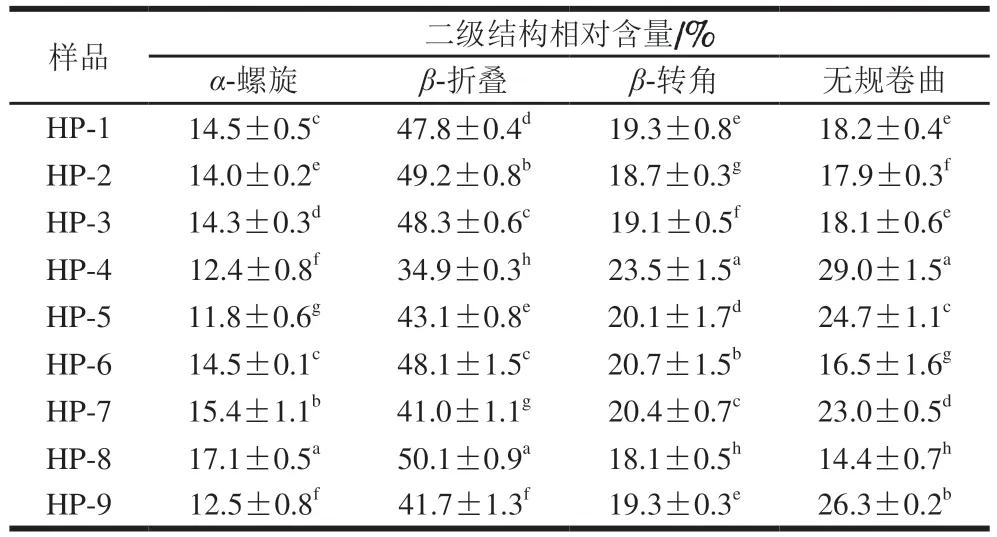
表2 不同高壓均質下的SPI和SPI-SI二級結構相對含量Table 2 Relative contents of secondary structures in SPI and SPI-SI complex under different homogenization pressures
蛋白質的紅外光譜擁有多個特征吸收譜區域組成,其中酰胺I區波數范圍是1 600~1 700 cm-1。主要由C=O伸縮振動引起,其主要對蛋白質的二級結構敏感[20]。高壓均質處理后,SPI的FTIR光譜圖如圖4所示,FTIR光譜可以靈敏地反映肽鏈結構的變化。根據FTIR數據擬合過程的蛋白質二級結構的變化如表2所示。從40 MPa升高到80 MPa時,α-螺旋相對含量降低(HP-7和HP-8除外),β-轉角和無規卷曲相對含量顯著下降,β-折疊相對含量逐漸升高。α-螺旋是蛋白質結構中最穩定的結構,其含量降低表明適宜的高壓均質壓力可以改變蛋白質的二級結構,蛋白質的空間結構變得更加拉伸,可能會影響SPI與其他物質的結合程度。據報道,β-折疊含量的增加表明負責疏水相互作用的蛋白質位點暴露,從而導致蛋白質表面疏水性的增強[21],這在蛋白質表面疏水性分析中得到進一步證實。但在120 MPa下,呈現α-螺旋含量升高(HP-7和HP-8除外),β-轉角含量顯著上升。這種現象表明高壓均質處理處理改變了SPI的氫鍵,導致不同二級結構之間的轉化。
2.4 復合物溶液紫外光譜分析結果
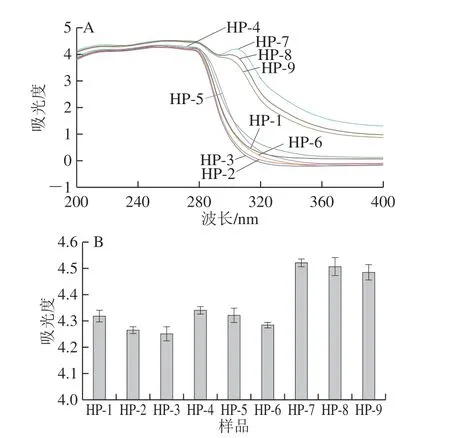
圖5 不同高壓均質條件下SPI和SPI-SI復合物的紫外光譜(A)和最大吸光度(B)Fig. 5 Ultraviolet spectra (A) and maximum absorbance (B) of SPI and SPI-SI complex under different homogenization pressures
色氨酸、酪氨酸、苯丙氨酸和含硫氨基酸在230~310 nm的波長范圍內具有吸收峰。其中,色氨酸、酪氨酸和苯丙氨酸由于其不同的顏色組而具有不同的吸收光譜。色氨酸和酪氨酸殘基的共軛雙鍵在280 nm波長處具有吸收峰[22]。如圖5B所示,隨著均質壓力的增加,樣品的最大吸光度下降,這可能是由于高壓均質處理導致蛋白質結構發生解折疊,使更多的發色團轉移到蛋白質表面,從而降低紫外吸收。隨著SI質量濃度的增加,紫外吸收光譜最大吸收峰從254 nm到262 nm,發生了紅移(圖5A),說明蛋白質的構象發生了變化。這可能是由于SPI和SI的相互作用影響了蛋白質分子的微環境,使更多芳香族氨基酸殘基附近微環境親水性增強,從而導致不同高壓均質處理SPI-SI復合物結構的不同。此外,可以推測SPI-SI的猝滅機理是靜態猝滅,因為動態猝滅僅影響猝滅分子的激發態,而不會改變猝滅物質的吸收光譜[23]。
2.5 復合物溶液熒光光譜分析結果
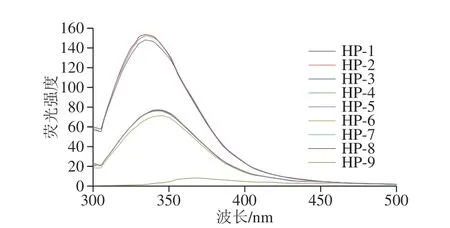
圖6 不同高壓均質條件下SPI和SPI-SI復合物的熒光光譜Fig. 6 Fluorescence spectra of SPI and SPI-SI complex under different homogenization pressures
內源性熒光特性是因為蛋白質內部含有不同的發色基團,主要是芳香族氨基酸,常用于監測蛋白質三級結構構象的變化。當在280 nm波長處激發時,蛋白質的熒光光譜主要歸因于Tyr和Trp殘基的熒光發射[24]。圖6為高壓均質處理后SPI和SPI-SI復合物的熒光光譜。與40 MPa相比,均質壓力為120 MPa明顯降低了SPI的熒光強度,已有研究已經證明Lys、His和Cys殘基具有猝滅Trp和Tyr殘基熒光的能力[25],高壓均質處理可使這些殘基更接近Trp和Tyr殘基。另外本研究還發現,隨著壓力增加,導致最大波長發生輕微的紅移,這些結果表明,SPI中Trp和Tyr殘基附近微環境親水性增強,高壓均質也改變了蛋白質的構象。
蛋白質熒光的變化與Trp周圍氨基酸殘基的移動有關。如圖6所示,與單獨SPI相比,高壓均質處理后SPI-SI的熒光強度明顯降低,證實了SI對熒光的猝滅作用,可能由于高壓均質處理使更多的Try和Tyr殘基暴露,從而增強了與SI的芳香環的疏水相互作用,這導致Trp和Tyr熒光的更強猝滅。另外,隨著SI質量濃度的增加,熒光強度明顯下降,可能是經過高壓均質處理產生的松散肽處于熱力學不穩定狀態并且傾向于通過疏水相互作用與更多SI締合,從而具有較高的聚集程度,這可以從顆粒尺寸中證實[26]。很明顯,添加SI后,復合物的最大峰位置略微紅移,表明Trp和Tyr處于極性更強的環境,這可能與壓力引起的SPI二級結構的改變有關,或者可能歸因于SI分子中的苯環[27]。
2.6 熒光猝滅機理分析
根據Stern-Volmer方程(式(1))計算不同溫度條件下的猝滅常數,從而可以初步判斷該反應的熒光猝滅機制。
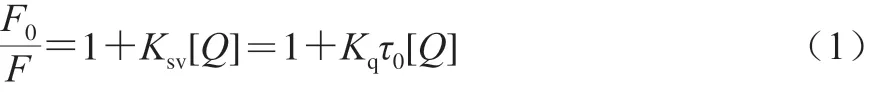
式中:F0和F分別是SPI中未加入和加入猝滅劑時的熒光強度;[Q]是猝滅劑質量濃度/(μg/mL);KSV是猝滅常數/(L/mol);Kq是雙分子猝滅速率常數/(L/(mol·s));τ0為不存在猝滅劑時熒光體的壽命,生物大分子的平均壽命約為10-8s[8]。
因此,可通過F0/F對[Q]的線性回歸確定KSV。熒光猝滅可進一步分類為動態或靜態猝滅。對于靜態猝滅,猝滅數據可以根據修改的Stern-Volmer方程(式(2))來分析。
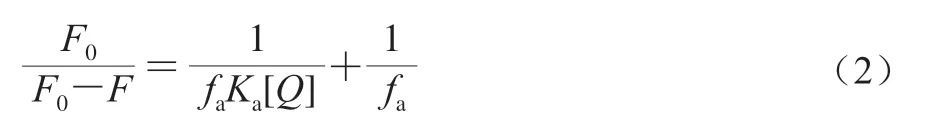
式中:fa是蛋白質(熒光基團)是可接近熒光的分數;Ka是可獲得熒光基團的猝滅常數/(L/mol),其可作為猝滅劑和受體之間的結合常數。
通過F0/(F0-F)和1/[Q]之間的線性回歸,能夠確定1/faKa(斜率)和1/fa(截距),因此可求得Ka。
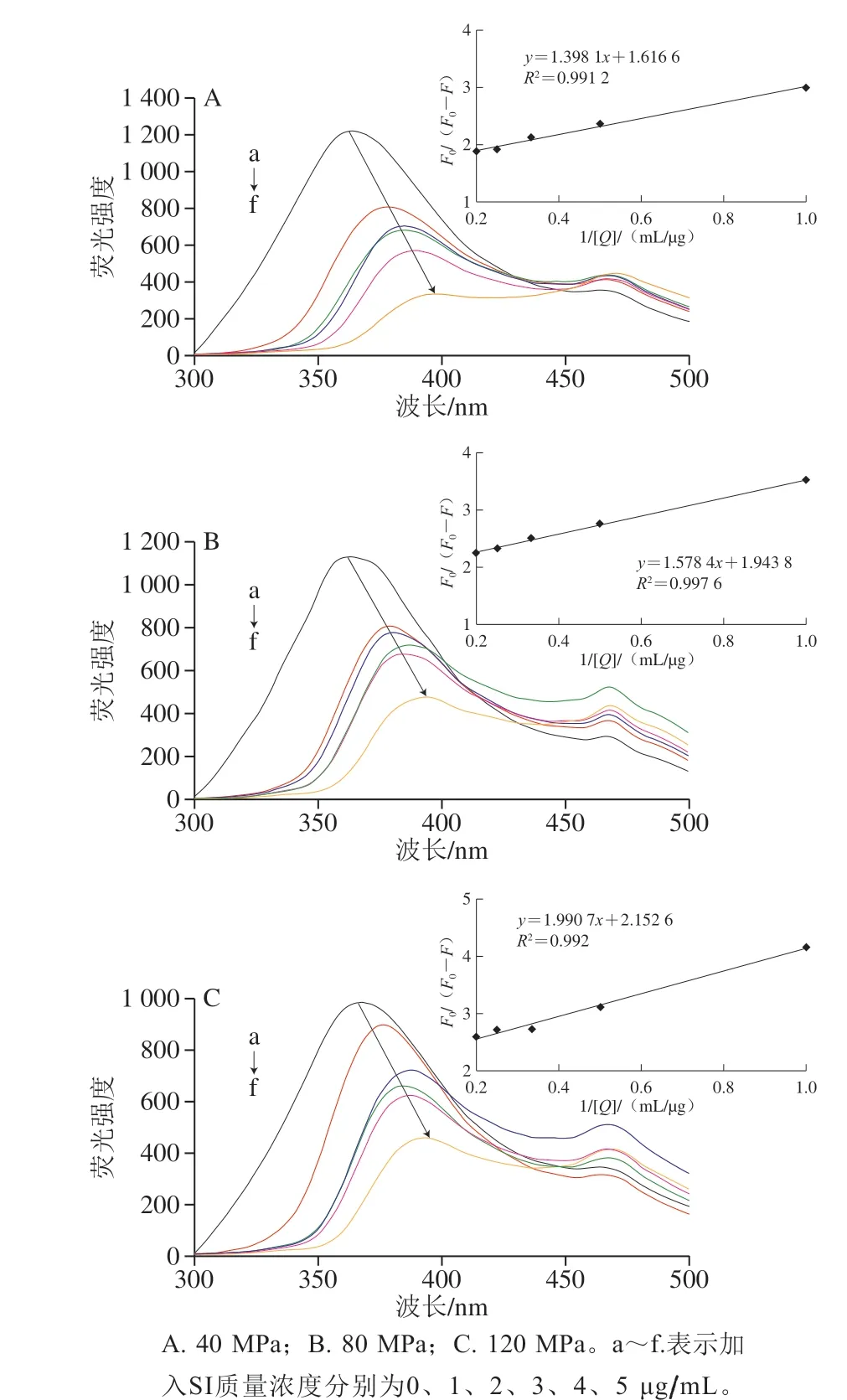
圖7 不同均質壓力下SI對SPI的熒光光譜影響Fig. 7 Fluorescence spectra of SPI-SI complex under different homogenization pressures
熒光猝滅法用于進一步研究SPI和SI之間的結合反應。蛋白質的固有熒光光譜對疏水性殘基發色團(例如Trp或Tyr)的環境變化非常敏感,在280 nm的激發波長下,蛋白質的固有熒光發射主要來自其Trp殘基[22]。如圖7所示,可以看出在沒有SI存在時,樣品顯示出最強的熒光強度。隨著SI的質量濃度增加,SPI的最大熒光強度逐漸降低,且出現明顯的紅移,表明SPI與SI之間存在明顯的相互作用,SPI空間構象發生改變。紅移表明Trp殘基微環境親水性增強。在SPI-花青素相互作用和SPI-白藜蘆醇相互作用中也觀察到類似的熒光現象[13,28]。
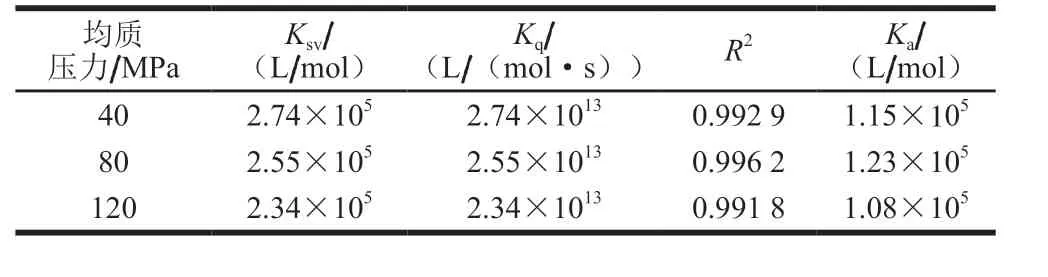
表3 SPI-SI復合物的熒光猝滅速率常數、雙分子猝滅速率常數、結合常數Table 3 Fluorescence quenching constants, bimolecular quenching rate constant and binding constants of SPI-SI complex
根據Stern-Volmer方程,研究在不同均質壓力下,SI猝滅SPI的程度。一般來說,各類猝滅劑對生物大分子的最大動態猝滅速率常數Kq為2×1010L/(mol·s)[8],本研究中40、80、120 MPa下Kq分別為2.74×1013、2.55×1013、2.34×1013L/(mol·s),均高于最大動態猝滅常數(表3)。這表明SPI和SI之間的猝滅過程主要是由于相互作用形成了復合物而引發了靜態猝滅。從圖7中插圖可以觀察到,在不同均質壓力下,F0/(F0-F)對1/[Q]的圖形呈良好的線性關系(R2=0.991 2~0.997 6)。圖中曲線呈線性關系意味著所有猝滅劑分子(如本實驗中SI)均勻地進入蛋白質的結合位點。此外,通過修改的Stern-Volmer等式計算猝滅常數Ka,其大小反映猝滅劑對熒光基團的接觸程度和反應速度[28]。80 MPa下Ka均高于40 MPa和120 MPa下Ka,表明經過均質壓力為80 MPa處理的SPI使其與SI接觸程度更高,有利于形成SPI-SI復合物。
2.7 復合物溶解性分析結果
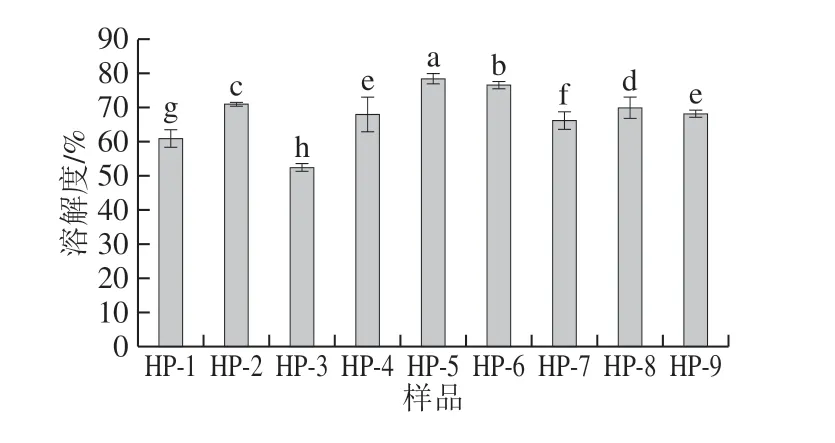
圖8 不同高壓均質條件下SPI和SPI-SI復合物的溶解度Fig. 8 Solubility of SPI and SPI-SI complex under different homogenization pressures
溶解度是蛋白質變性和聚集的最實用的量度,因此是蛋白質功能的良好指標。高壓均質處理后,所有樣品的溶解度均得到改善(天然SPI溶解度約為40%)[29],并在80 MPa時達到最大值。對這種現象的解釋是高壓均質處理可以減小SPI的粒徑,使蛋白質分子的表面區域變大,從而增加蛋白質-水相互作用,進而提高蛋白質的溶解度[30]。此外,有研究發現溶解度增加可能是暴露的基團通過氫鍵與水相互作用造成的[20]。然而,SPI在120 MPa下的溶解度略低于在80 MPa下的(圖8),這可能是均質過程中產生的熱量導致蛋白質部分變性和聚集體形成。SI質量濃度較低時,溶解度得到改善,當質量濃度進一步增加至2 mg/mL時,導致溶解度降低。這些結果表明,SI具有增加蛋白質溶解度的能力。高壓處理改變了SPI的性質,其與構象變化相關,例如疏水基團的暴露,SPI的疏水性明顯增強。因此,帶電基團可以在蛋白質表面上重新分布,這將影響基團電離。同時,SPI分子部分展開,更容易與SI發生疏水相互作用和氫鍵作用,這將改變蛋白質的電位。高溶解度歸因于疏水殘基的數量少和電荷升高。因此,SI的添加可以明顯改善高壓均質處理的SPI的性質。
2.8 復合物表面疏水性分析結果
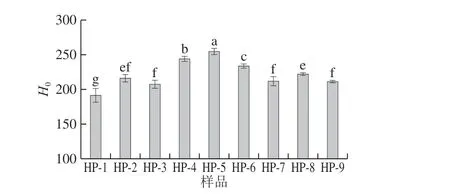
圖9 不同高壓均質條件下SPI和SPI-SI復合物的表面疏水性Fig. 9 Surface hydrophobicity of SPI and SPI-SI complex under different homogenization pressures
蛋白質表面疏水性表征與極性溶劑接觸蛋白質表面上疏水基團數量,用于評估蛋白質構象變化的結構特征之一,并且與其功能性質密切相關[31]。如圖9所示,高壓均質處理后H0明顯增加。H0的增加是由大蛋白質聚集體的破壞引起的,其誘導埋藏的疏水基團的暴露。H0從40 MPa逐漸增加到80 MPa,并在80 MPa下達到最大值。當壓力升至120 MPa時,H0與80 MPa相比減弱。這可能是經高壓均質處理引起的空化現象使SPI分子發生一定程度的展開,因此增加了疏水基團的數量以及最初在SPI分子內暴露于外部環境的區域,但其中一些聚集體會在較高壓力下發生疏水相互作用而重新聚集。這與文獻[32]所報道高壓處理后乳清蛋白的疏水性增加相似。對于低質量濃度SI樣品的H0高于無SI樣品,表明SI促進ANS與蛋白質表面的疏水位點的結合。SI質量濃度增大,表面疏水性的降低可能是SPI構象發生變化造成的,SPI與SI形成分子間相互作用和聚集,會使疏水基團逐漸埋藏在蛋白質內部[24]。
3 結 論
本實驗研究不同均質壓力對不同比例SPI-SI復合物的結構和功能的影響。均質壓力為80 MPa、SI質量濃度為0.2 mg/mL時,Zeta電位絕對值、蛋白質溶解度和表面疏水性分別增加了6.18 mV、28%和33%。同時,提高均質壓力顯著降低了復合物的粒徑。通過分析FTIR、紫外光譜、熒光光譜變化發現,SPI二級結構和三級結構發生了變化,隨著壓力的增加,α-螺旋相對含量先減少后增加,β-折疊相對含量先增加后減少,芳香族氨基酸殘基附近微環境親水性增強。這表明高壓均質會影響SPI-SI之間相互作用,適度的壓力和低質量濃度的SI有利于提高復合物的功能特性。功能特性的變化可以滿足食品工業中制成復雜食品的需求,但需要進一步研究以了解其具體機制。本實驗結果可為蛋白質-多酚復合物在食品工業中的應用提供一定的指導。

