宜賓芽菜拌鹽干腌過程中的主要成分變化及其與亞硝酸鹽含量變化的相關性分析
楊建飛,左勇,2*,馬懿*,徐佳,黃雪芹
1(四川輕化工大學 生物工程學院,四川 宜賓,644000)2(四川師范大學 生命科學學院,四川 成都,610101)
宜賓芽菜(簡稱芽菜)是以芥菜為原料,經過劃絲、晾曬、拌鹽干腌、拌料復腌等工藝制成的一類發酵蔬菜制品,富含多種氨基酸、有機酸、還原糖、揮發性風味物質等營養成分,具有脆、嫩、鮮、香的口感,深受廣大消費者的喜愛。芽菜由于獨特的原料及發酵工藝,制作時長需要1年左右,其中拌鹽干腌過程需要2~3個月[1],是亞硝峰出現的主要時期[2],也是芽菜風味和色澤形成的重要環節。
現有國內外學者研究表明,蔬菜發酵過程中亞硝酸鹽的形成不可避免,且存在超標現象[3-4]。從食品安全角度來說,亞硝酸鹽基本上被消費者視為有害物質,原因在于亞硝酸鹽能使血液中正常攜氧的低鐵血紅蛋白被氧化成高鐵血紅蛋白,失去攜氧能力而引起組織缺氧[5],若人體攝入過高的亞硝酸鹽,具有引發高鐵血紅蛋白血癥、Ⅰ型糖尿病和癌癥等的風險[6-7]。因此,亞硝酸鹽含量高低已成為衡量發酵蔬菜安全與否的主要指標。
目前,關于蔬菜發酵過程中,亞硝酸鹽的形成及含量變化規律已基本明確[8],大量研究主要集中在亞硝酸鹽的降解和含量控制方面,而關于發酵蔬菜主要成分的變化與亞硝酸鹽含量變化的相關性研究鮮有報道。本文以拌鹽干腌過程中的芽菜為研究對象,分析其發酵過程中硝酸鹽、氨基酸態氮、還原糖、揮發性風味物質、有機酸等主要成分的變化及其與亞硝酸鹽含量變化的相關性,以期為芽菜中亞硝酸鹽含量的控制及影響因素研究提供參考。
1 材料與方法
1.1 材料與試劑
芽菜,0 d開始腌制,共腌制80 d,每10 d取樣分析,宜賓市某企業提供;KNO3、NaNO2、磷酸二氫鉀、草酸、乳酸、乙酸、酒石酸(分析純),成都市科龍化工試劑廠;蘋果酸、檸檬酸、琥珀酸、甲醇(色譜純),上海源葉生物科技有限公司。
1.2 儀器與設備
STARTER2C pH計,上海奧豪斯儀器有限公司;T6紫外可知分光光度計,北京普析通用儀器有限責任公司;1260 infinity Ⅱ高效液相色譜儀、6890N-5979B氣相色譜-質譜聯用儀,美國安捷倫公司;0.22 μm水系濾膜,天津市津騰實驗設備有限公司;SPME固相微萃取進樣器、50/30 mm DVB/CAR/PDMS萃取頭,美國Supelco公司。
1.3 方法
1.3.1 芽菜傳統制作工藝
芽菜傳統制作工藝如下所示:
芥菜→晾曬→刮絲→拌鹽→攪拌→拌鹽→洗凈→脫水→添加輔料→裝壇→密封→發酵→加入蒜氨酸→檢驗→成品→根據需要加工成所需的調味品[9]
1.3.2 硝酸鹽的測定
參照趙杰[10]的雙波長法,并稍作改進,選擇在205 nm處測定芽菜發酵過程中硝酸鹽含量的變化,消除亞硝酸鹽的干擾,選擇275 nm處進行校正,消除大多數有機物的干擾。
1.3.3 亞硝酸鹽的測定
依據GB 5009.33—2016中的分光光度法[11],并稍作優化,在芽菜提取樣液中加入0.2 g活性炭,避免色澤干擾亞硝酸鹽含量的測定。
1.3.4 pH值的測定
依據GB 5009.237—2016中的pH計法[12]測定芽菜發酵過程中pH值的變化。
1.3.5 氨基酸態氮的測定
依據GB 5009.235—2016中的甲醛值法[13]測定芽菜發酵過程中氨基酸態氮含量的變化。
1.3.6 還原糖的測定
依據GB 5009.7—2016中的直接滴定法[14],以葡萄糖計,測定芽菜發酵過程中還原糖含量的變化。
1.3.7 揮發性風味物質的測定
參照GANGULY等[15]和鄭炯等[16]的頂空固相微萃取-氣質聯用法(solid phase micro-extraction gas chromatography mass spectrometry,SPME-GC-MS)并加以改進,芽菜剪碎研磨均勻后,稱取4.0 g置于15 mL的頂空進樣瓶中,加入飽和NaCl溶液2 mL,以增加離子強度,促進風味物質的揮發,在70 ℃下加熱平衡15 min后吸附45 min,在 230 ℃下解析5 min。GC條件:DB-WAX色譜柱(60 m×250 μm×0.25 μm);程序升溫:初溫50 ℃,保持3 min,再以5 ℃/min到120 ℃,保持1 min,再以10 ℃/min到230 ℃,保持5 min;載氣為氦氣,不分流進樣,體積流量為1.0 mL/min。MS條件:離子源為EI源;離子化能量70 eV,采集模式為全掃描,離子源溫度230 ℃,MS四極桿溫度150 ℃,溶劑延遲3 min。
1.3.8 有機酸的測定
參照商景天等[17]的高效液相色譜法(high performance liquid chromatography,HPLC)并加以改進,稱取2.0 g研磨均勻的芽菜樣品,加入75 ℃的蒸餾水50 mL,75 ℃水浴20 min后過濾,臨用前經0.22 μm水系濾膜過濾后進樣分析。HPLC條件:Agilent ZORBAX SB-Aq (4.6 mm×250 mm,5 μm) 色譜柱,VWD檢測器,檢測波長210 nm,流動相A為磷酸二氫鉀(pH=2.52),流動相B為甲醇,A、B相的體積比為95∶5,進樣量15 μL,流速0.4 mL/min,柱溫25 ℃。
采用外標法對芽菜有機酸定量,用超純水分別配制1.0 mg/mL的草酸、酒石酸、蘋果酸、乳酸、乙酸、檸檬酸、琥珀酸7種有機酸單標品儲備液,再配制質量濃度梯度為10、20、40、60、80、100、120 μg/mL的混合有機酸標準溶液,由于草酸具有較高的峰值,配制其質量濃度梯度為2、4、8、12、16、20、24 μg/mL。按上述色譜條件上機測定。
1.4 數據處理與分析
采用氣相色譜-質譜連用技術得到離子色譜圖,通過計算機譜庫檢索,選擇相似度≥80%的組分作為芽菜中的揮發性風味成分,采用峰面積歸一化法計算相對百分含量[18],采用SPSS 19.0的皮爾遜系數作相關性分析[19],采用Origin 2018進行圖表的繪制。
2 結果與分析
2.1 硝酸鹽含量的變化
芽菜拌鹽干腌過程中,硝酸鹽的含量變化如圖1所示,芽菜原料中含有大量的硝酸鹽,隨著腌制時間延長,硝酸鹽含量不斷降低,最終低至722.58 mg/kg,降低了75.99%,可能是芽菜自身硝酸還原酶與發酵環境中硝酸還原菌產的硝酸還原酶協同降解硝酸鹽[20-21],使得硝酸鹽含量不斷降低,同時產生部分亞硝酸鹽。
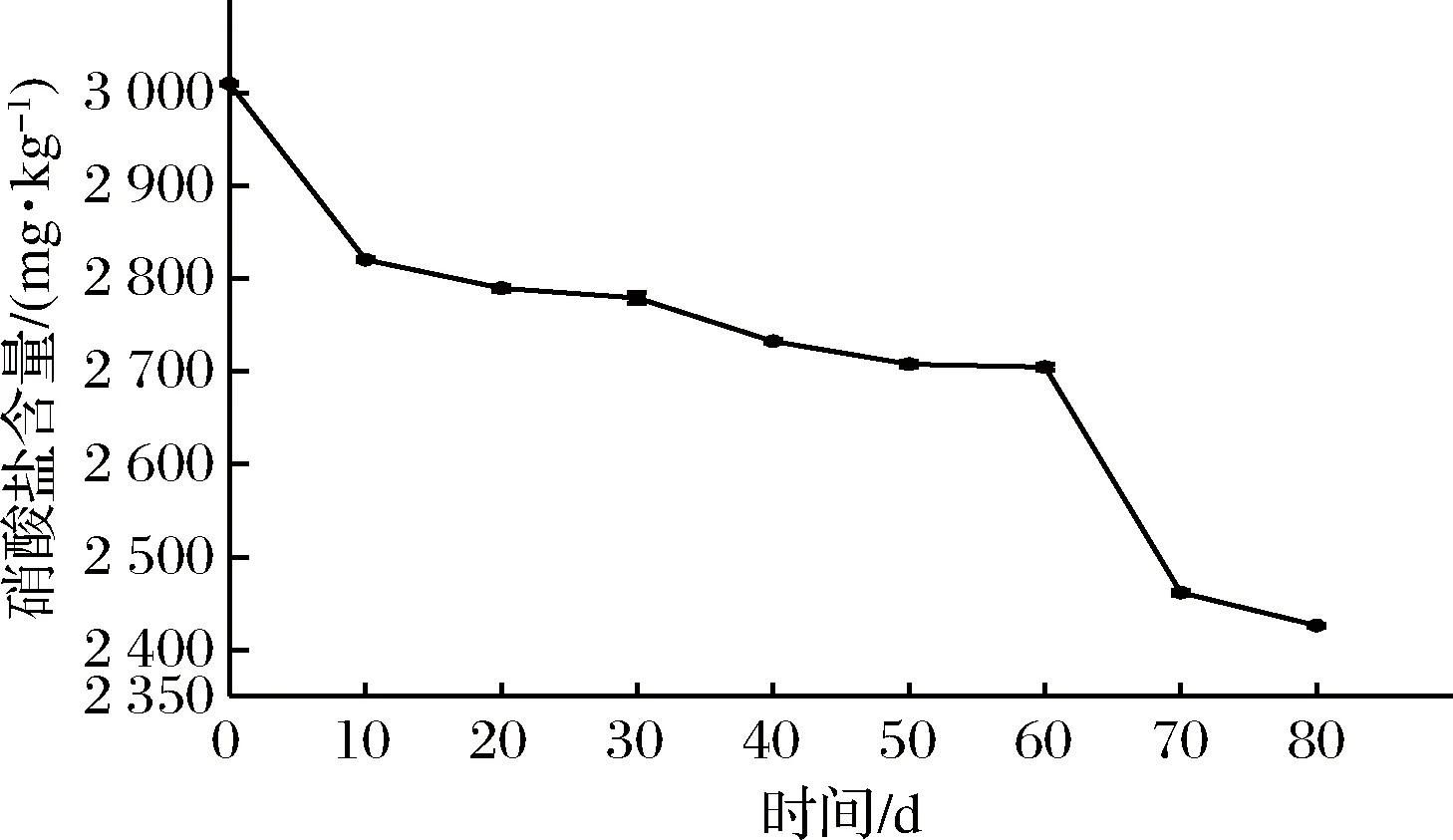
圖1 硝酸鹽含量的變化Fig.1 The changes of nitrate content
2.2 亞硝酸鹽含量及pH值的變化
芽菜拌鹽干腌過程中,亞硝酸鹽含量和pH值的變化如圖2所示,芽菜原料中的亞硝酸鹽含量為2.70 mg/kg,隨著腌制時間延長,亞硝酸鹽含量先增加后降低最后趨于平緩。芽菜在腌制30 d時出現亞硝峰,含量為3.37 mg/kg,可能是部分硝酸鹽被還原為亞硝酸鹽導致[3],隨后亞硝酸鹽含量迅速降低,可能是芽菜中的乳酸菌產亞硝酸鹽還原酶和產酸協同作用,使得亞硝酸鹽迅速降解[22]。芽菜pH值隨發酵時間延長不斷降低,當pH值低于4.0時,亞硝酸鹽的含量保持在1.53 mg/kg左右,可能是強酸性環境抑制了硝酸還原菌的生長繁殖,同時降低了亞硝酸鹽還原酶的酶活性,這與WANG等[23]的研究結果相似。
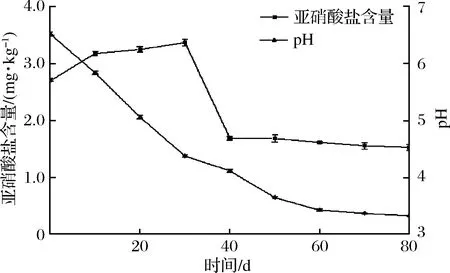
圖2 亞硝酸鹽含量及pH值的變化Fig.2 The change of nitrite content and pH value
2.3 氨基酸態氮含量的變化
芽菜拌鹽干腌過程中,氨基酸態氮的含量變化如圖3所示,氨基酸態氮含量的變化趨勢和圖2中亞硝酸鹽含量的變化趨勢相似,表明兩者之間可能存在正相關關系。氨基酸態氮含量在芽菜發酵30 d時達到最高為3.70 g/kg,可能是芽菜植物蛋白被發酵菌株利用,生成了氨基酸態氮類物質[24],隨后,氨基酸態氮含量不斷降低至1.60 g/kg,可能是部分游離氨基酸的氨基和還原糖的羰基發生了羰氨反應[2],形成烯醇、呋喃、酮類等香味前體物質。
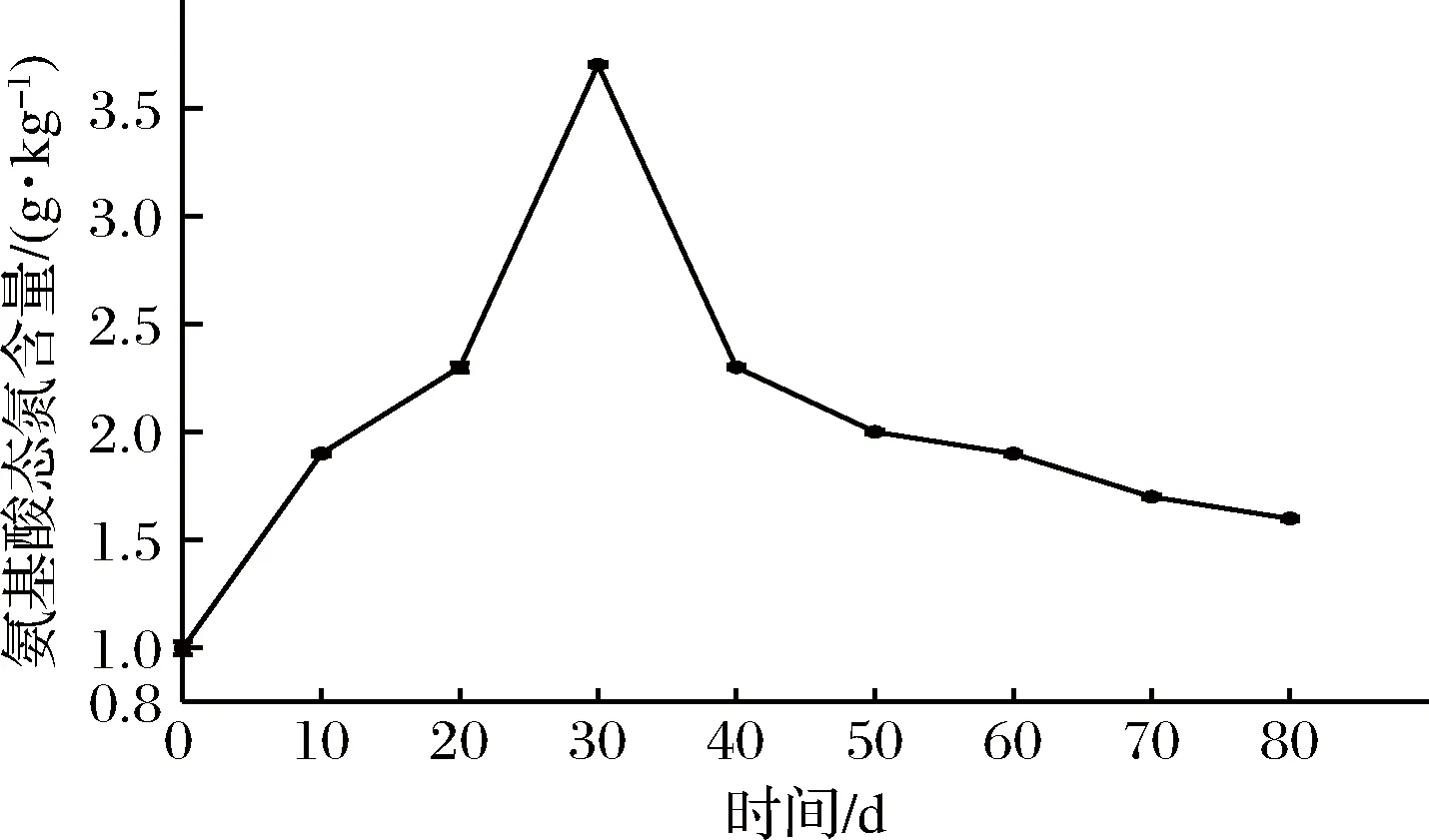
圖3 氨基酸態氮含量的變化Fig.3 The changes of nitrogen content in amino acid state
2.4 還原糖含量的變化
芽菜拌鹽干腌過程中,還原糖的含量變化如圖4所示。還原糖的含量變化與圖2中亞硝酸鹽含量變化趨勢相似,均在芽菜腌制30 d時達到最高含量,表明兩者可能存在正相關關系。芽菜腌制前10 d,還原糖含量迅速增加,可能是芽菜纖維素在微生物和纖維素酶作用下分解為還原糖[25],在10~20 d,還原糖含量沒有顯著變化,可能是發酵菌株利用還原糖為碳源生長繁殖。隨后,還原糖含量迅速增加至41.1 g/kg,可能是溫度、pH等達到纖維素酶最適范圍,最后還原糖含量不斷降低,可能是芽菜纖維素含量不足,部分還原糖與氨基酸類發生羰氨反應,最終含量為10.8 g/kg,是發酵初期的5.75倍,這與徐坤等[2]的研究結果相似。
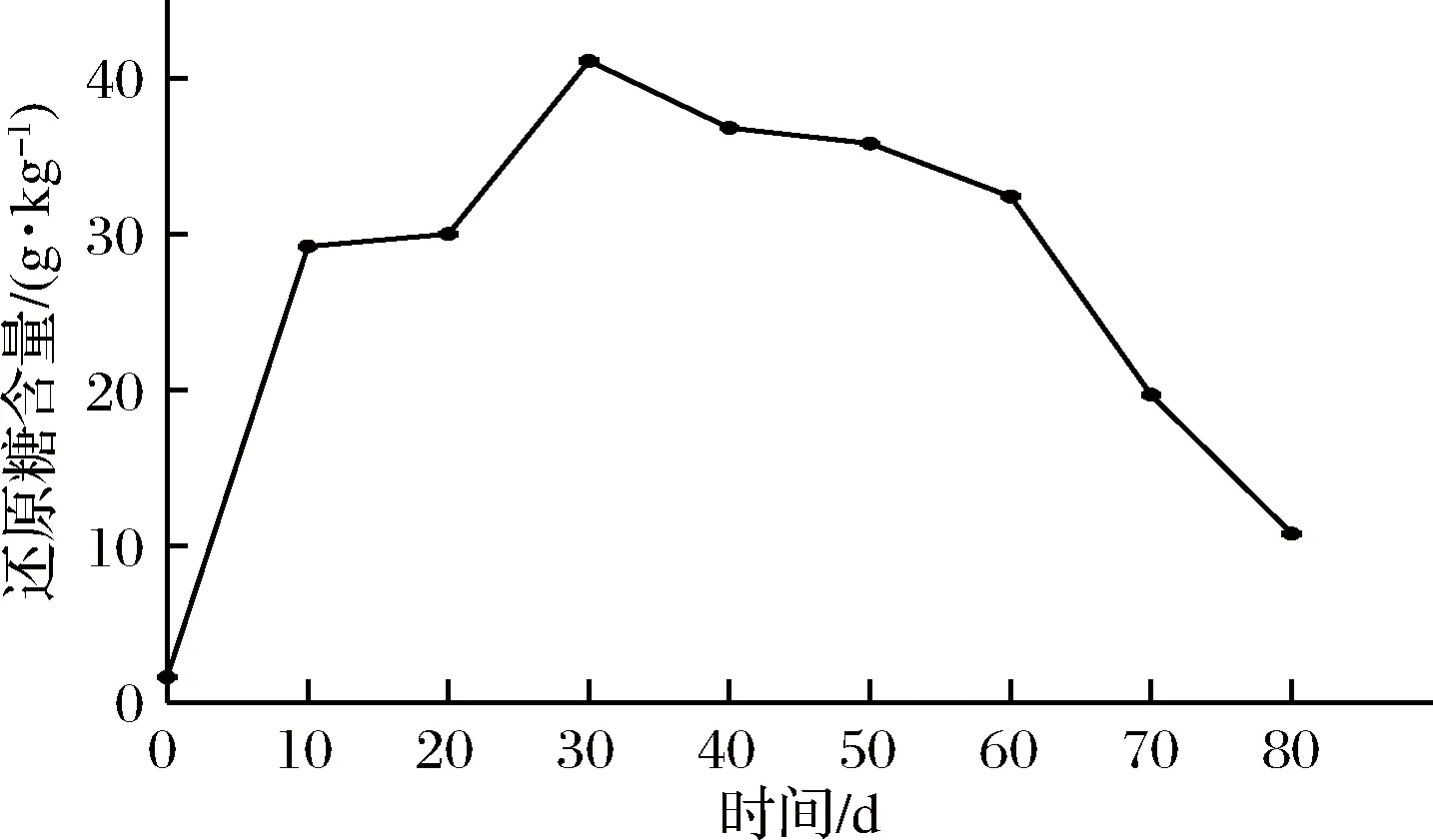
圖4 還原糖含量的變化Fig.4 The changes of sugar content
2.5 揮發性風味物質種類和相對含量的變化
芽菜拌鹽干腌過程中共檢測出83種揮發性風味物質,主要分為10類,包括呋喃類3種、腈類3種、醚類3種、烷類4種、醇類12種、酮類8種、醛類15種、酚類2種、烯類4種、酯類29種。揮發性風味物質的種類和含量變化如表1所示。苯乙醇、乙醇、芳樟醇、4-萜品醇、異硫氰酸烯丙酯的相對含量一直保持較高的水平,這與左勇等[26]的研究結果一致,表明這6種物質可能是芽菜中揮發性風味的主要貢獻者。隨著腌制時間延長,芽菜揮發性風味物質的種類先增加后降低,但總相對含量不斷增加,比原料中高26.96%,貢獻較大的成分有苯代丙腈、茴香腦、苯乙醇、乙醇、芳樟醇、4-萜品醇、硫氰酸烯丙酯、棕櫚酸乙酯等,這與張靜等[27]的研究結果相似。另外可見,芽菜腌制0~60 d,醛類、酮類種數居多,隨后烯類和酯類種數增加,醛類、酮類種數明顯減少,而且呋喃類、2,6-二甲基環己醇、3,5-辛二烯-2-酮、β-紫羅蘭酮、己醛、反式-2-戊烯醛、苯甲醛、異硫氰酸烯丙酯、3-丁烯基異硫氰酸酯、壬基氯乙酸酯、二氫獼猴桃內酯的相對含量隨芽菜腌制時間增加而降低,表明這些物質的含量降低,以及烯類和酯類種數的增加可能是標志芽菜腌制成熟的重要指標。

表1 芽菜拌鹽干腌過程中揮發性風味物質成分及相對含量的變化 單位:%
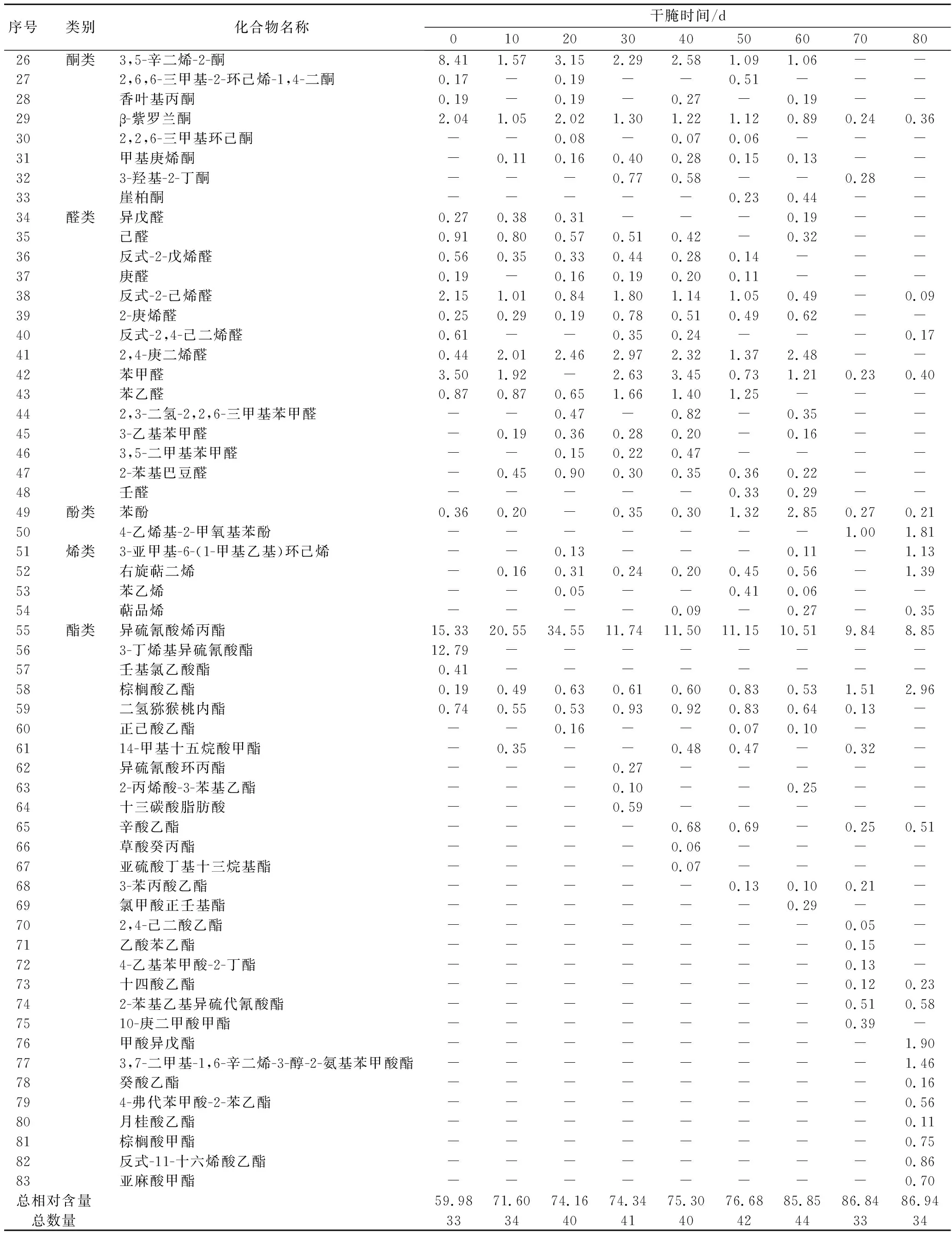
續表1
2.6 有機酸種類和含量的變化
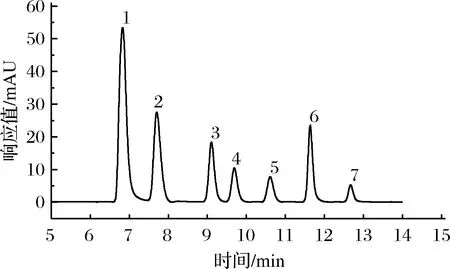
1-草酸;2-酒石酸;3-蘋果酸;4-乳酸;5-乙酸;6-檸檬酸;7-琥珀酸圖5 混合有機酸標準色譜圖Fig.5 Standard diagram of mixed organic acids
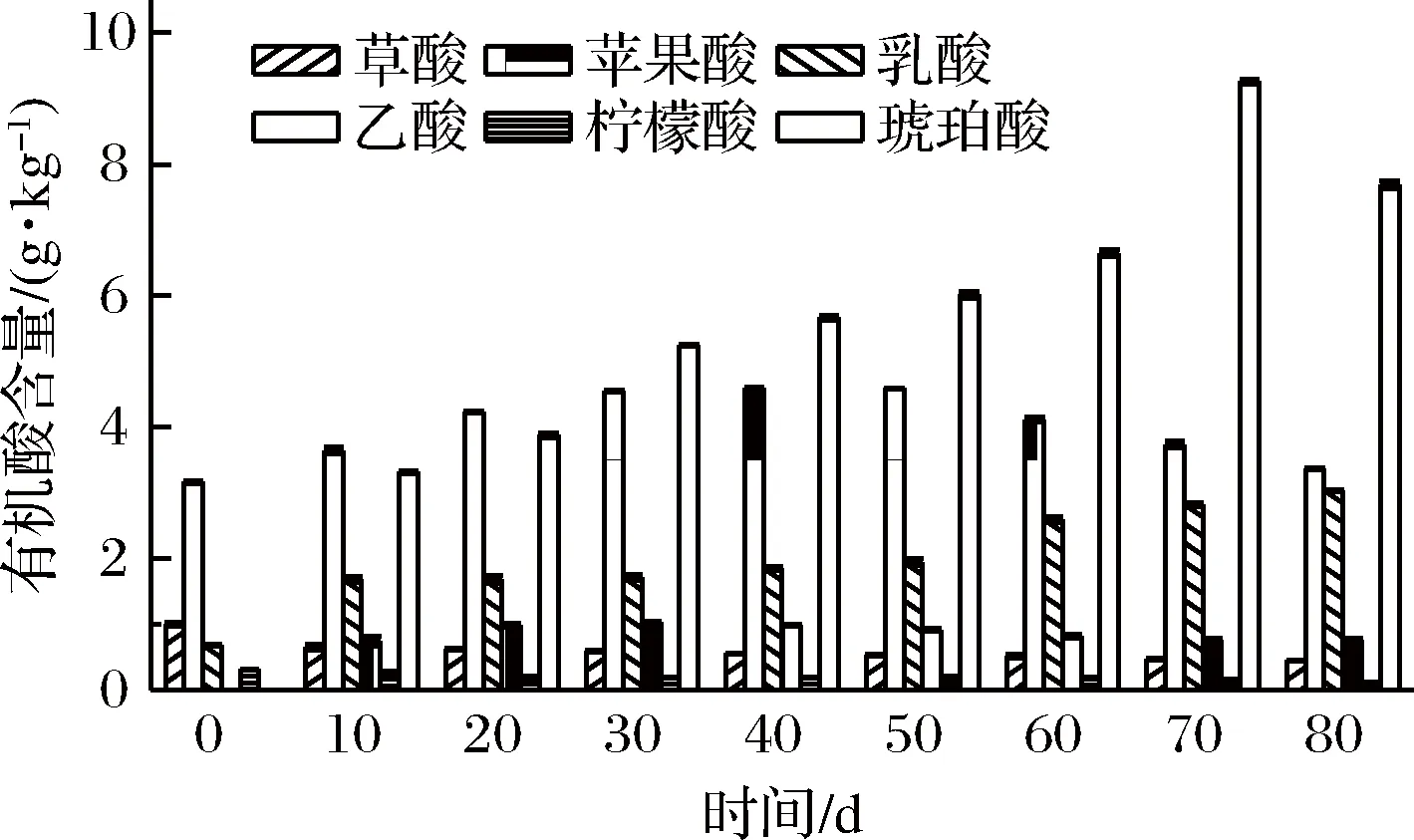
圖6 有機酸種類及含量的變化Fig.6 The change of organic acid types and contents
2.7 芽菜主要成分含量變化與亞硝酸鹽含量變化的相關性
由于芽菜拌鹽干腌過程中檢出的揮發性風味物質較多,表2中僅列出與亞硝酸鹽含量變化有關的揮發性風味成分。由表2可知,檢出的83種揮發性風味物質中,只有5種成分的含量變化與亞硝酸鹽的含量變化具有顯著相關性,其中己醛、反式-2-戊烯醛、反式-2-己烯醛與亞硝酸鹽含量變化呈極顯著正相關;β-紫羅蘭酮、辛酸乙酯分別與亞硝酸鹽含量變化呈顯著正相關和顯著負相關;硝酸鹽、還原糖、氨基酸態氮均與亞硝酸鹽含量變化呈顯著正相關,這與2.1~2.4分析結果相符。另外可見,芽菜的6種有機酸中,草酸和檸檬酸與亞硝酸鹽含量變化呈極顯著正相關;乳酸和琥珀酸與亞硝酸鹽含量變化呈極顯著的負相關;蘋果酸和乙酸與亞硝鹽含量變化的相關性不顯著。表明芽菜發酵過程中,亞硝酸鹽含量高低可能對芽菜的揮發性風味物質具有調控作用[31-32],較高含量的硝酸鹽會促進亞硝酸鹽含量增加[3],而乳酸和琥珀酸可能對亞硝酸鹽具有降解作用[33-34]。
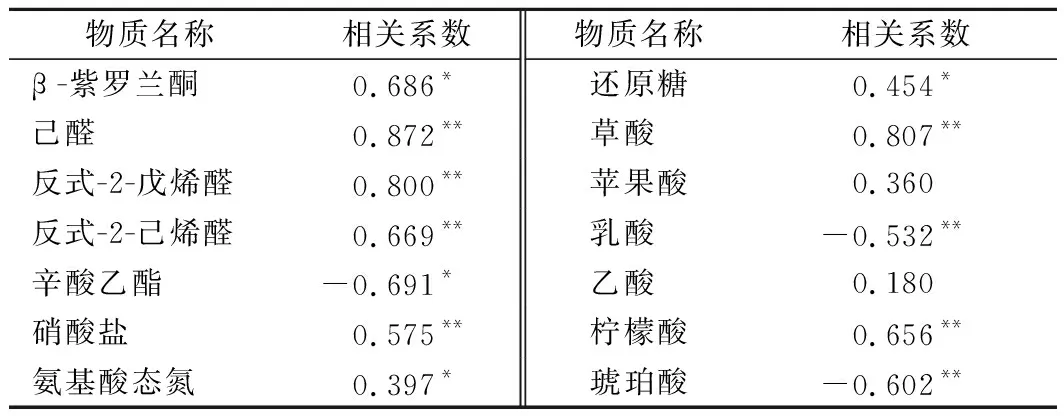
表2 芽菜主要成分含量變化與亞硝酸鹽含量變化的相關性Table 2 Correlation between the content of main components and the content of nitrite in sprout
3 結論
在芽菜拌鹽干腌過程中,硝酸鹽含量不斷降低,最終含量為722.58 mg/kg;亞硝酸鹽、氨基酸態氮、還原糖的含量先增加后降低最后趨于穩定,最終含量分別為1.53 mg/kg、1.60、10.8 g/kg;揮發性風味物質共檢出83種,其種類先增加后降低,但總相對含量不斷增加,比原料中高26.96%;有機酸種類由原料中的4種增加到6種,其中蘋果酸、琥珀酸的含量先增加后降低,最終含量分別為3.37、7.69 g/kg;乳酸含量不斷增加至3.04 g/kg;檸檬酸和草酸的含量分別不斷降低至0.11、0.46 g/kg,乙酸含量一直保持在1.0 g/kg以下。
通過分析芽菜主要成分含量變化與亞硝酸鹽含量變化的相關性,得出揮發性己醛、反式-2-戊烯醛、反式-2-己烯醛以及硝酸鹽、草酸、檸檬酸與亞硝酸鹽含量變化呈極顯著正相關;β-紫羅蘭酮、氨基酸態氮、還原糖與亞硝酸鹽含量變化呈顯著正相關;乳酸和琥珀酸與亞硝酸鹽含量變化呈極顯著負相關;揮發性辛酸乙酯與亞硝酸鹽含量變化呈顯著負相關;蘋果酸和乙酸與亞硝酸鹽含量變化的相關性不顯著。說明在芽菜拌鹽干腌過程中,亞硝酸鹽含量的變化與其多種主要成分及其含量變化存在顯著相關性,這將為芽菜腌制過程中亞硝酸鹽含量的控制及影響因素研究提供理論依據。

