生物催化合成1-苯乙醇及其衍生物的研究進展
杜 剛
(陜西國防工業職業技術學院化學工程學院,陜西 西安 710302)
手性藥物具有獨特的藥理作用和巨大的經濟價值,正在被全世界的藥物學家所關注。現階段手性藥物的獲得依然是個技術難題,通常認為手性中間體是合成手性藥物的前提和基礎。1-苯乙醇及其衍生物就是一類重要的手性中間體,如S-(-)-苯乙醇可用于合成抗抑郁藥物曲舍林,R-(+)-苯乙醇則可用于合成抑制膽固醇吸收的藥物[1],如2′-氯苯乙醇是L-氯丙那林的重要中間體[2]。但是由于技術上的原因,當前還無法對每一種手性醇中間體實現工業化生產。1-苯乙醇及其衍生物的合成方法主要有化學法和生物法。與化學法相比,生物法具有選擇性高、反應條件溫和、產物光學純度高等優點,是國內外合成手性中間體的主要方法[3-4],可分為整細胞催化法、酶催化法等。關于1-苯乙醇及其衍生物的合成是目前國內外的研究熱點。研究較多的是生物不對稱還原潛手性酮,生物催化拆分外消旋混合物也受到極大的關注,手性催化劑的選擇、反應體系以及反應條件的優化等都是該領域的研究重點。基于此,作者從生物催化劑的選擇、整細胞催化、酶催化等三方面對1-苯乙醇及其衍生物的生物催化合成研究進展進行綜述,為手性藥物的合成提供幫助。
1 生物催化劑的選擇
與化學催化一樣,催化劑的選擇對生物催化有著重大影響。生物催化劑決定著手性醇的收率及光學純度的高低,一般通過生物方法從自然界中篩選出高效的生物催化劑。目前,可用于生物催化合成1-苯乙醇及其衍生物的生物催化劑有很多,如藍藻、酵母、真菌、植物細胞以及酶等。劉慧等[5]利用96微孔板對300株常用菌株進行催化活性測定,發現真菌R.mucilageinosaGIM 2.157對鄰-、間-、對-溴苯乙酮均具有較高的催化活性,可得到S-構型手性醇產物,收率達到99%,ee值也達到99%。Perna等[6]從不同菌株中篩選到L.reuteriDSM 20016,此菌株可整細胞催化苯乙酮合成(R)-1-苯乙醇,在較短時間內即可完成轉化,ee值高達99%。何軍邀等[7]從土壤中分離得到一株具有很強羰基還原能力的菌株厄斯考維菌(Oerskoviaturbata)ZJPH 1604,可不對稱催化3-氯苯乙酮合成(R)-1-(3-氯苯基)乙醇,ee值超過99.9%。Mandal等[8]以苯乙酮為底物對真菌的催化活性進行測定(表1),發現生物催化劑對手性產物起著決定性的作用,不僅決定其收率,而且決定其構型。

表1 用于催化還原苯乙酮的真菌催化劑的篩選
在生物催化羰基酮的過程中,產物大多遵守Prelog原則[9](圖1)。當小的取代基被大的取代基取代時,或者取代基的位置不同時,產物空間構型就有可能發生轉變,出現反-Prelog原則,因此通過調整底物分子取代基,可以得到不同構型的手性產物。

圖1 Prelog原則示意圖Fig.1 Schematic of Prelog rule
2 整細胞催化
整細胞催化的反應條件溫和、操作簡單、催化劑廉價易得,反應時無需添加輔酶,大大降低了成本。裴朝紅等[10]以從土壤中篩選到的紅球菌屬菌株Rhodococcussp.為催化劑,將α-羥基苯乙酮不對稱還原成(R)-苯乙二醇,菌體轉化α-羥基苯乙酮的最優濃度為3.0 g·L-1,轉化率高達96.2%,ee值為99.3%。曹綱等[11]在30 ℃條件下,通過乳酸克魯維酵母(Kluyveromyceslactics)整細胞催化苯乙酮,24 h得到(R)-1-苯乙醇,收率為95%,ee值達到99.5%以上。
利用基因突變或重組技術,整細胞催化往往可以獲得更好的效果。李鳴等[12]以羰基還原酶基因SCRⅡ-A220D和葡萄糖脫氫酶基因gdh共表達的重組菌株E.coliBL21/pET-SCRⅡ-A220D-SD-AS-gdh為生物催化劑,催化潛手性酮得到(R)-4-甲氧基-1-苯乙醇,收率達到82%,ee值為98%。
Wei等[13]利用含有羰基還原酶突變體(mut-accr)的BL21(DE3)(pETDuet-gst-mut-accr-gdh)整細胞催化2-羥基苯乙酮轉化為(S)-2-苯乙二醇,該生物催化劑的催化活性是原AcCR重組細胞的15.9倍,在最佳條件下,收率為95.2%,ee值達到99%以上。除了利用菌體整細胞進行催化外,Baldassarre等[14]以胡蘿卜根為催化劑,50 h得到ee值大于95%的手性醇;柴文等[15]用胡蘿卜根部細胞組織生物催化6種苯乙酮衍生物的不對稱還原反應(圖2),均在72 h內得到S-構型手性醇,還原產物具有良好的化學純度(60%~70%),ee值可達92%以上。
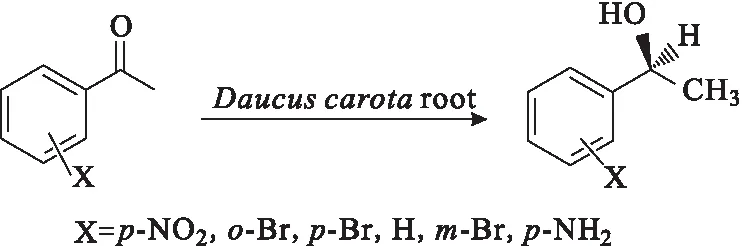
圖2 苯乙酮衍生物的不對稱催化還原反應Fig.2 Asymmetric catalytic reduction reaction of acetophenone derivatives
在整細胞催化過程中,底物與產物會抑制菌體細胞的生長、降低其催化活性。在水相體系中引入有機相形成兩相體系是提高收率與選擇性的較好策略。有機相的引入可以增加非極性底物的濃度,同時底物和產物主要存在于有機相,減少了對存在于水相中的菌體細胞的影響,提高了底物轉化率和選擇性。有機相的引入要考慮生物相容性,溶劑的logP越小,其對菌體細胞的毒性就越大。Cho等[16]發現,乙酸乙酯、環己酮、鄰苯二甲酸二辛酯等對重組大腸桿菌細胞具有較高的生物相容性,logP在4.50左右較為合適(表2);歐志敏等[17]研究了溶劑對熱帶假絲酵母(Candidatropicalis)CGMC 15016細胞催化活性的影響,發現菌體細胞在logP為2~4的有機溶劑中具有中等的代謝活力,而在logP>4的有機溶劑中代謝活力能達到更高。
3 酶催化
酶催化反應效率高、條件溫和、容易控制、操作穩定性好、受底物濃度影響小,滿足工業化生產要求。用于酶催化反應合成手性醇的酶有水解酶和氧化還原酶。
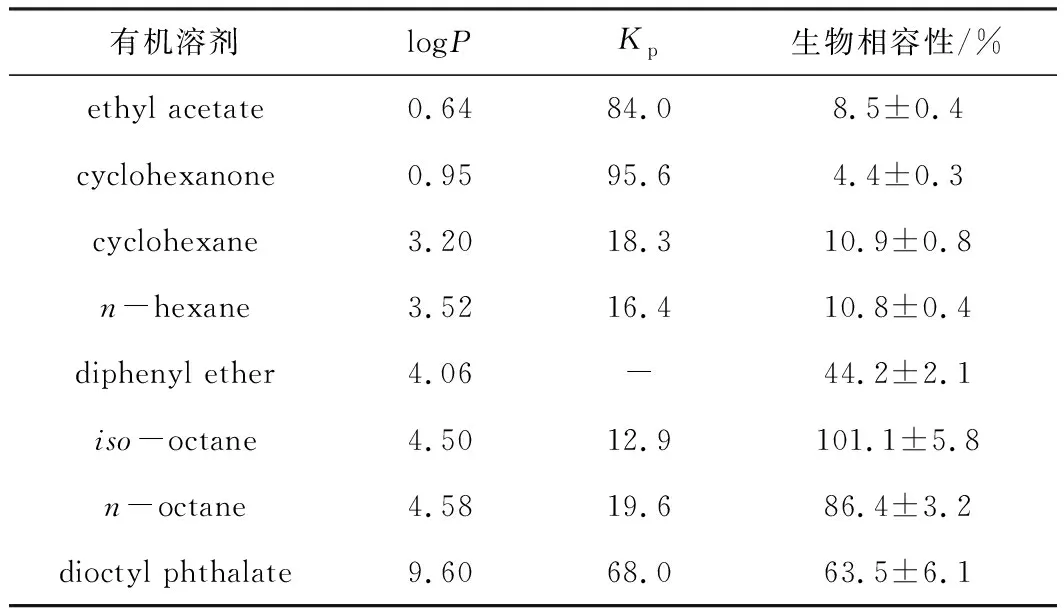
表2 苯乙酮的分配系數及有機溶劑對重組大腸桿菌細胞的生物相容性
水解酶中最常用的是酯酶、脂肪酶、裂解酶等,具有高度的選擇性和專一性、不良反應少、價格低廉、在使用中無需添加輔助因子等特點,已成為研究熱點。秦燕等[18]以異丙醚為反應介質、乙酸乙烯酯為酰基供體,利用脂肪酶YCJ01催化拆分對位取代1-苯乙醇衍生物,底物轉化率可達49.96%,ee值達到97%以上。康麗峰等[19]在有機相中用固定化豬胰脂肪酶(PPL)催化1-苯乙醇轉酯化拆分反應,在反應溫度為45 ℃、反應時間為13 h的條件下,ee值可達99.3%。Yan等[4]用表面活性劑對米曲霉脂肪酶進行改性后,將其用于(RS)-1-苯乙醇與醋酸乙烯酯交換反應,轉化率為46.8%,(R)-1-苯乙酸乙酯ee值大于99%。
氧化還原酶雖然在反應時需要加入輔酶,但是可以在羰基上引入活性基團,具有不可比擬的優勢,被認為是最有價值的一類酶催化劑。陳敏等[20]構建了LcSDR和EsGDH雙酶耦聯體系,將其用于催化不對稱還原苯乙酮合成(R)-苯乙醇,2 h收率達到93.8%,ee值不低于99%。楊猛等[21]以Corynebacteriumsp.的酮還原酶KRED30和Bacillussubtilis的D-葡萄糖脫氫酶GDH1構建的雙酶復合交聯酶聚集體為催化劑,催化還原3-氯苯乙酮,手性醇收率為100%,ee值>98%。Chen等[22]以源于Lactobacilluskefir的變異醇脫氫酶(A94T/F147L/L199H/A202L)結合葡萄糖脫氫酶(GDH)為催化劑,將2-氯-1-(2,4-二氯苯基)乙酮轉化為(S)-2-氯-1-(2,4-二氯苯基)乙醇,35 ℃下反應6 h的轉化率約為100%,ee值為99.5%。劉麗勤等[23]構建了重組大腸桿菌E.coliBL21-ADH和E.coliBL21-GDH,將乙醇脫氫酶與葡萄糖脫氫酶偶聯不對稱還原2,6-二氯-3-氟苯乙酮,得到抗癌藥物克唑替尼的手性中間體(S)-1-(2,6-二氯-3-氟苯基)乙醇(圖3),轉化率為93.75%,ee值達到99%。
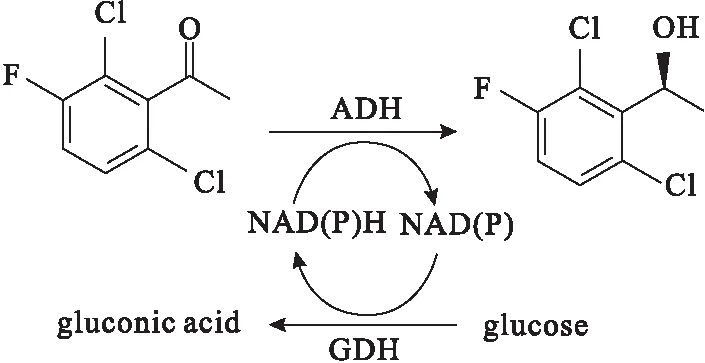
圖3 酶催化合成(S)-1-(2,6-二氯-3-氟苯基)乙醇Fig.3 Enzyme catalytic synthesis of (S)-1-(2,6-dichloro-3-fluorophenyl)ethanol
4 結語
與化學法相比,生物催化合成1-苯乙醇及其衍生物具有反應條件溫和、光學收率高等特點,但是也存在一些問題:在整細胞催化中,由于生物催化劑會受到細胞耐受性的影響,通常反應底物濃度較低,若底物濃度過高則產物收率可能會下降;酶催化雖然被認為是最有可能實現產業化的途徑之一,但在酶的提取、保存、固定化等關鍵技術上還應有所突破。相信,隨著生物技術的發展,生物催化合成1-苯乙醇及其衍生物會得到越來越多的重視與研究。

