小分子烷烴與烯烴在離子液體中的溶解性能
張睿,董淑媛,伍洛,劉植昌,徐春明,劉海燕,孟祥海
(中國石油大學(北京)重質油國家重點實驗室,北京102249)
引 言
乙烯、丙烯等小分子烯烴是石油化工的基本原料,由其可生產出眾多化工產品,市場對小分子烯烴的需求量逐年增加。小分子烯烴主要來源于蒸氣裂解、催化裂解和催化裂化[1?2],近些年來甲醇制烯烴[3]、烷烴催化氧化脫氫制烯烴[4]等技術也越來越受到重視。而上述過程均得到小分子烯烴與烷烴的混合物,將其進行分離是高附加值烯烴合理利用的前提。
目前,小分子烯烴與烷烴的分離技術主要包括低溫精餾、萃取精餾、吸收分離、膜分離、吸附分離等方法[5?8]。吸收是氣體分離的重要手段,離子液體(ionic liquid,IL)作為一類新型的綠色溶劑,具有良好的熱穩定性與極低的揮發性,且離子液體的極性可調、陰陽離子結構可設計,對眾多氣體表現出不同的選擇性溶解能力,在氣體吸收分離領域備受關注[9?12]。離 子 液 體 可 用 于 酸 性 氣 體(CO2、SO2、H2S)[13?16]、小 分 子 烴 類(烷 烴、烯 烴、二 烯 烴、炔烴)[17?20]的吸收分離,并表現出良好的選擇性分離效果。
眾多學者在離子液體選擇性溶解分離小分子烴類方面開展了大量高效的研究。Jacquemin等[21?22]考察了甲烷、乙烷、乙烯等小分子烴類在[Bmim][BF4]、[Bmim][PF6]離子液體中的溶解度,發現乙烯的溶解度顯著高于甲烷和乙烷的溶解度,隨著溫度的降低和壓力的升高,小分子烴類在離子液體中的溶解度增大。Lee 等[23]研究表明,丙烯、丁烯在離子液體中的溶解度比丙烷、丁烷的溶解度大。Fallanza等[24]用真實溶劑似導體屏蔽模型(COSMO?RS),分析了不同離子液體對丙烷和丙烯的溶解度及丙烯/丙烷的選擇性,發現隨氣體在離子液體中溶解度的降低,溶解選擇性會相應提高;對咪唑類、吡啶類、吡咯類離子液體,陽離子結構的不同對氣體溶解度影響不大。
Kilaru等[25]研究了乙烯、丙烯、丁烯、丁二烯等氣體在咪唑類、季磷鹽類等離子液體中的溶解度,發現丁二烯在考察的多種離子液體中的溶解度均比其他幾種烴類的溶解度大,其在[Emim][Tf2N]中的溶解度為0.0910 mol/mol,在[C6mim][Tf2N]中溶解度達到0.116 mol/mol。Palgunadi 等[26]研究發現咪唑類離子液體可用于乙炔和乙烯的分離,并表現出較好的乙炔/乙烯選擇性,且離子液體的陰離子比陽離子對溶解度影響更大。Xing等[27]利用分子動力學模擬的方法探究了乙烯和乙炔在五種離子液體中的溶解機理,發現乙烯溶解時陽離子與乙烯之間的范德華力起著重要作用,而乙炔與陰離子間的氫鍵作用決定了其在離子液體中的溶解能力。
綜合文獻報道,可以發現小分子烴類在離子液體中的溶解度隨烴類分子不飽和度的增大而增大,二烯烴和炔烴的溶解度顯著高于同碳數的烯烴和烷烴的溶解度,烯烴的溶解度顯著高于同碳數的烷烴的溶解度。對于乙烯/乙烷、丙烯/丙烷的吸收分離,盡管多種離子液體表現出了較好的實驗結果,但是烯烴/烷烴的溶解選擇性仍然不夠高,大多在3以下[28]。
為了提升烯烴/烷烴的溶解選擇性,研究者將含有Cu(Ⅰ)、Ag 的鹽溶解到離子液體中形成復配溶劑,可以大幅提升溶解選擇性[29?32]。Galan等[29,33]研究發現,在離子液體中溶解含Ag 的鹽形成復配溶劑,能夠顯著增大乙烯或丙烯的溶解度,而對乙烷或丙烷的溶解度影響不大,進而能大幅提升乙烯/乙烷的溶解選擇性。復配溶劑也能增大丙烯/丙烷的溶解選擇性,在25℃和0.1 MPa 的條件下,丙烯/丙烷在[Bmim]SCN?CuSCN 復配溶劑中的溶解選擇性可高達10以上[34]。
無論是報道的離子液體,還是離子液體與金屬鹽的復配溶劑,相比傳統的分離溶劑都存在成本高的弊端。在溶解度和溶解選擇性相近的情況下,降低離子液體的成本是其工業化的重要因素。鑒于此,本文針對成本相對較低的銨鹽類離子液體,研究其對小分子烯烴與烷烴的溶解性能,以及離子液體的重復使用性能。
1 實驗材料和方法
1.1 材料
實驗所用原料包括鹽酸三乙胺(Et3NHCl)、鹽酸二乙胺(Et2NH2Cl)、鹽酸乙胺(EtNH3Cl)、鹽酸三甲胺(Me3NHCl)、鹽酸二甲胺(Me2NH2Cl)等鹽酸銨鹽,純度均≥99%;CuCl(≥99.8%)、AlCl3(≥98%)、FeCl3(≥98%)、FeCl2(≥99.9%)等Lewis 酸,購自阿拉丁試劑(上海)有限公司。1?丁基?3 甲基咪唑氯鹽([Bmim]Cl,≥97%)與1?丁基?3?甲基咪唑四氟硼酸鹽([Bmim][BF4],≥97%)購自上海成捷化學有限公司。乙烯、乙烷、丙烯、丙烷、異丁烷、異丁烯等小分子烴類,純度均≥99.9%,購自北京市北溫氣體制造廠。氣相色譜檢測所用的高純氮氣、氫氣、空氣購自北京氦普北分氣體工業有限公司。
1.2 氣體溶解度與溶解速率的測定方法
利用體積法測量原理,設計了如圖1 所示的實驗裝置,用于測量溶解度較小的氣體在離子液體中的溶解度。該實驗裝置由原料氣注入系統、氣體溶解系統、抽真空系統、壓力傳感記錄系統四部分組成。
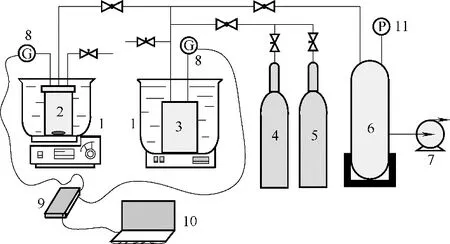
圖1 氣體溶解度測試裝置Fig.1 Gas solubility testing equipment
溶解度的測定方法及操作步驟如下:向氣體溶解器(110 ml)內加入一定量的離子液體后密封,將氣體溶解器和氣體罐(216 ml)放入恒溫水浴(或油浴)中保持恒溫。開啟抽真空系統,將氣體罐和氣體溶解器抽真空,當真空度接近1.0×105Pa 時關閉抽真空系統。打開閥門向氣體罐內注入一定量的氣體后關閉閥門,開啟壓力傳感系統。打開氣體溶解器和氣體罐之間的球閥,使氣體罐內的氣體進入氣體溶解器,關閉閥門后開啟磁力攪拌器,加快氣體在離子液體中的溶解。為測定一定壓力下氣體的溶解度,需不斷向氣體溶解器內充入氣體,直到壓力不再變化,溶解達到平衡。根據實驗前后氣體罐與氣體溶解器內的壓力、體積以及離子液體加入量、系統溫度,可以計算出該測試條件下氣體在離子液體中的溶解度。根據壓力傳感器實時采集的數據,可以計算出氣體在離子液體中的溶解速率。烴類溶解度為每摩爾離子液體溶解的烴類物質的量(mol/mol),可通過式(1)進行計算;烯烴/烷烴溶解選擇性為烯烴溶解度與烷烴溶解度的比值,可通過式(2)進行計算;氣體在離子液體中的溶解速率可通過式(3)進行計算。
利用上述實驗裝置也可測定烷烴與烯烴混合物在離子液體中的溶解性能。根據溶解前后的壓力數據、容器體積數據、離子液體加入量、系統溫度以及溶解前后氣體的組成數據,可以計算出烷烴和烯烴在氣相和離子液體相的分配吸收和分離選擇性。

1.3 離子液體中溶解氣體的解吸測定方法
當氣體在離子液體中達到溶解平衡后,不斷升高水浴溫度,使溶解在離子液體中的氣體逐漸解吸。開啟抽真空系統,將緩沖罐和氣體罐抽真空,當真空度接近1.0×105Pa 時關閉抽真空系統。打開球閥,使氣體溶解器內已解吸出的氣體進入已抽完真空的氣體罐內。不斷重復以上操作,直至氣體溶解器內的氣體壓力不再變化,此時氣體解吸達到平衡。根據實驗前后氣體罐與氣體溶解器內的壓力、體積以及離子液體用量、系統溫度、溶解度數據,可以計算出該條件下離子液體中氣體的解吸率。
2 實驗結果與討論
2.1 離子液體吸收劑的優選
根據實驗材料部分列出的陽離子供體和陰離子供體,合成了一系列離子液體。在溫度30℃、壓力0.2 MPa 及轉速800 r/min 的操作條件下,考察了離子液體對乙烯和乙烷的溶解性能,結果見表1。當離子液體的陰離子供體相同時,銨鹽類和咪唑類離子液體對乙烯、乙烷的溶解性能比較接近,即兩種陽離子供體的影響不大。因此從離子液體生產成本的角度考慮,選用價格相對較低的銨鹽類作為離子液體的陽離子供體。當離子液體的陽離子供體相同時,CuCl 作為陰離子供體時合成的離子液體對乙烯/乙烷的溶解選擇性最高,因此選擇CuCl 作為陰離子供體進行后續研究。同時發現,當陰陽離子供體的摩爾比不同時,所合成的離子液體對乙烯、乙烷的溶解性能有著一定的影響,因此后續需要進一步考察離子液體陰陽離子供體配比的影響規律。
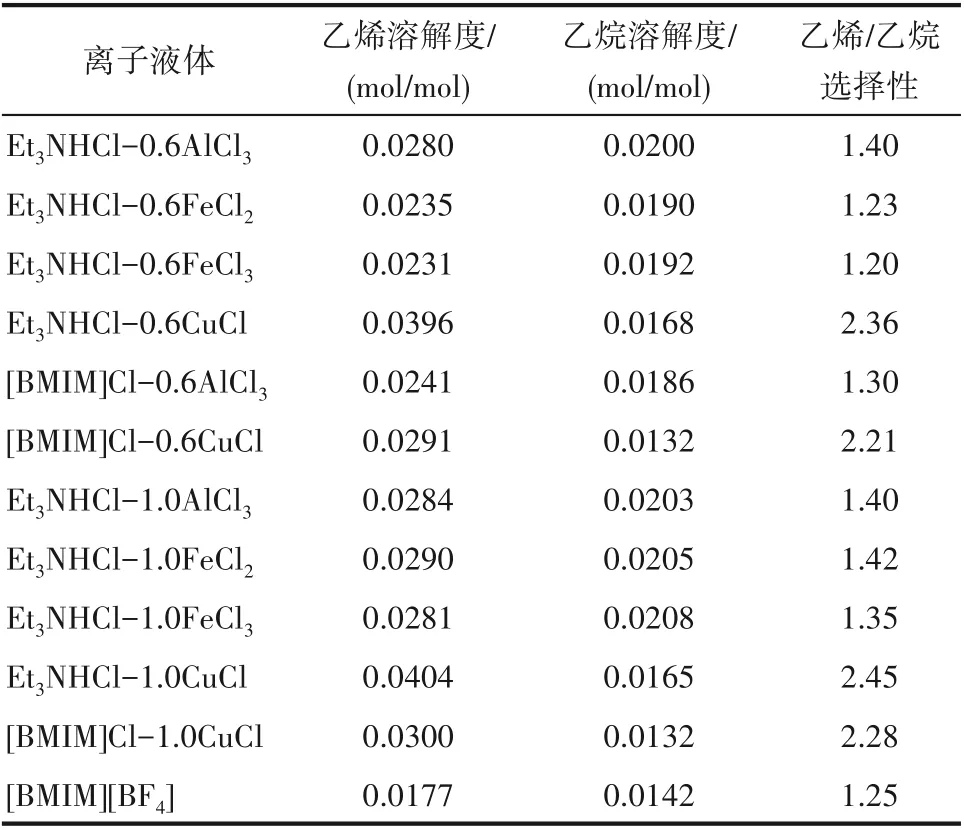
表1 離子液體種類對乙烯與乙烷的溶解度和溶解選擇性的影響Table 1 Effect of ionic liquid types on solubility and solubility selectivity of ethene and ethane
針對優選出的銨鹽類陽離子供體,固定陰陽離子供體的摩爾比為1∶1,選擇具有不同烷基鏈長度和烷基個數的鹽酸銨鹽,與CuCl合成了一系列離子液體,之后篩選了5 種黏度和熔點相對較低的離子液體,在溫度100℃、壓力0.2 MPa 及轉速800 r/min的操作條件下,考察了離子液體對乙烯和乙烷的溶解性能,結果見表2。當陽離子供體的烷基鏈長度相同時,烷基數增大,所合成離子液體對乙烯和乙烷的溶解度都增大,乙烯/乙烷溶解選擇性也呈增大趨勢。當陽離子供體的烷基數相同時,烷基鏈增長,所合成離子液體對乙烯和乙烷的溶解度略有增大,但是對乙烯/乙烷溶解選擇性影響不大。從對乙烯 乙 烷 溶 解 的 角 度 考 慮,Et3NHCl?1.0CuCl 與Me3NHCl?1.0CuCl 兩種離子液體的性能接近,但是后者的熔點(68℃)偏高,無法在低溫下溶解烴類,因此優選鹽酸三乙胺作為離子液體的陽離子供體。
實驗發現離子液體中CuCl 的含量會影響小分子烷烴與烯烴的溶解性。調變Et3NHCl與CuCl的摩爾比合成了一系列離子液體,在溫度30℃、壓力0.2 MPa 及轉速800 r/min 的操作條件下,考察了離子液體對乙烯和乙烷的溶解性能,結果見表3。對于Et3NHCl?xCuCl 離子液 體,當x<2.1 時,隨著CuCl/Et3NHCl 摩爾比的增加,離子液體中乙烯的溶解度和乙烯/乙烷溶解選擇性逐漸增大,乙烷的溶解度逐漸減小。但當2.1≤x≤2.4 時,CuCl/Et3NHCl 摩爾比對乙烯、乙烷的溶解度和乙烯/乙烷溶解選擇性影響不大。在離子液體合成過程中,當x≥2.2 時,CuCl 并未完全溶解,因此CuCl 與Et3NHCl 的最佳摩爾比為2.1∶1,此時乙烯/乙烷的溶解選擇性可達8.78。已有文獻報道,含Cu(Ⅰ)或Ag 的離子液體或離子液體與Cu(Ⅰ)鹽或Ag 鹽的復配溶劑可以與烯烴的不飽和鍵之間有較強的相互作用,表現出對烯烴的溶解度較大[19,29,34]。Cu(Ⅰ)鹽或Ag 鹽與烯烴不飽和鍵之間的作用通過計算機模擬得到了驗證和解釋[35]。烯烴的雙鍵能夠與含有空軌道的Cu(Ⅰ)發生π 絡合,使乙烯在離子液體中的溶解度增大,這是CuCl類離子液體對乙烯溶解度遠高于其他Lewis 酸類離子液體的主要原因。綜上,優選出的用于小分子烯烴和烷烴溶解分離的離子液體是Et3NHCl?2.1CuCl。該離子液體的密度(30℃)、黏度(30℃)和熔點分別是1.7361 g/ml、272 mPa·s和?66℃。
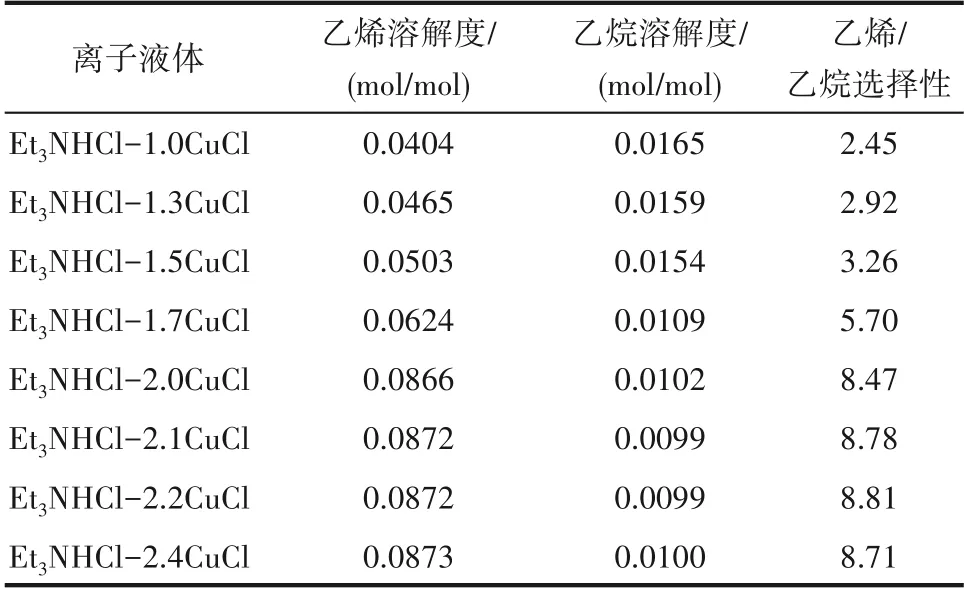
表3 CuCl/Et3NHCl摩爾比對乙烯與乙烷的溶解度和溶解選擇性的影響Table 3 Effect of CuCl/Et3NHCl molar ratio on solubility and solubility selectivity of ethene and ethane
2.2 離子液體Et3NHCl-2.1CuCl 對小分子烷烴與烯烴的溶解規律
2.2.1 溫度對小分子烷烴與烯烴溶解度的影響 針對優選出的Et3NHCl?2.1CuCl 離子液體,在壓力0.2 MPa、轉速800 r/min 的條件下,在30~70℃范圍內考察了溫度對小分子烷烴和烯烴溶解性能的影響規律,結果見表4。隨溫度的升高,小分子烴類在離子液體中的溶解度呈現減小的趨勢,且烯烴溶解度的減小幅度比烷烴的明顯。溫度從30℃升高到70℃,烯烴/烷烴溶解選擇性也呈現減小的趨勢,且乙烯/乙烷溶解選擇性與丙烯/丙烷溶解選擇性減小幅度較大,分別達到了52%和49%;而異丁烯/異丁烷溶解選擇性減小較為緩慢,降幅僅為16%。
烴類在離子液體中的溶解包括化學溶解和物理溶解,化學溶解為放熱效應,升高溫度不利于氣體的溶解。以物理作用溶解在離子液體的烴類,分子的熱運動速率隨著溫度的升高而加大,容易從離子液體的表面逸出。烯烴的雙鍵能夠與離子液體中的Cu(Ⅰ)絡合,烯烴與離子液體之間的作用包括物理作用和化學作用,因此其溶解包括物理溶解和化學溶解。烷烴與離子液體之間的作用主要是物理作用,其溶解主要為物理溶解。烯烴雙鍵Cu(Ⅰ)的絡合作用不強,溫度對其影響較大,表現為升溫后烯烴溶解度的降幅較大,而烷烴溶解度的降幅相對較小。實驗考察范圍內最佳的溶解溫度為30℃,此時具有最大的烯烴/烷烴溶解選擇性和最大的烯烴溶解度。
2.2.2 壓力對小分子烷烴與烯烴溶解度的影響 針對優選出的Et3NHCl?2.1CuCl 離子液體,在溫度30℃、轉速800 r/min的條件下,在0.2~0.81 MPa范圍內考察了壓力對小分子烷烴和烯烴溶解性能的影響規律,結果見表5。壓力從0.2 MPa 升高到0.81 MPa,小分子烴類在離子液體中的溶解度呈現增大的趨勢,且烷烴溶解度的增大幅度比烯烴的明顯,乙烯和丙烯溶解度分別增加到初始的2.76倍和2.71倍,而乙烷和丙烷溶解度分別增大到初始的6.83 倍和4.27 倍;受此影響,烯烴/烷烴溶解選擇性呈現減小的趨勢,且乙烯/乙烷溶解選擇性與丙烯/丙烷溶解選擇性的降幅分別達到了60%和37%。受飽和蒸氣壓的影響,異丁烷和異丁烯的溶解度僅在0.3 MPa 以下進行測試,得到的溶解規律跟乙烷、乙烯、丙烷、丙烯是相似的。
由廣義的亨利定律可知,在一定溫度下,當氣體溶解達到平衡時,氣體在此溶液中的溶解度和氣相中該氣體的分壓呈正比,而離子液體對氣體的物理溶解在一定程度上符合廣義亨利定律。伴隨壓力的升高,烴類在離子液體中的物理溶解和化學溶解都會增大,且物理溶解的增大幅度比化學溶解的大,因此物理溶解的作用比例在逐步增大。表現為烯烴溶解度隨壓力升高的增幅較小,而烷烴溶解度的增幅相對較大。實驗考察范圍內較為合適的壓力為0.2 MPa,此時具有最大的烯烴/烷烴溶解選擇性。
2.2.3 與文獻報道的溶解性能對比 常規的離子液體對小分子烯烴/烷烴溶解選擇性較低[28],將含Cu(Ⅰ)、Ag 的鹽溶解到離子液體中形成復配溶劑可以大幅提升溶解選擇性,本小節匯總了文獻報道的一些較好的結果與本文的研究結果,如表6 所示。離子液體中溶解的Cu(Ⅰ)鹽或Ag 鹽越多,其對烯烴的溶解度和烯烴/烷烴選擇性越高。離子液體中添加Ag鹽得到的復配溶劑對小分子烴類表現出較高的溶解度和烯烴/烷烴選擇性,這主要得益于Ag 鹽中的陰離子對Ag+的作用。本文合成的離子液體在較為苛刻的條件下(較高的壓力和溫度)的丙烯/丙烷選擇性,與文獻報道的含有Cu(Ⅰ)鹽的復配溶劑在較低的溫度和壓力下的丙烯/丙烷選擇性相近,同時本文合成的離子液體具有更高的烯烴溶解度。
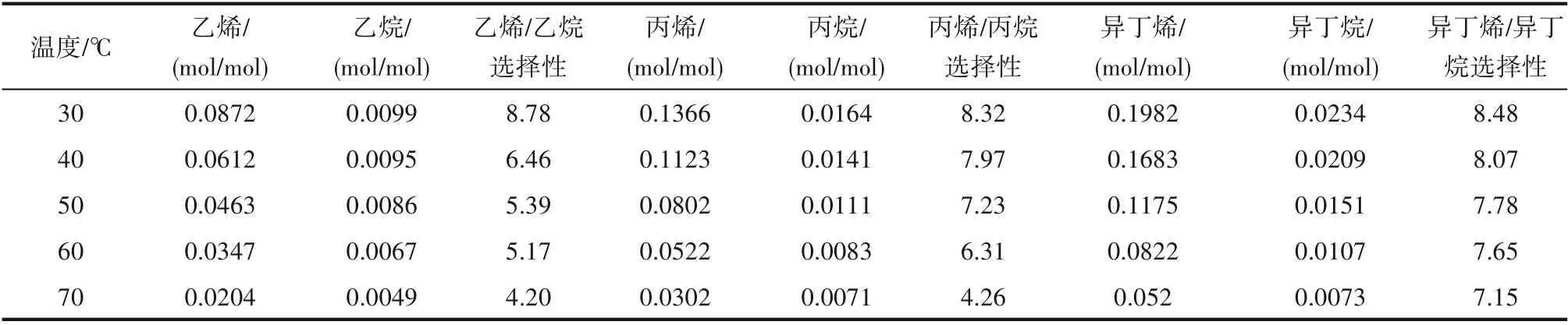
表4 溫度對小分子烷烴與烯烴溶解度及溶解選擇性的影響Table 4 Effect of temperature on solubility and solubility selectivity of alkanes and alkenes
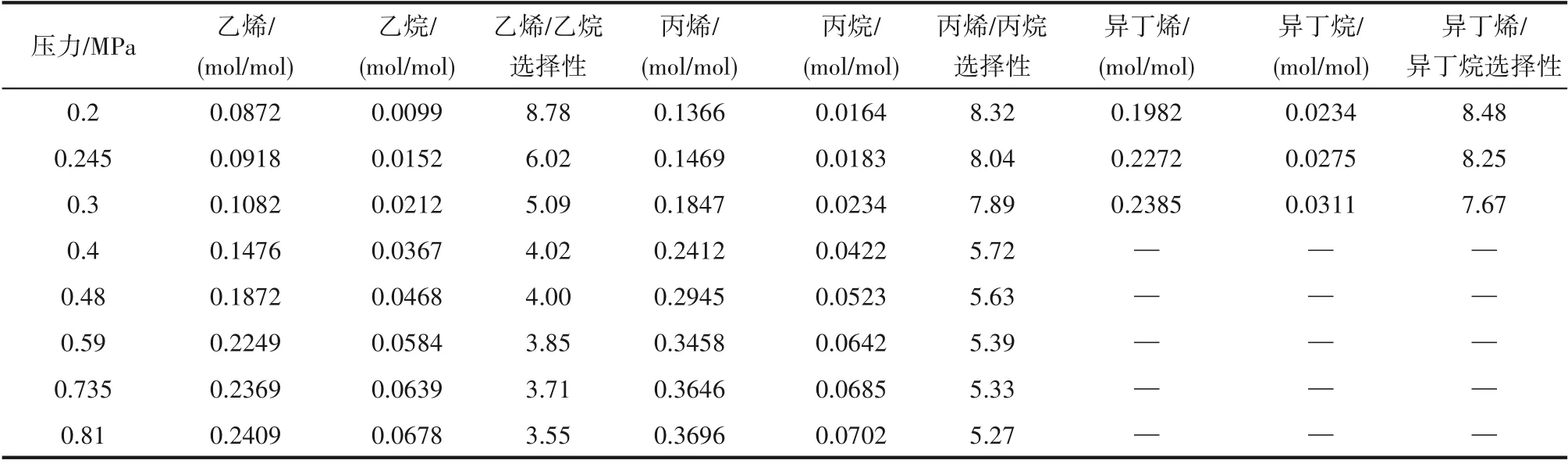
表5 壓力對小分子烷烴與烯烴溶解度及溶解選擇性的影響Table 5 Effect of pressure on solubility and solubility selectivity of alkanes and alkenes
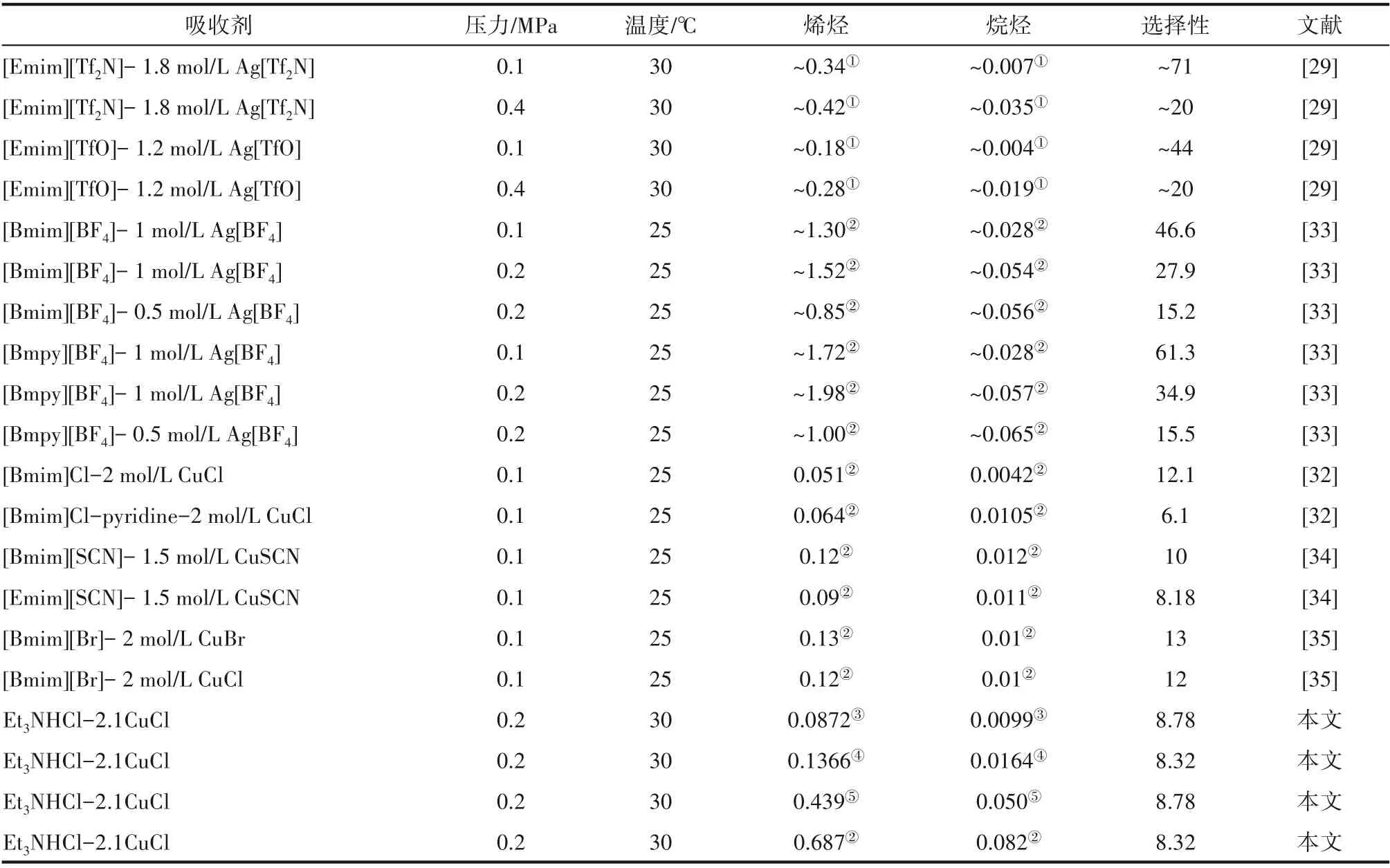
表6 小分子烷烴與烯烴在不同吸收劑中的溶解性能Table 6 Solubility of light alkanes and alkenes in different absorbents
2.3 離子液體中小分子烴類的溶解速率
對于氣體吸收分離過程,溶解度和溶解速率是化工設計的重要參數,決定了操作過程和設備的效率。在初始壓力0.2 MPa、離子液體加入量20 ml、轉速為800 r/min 的條件下,研究了不同溫度下丙烷、丙烯在離子液體Et3NHCl?2.1CuCl 中的溶解速率,結果如圖2 所示。在溫度30℃、轉速為800 r/min 的條件下,研究了不同初始壓力下乙烷、乙烯在離子液體Et3NHCl?2.1CuCl 中的溶解速率,結果如圖3所示。
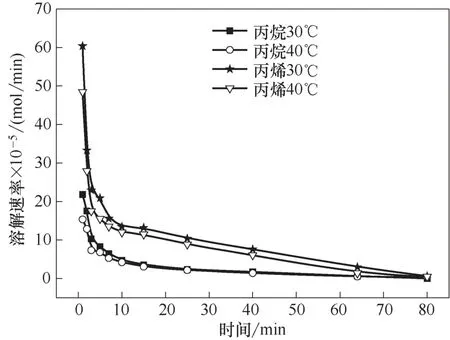
圖2 不同溫度下丙烷與丙烯溶解速率隨時間的變化Fig.2 Dissolution rate of propane and propene as a function of time at different temperatures
隨著溶解時間的延長,烯烴與烷烴的溶解速率均先快速減小,之后緩慢減小,最后接近于0。溶解的一開始,離子液體中沒有烴類,氣相中烴類的壓力高,此時有較大的溶解推動力,溶解速率最大;伴隨烴類在離子液體中的溶解,離子液體中烴類的濃度逐漸升高,氣相中烴類壓力逐漸減小,溶解推動力減小,溶解速率也減小。烯烴的溶解速率高于相應烷烴的溶解速率,但是烯烴達到溶解平衡所需的時間比相應的烷烴長。
在轉速一定時,氣體的溶解速率受溫度和壓力的影響。在較短的時間內,較低的溫度和較高的壓力有利于氣體溶解;隨著時間的延長,溫度和壓力對氣體溶解速率的影響逐漸減小,當氣體溶解接近平衡時,氣體的溶解速率幾乎為零。因此,為了提高離子液體對小分子烷烴和烯烴的分離效率,需要選擇合適的操作溫度和壓力。
2.4 離子液體對小分子烷烴烯烴混合物的吸收分離
在溫度30℃、壓力0.2 MPa 的操作條件下,用離子液體Et3NHCl?2.1CuCl 對乙烷乙烯混合氣、丙烷丙烯混合氣進行吸收分離,混合氣中烯烴體積分數為20%~80%。根據測試結果計算出了離子液體對混合氣的烯烴/烷烴分離選擇性,結果如圖4 所示。隨著烯烴在混合氣中體積含量的增大,烯烴/烷烴分離選擇性呈現下降趨勢,且烯烴含量較低時下降幅度較大。在不同的原料配比下,烷烴與烯烴在離子液體中的平衡溶解量均隨著其在混合氣中含量的增加而增大,且烯烴的溶解量比烷烴的大。混合氣中烯烴含量較低時,烯烴與Cu(Ⅰ)的絡合比例較大,在離子液體相的分配系數較大,因此烯烴/烷烴的分離選擇性較高。實驗結果表明,離子液體對烯烴體積分數介于20%~50%之間的混合氣具有良好的分離效果,不僅具有較高的烯烴/烷烴分離選擇性,而且保證了對烯烴的溶解能力。
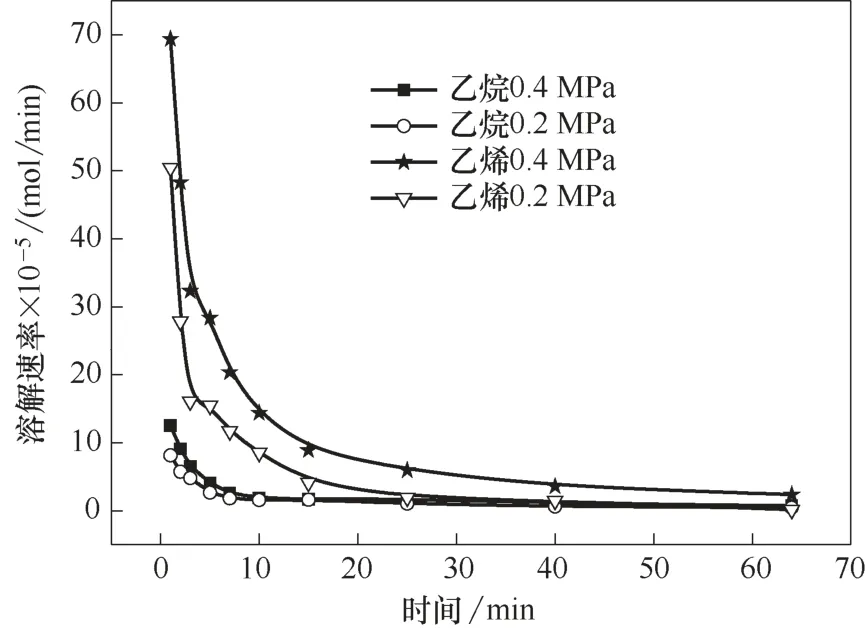
圖3 不同初始壓力下乙烷與乙烯溶解速率隨時間的變化Fig.3 Dissolution rate of ethane and ethene as a function of time at different initial pressures
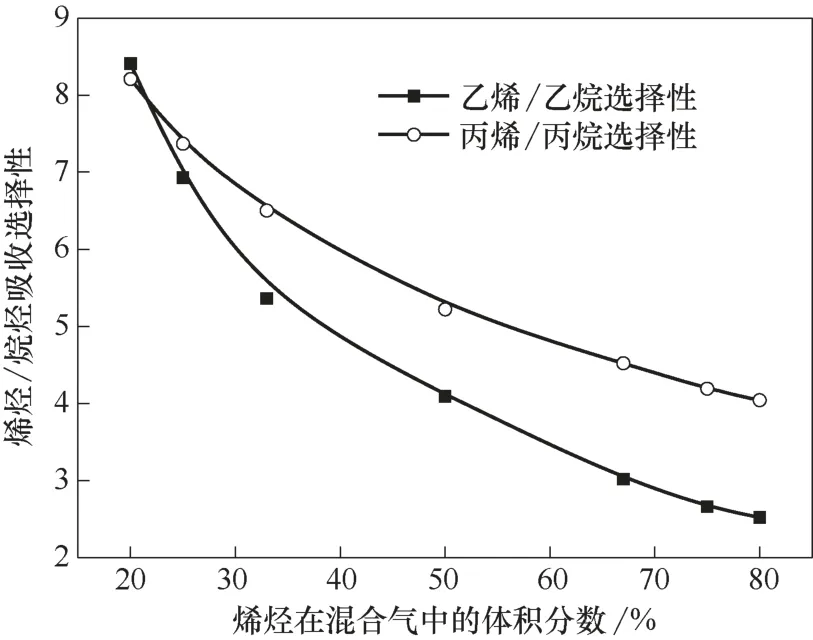
圖4 不同原料配比下在離子液體中的烯烴/烷烴分離選擇性Fig.4 Alkene/alkane separation selectivity in ionic liquid at different alkene contents
2.5 離子液體中小分子烴類的解吸
在適當條件下將離子液體中的烴類解吸出來,是離子液體循環利用的前提。烯烴在離子液體中的溶解主要是化學作用和物理作用的雙重結果,而烷烴主要為物理溶解。烯烴雙鍵與離子液體中的Cu(Ⅰ)發生的π 絡合作用較弱,高溫時絡合作用容易被打破,釋放出烯烴;在高溫時物理溶解的烷烴和部分烯烴也容易釋放出來。在溫度30℃、壓力0.2 MPa、轉速800 r/min 的操作條件下,首先用Et3NHCl?2.1CuCl離子液體對氣體進行溶解實驗,當氣體溶解達到平衡時開始對氣體進行解吸,考察解吸溫度和時間對解吸率的影響,結果見圖5~圖7。
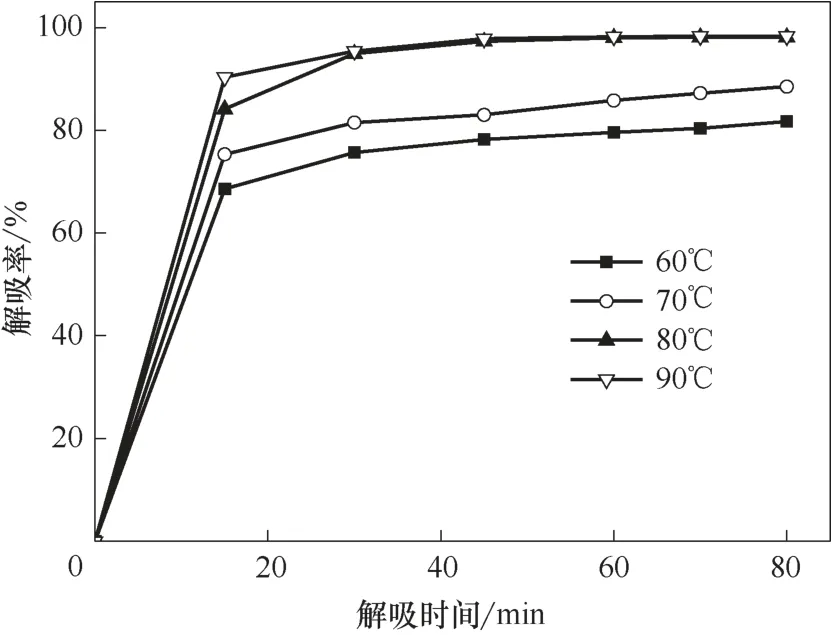
圖5 不同溫度下乙烷解吸率隨解吸時間的變化趨勢Fig.5 Desorption percentage of ethane as a function of desorption time at different temperatures
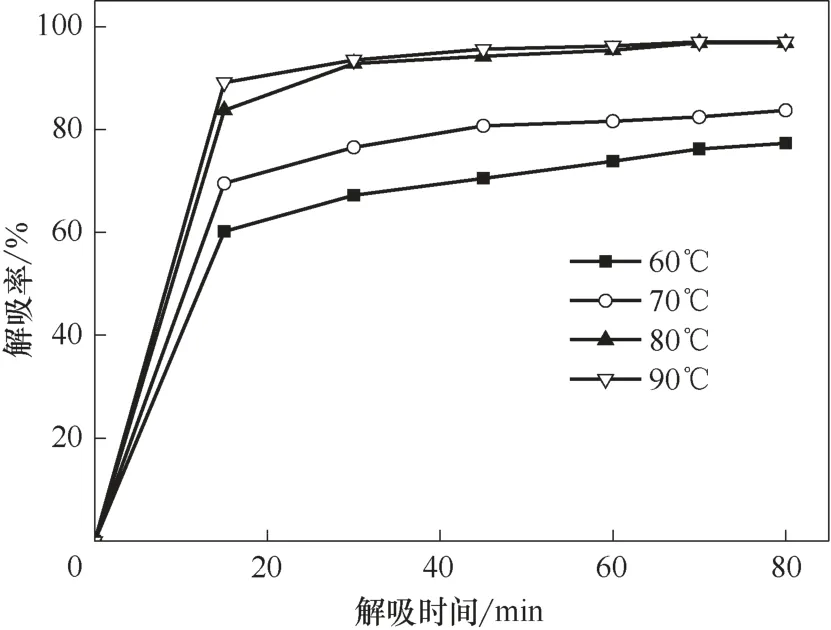
圖6 不同溫度下乙烯解吸率隨解吸時間的變化趨勢Fig.6 Desorption percentage of ethene as a function of desorption time at different temperatures
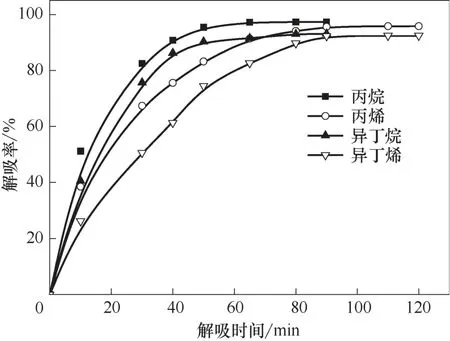
圖7 80℃下丙烷、丙烯、異丁烷和異丁烯解吸率隨解吸時間的變化趨勢Fig.7 Desorption percentage of propane,propene,i?butane and i?butene as a function of desorption time at 80℃
無論烯烴還是烷烴,解吸率隨解吸時間的延長先快速增大,在解吸一段時間后緩慢增大,直到解吸達到平衡。小分子的乙烷最容易解吸,較快達到解吸平衡;其次是乙烯,再次是丙烷和異丁烷,解吸最慢的是丙烯和異丁烯。相對來說,分子越小,解吸時間越短;烷烴比同碳數的烯烴容易解吸。溫度對解吸率也有較大的影響,解吸率隨溫度的升高而增大,且隨著解吸時間的延長,溫度對解吸率的影響逐漸堿小。當溫度高于80℃后,解吸率受溫度的影響較小。
實驗確定了小分子烴類較優的解吸條件和相應的解吸率,較優的解吸溫度是80℃,乙烷在解吸時間40 min 的解吸率達97.2%,乙烯在解吸時間55 min的解吸率達95.4%,丙烷在解吸時間50 min的解吸率達94.8%,丙烯在解吸時間80 min 的解吸率為93.1%,異丁烷在解吸時間70 min 的解吸率為93.0%,異丁烯在解吸時間90 min 的解吸率為92.3%。分子越大,較優的解吸時間越長,相應解吸率也緩慢減小。
2.6 離子液體的重復利用
離子液體將溶解在其中的小分子烴類解吸之后,進一步考察其重復利用性能。將離子液體的第n 次重復利用效率定義為第n 次解吸后離子液體對烴類溶解度(或烷烴/烯烴選擇性)與新鮮離子液體對烴類溶解度(或烷烴/烯烴選擇性)的比值的百分數。
在溫度30℃、壓力0.2 MPa、轉速800 r/min 的操作條件下,利用新鮮離子液體Et3NHCl?2.1CuCl 分別對小分子烷烴和烯烴進行吸收,當吸收達到平衡后,計算出溶解度;之后升高溫度解吸溶解在離子液體中的氣體直至解吸達到平衡。在上述相同的操作條件下,反復進行吸收?解吸實驗,考察離子液體的重復利用性能,實驗結果見表7。隨著重復利用次數的增多,小分子烷烴和烯烴在離子液體中的溶解度均會緩慢減小,表現為離子液體重復利用效率緩慢減小;而烯烴/烷烴溶解選擇性幾乎沒有變化。當離子液體重復利用5 次時,小分子烴類在離子液體中的溶解度相比其在新鮮離子液體中的溶解度的減小幅度基本在5%以內,說明離子液體的重復利用性能良好。
2.7 實驗結果的量子化學計算解釋
實驗研究和文獻報道均發現,離子液體的陰離子對小分子烯烴和烷烴的溶解性能影響較大,因此本節利用Gaussian 09 軟件對前述離子液體的陰離子作用進行了分析計算。所有結構的優化和頻率分析均在PBE0?D3 泛函結合自定義基組的水平下完成,所獲得的結構為極小點結構,無虛頻。自定義基組如下:對Al、Cl 選用6?311+G**基組,對Cu、Fe 選 用SDD 贗 勢 基 組 和 贗 勢,對C、H 選 用6?311G**基組。乙烯、乙烷與各種金屬陰離子結合能的計算均在雙雜化泛函RI?PWPB95?D3 結合ma?def2?QZVPP基組的水平下完成,通過ORCA 4.2[36]軟件包實現。所有分子結構圖的繪制通過Gaussian View 5.0.9實現,所有等值面圖和平面圖的得出和繪制由Multiwfn 3.7(dev)[37]和VMD 1.9.3[38]軟件實現。
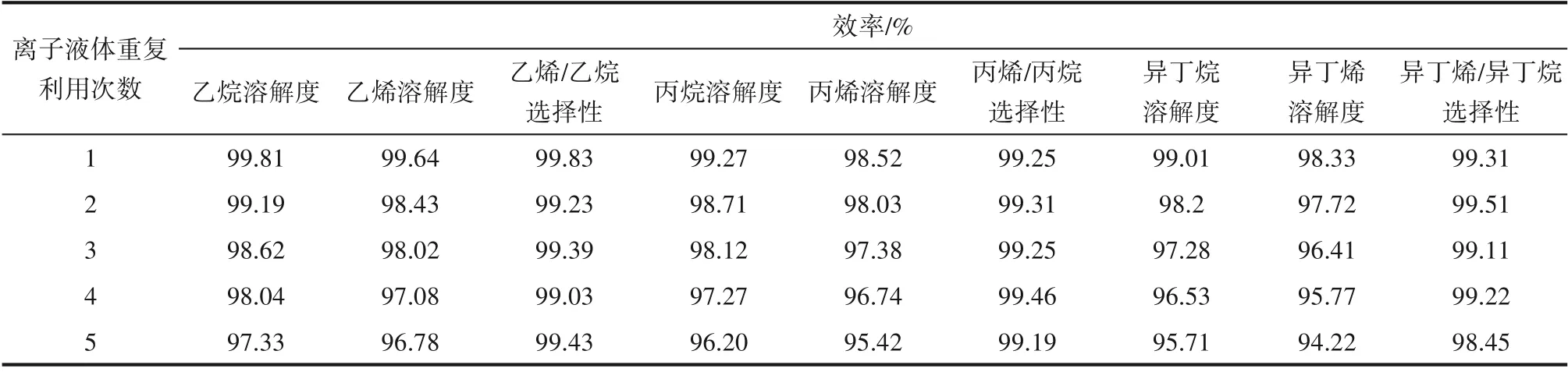
表7 離子液體對小分子烴類溶解的重復利用效率Table 7 Reusing efficiency of ionic liquid for dissolution of light hydrocarbons
在陽離子供體相同時,陰離子供體的不同對乙烯的溶解性有著顯著影響,其中CuCl作為陰離子供體時合成的離子液體對乙烯/乙烷的溶解度最高。在離子液體中,當CuCl與陽離子供體的摩爾比小于1 時,其陰離子主要為[CuCl2]ˉ,當CuCl 與陽離子供體的摩爾比大于1 時其陰離子中[Cu2Cl3]ˉ隨摩爾比的增大而逐漸增加,當CuCl與陽離子供體的摩爾比為2 時,陰離子主要為[Cu2Cl3]ˉ。那么當陰離子供體為AlCl3和FeCl3時,其對應的陰離子分別是[AlCl4]ˉ、[Al2Cl7]ˉ、[FeCl4]ˉ、[Fe2Cl7]ˉ。通過量化計算考察了上述六種陰離子與乙烯的作用結構及其結合能,結果如圖8所示。
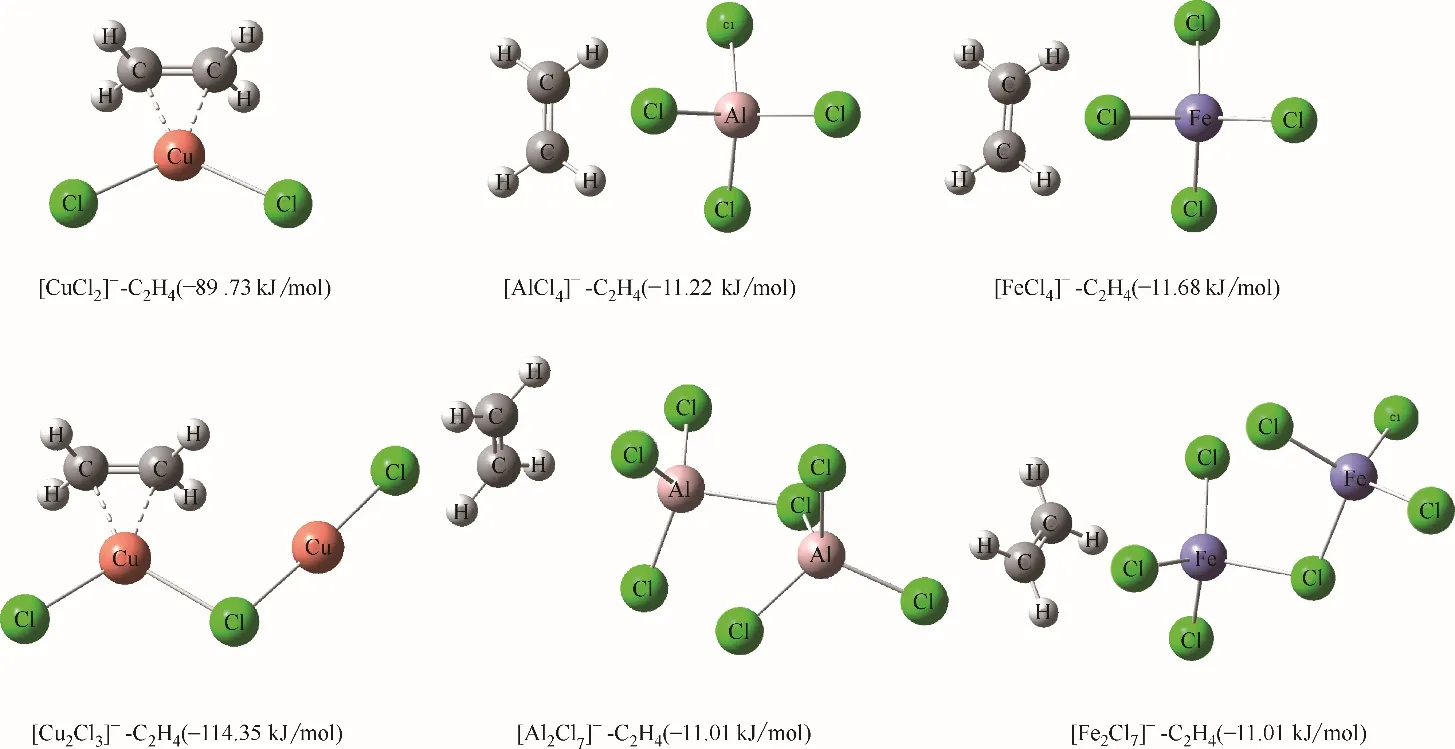
圖8 六種陰離子與乙烯的作用結構及結合能Fig.8 Interaction structure and binding energy between C2H4 and various anions
從結合能來看,[CuCl2]ˉ和[Cu2Cl3]ˉ對乙烯的結合能顯著大于[AlCl4]ˉ、[Al2Cl7]ˉ、[FeCl4]ˉ、[Fe2Cl7]ˉ的結合能,這說明[CuCl2]ˉ和[Cu2Cl3]ˉ對烯烴具有較強的絡合作用,而[AlCl4]ˉ、[Al2Cl7]ˉ、[FeCl4]ˉ、[Fe2Cl7]ˉ與烯烴之間則為范德華作用和以靜電作用為主導的Cl…H—Cl 弱氫鍵作用。因此,CuCl 作為陰離子供體時合成的離子液體對乙烯的溶解度最高。實際上[CuCl2]ˉ和[Cu2Cl3]ˉ與烯烴的相互作用即為Dewar?Chatt 模型[39]中π 絡合作用。以[CuCl2]ˉ?C2H4絡合物為例進行分析,對其產生的分子軌道按Pipek?Mezey方法[40]進行軌道定域化,得到有利于絡合物形成的兩個主要定域化分子軌道,如圖9 所示。可以看出,一個定域化軌道[圖9(a)]由于乙烯的π 軌道與Cu(Ⅰ)的sp2型雜化軌道重疊形成,也就是π 電子向Cu(Ⅰ)空軌道的饋贈,構成三中心兩電子σ 鍵。而另一個定域化軌道[圖9(b)]由烯烴的π*軌道與Cu(Ⅰ)的dxy軌道重疊形成,也就是d電子向乙烯的反向饋贈,構成三中心兩電子π鍵,其對絡合物的穩定起到重要作用。同樣地,從π 電子密度分布[圖9(c)],也可以看出π電子被束縛在Cu?C鍵上,烯烴的π電子密度減小,雙鍵被削弱。電子定域化函數(electron localization function, ELF)[41]和定域化軌道定位函數(localized orbital locator, LOL)[42][圖9(d)、(e)]經常被用來衡量電子的定域性,從絡合物的ELF和LOL 平面圖可以看出,無論是Cu?C 鍵還是Cu?Cl鍵的電子定域性都很弱,這是因為Cu?Cl和Cu?C 鍵均為強極性共價鍵,并有強離子性特征。
[CuCl2]ˉ和[Cu2Cl3]ˉ為何會對乙烯/乙烷、丙烯/丙烷實現高選擇性的溶解呢?同樣地,從結合能的角度進行定量分析,[CuCl2]ˉ和[Cu2Cl3]ˉ與乙烷、丙烯、丙烷的作用結構及其結合能如圖10所示。結合圖8和圖10 可以看出,[CuCl2]ˉ和[Cu2Cl3]ˉ結合乙烯、丙烯的能力顯著強于乙烷、丙烷,因此CuCl 離子液體能夠通過化學作用實現高選擇性地溶解乙烯、丙烯,而乙烷、丙烷則是通過物理作用溶解。
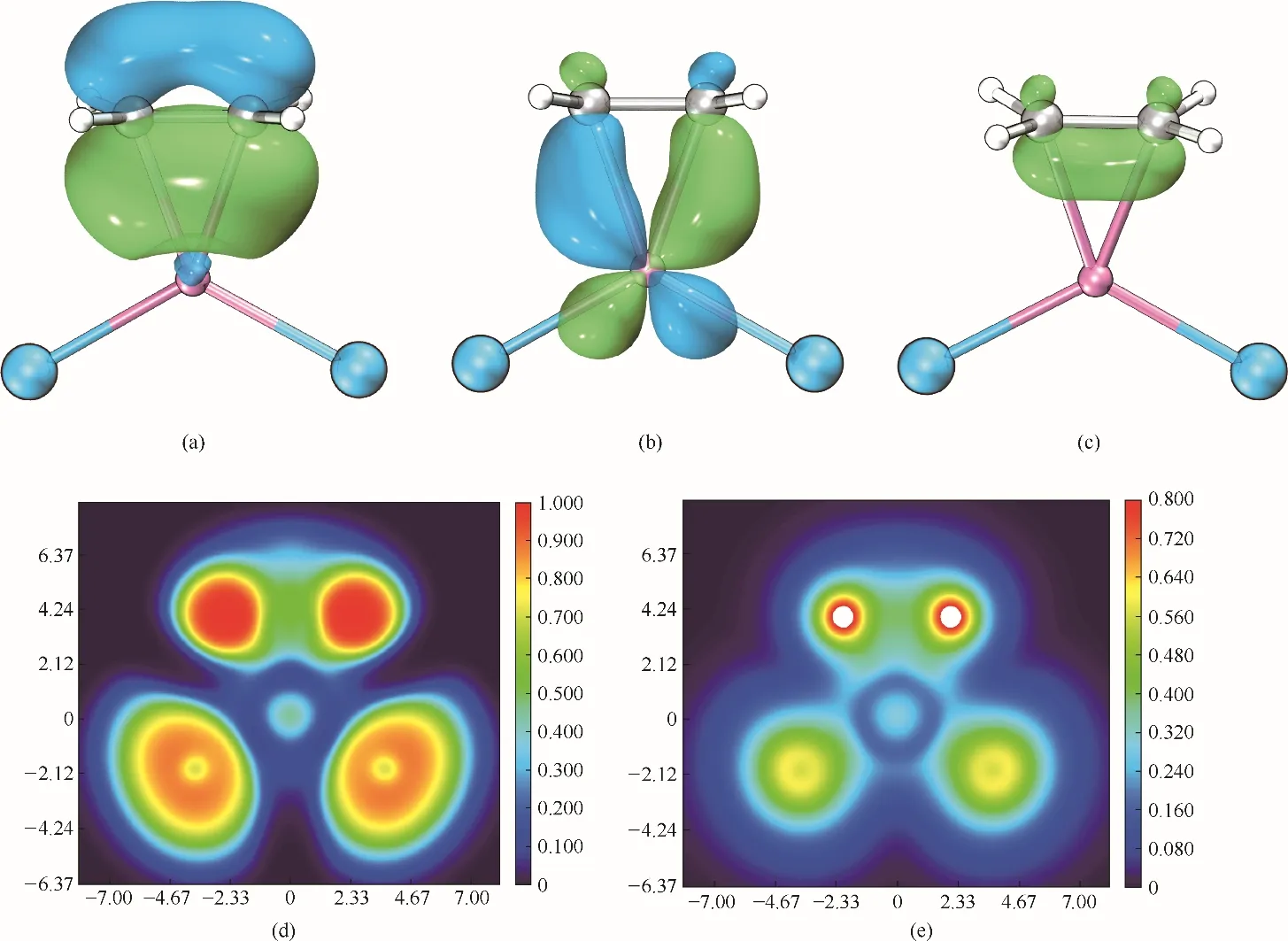
圖9 [CuCl2]ˉ?C2H4絡合物的定域化軌道[(a)、(b)];π電子密度等值面圖(c)(等值面設為0.05);ELF和LOL平面圖[(d)、(e)]Fig.9 LMOs[(a),(b)],π electron density isosurface map(isovalue=0.05)(c),ELF(d)and LOL(e)color filled map of[CuCl2]ˉ?C2H4complex
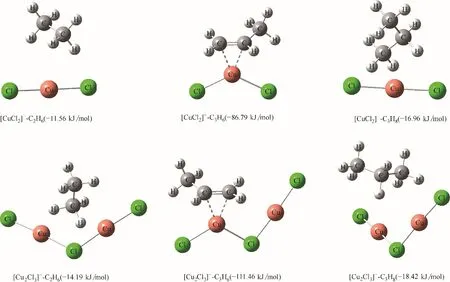
圖10 [CuCl2]ˉ、[Cu2Cl3]ˉ與乙烷、丙烯、丙烷的作用結構及結合能Fig.10 Interaction structure and binding energy between[CuCl2]ˉ([Cu2Cl3]ˉ)and C2H6(C3H6,C3H8)
對比[CuCl2]ˉ和[Cu2Cl3]ˉ與乙烯、乙烷的結合能,不難發現[Cu2Cl3]ˉ與[CuCl2]ˉ更容易結合乙烯,實驗結果表明,當CuCl 與陽離子供體摩爾比大于1 時,增加CuCl 的量也確實會提高離子液體對乙烯/乙烷的溶解選擇性,實驗與計算結果具有較好的一致性。從結構上來看,[CuCl2]ˉ?C2H4和[Cu2Cl3]ˉ?C2H4兩個絡合結構中,Clˉ具有價層滿8 電子結構,其與Cu+結合時,Cu (Ⅰ)的三個sp2雜化軌道分別與兩個Cl的p軌道重疊及乙烯的π軌道重疊形成3個σ鍵,呈平面三角形構型。所不同的是有一個Cl 所處的環境不同,[CuCl2]ˉ中是端Cl,而[Cu2Cl3]ˉ中是橋Cl,這使得Cu(Ⅰ)的配位環境不同,因而造成Cu(Ⅰ)絡合烯烴的能力不同。具體體現在Cu(Ⅰ)對烯烴的靜電作用和Cu(Ⅰ)周圍電子的軟度,整個過程可看作是親核試劑對親核位點的進攻,考慮引入Hirshfeld原子電荷[43]表征Cu(Ⅰ)的靜電作用,引入概念密度泛函中的局部親核指數[44]來表征Cu(Ⅰ)周圍電子的軟度,結果如表8 所示。顯然,[Cu2Cl3]ˉ中Cu(Ⅰ)的正電性顯著強于[CuCl2]ˉ中Cu(Ⅰ)的正電性,這意味著[Cu2Cl3]ˉ中Cu(Ⅰ)具有更強的長程靜電作用,更容易將乙烯分子拉到Cu(Ⅰ)位點附近。而更高的親核指數則表明[Cu2Cl3]ˉ中Cu(Ⅰ)更容易與其附近乙烯發生親核反應。綜合來看,[Cu2Cl3]ˉ比[CuCl2]ˉ更容易絡合乙烯。
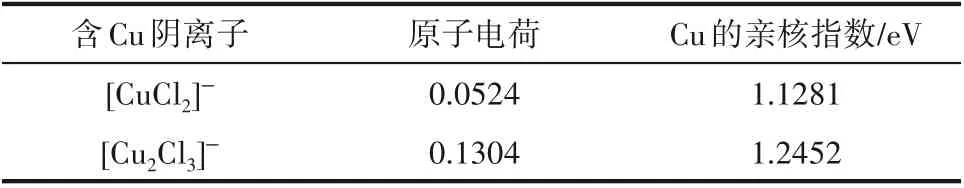
表8 兩種含Cu陰離子中Cu的Hirshfeld原子電荷和親核指數Table 8 Hirshfeld atomic charge and nucleophilicity index
僅從單分子乙烯結合能來看,兩者之間的結合能的差距并非十分顯著,無法解釋含CuCl離子液體對乙烯/乙烷選擇性的巨大提升(2.45~8.78)。實際上[Cu2Cl3]ˉ具有雙Cu(Ⅰ)位點,并且其在結合一分子乙烯的情況下,另一Cu(Ⅰ)位點與另一分子乙烯的結合能仍能達到?110.91 kJ/mol[圖11(a)],這意味著[Cu2Cl3]ˉ的活性位點明顯多于[CuCl2]ˉ,因此能夠結合更多分子的乙烯。實際上當CuCl 與陽離子供體的摩爾比為2.1 時,[Cu3Cl4]ˉ也有所增加,其具有兩種Cu(Ⅰ)位點,中間的Cu(Ⅰ)位點與乙烯的結合能(?124.23 kJ/mol)相較于兩端的Cu(Ⅰ)位點與乙烯的結合能(?117.07 kJ/mol)要高,更高于[Cu2Cl3]ˉ與乙烯的結合能(?114.35 kJ/mol)。這就解釋了CuCl 與陽離子供體的摩爾比為2~2.1 時,含CuCl 離子液體對乙烯/乙烷選擇性進一步提升(8.47~8.78)。上述分析都是基于一個Cu(Ⅰ)位點結合一個乙烯的情況,實際上一個Cu(Ⅰ)位點還能結合另一分子乙烯,以形成四配位的扭曲四面體空間構型。需要注意的是,[CuCl2]ˉ與另一乙烯分子的結合能會顯著下降[?56.11 kJ/mol,圖11(b)],這意味著乙烯會優先結合未被占據的Cu(Ⅰ)位點,對于[Cu2Cl3]ˉ也有著同樣的結論[圖11(c)],但?92.91 kJ/mol 的結合能仍然略大于[CuCl2]ˉ對C2H4的結合能,進一步說明了[Cu2Cl3]ˉ對乙烯結合的巨大優勢。
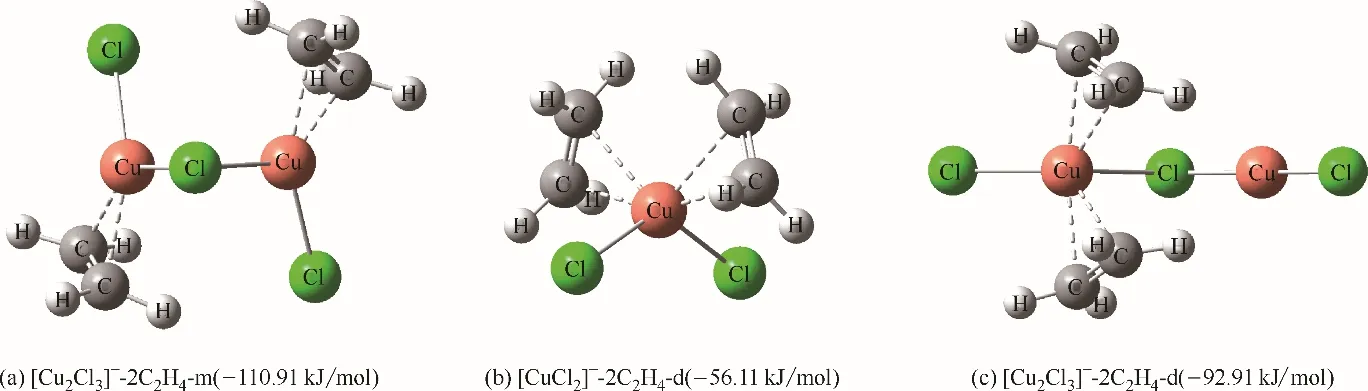
圖11 [CuCl2]ˉ、[Cu2Cl3]ˉ與兩分子乙烯的作用結構及結合能Fig.11 Interaction structure and binding energy between[CuCl2]ˉ,[Cu2Cl3]ˉand two ethylene molecules
3 結 論
(1)含有Cu(Ⅰ)的離子液體對小分子烴類呈現出較高的溶解度和烯烴/烷烴溶解選擇性,優選出的離子液體是Et3NHCl?2.1CuCl。
(2)低溫和高壓有利于烴類在離子液體中的溶解,升高溫度和壓力會減小烯烴/烷烴溶解選擇性;烯烴/烷烴溶解選擇性在30℃和0.2 MPa的條件下均大于8.3。
(3)烴類在離子液體中的溶解速率在溶解初始時較大且隨時間的延長快速減小,烯烴的溶解速率高于烷烴的溶解速率。烯烴與烷烴混合氣中烯烴的含量越低,烯烴/烷烴分離選擇性越大。
(4)升溫可將小分子烴類從離子液體中解吸出來,恢復離子液體對烴類的溶解能力。烷烴比烯烴容易解吸,小分子烴類比大分子烴類容易解吸。在解吸溫度80℃和一定時間下,解吸率可達92%以上。
(5)離子液體對小分子烷烴和烯烴的吸收分離具有良好的重復使用性能,重復利用5 次時溶解度的減小幅度不超過5%,且對烯烴/烷烴溶解選擇性基本無影響。
(6)通過量子化學計算得到了離子液體中不同陰離子與小分子烴類的作用結構與結合能,解釋了含CuCl 離子液體對烯烴溶解度高以及Et3NHCl?2.1CuCl離子液體具有高烯烴/烷烴選擇性的原因。
符 號 說 明
MIL——離子液體的摩爾質量,g/mol
mIL——離子液體的質量,g
nH,nIL——分別為溶解的烴類、離子液體的物質的量,mol
nHi,nHi+1——分別為時間為ti和ti+1時溶解氣體的物質的量,mol
Pg0,Pgf——分別為氣體罐初始壓力與溶解結束后的壓力,Pa
Psi,Psi+1——分別為溶解時間為ti和ti+1時氣體溶解罐的壓力,Pa
Ps0,Ps——分別為氣體溶解罐初始壓力與溶解結束后的壓力,Pa
R——氣體常數,8.314 J/(mol·K)
r——烴類在離子液體中的溶解速率,mol/min
s——烯烴/烷烴溶解選擇性
T——溫度,K
ti,ti+1——分別為從溶解開始到i和i+1的時間,min
Vg,VIL,Vs——分別為氣體罐、離子液體與氣體溶解罐的體積,m3
x——烴類在離子液體中的溶解度,mol/mol
xO,xP——分別為烯烴與烷烴的溶解度,mol/mol

