TiO2納米管陣列電合成的擴散-反應耦合強化機制研究
周黃,常禹,范興,張楠楠,陶長元
(重慶大學化學化工學院,重慶401331)
引 言
TiO2因具有安全穩(wěn)定、氧化能力強以及高催化活性等優(yōu)點,在解決環(huán)境污染和緩解能源危機方面具有優(yōu)勢,被寄予厚望[1?9]。其中高度有序的TiO2納米管陣列具有高比表面積、傳輸通道高效、物理化學性能穩(wěn)定等特點,在光催化、傳感器、太陽能電池以及生物等方面應用廣泛[10?16]。Gr?tzel 等[17]通過簡單的電化學陽極氧化鈦金屬板法制備出高度有序排列的TiO2納米管。隨后眾多研究人員對TiO2納米結構的生長、修飾、性質和應用進行了大量的深入工作。TiO2納米管陣列的制備方法有水熱法、模板法、溶膠?凝膠法以及陽極氧化法[18?20]。模板法、溶膠凝膠法、水熱合成法制備的TiO2納米管管長、管徑有限,且不易通過實驗條件控制。而陽極氧化法因其制備的TiO2納米管陣列高度有序、分布均勻且結構多變易控而被廣泛采用。此外,相對于水熱法和模板法制備TiO2納米管,陽極氧化法還有一個不可忽略的優(yōu)勢,即TiO2納米管與Ti 基底直接相連,用作電極時,無需黏結劑,Ti 基底可直接作為集流體[21]。近年來的研究結果表明,通過陽極氧化法制備TiO2納米管過程中影響TiO2納米管形貌、管徑及孔徑的因素有很多,如電解液中氟離子濃度、水含量、施加電壓或電流、陽極氧化時間和電解液的溫度等[22?24]。
盡管陽極氧化法制備TiO2納米管已經(jīng)研究了十幾年,但形成機理方面的報道仍相對較少,尤其是TiO2納米管陣列生長過程的動力學機制方面的基礎研究極為匱乏[25?26], 這極大限制了TiO2納米管陣列的規(guī)模化可控制備以及反應器設計。已有研究認為在電氧化制備TiO2納米管過程中,金屬先溶解成離子,然后水解在電極表面形成凝膠膜。同時,H2O被氧化生成O2和H+。在陰離子配體的作用下,氧化凝膠表面局部過量的H+使其發(fā)生點蝕,從而形成納米管/孔。然后離子在孔中積累,加速腐蝕,導致納米管的生長。氣泡的滲出加速了氣孔的擴大[27]。上述點蝕機理簡單易行。然而很難解釋納米結構的高度周期性分布和沿納米管深度方向的均勻性。高價離子的水解和凝膠化,如Ti4+和Al3+通常是多個步驟的過程,涉及大量中間體,比如TiOHx4?x低聚羥基鈦中間體。電氧化過程中的擴散步驟將與電氧化步驟耦合,使動力學更加復雜。有報道稱,在鈦和鋁電氧化過程中,存在電化學振蕩和其他非線性動力學行為[28?29]。Tao等[30]詳細解釋了TiO2納米管陣列的自組織形成機制,提出溶解?擊穿模型,他們指出由于氧化物的膨脹效應以及反應熱的原因,使機體內(nèi)部能量增大。為使內(nèi)部能量和表面能平衡,表面能必須增大,此時氧化物層表面產(chǎn)生裂隙縫,再通過裂隙出的擊穿?溶解反應形成納米管。以上所做的研究都是從電流的動態(tài)變化來研究TiO2納米管陣列的化學形成過程,并提出相應的模型,解釋了納米管形貌的變化。但是此模型中所涉及的反應機制難以解釋此過程中出現(xiàn)的電流振蕩現(xiàn)象,更無法解析納米管兩端通透等現(xiàn)象。近代非平衡非線性物理化學理論研究表明:在遠離平衡的反應擴散耦合體系中,如果存在中間體自催化活化等非線性動力學機制,將可能導致產(chǎn)生空間有序的斑圖結構以及周期性電化學振蕩等非線性現(xiàn)象[31]。相關理論已廣泛應用于解釋生物周期律等宏觀時空自組織現(xiàn)象。然而在解釋納米/微米系統(tǒng)中的非線性自組織機制方面文獻報道甚少[32?33]。非線性動力學機制的研究將有助于合成更先進的氧化物納米陣列。
本文系統(tǒng)考察了陽極氧化法制備TiO2納米管陣列過程的生長機制。探索了溫度、電壓、氟含量及水含量等對TiO2納米管生長速率以及不同生長階段電化學行為的影響,制備了結構規(guī)整的TiO2納米管陣列。研究還利用電化學阻抗等方法測試TiO2納米管生長初期界面電化學的演變,并分析了等效電路的變化,基于非線性動力學理論的視角探討了TiO2納米管陣列生長過程中非線性動力學機制。
1 實驗材料和方法
1.1 材料
乙二醇、氟化銨、無水乙醇、丙酮和氫氟酸,分析純,重慶川東化工(集團)有限公司化學試劑廠;鈦片電極(99.9%):2 mm×2 cm×2 cm,寶雞市利泰有色金屬有限公司;不銹鋼片電極:2 mm×2 cm×2 cm,重慶助研科技有限公司;銀/氯化銀參比電極,重慶助研科技有限公司;試驗用去離子水經(jīng)New Human Power Ⅱ制備。
1.2 實驗方法
1.2.1 樣品前處理 將尺寸為2 mm×2 cm×2 cm 的鈦片以及尺寸為2 mm×2 cm×2 cm 的不銹鋼片用砂紙(600#、800#、1600#)打磨拋光,然后分別以乙醇,丙酮為清洗液超聲清洗10 min 去除表面油污,再經(jīng)去離子水以及乙醇清洗后自然干燥,待用。
1.2.2 陽極氧化 沒有特別說明,燒杯中電解質均含去離子水[2%(體積)]、乙二醇[98%(體積)]、氟化銨[0.3%(質量)]。將不銹鋼片和和鈦片分別插于對應的孔中,固定后保持間距為2 cm,然后將整個裝置放入集熱式恒溫加熱磁力攪拌器,恒溫的溫度設定為30℃。將不銹鋼電極與直流穩(wěn)壓電源(Honbao Experimental Instrumental Factory,China)的 負 極 相連,鈦片與直流穩(wěn)壓電源的正極相連,設置直流穩(wěn)壓電源的輸出電壓為(55、65、85、100 V)。最后打開直流穩(wěn)壓電源,根據(jù)反應特定的時間進行電解反應。反應初始可以觀察到鈦片表面由因拋光得到的灰白色轉變?yōu)樗{色,然后又轉變?yōu)榈S色,而不銹鋼電極上產(chǎn)生了許多氣泡。電解結束后,陽極鈦片在室溫下自然風干24 h 并于馬弗爐中煅燒2 h(450℃)。升溫速率為10℃/min。
1.3 樣品表征與分析測試
退火后TiO2納米管的形貌經(jīng)場發(fā)射掃描電鏡進行形貌表征(FE?SEM,Hitachi S?4800,Japan)。電解電流隨時間的變化通過CHI660D 電化學工作站(Shanghai Chenhua, China)采集采樣電阻分壓測定。交流阻抗分析,采用銀/氯化銀電極作為參比電極在原電解體系中進行測試。
2 實驗結果與討論
2.1 二氧化鈦納米管結構隨電解時間的演變
陽極氧化過程中的電流?時間(I-t)曲線能夠較直接地反映TiO2納米管的形成及變化情況,根據(jù)圖1(a)可知,隨著電解時間的延長,電解電流經(jīng)歷了快速下降階段(1)、小幅上升階段(2)、逐漸下降階段(3)~(4)等幾個階段。為探究納米有序結構隨電解時間的變化規(guī)律,圖1(b)~(d)呈現(xiàn)了在去離子水[2%(體積)]、乙二醇[98%(體積)]、氟化銨[0.3%(質量)]的體系中,65 V 恒壓電解過程中不同階段陽極TiO2結構形貌的變化。
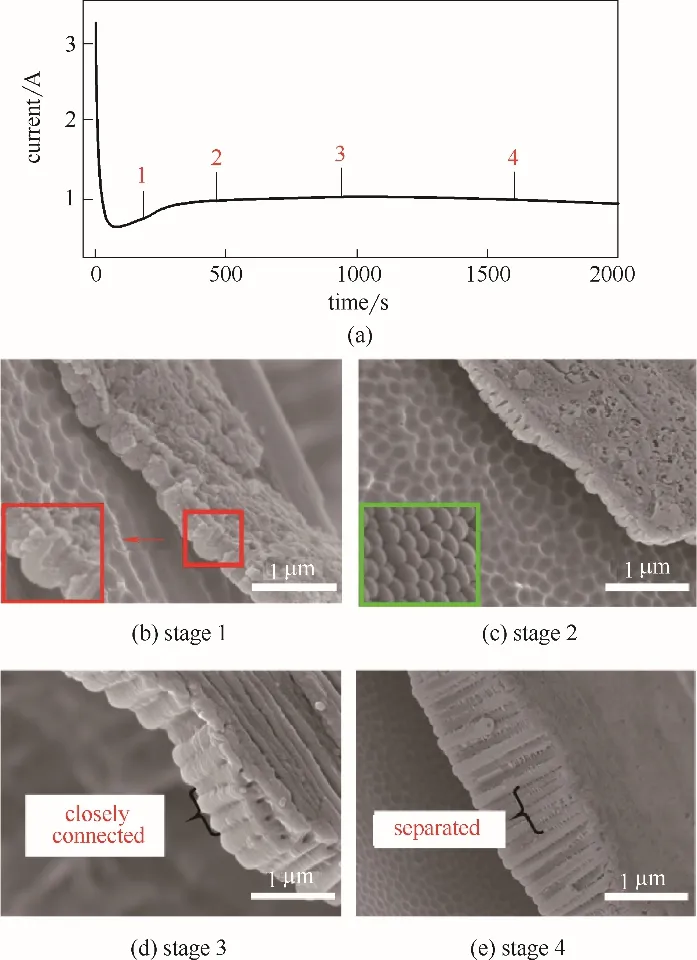
圖1 鈦電極表面TiO2納米管生成過程中電流時間曲線(a)以及(a)圖中TiO2納米管生成過程中階段(1)~(4)的SEM圖[(b)~(e)]Fig.1 Plot of current vs time in growth process of TiO2nanotubes by anodization on surface of Ti electrode(a)and SEM images[(b)—(e)]of TiO2 nanotube arrays at stage(1)—(4)in Fig.1(a),respectively
在氧化的最初階段(1),電極表面形成了致密的氧化膜且膜厚約為80~100 nm,表面形貌如圖1(b)所示,為多孔狀;在氧化階段(2),氧化膜被F?化學溶解,隨后溶解的同時又發(fā)生生成反應,電流密度增加,氧化物薄膜上開始出現(xiàn)不規(guī)則的納米管陣列且這些納米管與鈦基底相連,表面形貌如圖1(c)所示;在氧化階段(3),隨著電解時間延長納米管陣列趨于規(guī)整并不斷生長,如圖1(d)~(e)。先前的研究認為在電解初期,在鈦基底表面形成一層氧化膜后,氧化膜層承受的電場強度急劇增大,在含氟溶液和電場的共同作用下,TiO2阻擋層發(fā)生隨機擊穿溶解形成孔核,隨著氧化時間的增加,隨機分布的孔核發(fā)展成為小孔,孔的密度也不斷增加,最后均勻分布在表面。然而,TiO2納米管形成的過程中出現(xiàn)的許多現(xiàn)象是目前這個理論無法解釋的,例如納米結構的高度周期性分布和沿納米管深度方向的均勻性、反應中間體擴散反應耦合導致的自組織形成的納米半球,如圖1(c)中納米管底部半球形形貌,所以TiO2納米管的形成機理至今仍不明確。
本研究中提出陽極電解Ti 形成Ti4+,進一步水解成含水低聚羥基鈦中間體,低聚羥基鈦中間體在電場作用下有序排列成納米管陣列結構,后在某些條件下失去水生成二氧化鈦的電解過程。此電解過程中電極反應與電解液中離子擴散耦合形成了納米管生長過程中的非線性特征。首先,陽極電解初期,表面電解生成鈦離子并水解產(chǎn)生鈦氫氧化物覆蓋在陽極表面,甚至形成致密的氫氧化物層,如圖1(b),電導率劇降使體系電流也隨之快速降低;而后此層氫氧化物層部分逐漸溶解,且低聚羥基鈦中間體在電場作用下自組織形成納米管雛形,如圖1(c),隨陽極氧化時間延長,納米管不斷生長且趨于規(guī)整,納米管上部的氫氧化物層因溶解而變薄且致密,如圖1(d)和(e)。
2.2 電解電壓對納米管生長的影響
為研究陽極氧化制備TiO2納米管陣列過程中,氧化電壓對納米管生長速率的影響,在0.3%(質量)NH4F,去離子水[2%(體積)]、乙二醇[98%(體積)]的體系中制備TiO2納米管陣列,氧化時間為2 h,其中圖2(a)是在不同電壓(55、65、85、100 V)下制備TiO2納米管陣列以及對應生長過程中記錄的電流?時間曲線。
電解電壓為TiO2納米管特征形貌,納米管生長速率的重要影響因素,如圖2(a),體系電流密度隨電壓的增加而升高,表明納米管生長隨電壓的增大而加快。圖2(b)~(c)表明,隨著電壓增大,逐漸得到較為規(guī)整TiO2納米管,隨著電壓進一步增大,部分TiO2納米管斷裂,如圖2(d)。實驗中電壓增加到100 V時,已經(jīng)不成管狀結構,為類似絮狀結構,如圖2(e)。一方面,電壓升高加快了納米管管底電場輔助氧化反應和氧化物溶解反應,即電化學刻蝕速率隨電壓的增大而變快;另一方面加速了電解液中離子的遷移。有機體系中,電場作用下的離子遷移作用遠大于由于離子濃度差而引起的離子擴散作用。乙二醇體系中,含H+極少,H+從納米管管底產(chǎn)生,H+在電場作用向納米管管口方向遷移,完成管口成型的TiO2納米管的溶解反應。所以隨電壓的增大,遷移速率增快,因而管口成型納米管的溶解反應也變快,但增加的幅度不如電化學刻蝕速率。因此,電壓增大帶來的結果使納米管生長速率加快,納米管增長,隨著電壓的進一步升高,反應過程中低聚羥基鈦中間體擴散?反應耦合失穩(wěn),從而導致空間有序結構消失。
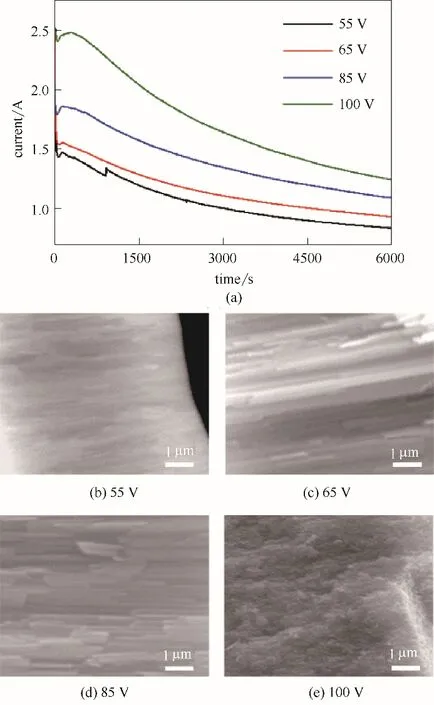
圖2 不同電解電壓下陽極氧化法制備TiO2納米管生長過程中的電流時間曲線(a)以及對應TiO2納米管的SEM圖[(b)~(e)]Fig.2 Plot of current vs time(a)and the SEM images[(b)—(e)]in the growth process of TiO2 nanotubes by anodization under different voltage
本實驗中提出,納米管陣列是低聚羥基鈦中間體在電場作用下自組織形成的,電壓過大或過低都會影響鈦低聚羥基鈦中間體的自組織生長情況,以及其中間體擴散?反應耦合,所以電解電壓過大或過小都會對納米管陣列的有序性產(chǎn)生影響。
2.3 氟含量對納米管生長的影響
當其他條件確定時,增加氟離子的量不僅會改變電解液的pH,同時將促進TiO2的溶解,所以氟含量必須控制在較低水平以減小溶解,但同時又需要達到保證納米管生長的水平。在圖3(a)中,隨著氟離子量的增加,陽極氧化電流也逐漸增加,在該氟離子的量的區(qū)間內(nèi),表明納米管生長隨氟離子的量增大而加快。NH4F 濃度為0.3%(質量)電解液中,隨陽極氧化時間的增加,各階段的Nyquist 圖為圓弧段,為簡單反應的特征譜圖,如圖3(b)。NH4F 濃度為0.7%(質量)電解液中,陽極氧化初期,譜圖中曲線在高頻時向第四象限彎曲,體系均表現(xiàn)一定的感抗行為;陽極氧化時間為200 s 時,Nyquist 圖低頻段弧趨近為45°的直線,等效電路中將出現(xiàn)Walburg 阻抗(n=0.5),此時電極反應受擴散步驟控制,體系濃差極化明顯。根據(jù)特征阻抗譜圖的變化,得出隨氟含量變化體系等效電路的演化圖,如圖3(d)。隨氟含量的增加,體系表現(xiàn)出一定的感抗行為(L)[圖3(d)中Cdl為雙電容]。
從得到的電分析測試結果可以看出,當氟含量較低時,等效電路為一簡單反應電路,表明此時電極反應由電荷轉移步驟(陽極鈦的氧化反應)控制;氟含量增加后,等效電路中增加等效電阻R0和電感L,且與反應電阻Rf并聯(lián),表明此時體系中除有鈦的氧化反應外,還有電阻為R0的反應發(fā)生,且此反應有感抗(L)性質。在本研究提出的反應機理中為水合鈦氫氧化物之間的相互轉化反應,而此系列反應與擴散的耦合為引起納米管生長過程中出現(xiàn)非線性規(guī)律的根本來源。因此在氟含量較高時,體系表現(xiàn)了非線性機制,結合圖3(d)與圖1 表明,體系非線性存在于鈦氫氧化物溶解伴隨有初期納米管生長階段[階段(1)]。
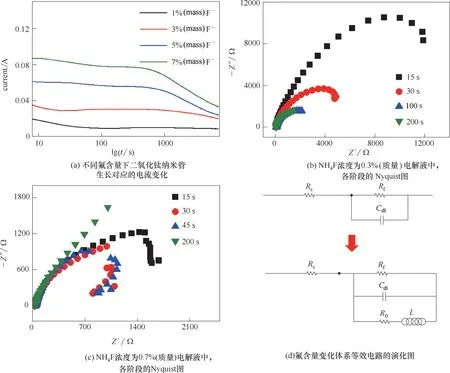
圖3 氟含量對TiO2納米管生長的影響Fig.3 Effect of F?concentration on the growth of TiO2 nanotubes
2.4 電解質水含量對納米管生長的影響
為了探究納米管生長初期界面電化學機制的演變,圖4 總結了電解質含水量分別為2%~8%(體積)的體系在不同電解時間的Nyquist 圖。當電解液中水含量增加時,電解回路的電流初始值,以及穩(wěn)定狀態(tài)時的電流值都減小;水含量為2%(體積)時,電流初始值最大,隨時間延長,平衡電流減小,減小到與水含量為6%(體積)時相當時,曲線沒有第三階段氧化物部分溶解部分,電流逐漸減小,同上文中討論的氟含量曲線一致。所以,水含量越少電解回路電流越大,納米管的生長速率越快;但增加到一定值時,反而會減小納米管的生長速率。
圖5(a)為電解Ti 片10 s 后對應的測試結果,結果顯示為反向的容抗弧。隨電解時間延長,測得的容抗弧為正。而圖5(c)中顯示10 s對應的Nyquist圖形近似45°的直線。這表明此時存在Walburg 阻抗(n=0.5)[34]。電解時間超過30 s 后,Nyquist 圖形變嚴重。分析認為這一現(xiàn)象是電極表面彌散效應引起的。
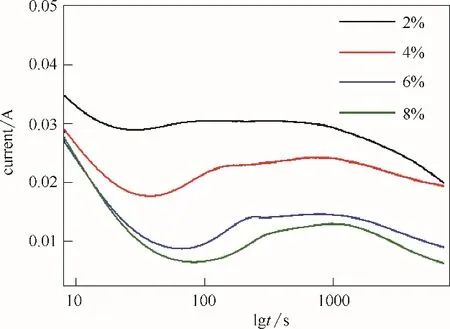
圖4 不同電解質含水量對應的陽極氧化電流變化Fig.4 Plot of current vs.time during growth of TiO2 nanotube arrays for varying water concentration
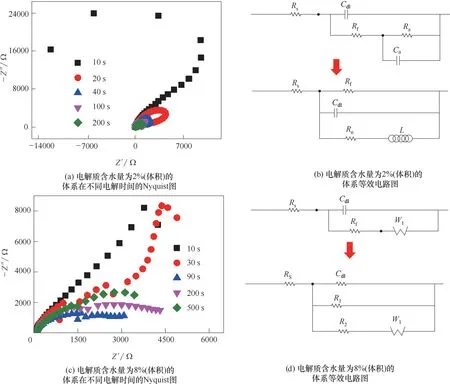
圖5 水含量對TiO2納米管生長的影響Fig.5 The effects of H2O content on the growth of TiO2 nanotubes
在此基礎上,研究建立了不同含水量電解體系中的等效電路圖。圖5(b)為含水量2%(體積)的電解體系等效電路隨時間的演化圖。陽極氧化時間為10 s時,等效電路中等效電阻Ra<0,等效電容Ca>0。隨著陽極氧化時間的延長,體系表現(xiàn)出一定的感抗行為(L)。此時,體系可能形成能夠反饋機制導致電流出現(xiàn)振蕩。圖5(d)為水含量8%(體積)的電解體系等效電路隨時間的演化圖。可知剛開始電解時體系存在半無限擴散電阻。此時電解反應主要由半無限擴散控制。隨著電解時間延長,Nyquist 圖變?yōu)榧訉挼娜菘够 Mㄟ^對比可知含水量的變化將導致體系的反應動力學機制發(fā)生重大改變。水含量較低時,反應體系的等效電路與氟含量為2%(質量)時相同,體系電化學性質也應相似,體系反應中包括鈦的陽極氧化反應以及鈦氫氧化物之間的相互轉化反應等,此時體系可能形成反饋機制導致電流出現(xiàn)振蕩;而水含量增加時,阻抗譜圖為加寬的容抗弧(加寬的容抗弧為兩阻抗大小相似的電極反應耦合產(chǎn)生)。另一方面,陽極氧化鈦產(chǎn)生Ti4+的同時,陽極表面電解液中水也發(fā)生氧化反應產(chǎn)生O2,水含量大時,水的氧化反應加強,鈦的氧化和水的氧化反應耦合形成了阻抗譜圖中加寬的容抗弧。
綜合以上實驗結果,在氟含量較高或水含量較低時,電化學測試的阻抗譜中出現(xiàn)感抗弧,建立的等效電路中出現(xiàn)等效電感元件,而此元件的產(chǎn)生表明體系的系列反應中存在有非線性的反饋機制。此現(xiàn)象均出現(xiàn)在納米管生長初期階段,如圖1中的階段(1)。
2.5 反應動力學機制分析
根據(jù)非平衡態(tài)理論[35],如果反應體系中存在兩種類型的中間體,則擴散反應耦合體系中可能形成有序結構。一種中間體可以加速反應,這就是所謂的活化子,而另一種中間體可以減緩反應,這就是所謂的抑制子[36]。當活化子的擴散系數(shù)小于抑制子時,可通過自組織過程形成周期性的空間結構。低聚羥基鈦反應中間體的非線性反應行為,為有序納米結構的自組織提供了周期空間結構和周期電流振蕩的聯(lián)系[37]。上述試驗結果表明,電解中間產(chǎn)物的反應行為受反應時間以及含水量影響很大。分析認為,電解過程中,陽極Ti 電氧化產(chǎn)生Ti4+和H+,其在電場驅動下遷移遠離電極表面,并在遠離電極表面的過程中發(fā)生水解反應,形成氫氧化鈦等小分子[38]。它們可進一步縮合,形成Ti(OH)4(H2O)2、Ti2(OH)8(H2O)2、Ti2O(OH)4(H2O)22+、Ti(OH)3(H2O)+等縮合離子[39]。縮合離子不僅可作為成核中心引發(fā)膠團生長,還可以水解產(chǎn)生新的成核中心加速形成更多的膠團。縮合離子等水解中間體有助于加速鈦凝膠的形成,而H2O 與H+卻可以通過促進水解來抑制膠團的生長。此外,H2O 與H+擴散系數(shù)比縮合離子等水解中間體大,這符合形成有序斑圖結構的必要條件。分析認為,電極表面[H2O]以及凝膠濃度隨電解時間的變化為體系擴散?反應動力學機制演化提供了可能。
陽極電解過程中,Ti4+和H+產(chǎn)生于電極表面,反應式如式(1)~式(2)
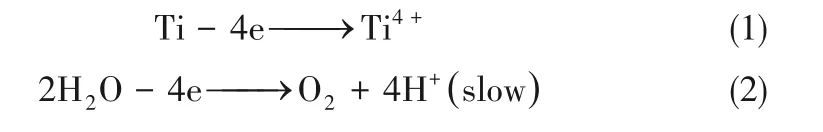
反應初期,陽極表面[H2O]相對較大,水氧化導致pH下降;隨后氫氧化物凝膠形成,電極表面[H2O]逐漸減小,H+的生成速率減慢,而H+的擴散系數(shù)較大。
H+和Ti4+與膠體反應形成帶電膠體離子,聚合后形成致密膠體層,形成高價膠體離子
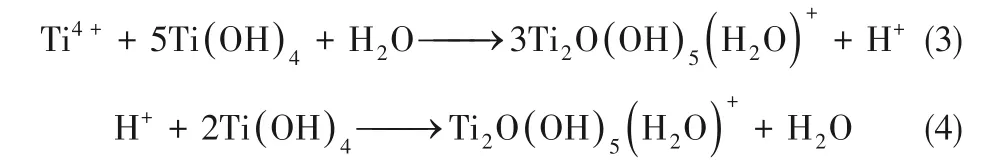
TiO2納米管陣列形成過程主要是由羥基鈦化合物水解及縮聚過程的中間體反應擴散耦合機制決定。但是該過程也會受其他離子的影響,尤其是F?等鹵素離子。其中,F(xiàn)?離子不僅是作為支撐電解質的陰離子,同樣也會與Ti離子反應結合,形成氟化物。
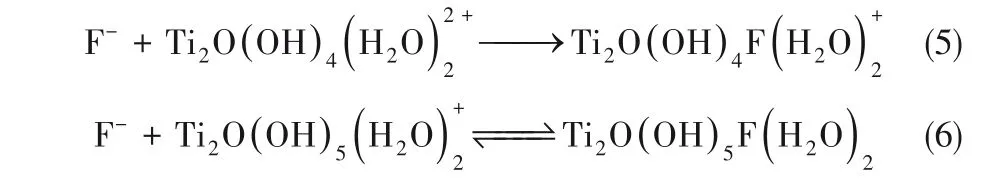
當膠團體系中H+擴散與生成達到平衡時,可認為體系電極表面附近主要存在如式(7)~式(13)七個反應
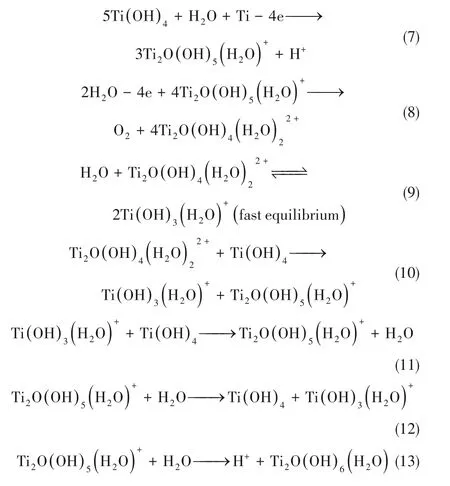
式(1)、式(3)綜合可得式(7),H+活性強,會快速與低價膠體離子反應生成高價膠體離子
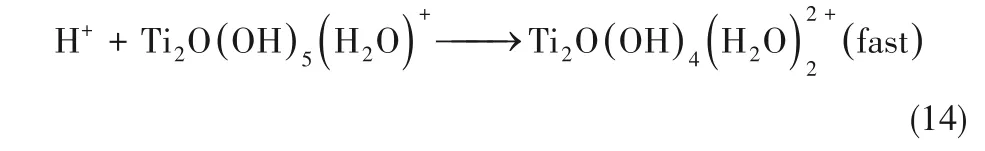
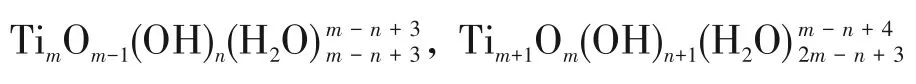
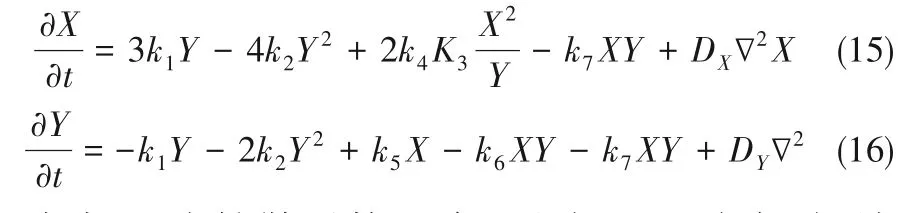
式中,D 為擴散系數(shù)矩陣。電解過程穩(wěn)定時,納米管中遠離電極表面的地方,無電子轉移,形成致密膠體層后,Ti4+和H+在膠體層中的擴散極慢,因此式(3)、式(4)的反應速率很慢,可以忽略,此時體系的二變量動力學方程組為
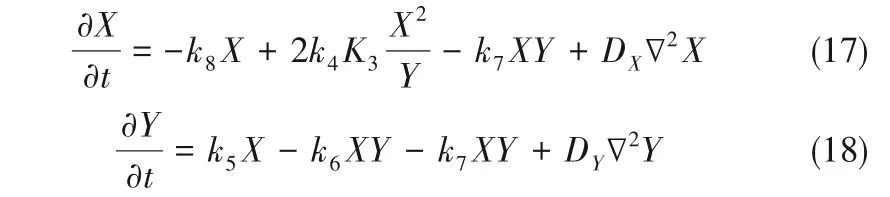
對式(17)、式(18)做微擾,令

式中,X0,Y0分別為δX/δt=0且δY/δt=0時方程組的穩(wěn)態(tài)解。對式(17)、式(18)進行線性穩(wěn)定性分析,近似忽略高階項,可導出Jacob行列式J
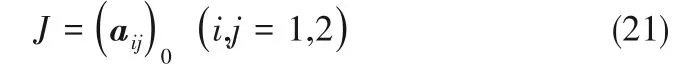
其中得到a11、a12、a21、a22如下
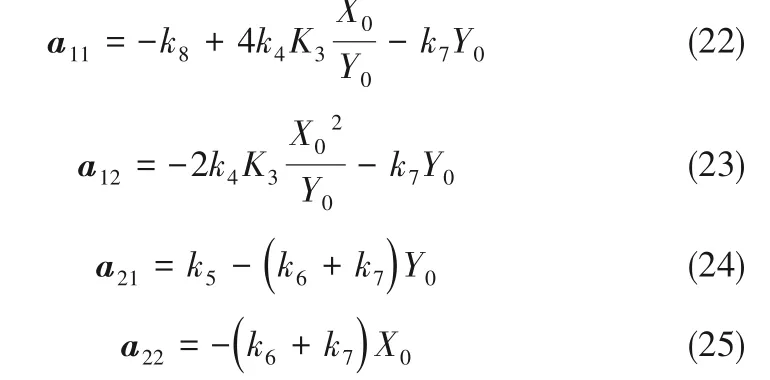
取模數(shù)為k時,
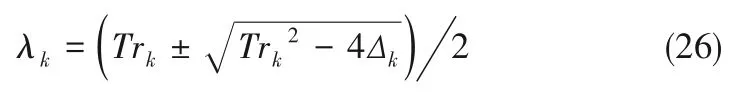
式中,Trk為Jacob 矩陣的秩,Δk為Jacob 行列式的值
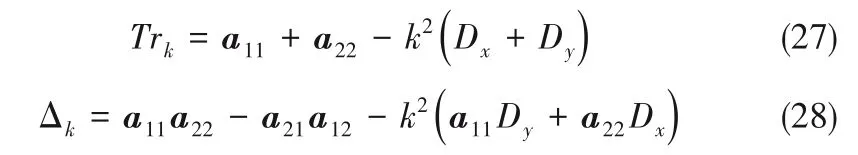
式中,下角標x,y分別為X0,Y0的微擾變量。則系統(tǒng)對微擾的最危險模數(shù)kc
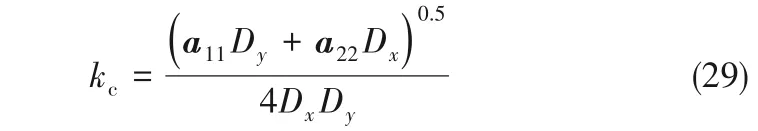
此時Δkc有最小值,
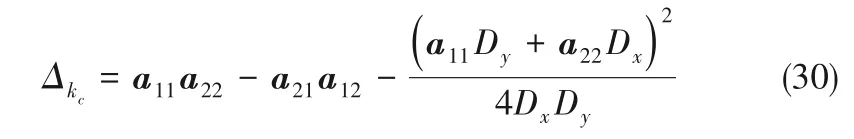
隨著電解進行,縮合離子粒徑逐漸增加,當所形成的離子粒徑較大時,有Dy>>Dx,Δkc近似值如下
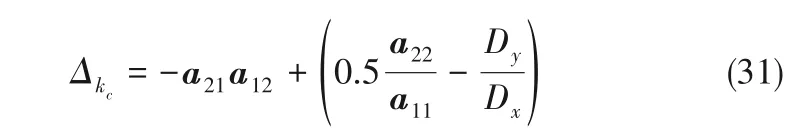
取X0、Y0分別為
解得定態(tài)解X0和Y0
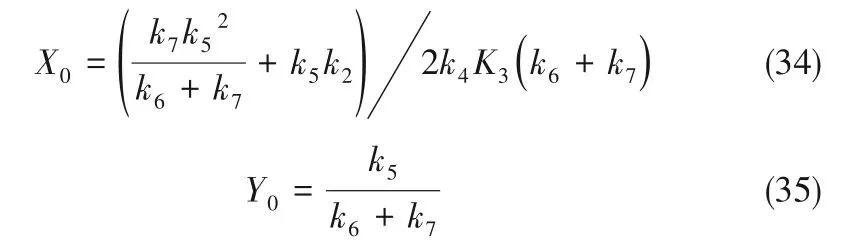
從而可以得出Jacob 行列式的秩Tr0和Δ0(取模數(shù)k=0,進行線性穩(wěn)定性分析)分別為
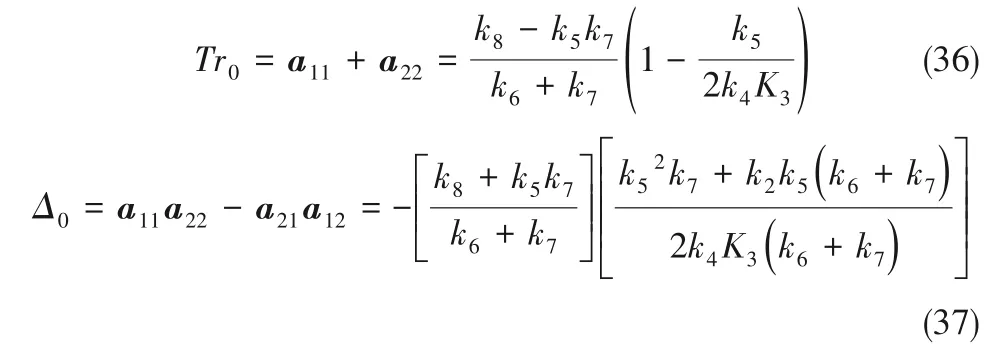
增大電壓時,納米管中H+在電場作用的遷移速率增大,反應式(14)增強,k8增大,當Δkc=0時,
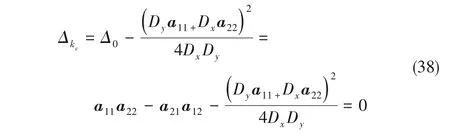
當Δ0的值如下時
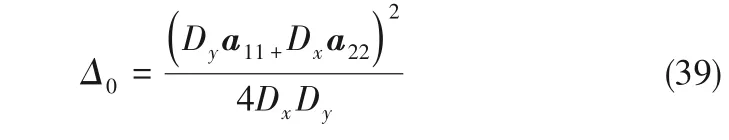
可得體系的振蕩波長λ
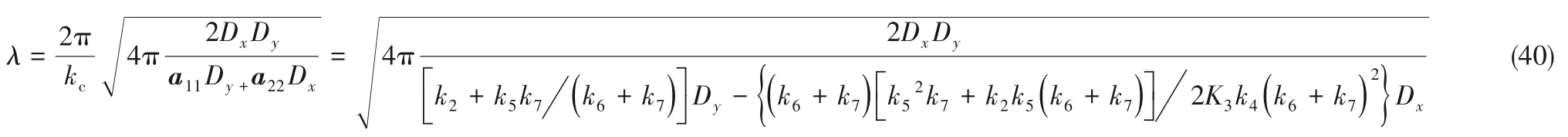
體系中阻滯子(H2O)的擴散速率遠低于活化子(低聚羥基鈦中間體)的擴散速度,振蕩區(qū)間內(nèi)體系電壓增大使k8增大,對應波長縮短,相應氫氧化物納米陣列的周期越短。
根據(jù)線性穩(wěn)定性分析,當Tr0<0,Δ0>0時,若存在kc使Δkc<0,則體系可以失去空間穩(wěn)定性,X 將沿電極表面作周期性分布,從而可以導致形成有序結構的氫氧化物凝膠。此時,同樣可以由方程組導出X 沿電極表面作周期性分布的波長λ1為
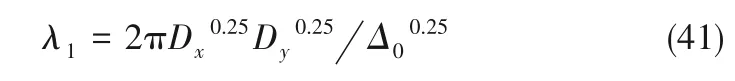
帶入Δ0的值帶入得到波長λ2為
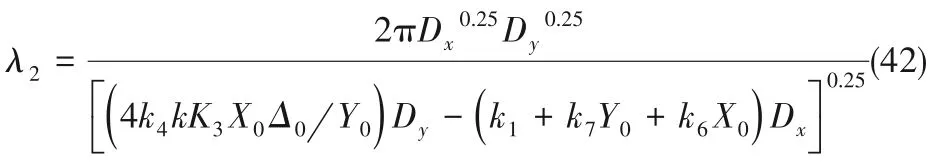
膠團或縮合離子Y的擴散系數(shù)越小,波長越短,相應氫氧化物納米陣列的周期越短。令k7Y0=Z,則Δ0、Tr0均為Z 的高次函數(shù)。隨著電解的進行各反應速率逐漸變化。Δ0和Tr0隨Z、Y0的變化趨勢如圖6所示。剛開始時Z 較大,此時有Tr0<0,Δ0>0 并且Δkc<0。此時體系對空間失穩(wěn),出現(xiàn)自組織納米管陣列。隨著電解時間延長,Y0減小,對應Z 逐漸減小。根據(jù)圖6 可知,隨著Z 減小,Δ0也減小,對應納米管的管心距增大。當Z 減小到1 附近時有Tr0=0,Δ0>0,此時體系對時間失穩(wěn),可能出現(xiàn)電流振蕩。反應動力學分析表明電流振蕩與有序陣列結構的形成均與反應中間體擴散反應耦合的非線性機制相關。在適合的條件下,體系能夠存在電流振蕩。
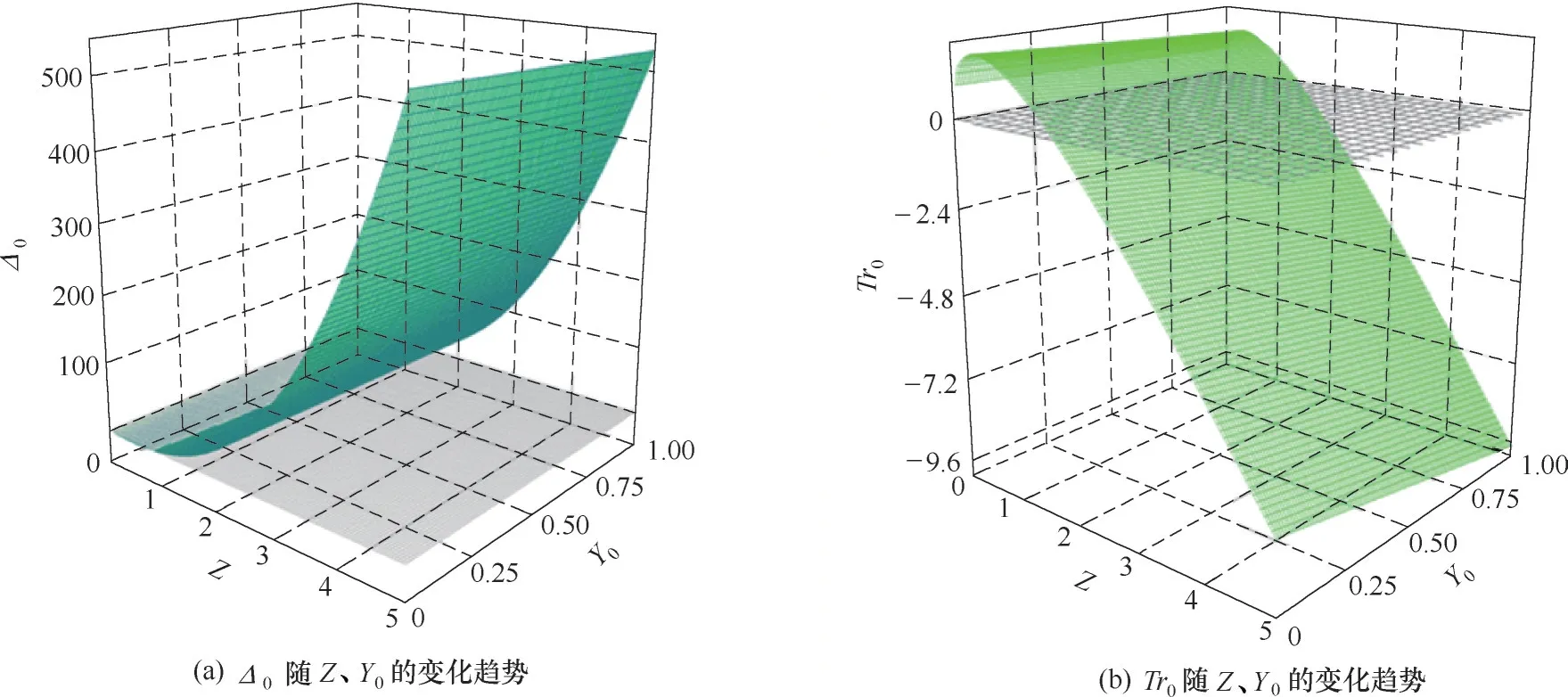
圖6 Δ0以及Tr0分別隨Z、Y0的變化趨勢(k4k3=0.9,k1=0.01,k6=0.5)Fig.6 Δ0,Tr0 change with Z,Y0 respectively(k4k3=0.9,k1=0.01,k6=0.5)
3 結 論
本文系統(tǒng)考察了陽極氧化法制備TiO2納米管陣列過程的生長機制。探索了溫度、電壓、氟含量及水含量等對TiO2納米管生長速率以及不同生長階段電化學行為的影響,并制備了結構規(guī)整的TiO2納米管陣列。研究還利用電化學阻抗等方法測試TiO2納米管生長初期界面電化學的演變,并分析了等效電路的變化,基于非線性動力學理論的視角探討了TiO2納米管陣列生長過程中非線性動力學機制。研究結果表明,TiO2納米管生長速率與電解電壓,氟含量以及溫度都成正相關,與水含量負相關,并且影響生長過程中各階段的電化學行為。水含量較高電解液中,阻抗譜是加寬的容抗弧,鈦表面發(fā)生點蝕現(xiàn)象;氟含量較高電解液中,陽極氧化初期,等效電路由簡單電路演化為帶有電感元件L 的復雜電路,表明體系具有反饋性質,并且隨氟含量的增加,體系的反饋性增強。研究針對大電流氧化下的TiO2納米管陣列電合成過程,提出基于羥基鈦化合物中間體的擴散?反應耦合非線性動力學機制,并解析了參數(shù)閾值。

