PD-L1在卵巢高級別漿液性癌預后中的價值
鄧宇鵬,許 娜,婁 彤,劉崇東
(首都醫科大學附屬北京朝陽醫院,北京100020)
為了進一步了解PD-L1和CD8在卵巢癌中的表達情況以及評價其對預后的預測價值,我們建立了近10年來在我院完成初次腫瘤細胞減滅術治療的卵巢高級別漿液性癌患者的臨床病例資料庫,進行回顧性分析及隨訪調查,研究影響卵巢高級別漿液性癌患者預后的相關臨床及病理因素。同時制作卵巢高級別漿液性癌患者的病理組織芯片,通過免疫組織化學染色評價相關蛋白在卵巢癌病灶中的定位及表達水平情況,研究PD-L1和CD8在卵巢高級別漿液性癌中是否存在表達差異,同時分析蛋白表達強度與預后是否存在相關性,從而進一步驗證PD-L1和CD8是否可以預測卵巢高級別漿液性癌的預后,并為卵巢高級別漿液性癌的PD-1/PD-L1阻斷治療的響應度提供預測價值。
1 材料和方法
1.1 病人來源
選取2010年1月至2019年1月在首都醫科大學附屬北京朝陽醫院經手術治療的高級別漿液性惡性腫瘤患者及病理資料。病人入選標準:(1) 在首都醫科大學附屬北京朝陽醫院完成手術治療;(2) 術后病理證實為卵巢高級別漿液性癌;(3) 首次腫瘤減滅術后完成以鉑類為基礎的規范化化療;(4) 臨床資料完整。其中病理診斷不明確;合并其他類型卵巢良惡性腫瘤或其他器官原發惡性腫瘤;首次腫瘤減滅術術后未接受規范化化療;臨床資料不完整或標本缺失的患者不納入本項研究。收集患者年齡、是否絕經、術前CA125水平、有無新輔助化療及化療方案和療程、腫瘤細胞減滅術滿意度(殘留病灶<1 cm、≥1 cm)、病理類型、FIGO 臨床分期(采用國際婦產科聯盟 FIGO-2014手術-病理分期標準重新分期[1])、有無腹水、腹水或腹腔沖洗液細胞學情況(陰性、陽性)、腫瘤包膜是否完整(包膜完整、術前自發破裂、術中破裂)、有無淋巴結轉移、術后化療方案及療程、化療效果(完全緩解、部分緩解、疾病進展、疾病穩定)、有無復發、復發后治療等信息。治療后患者隨訪,前6個月隨訪每個月1次,后6個月每3個月隨訪一次,第2-5年每6個月隨訪1次,然后每1年1次。
1.2 組織芯片制作
取入組病人石蠟包埋組織標本,進行病理復核并調取蠟塊,由病理科醫師根據切片 HE 染色結果在對應的組織蠟塊(供體蠟塊)上進行癌灶定位并標記,取樣針為直徑 1.0 mm,樣本間間距 1.0 mm,依據組織來源及病理號順序設計樣本序號排列,記錄每個樣本在陣列中的具體位置。使用手動式組織微陣列制作儀制作組織芯片,密封后置于 4℃冰箱內長期保存備用。
1.3 免疫組化
取組織芯片切片,用免疫組化鏈霉菌抗生物素蛋白-過氧化物酶連接(SP)法檢測PD-L1及CD8的表達。兔抗人PD-L1抗體(CST)工作濃度為1:50和小鼠抗人CD8抗體工作濃度為1∶10。染色方法按SP試劑盒說明書進行。
1.4 組織芯片圖像掃描及免疫組化染色結果分析
將組織芯片掃描并用軟件自動程序進行分析。設置組織切片上所有的深棕色為強陽性,棕黃色為中度陽性,淺黃色為弱陽性,藍色細胞核為陰性。進而對每個組織點進行識別分析出強陽性,中度陽性,弱陽性及陰性的面積(單位:像素),陽性的百分比,及最后進行組織化學評分(H-score)。H-score=(無著色腫瘤細胞百分率×0)+(弱著色腫瘤細胞百分率×1)+ (中度著色腫瘤細胞百分率×2)+(強著色腫瘤細胞百分率×3)。計算PD-L1在癌巢和間質中的H-score,以中位數作為臨界值,≤中位數為低表達組,>中位數為高表達組。通過計數胞膜上有 CD8 陽性染色的淋巴細胞個數,檢測 CD8+ TILs 的浸潤情況。
1.5 統計學分析
所有數據均使用 SPSS 25.0 統計軟件進行統計分析,應用平均值±標準差、頻數等對數據進行統計分析。P<0.05 認為有統計學意義。
(1)PD-L1、CD8表達與卵巢高級別漿液性癌預后的生存分析:采用 Kaplan-Meier 法繪制生存曲線(Kaplan-Meier survival analysis),采用對數秩檢驗(Log-rank test)比較生存差異。分析PD-L1、CD8在卵巢高級別漿液性癌的不同患者中的表達強度是否與 PFS、OS 相關。
(2)PD-L1、CD8在卵巢高級別漿液性癌中的表達與臨床病理特征的相關性分析:采用Spearman秩相關檢驗分析兩種蛋白表達強度/密度高低與臨床病理特征的相關性及兩者之間的相關性。
(3)PD-L1、CD8及臨床病理特征與卵巢高級別漿液性癌預后的多因素分析:將單因素分析中P<0.05的因素納入多因素回歸分析,采用 Cox 比例風險回歸模型(Cox regression model)進行兩種蛋白及臨床病理特征與預后的多因素分析,評估預后因素作用。
2 結果
2.1 免疫組織化學染色結果
通過免疫組織化學染色,檢測PD-L1和CD8在卵巢高級別漿液性癌中的表達情況。2種蛋白在卵巢高級別漿液性癌中的免疫組織化學染色顯微圖像和H-score 評分/計數分別見圖1、表1和表2。

IJMN示病灶,KLOP示間質。放大倍數:A-D/I-L×200,E-H/M-P×400。
PD-L1 蛋白表達主要定位于卵巢高級別漿液性癌細胞的細胞質和細胞膜。90例卵巢高級別漿液性癌患者的PD-L1染色H-score中位數為37.8(5-82),以其作為臨界值將患者分為PD-L1高表達組和PD-L1低表達組,PD-L1 低表達組的病例為43(47.8%)例,H-score中位數18.2(5-37),高表達組的病例為47(52.2%)例,H-score中位數55.4(39-82)。90例病理切片的CD8+ TILs的中位數為14.7(2-21),以其作為臨界值將患者分為CD8+ TILs高密度組和CD8+ TILs低密度組;癌巢內 CD8+ TILs 高密度組的病例數為47(52.2%)例,CD8+ TILs計數中位數為16.5(15-21)個/HPF,低密度組病例數為43(47.8%)例,CD8+ TILs計數中位數為13.8(2-14)個/HPF;間質內CD8+TILs的中位數為15.8(2-28)個/HPF 。間質中CD8+ TILs高密度的病例為46(51.1%)例,CD8+ TILs計數中位數19.7(16-28)個/HPF,CD8+ TILs低密度的病例為44(48.9%)例,CD8+ TILs計數中位數14.2(2-15)個/HPF。
2.2 PD-L1、CD8在卵巢高級別漿液性癌中的表達與預后
PD-L1、CD8在卵巢高級別漿液性癌中的表達情況見圖1,表達差異的生存曲線見圖2、圖3,統計學分析結果提示:PD-L1低表達組的患者的5年生存預后均明顯高于高表達組(5年OS:77.3% vs 22.7%,P<0.001;5年PFS:56% vs 0%,P<0.001)。PD-L1低表達組和高表達組的總生存期分別為56.54±24.39月、40.19±24.18月,無進展生存期分別為31.74±18.31月、17.29±11.35月。分別計數癌巢和間質內CD8+TILs的數目,癌巢內CD8+TILs高密度組的5年生存預后高于低密度組,但無統計學意義(5年OS:51.4% vs 48.1%,P=0.794;5年PFS:43.3% vs 29.5%,P=0.415)。癌巢內CD8+TILs高密度組和低密度組的總生存期分別為43.32±24.63月、37.35±24.02月,無進展生存期分別為32.85±21.67月、30.53±22.89月。間質內CD8+TILs高低密度對OS、PFS無明顯影響(P=0.770、P=0.571)。

表1 PD-L1在卵巢高級別漿液性癌中的H-score

表2 CD8+ TILs在卵巢高級別漿液性癌中的計數
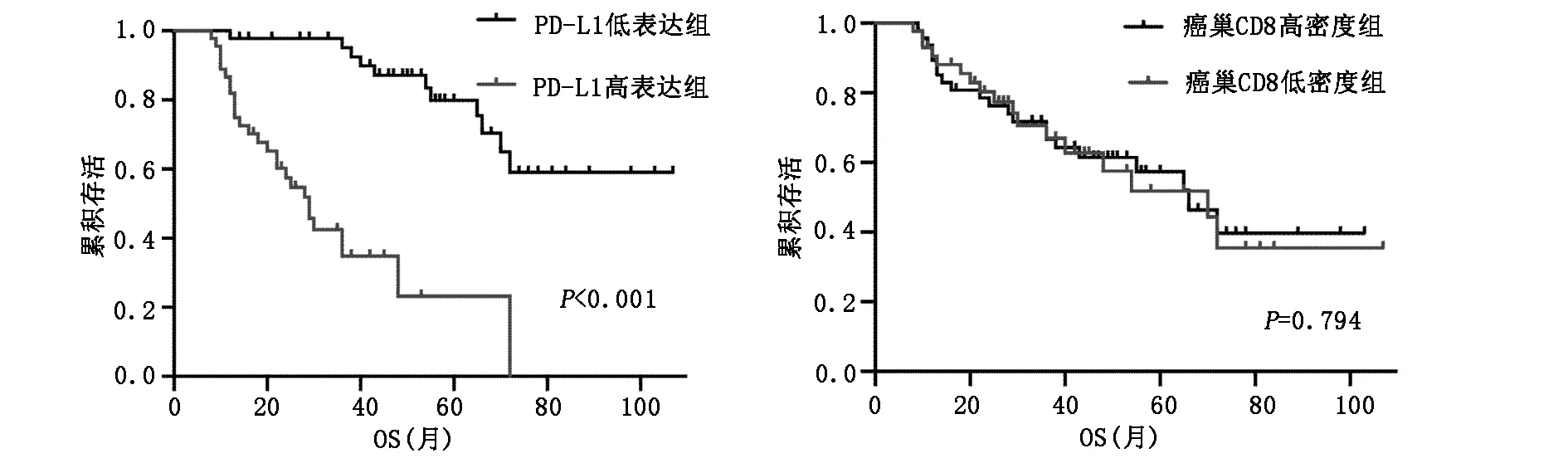
圖2 PD-L1、CD8表達差異的OS生存曲線
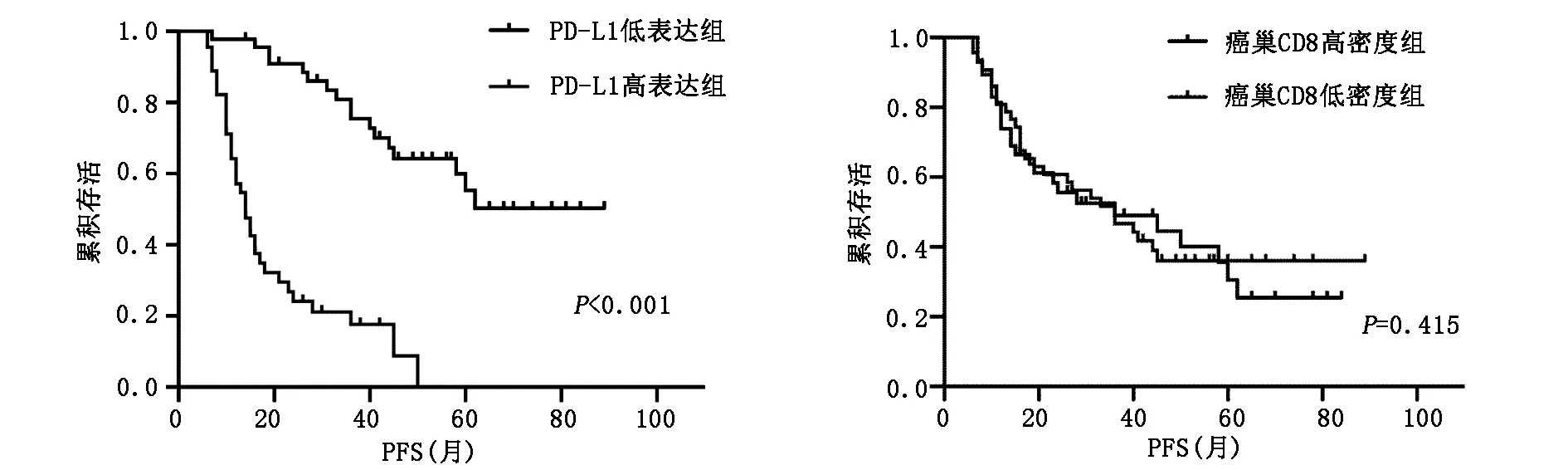
圖3 PD-L1、CD8表達差異的PFS生存曲線
2.3 PD-L1、CD8表達與卵巢高級別漿液性癌患者的臨床病理特征的相關性分析
統計分析結果見表3。統計學分析結果提示:PD-L1表達與患者具有惡性腫瘤病史(P=0.017,r=0.251)有相關性,與FIGO分期(P=0.045,rs=0.212)有相關性。癌巢內CD8+TILs的密度與臨床病理特征均無明顯相關性。癌巢內CD8+TILs的密度與PD-L1表達有負相關性(P=0.038,rs=-0.219)。
2.4 PD-L1、CD8表達與卵巢高級別漿液性癌患者的預后的多因素分析
分別以卵巢高級別漿液性癌復發和患者死亡為因變量,以在單因素分析中具有顯著差異的臨床病理特征變量及三種蛋白的表達為協變量,采取 Cox 比例風險回歸模型分析,用 Wald 檢驗對變量進行篩選。PFS和OS相關危險因素多因素分析見表4。
其中PFS相關的Cox 比例風險回歸統計得到的結果如下:PD-L1表達、腫瘤細胞減滅術滿意度、新輔助化療進入 Cox 模型(P值分別為<0.001、0.001和0.038)。與OS相關的 Cox 比例風險回歸統計得到的結果如下:PD-L1表達進入 Cox 模型(P<0.001)。

表3 PD-L1、CD8表達與臨床病理特征的相關性分析
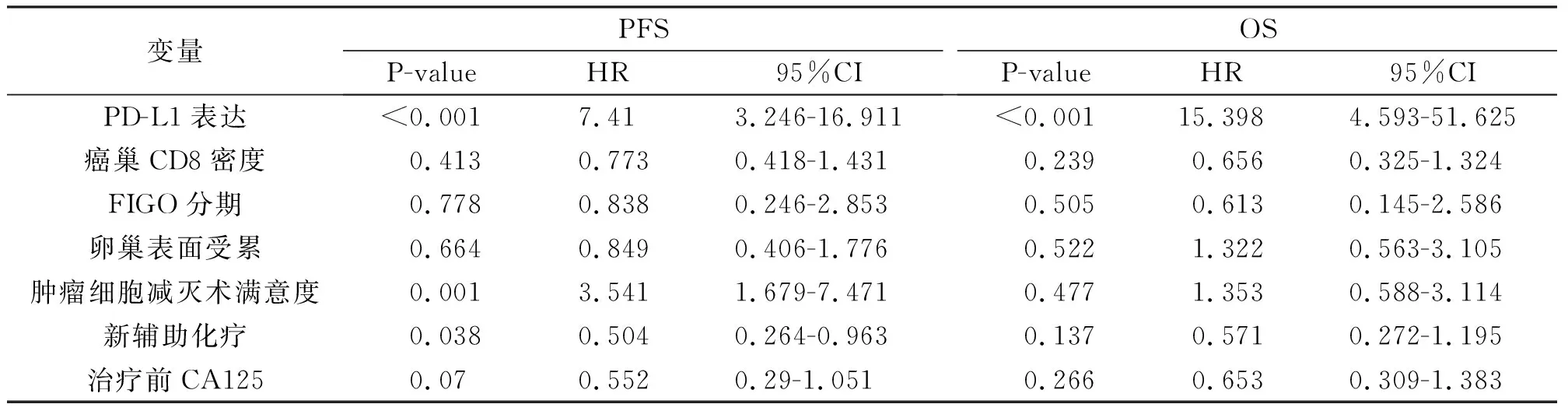
表4 PD-L1、CD8表達及臨床病理特征與預后的多因素分析
3 討論
免疫系統具有免疫監視、防御、調控的作用,而免疫逃逸是指通過降低腫瘤細胞的免疫原性來促進腫瘤細胞存活。腫瘤細胞通過表達PD-L1與T細胞表面的PD-1結合,使T細胞功能處于抑制狀態,從而發生免疫逃逸[2]。TILs是一類浸潤到腫瘤細胞中的淋巴細胞,包括B細胞、T細胞、NK細胞等具有特異性殺傷腫瘤功能的細胞[3]。CD8+TILs,又稱為細胞毒T細胞,在機體識別抗原后能夠對帶有相應抗原的細胞發揮特異性殺傷作用,是機體抗腫瘤免疫的核心執行者。正常組織極少表達 PD-L1,與其他惡性腫瘤包括肺癌(50%)、食管癌(44%)、胃癌(42%)、乳腺癌(34%)和腎癌(37%)相比[4-8],PD-L1在卵巢癌中的表達率最高[9]。然而目前的臨床試驗中,卵巢癌對PD-L1阻斷治療的響應度并不理想,這提示我們卵巢癌中可能存在其他抗腫瘤免疫的不利因素,如殺傷腫瘤細胞的執行者CD8+TILs的數目/密度,或其他對抗腫瘤免疫具有負調控作用的因子。多項研究表明腫瘤浸潤性CD8+TILs的數量越多,即腫瘤組織中的免疫儲備力量越多,患者使用PD-L1抗體的治療反應的預測性更好。這意味著PD-L1和CD8+TILs可以聯合預測腫瘤患者對PD-L1阻斷治療的響應度。
Hamanishi[10]等曾報道,該團隊檢測了70例不同病理類型石蠟包埋的上皮性卵巢癌組織標本,PD-L1高表達的患者預后明顯差于低表達者。因卵巢癌不同病理類型的異質性較大,如前述研究中,不同病理類型卵巢癌PD-L1表達有明顯差異,80%以上卵巢子宮內膜樣腺癌高表達PD-L1,卵巢漿液性癌PD-L1的高表達率約60%,而卵巢黏液性腺癌PD-L1高表達率<10%。因此本研究中僅選用卵巢高級別漿液性癌一種病理類型的病例。
目前已知PD-L1的表達上調方式可能有 2 種,即固有表達及適應性免疫抵抗途徑。固有表達指腫瘤細胞的癌基因通路啟動了PD-L1表達,這種情況下PD-L1往往在癌細胞呈彌漫性表達[11]。腫瘤細胞PD-L1表達上調的另一種機制是適應性免疫抵抗,干擾素誘導腫瘤細胞反應性高表達PD-L1,PD-L1使表達PD-1的T細胞功能耗竭或無能。此種表達有特征性表現,即PD-L1往往在腫瘤組織T細胞富集區,尤其腫瘤侵襲邊緣局限表達或高表達。在本研究中,PD-L1在腫瘤組織中的表達主要為彌漫性表達,局灶性表達較少見。因此,以PD-L1表達H-score評分的中位數作為高低表達的臨界值,結果具有可比性。本研究中,PD-L1高表達患者的預后明顯差于低表達患者。這表明PD-L1表達與卵巢癌患者的預后存在負相關關系,可能反映了宿主抗腫瘤免疫功能的抑制程度。
此外,本研究在分別分析間質和癌巢內的CD8+TILs密度高低對患者的生存預后的影響時發現,二者對患者生存預后的影響均不顯著,即腫瘤中的CD8+TILs密度似乎與患者的生存預后無關。由此可見,單純的癌巢CD8+TILs密度并不能作為預測卵巢漿液性癌患者預后的指標,其抗腫瘤免疫效應不僅受細胞密度、也受到功能狀態的影響。此外本研究中還發現,PD-L1表達與癌巢中CD8+TILs存在明顯的負相關關系,這提示PD-L1的表達抑制了抗腫瘤的CD8+TILs在腫瘤組織中的浸潤,通過這一方式繼續影響其發揮抗腫瘤作用。多因素分析還顯示PD-L1高表達是影響患者PFS、OS的獨立危險因素,因此明確腫瘤組織PD-L1表達情況具有重要的臨床意義。
綜上所述,卵巢高級別漿液性癌的腫瘤組織中的PD-L1的表達與患者預后密切相關,是影響患者PFS、OS的獨立危險因素;PD-L1表達與癌巢中CD8+TILs存在明顯的負相關關系,這提示PD-L1的表達不僅直接影響CD8+TILs細胞發揮免疫效應,還間接抑制了其在腫瘤組織中的浸潤,對于影響CD8+TILs功能的因素及相關分子標記物還需進一步研究。因此,重視卵巢癌腫瘤組織中的分子標記物檢測有助于評估患者預后。近年來免疫治療日益成為惡性腫瘤的重要治療手段,作為一種高度個體化的治療方案,期待有更深入的基礎研究預測患者對免疫治療的響應度和大規模臨床試驗來探索抗PD-1/PD-L1免疫治療在卵巢癌治療中的價值。

