著絲粒蛋白在肝癌發生、發展中的作用研究進展
崔忠源 吳志賢
著絲粒蛋白(centromere protein,CENP)是在著絲粒DNA(Centromere DNA)上組裝起來的眾多蛋白質統稱。目前研究表明,細胞分裂期間著絲粒蛋白家族成員的異常表達可能與腫瘤的發生發展密切相關。眾所周知,惡性腫瘤細胞最大的特點是具有不可控的持續分裂增殖能力,這可能是因為染色體不穩定進而導致基因組不穩定的結果。人們已發現染色體不穩定性(chromosomal instability,CIN)是絕大多數腫瘤的共同特征,與腫瘤發生發展的機制有千絲萬縷的關系[1-2]。而著絲粒蛋白異常表達則是染色體不穩定性的重要原因,近年來研究者們在對各種腫瘤中的著絲粒蛋白進行更多研究后,進一步證實了這種觀點[3]。著絲粒蛋白的異常表達同樣普遍存在于肝癌患者中,與患者預后相關,機制的研究發現其與肝癌細胞的增殖、侵襲、轉移乃至化療藥物敏感性等密切相關,本文將對這些研究進行綜述。且對肝癌細胞的各種生物學特性具有不可忽視的作用。
一、著絲粒蛋白簡介
著絲粒(Centromere)現在通常認為是一段包含組蛋白H3變體(CENP-A)且堿基對高度重復的特殊DNA序列。在細胞分裂期眾多聚集在這個序列上的蛋白質我們稱之為著絲粒蛋白,目前已經發現至少100種不同的著絲粒蛋白,極其重要的,如組成型著絲粒相關網絡(constitutive centromere associated network,CCAN)的16種著絲粒蛋白和組成KNL1-MIS12-NDC80(KMN)復合體的著絲粒蛋白,這兩組重要的蛋白復合體又稱為動粒(Kinetochore)(CCAN稱為內側動粒,KMN復合體稱為外側動粒),動粒在染色單體的分離中發揮著不可替代的作用[4-5]。當著絲粒蛋白質家族某些成員在細胞周期中出現過多或過少表達時可能影響細胞周期進程和姐妹染色單體的正常分離,進而導致染色體不穩定如形成非整倍體細胞或者原癌基因激活及抑癌基因失活,從而成為腫瘤發生發展重要因素[1, 6]。
在脊椎動物中,CCAN復合體包括5個子復合體,其作用是為外部動粒組裝提供平臺;KMN是動粒上主要微管受體,而且是許多其他蛋白質的招募平臺,具有紡錘體組裝檢查點(SAC)和其他調節器的作用。(標記紅色的為在肝癌中有研究的部分著絲粒蛋白成員)
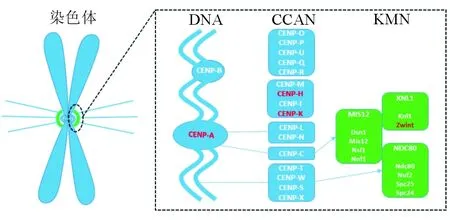
圖1 細胞分裂期間染色體與微管連接的成分由內向外依次分為三層:著絲粒、CCAN和KMN復合體
二、著絲粒蛋白質在肝癌中的研究
目前著絲粒蛋白在肝癌中的研究相對有限,主要研究的著絲粒蛋白有CENP-A,CENP-E,CENP-F,CENP-H,CENP-K以及Zwint。
(一)CENP-A 基礎研究發現CENP-A是組蛋白H3(構成核小體成分)的變體,CENP-A定位于著絲粒DNA,并可以募集其他著絲粒蛋白,因此它是動粒組建的基礎[4]。過去有多項研究表明CENP-A在肝癌中存在過表達[7-9]。CENP-A表達與HCC患者臨床病理參數之間的關系研究發現——血清HBsAg陽性患者CENP-A過表達的頻率高于陰性患者,隨著腫瘤組織學分級的進展,CENP-A表達有增加趨勢[8]。有研究者發現CENP-A表達與HBx COOH突變(HBx,乙型肝炎病毒X蛋白)之間存在正相關,并提出HBx突變體可能是通過非物理結合的機制增加CENP-A表達[9]。另外,也研究發現CENP-A能通過參與細胞周期蛋白G1、MDM2、Bcl-2和Bax的調控從而影響腫瘤細胞的增殖或凋亡,而未發現與抑癌基因P53存在明顯相關性[8, 10]。
(二)CENP-E CENP-E作為動力蛋白,能有效地連接著絲粒和微管,其在細胞內的表達水平和位置受到嚴格控制,在主軸檢查點蛋白(SCP)機制中發揮重要作用[11]。不同于其他著絲粒蛋白組分,與癌旁組織和LO2細胞相比,HCC組織和HepG2細胞中CENP-E mRNA和蛋白水平均顯著降低,敲低CENP-E后可誘導細胞凋亡,導致LO2細胞增殖減緩和SCP監測功能失調,使染色體非整倍性增加,這有可能與腫瘤的發生發展有關[11-12],研究者進一步提出CENP-E促進腫瘤發生的閾值水平可能在正常值的20%~50%范圍內[12]。最近的一項研究成果表明,該蛋白很有可能是未來抗癌藥物的一個新靶點[13]。
(三)CENP-F CENP-F是目前著絲粒蛋白家族中研究較多的一個,它是一種大約350 kDa的卷曲螺旋蛋白,在細胞進入M期之前,CENP-F的表達達到峰值,并且在有絲分裂完成后迅速降解[14]。研究者發現CENP-F基因在肝癌中高頻擴增,而擴增的CENP-F與患者年齡、AFP水平、腫瘤分級和腫瘤大小等臨床病理參數無明顯聯系,對化療藥物5-FU和多柔比星更具抵抗性[15]。但后來有研究者發現CENP-F上調與患者血清AFP、靜脈侵襲、晚期分級和較短的總體存活率是呈正相關的,進一步發現沉默CENP-F可降低細胞增殖、集落形成和裸鼠體內腫瘤形成的能力,還可通過下調細胞周期蛋白cdc2和B1導致細胞周期停滯在G2/M檢查點期間[16]。我國的學者研究后認為過表達的CENP-F則可能通過是促進細胞周期調控蛋白c-Myc和Cyclin D1的高表達,進一步激活相應通路,而提高肝癌細胞的增殖、遷移能力,誘導肝癌的發生和發展[17]。
CENP-F也有可能為早期HCC診斷提供依據。近年來研究發現在早期AFP陰性HCC患者的免疫應答中CENP-F抗體具有較高的陽性率[18],與AFP聯合檢測對早期HCC的診斷具有互補作用[19]。但最近一項包括在HCC、肝硬化、慢性HBV感染和健康對照者的大樣本人群中直接檢測具有重要潛在診斷價值的血清標志物水平的研究中顯示——CENP-F無論是單獨還是聯合其他標志物,其對早期HCC的診斷價值并不是最理想的[20]。該項研究者認為這可能是因為研究采用不同的對照組或者在這些肝硬化和肝炎患者中存在自身免疫性疾病所致的結果。總之,CENP-F對HCC更確切的診斷價值及在肝癌中的作用還有待更進一步的研究。
(四)CENP-H CENP-H是CENP-HIK復合物中一員,研究人員發現在缺乏CENP-H的情況下,細胞周期停滯于中期[21],可見其對細胞周期具有推動作用。 已有研究表明在HCC樣本中CENP-H mRNA和蛋白質水平高于相應的相鄰非癌樣品,免疫熒光測定顯示CENP-H定位于細胞核中。在60例HCC患者中分析CENP-H的表達與臨床病理特征之間的相關性顯示:CENP-H蛋白水平與患者年齡、性別、淋巴結轉移、遠處轉移和靜脈侵襲之間無統計學相關性。但發現CENP-H蛋白的表達與腫瘤組織學分級密切相關,組織學分級較高與HCC患者中CENP-H過表達的頻率較高顯著相關(P=0.001)。此外,腫瘤大小與患者中CENP-H表達也可能存在某種聯系[22]。進一步研究發現敲低CENP-H的表達能抑制體外Hep3B細胞增殖和單細胞集落形成的能力,在體內也能抑制腫瘤的生長,其機制可能是通過線粒體凋亡途徑參與HCC細胞的增殖和凋亡[23]。
(五)CENP-K CENP-K同樣是CENP-HIK復合物中一員。有研究者[24]發現在肝癌組織中CENP-K mRNA和蛋白質水平顯著升高,并且其mRNA表達水平與甲胎蛋白(AFP)水平(≥400 ng/mL)和腫瘤大小(≥3 cm)呈正相關,但與年齡、性別和淋巴轉移等情況無關。并且在多種肝癌細胞系中過表達和沉默CENP-K基因的實驗中,發現其對細胞的增殖和遷移克隆形成等均有影響。動物實驗表明過表達的CENP-K具有更強的致瘤作用。進一步研究發現在CENP-K過表達的HCC樣本中CENP-K啟動子DNA甲基化狀態顯著降低,過表達的CENP-K激活AKT和MDM2蛋白酪氨酸磷酸化,抑制TP53蛋白酪氨酸磷酸化。最近還有研究者發現敲低HCC細胞CENP-K后可以通過YAP1抑制上皮-間質轉化(EMT)[25]。這些結果表明CENP-K異常過表達可能有促進肝癌發生發展作用。
(六)Zwint Zwint是KNL1復合體的成分之一,是紡錘體組裝檢查點(spindle assembly checkpoint,SAC)的必須成分[4]。該蛋白質在肝癌、卵巢癌、乳腺癌以及肺腺癌等多種腫瘤中均過表達。近年研究發現Zwint mRNA和蛋白表達在HCC樣品和一些肝癌細胞系中上調,且與和臨床病理學特征(例如腫瘤大小和數量)顯著相關,其高表達與較差的總體存活率和較大的腫瘤復發傾向相關,同時發現Zwint還影響多種細胞周期蛋白的表達[26]。但是另一項研究結果卻顯示與癌旁組織相比,肝癌組織Zwint蛋白表達水平更低,臨床病理特征相關的分析發現在腫瘤越大(大于5 cm)、TNM分期越晚的患者中Zwint的表達水平越低,而且觀察到HCC患者手術后,Zwint高表達者具有更長復發時間和生存期[27]。這兩個研究顯示了不同的結果,該蛋白質在肝癌中的表達情況、作用意義等還有待進一步研究。
三、展望
著絲粒蛋白在肝癌中的研究可能會為肝癌的診療提供新的思路和方法。目前著絲粒蛋白在肝癌中的研究雖然較少,但已經初步發現著絲粒蛋白家族某些成員的表達水平存在顯著異常且與肝癌患者臨床病理特征及肝癌細胞生理學活性等存在密切聯系,而且可能涉及的機制眾多。對于目前這些研究結果及其意義,還需要更多更大樣本量的研究來進一步證實。此外,在腫瘤細胞中對著絲粒蛋白本身有無突變的研究鮮有報道,研究可能存在的異常體內外因素導致著絲粒蛋白質突變而致癌的機制是否會對腫瘤的特異性診斷和靶向治療更有重要意義?這也可能是未來基礎醫學研究的重要內容。

