基于鮮味氨基酸的扒雞老湯品質標準化與穩定性研究
薄存美,劉登勇,2*,王笑丹,張慶永
1(渤海大學 食品科學與工程學院, 生鮮農產品貯藏加工及安全控制技術國家地方聯合工程研究中心, 遼寧 錦州,121013) 2(江蘇省肉類生產與加工質量安全控制協同創新中心,江蘇 南京,210095) 3(吉林大學 食品科學與工程學院,吉林 長春,130062) 4(山東德州扒雞股份有限公司,山東 德州,253003)
扒雞是中華傳統的地方特色美食,因其鮮香滑爽、撕絲相連的特點[1]而深受消費者喜愛,是我國最具代表性燒雞類產品之一。扒雞老湯對產品滋味貢獻度較大,是決定產品品質的重要因素[2]。老湯是由香辛料和調味料加水熬制而成的新湯發展而來,新湯經過多年煮制,其中的滋味物質逐漸達到穩定,從而實現肉-湯傳質平衡,對產品品質的穩定性產生重要影響[3]。老湯的滋味貢獻包括鮮味貢獻和咸味貢獻,其中鮮味主要來源于老湯煮制過程中肉類降解的鮮味物質以及肉-湯中鮮味成分相互滲透達到傳質平衡。SASAKI等[4]、NISHIMURA等[5]和PONJNE等[6]分別對豬背景長肌、雞湯和通心粉等產品鮮味物質進行研究,發現鮮味成分有助于提高產品的美味口感。
近年來,對扒雞老湯滋味方面的研究主要包括循環鹵制次數[2]和不同鹵煮階段[7]含量變化規律的研究,對老湯標準化與穩定性相關方面的研究較少。鮮味氨基酸(包括谷氨酸和天冬氨酸)作為老湯中的典型鮮味代表物質之一,是老湯鮮味貢獻的重要來源[8],其含量變化可直接反映老湯品質的變化,因此實現其含量的實時監測對產品的標準化與穩定性狀態至關重要。本課題組前期研究以液相色譜檢測結果為標準,研究得出了適于N,N′-二苯基硫脲膜修飾傳感器快速、準確檢測扒雞老湯中鮮味氨基酸(包括谷氨酸和天冬氨酸)含量的最佳樣品前處理方式[9]。
本研究以扒雞煮制老湯為研究對象,對不同煮鍋、不同鹵煮批次老湯中鮮味氨基酸含量變化進行探究,并將高效液相色譜檢測結果作為標準,將膜修飾傳感器檢測結果與之進行比較,以期能夠為扒雞產品品質標準化與穩定性研究提供參考,并為N,N′-二苯基硫脲膜修飾傳感器在實際工廠的應用提供理論依據。
1 材料與方法
1.1 材料與儀器
1.1.1 材料與試劑
材料:扒雞老湯,山東德州扒雞股份有限公司。
試劑:異硫氰酸苯酯(pheryl isothiocyrate,PITC)、三乙胺、無水乙酸鈉、正己烷、冰乙酸、濃H2SO4、H2O2、正己烷、四氫呋喃、鄰苯二甲酸二辛酯、聚氯乙烯、N,N′-二苯基硫脲(N,N′-diphenylthiourea,DPTU)(國產分析純),北京索萊寶科技有限公司;谷氨酸、天冬氨酸為標準品(純度>99%);乙腈、甲醇(色譜純),美國Signna公司。
1.1.2 儀器與設備
CHI660E電化學工作站,北京壯仕科技有限公司;LC-20AT高效液相色譜儀,日本島津儀器公司;Allegra 64R冷凍離心機,美國Beckman公司;AL104電子天平,瑞士Mettler Toledo公司;鉑盤電極、鉑絲電極、232型飽和甘汞電極,上海楚兮實業有限公司。
1.2 實驗方法
1.2.1 取樣方法
老湯樣品取樣后立即進行過濾處理(4層紗布,200目),去除殘余的肉渣以及其他大物質顆粒,經過濾處理后得到的老湯用真空包裝袋以200 mL/袋左右的規格包裝,通過手動排除法排除真空包裝袋內殘留的空氣,密封冷凍完全,離心處理以進一步除去脂肪以及蛋白質等大分子顆粒物質,得到老湯澄清液。
為研究不同煮鍋老湯中的鮮味氨基酸含量的一致化與標準化,隨機選取10鍋老湯進行實驗,編號依次為A、B、C、D、E、F、G、H、I和J。將煮鍋中老湯表面的浮油撇去,取適量中間位置的老湯作為實驗樣品,每鍋檢測至少設置3個平行;隨后每間隔10 d取樣1次,每批次編號1、2、3、4和5,分別通過高效液相色譜和膜修飾傳感器檢測鮮味氨基酸含量,對老湯穩定性進行研究,并將兩者檢測結果進行比較。
1.2.2 液相色譜檢測
標準工作溶液的配制:準確稱取10.00 mg谷氨酸、天冬氨酸,用去離子水定容至10 mL,超聲溶解,得到(1+1)mg/mL的谷氨酸-天冬氨酸混合標準溶液,4 ℃保存。用去離子水稀釋成質量濃度為12.5、25.0、50.0、100.0、150.0、200.0和250.0 μg/mL的標準系列梯度混合溶液。
衍生化處理:參照芮鴻飛等[10]的方法并稍作修改,取500 μL上述稀釋后的老湯樣品,置于4 mL塑料試管中,再分別加入PITC-乙腈溶液、三乙胺-乙腈溶液各250 μL,充分混勻后在室溫下放置30 min,加入50 μL乙酸(體積分數20%)充分混勻,向衍生完畢后的溶液中加入1 mL正己烷,用旋渦振蕩儀振蕩60 s,萃取掉剩余的衍生試劑,靜置10 min分層,棄去上層正己烷溶液,用5 mL針頭注射器吸出下層清液,經0.45 μm有機濾膜過濾打入2 mL液相色譜頂空瓶內,用于液相色譜檢測。
色譜條件:色譜柱Agilent ZORBAX SB-C18(250 mm×4.6 mm, 5 μm); 柱溫40 ℃; 檢測波長254 nm;流速1 mL/min; 流動相A為乙酸鈉溶液,流動相B為體積分數80%乙腈溶液;流動相洗脫程序:0 min,A 92%;B 8%;2 min,A 92%;B 8%;10 min,A 90%;B 10%。
1.2.3 電極預處理
電極預處理參考朱靈濤[11]的方法并稍作修改,最終由鉑盤電極、鉑絲電極和飽和甘汞電極構建三電極體系,并進行后續電化學實驗。
1.2.4 膜修飾傳感器的制備
參照朱靈濤[11]的方法并稍作修改。膜溶液組成:5 mL四氫呋喃、0.50 mL鄰苯二甲酸二辛酯、0.08 g聚氯乙烯、0.095 g DPTU。采用直接滴涂法,用移液槍準確吸取10 μL膜溶液滴涂于鉑盤電極表面,自然晾干后備用。
1.2.5 標準溶液的配制
準確稱取谷氨酸、天冬氨酸各14.70、13.30 mg,用去離子水分別定容至100 mL,超聲至完全溶解,得到1 mmol/L谷氨酸和天冬氨酸標準溶液,4 ℃保存。臨用時分別稀釋成10-6、10-5.5、10-5、10-4.5、10-4、10-3.5和10-3mol/L進行膜修飾傳感器電信號檢測。
1.2.6 電化學傳感器檢測流程
扒雞老湯(除去浮于表層的油脂)→過濾(除去香辛料碎渣、肉末等大塊固形物)→取20 mL,離心(13 000×g、20 min)→取5 mL上清液→定容至100 mL→攪拌(磁力攪拌,1 h)→電化學檢測
采用開路電位法進行電化學檢測,參數設置為穩定時間60 s;檢測時間60 s;檢測間隔0.1 s;高電位+1.0 V,低電位-1.0 V。
1.3 數據處理
2 結果與分析
2.1 氨基酸檢測衍生時間的選擇
選用PITC-乙腈、三乙胺-乙腈溶液為樣品衍生時的衍生劑,以最大濃度混標為研究對象,考察20、30、40、50和60 min等不同衍生時間對檢測結果的影響。結果顯示,30 min后液相色譜檢測響應值結果差異不顯著(P>0.05),考慮到實驗效率,選擇30 min作為樣品的衍生時間。
2.2 檢測器柱溫的選擇
測器柱溫的不同會對峰的形狀和分離度產生影響,進而影響檢測結果的穩定性[12]。考察35、40和45 ℃ 三個溫度梯度對檢測結果的影響,35 ℃洗脫效果不好,峰高較低,峰形質量差;40和45 ℃時均洗脫完整,40 ℃時天冬氨酸和谷氨酸的分離度分別為1.693、5.862,45 ℃時分離度分別為1.140、1.269。對高效液相色譜圖而言,峰間分離度越大,說明峰的分離效果越好,峰的質量越好[13],因此選擇柱溫為40 ℃進行后續試驗。
2.3 氨基酸的定性分析
在流動相A為0.1 mol/L乙酸鈉溶液,流動相B為體積分數80%的乙腈溶液,樣品衍生時間為30 min,檢測器柱溫的40 ℃的條件下,天冬氨酸和谷氨酸的分離效果良好。在保證分離條件下,對流動相洗脫程序進行調整,得到最佳分離條件,洗脫程序如1.2.2小節所示,在此條件下2種氨基酸實現了基線分離。鮮味氨基酸的標準色譜圖如圖1所示,扒雞老湯樣品的色譜圖如圖2所示。
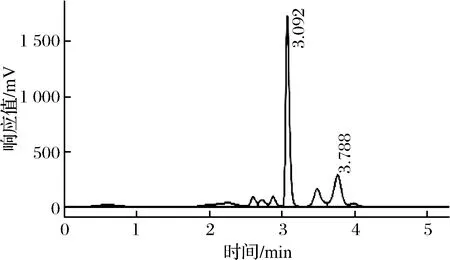
圖2 老湯中鮮味氨基酸高效液相色譜圖譜Fig.2 HPLC chromatogram of umami amino acids in brine
2.4 回歸方程的擬合
高效液相色譜及膜修飾傳感器檢測標準品的線性擬合回歸方程如表1所示。分別取7個濃度梯度進行線性擬合,每個梯度設置3個平行組試驗,數據擬合采用平均數,使用Origin 2017軟件進行擬合。

表1 線性回歸方程Table 1 Linear regression equation
2.5 基于鮮味氨基酸的工業老湯標準化研究
運用本文所建立的高效液相色譜儀檢測方法,以及在N,N′-二苯基硫脲膜修飾傳感器檢測扒雞老湯中鮮味氨基酸含量的最佳樣品前處理方式條件下,對所選取的10鍋工業化老湯中的2種鮮味氨基酸含量分別進行高效液相色譜以及膜修飾傳感器檢測,測定結果如表2所示。偏離度按公式(1)計算:
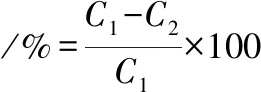
(1)
式中:C1,液相色譜檢測值,mmol/L;C2,傳感器檢測值,mmol/L。
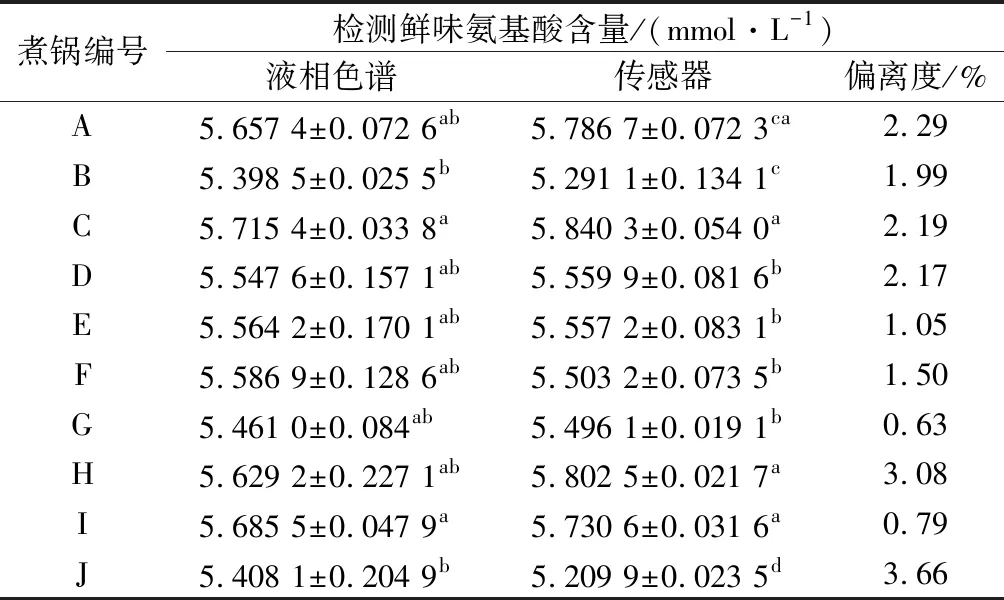
表2 傳感器檢測理論值與高效液相色譜儀檢測 實際值比較Table 2 Comparison between the theoretical value of the sensor detection and the actual value HPLC
高效液相色譜檢測結果表明,不同煮鍋間的谷氨酸和天冬氨酸含量存在差異性。對谷氨酸含量而言,煮鍋B和煮鍋J的谷氨酸含量與其他煮鍋存在顯著性差異(P<0.05),其余煮鍋谷氨酸含量雖存在差異,但在一定的可信度范圍內總體沒有顯著差異性(P>0.05)。天冬氨酸的含量在不同煮鍋間也存在差異性:煮鍋A、C和J的天冬氨酸含量與煮鍋E、F、G和H間存在顯著性差異(P<0.05),與煮鍋B、D和I無顯著性差異(P>0.05)。2種鮮味氨基酸含量的差異在不同煮鍋間的波動不大,老湯中鮮味氨基酸含量是處于動態平衡的狀態,谷氨酸和天冬氨酸含量最高的分別為煮鍋H和A,說明煮鍋H和A的肉樣煮制時間較長,肉中蛋白質的降解程度相對較高[14]。相對于總鮮味氨基酸含量而言,煮鍋A、C、D、E、F、G、H和I的鮮味氨基酸含量均不存在顯著性差異(P>0.05),原因可能是老湯經過多年使用,肉中鮮味氨基酸降解與形成速率以及在老湯中的溶解已達到動態平衡[15],鮮味氨基酸含量的檢測可用于評價老湯體系的品質變化規律。
膜修飾傳感器通過儀器收集、分析,實現物質含量測定[11]。通過將N,N′-二苯基硫脲膜修飾傳感器檢測結果與液相色譜檢測結果比較,結果的偏離程度<3.66%,說明電化學檢測結果雖存在一定偏移,但準確性相對較高,檢測結果穩定,數據可靠。且檢測的樣品前處理方法簡單,成本較低,值得工業化生產過程中用于鮮味氨基酸含量檢測中推廣。
為進一步比較液相色譜檢測結果與電化學檢測理論值兩者之間的差異性和聯系,采用雙變量相關性分析來研究兩者的關系。采用SPSS軟件進行Pearson相關性分析,以10鍋老湯檢測鮮味氨基酸含量的平行檢測3次的平均值進行模型構建,繪制Pearson分布散點圖,結果如圖3所示。
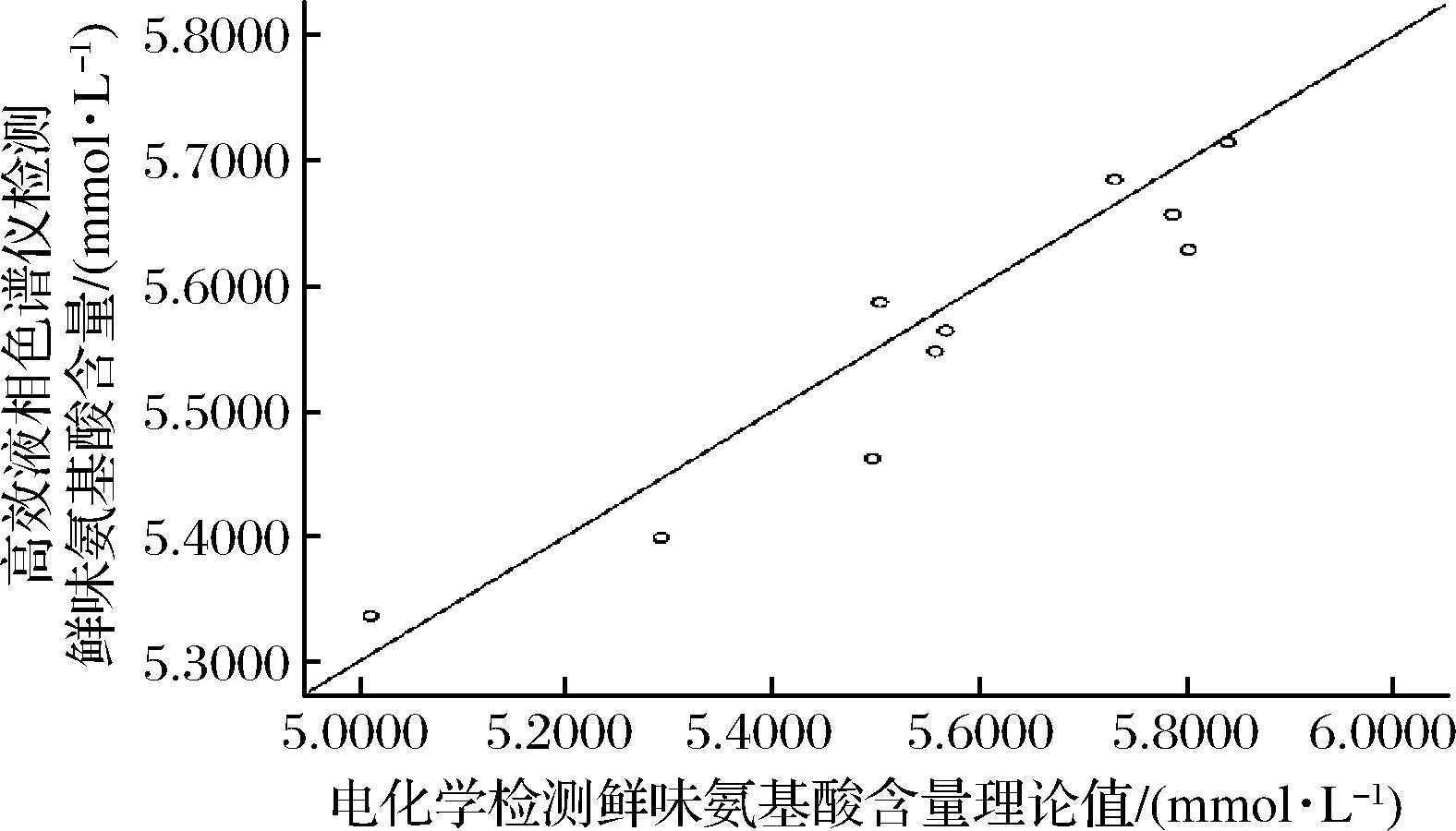
圖3 傳感器理論值與高效液相色譜儀檢測結果的分布圖Fig.3 Distribution of theoretical values of sensors and detection results of HPLC
由圖3可知,兩者的線性擬合度達到0.979,因此可認為傳感器所檢測的數據與高效液相色譜儀檢測的數據是相關的。
2.6 基于鮮味氨基酸的工業老湯穩定性研究
由表3可知,同一煮鍋不同取樣時間的老湯中鮮味氨基酸含量總體差異不顯著(P>0.05),但存在個別煮鍋不同取樣批次的鮮味氨基酸存在差異性,就煮鍋A而言,批次1和5的檢測值與其他取樣批次存在顯著差異(P<0.05);煮鍋E的鮮味氨基酸含量在不同取樣批次間存在差異性:批次1、2和5取樣檢測結果與批次3、4取樣檢測結果差異顯著;煮鍋G、I和J中不同取樣批次也存在顯著性差異(P<0.05);其余煮鍋不同取樣批次的檢測結果差異不顯著(P>0.05)。差異的原因可能是取樣時樣品處于不同鹵煮階段,同時原料肉中氨基酸的形成和降解速率的差異,造成肉湯間存在濃度差,導致肉湯間相互滲透[16];煮制雞種的差異也會造成檢測結果的差異性[18]。醬鹵老湯經多年煮制后,其中的滋味物質已達到動態平衡,平衡并不代表各物質含量一成不變,而是在合理的范圍內波動,從而達到老湯滋味對產品滋味貢獻的穩定性與和諧性。鮮味氨基酸作為老湯中鮮味貢獻的重要來源,其含量變化可直接反應老湯品質的變化,檢測出的醬鹵老湯中鮮味氨基酸含量在一定的范圍內波動變化,說明不同煮鍋及取樣間隔雖存在差異性,但數據波動在合理范圍內,可認為老湯品質是穩定的。表4是膜修飾傳感器檢測結果的測定結果,兩者在同一取樣條件下檢測的數據結果的統計學雖存在差異,但數據差異小,說明膜修飾傳感器可較好地替代液相色譜儀進行老湯中鮮味氨基酸含量的檢測,利用N,N′-二苯基硫脲膜修飾的傳感器檢測扒雞老湯中鮮味氨基酸含量的方法具有可行性,且相較于常規檢測方法更為簡便易行、快速、節約成本,可以用于實際生產。
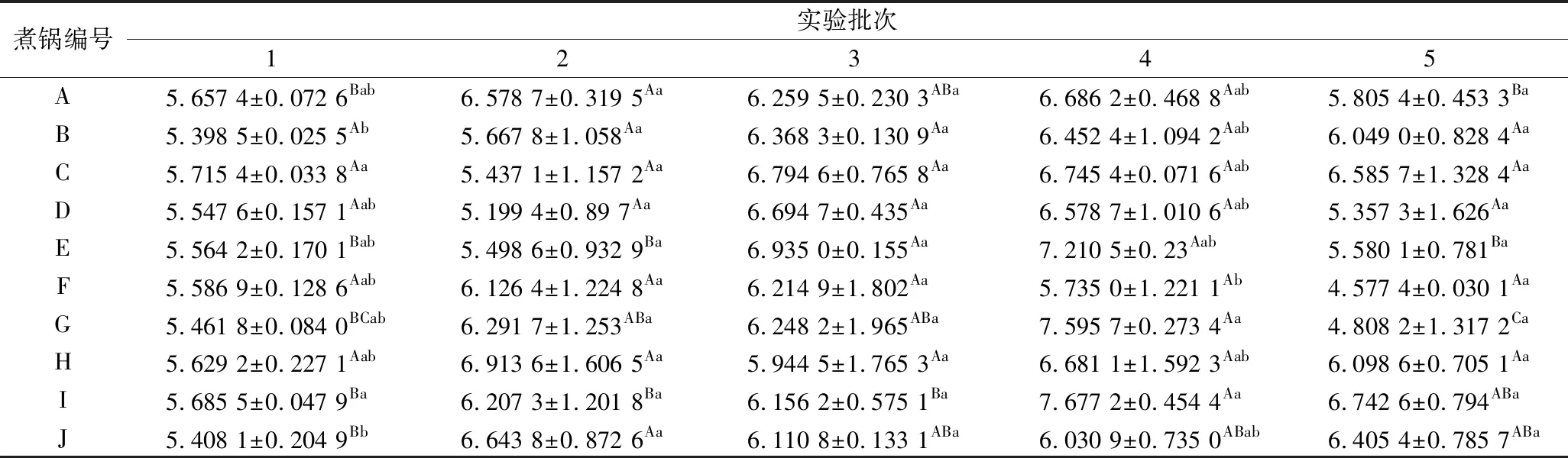
表3 鮮味氨基酸含量的高效液相色譜儀檢測結果 單位:mmol/L
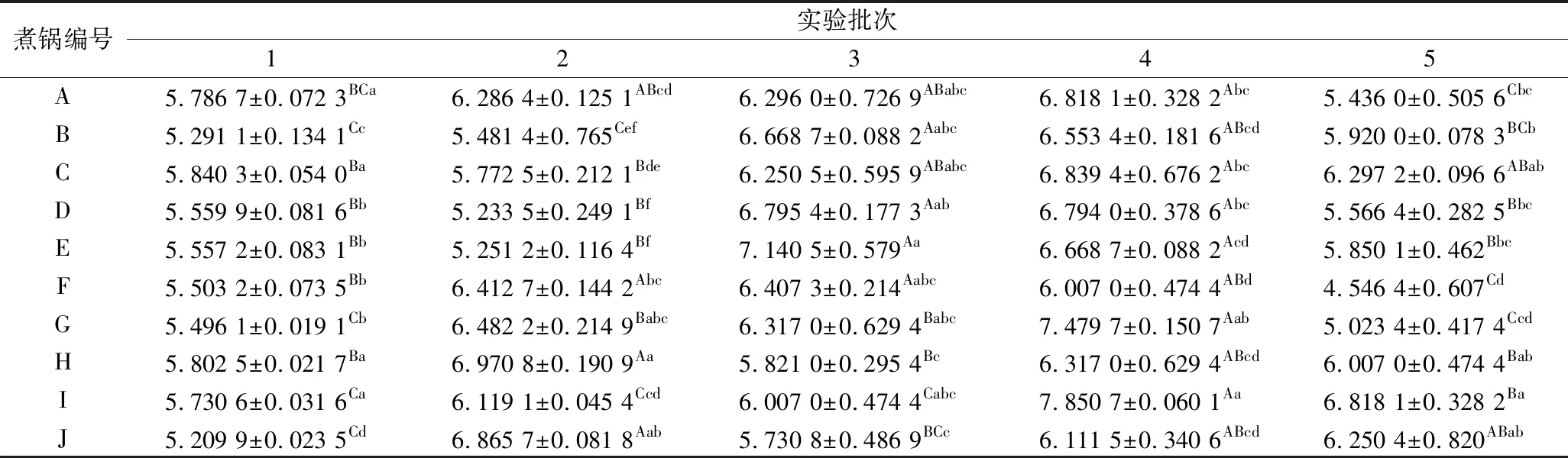
表4 鮮味氨基酸含量的膜修飾傳感器檢測結果 單位:mmol/L
2.7 傳感器檢測的干擾分析
就老湯的標準化而言,高效液相色譜儀實際檢測值與傳感器模型的擬合度為0.979,接近于1,說明2種檢測方法的結果較為接近,但擬合曲線發生了一定漂移;就老湯的穩定性而言,同一取樣條件下兩者的檢測結果接近,因此可以認為傳感器檢測值與高效液相色譜儀檢測的實際值較為接近,但實驗結果存在一定誤差,原因可能是檢測樣品差異。實際檢測中的工業化老湯盡管經過過濾及離心等一系列前處理,但是其成分相對復雜,其中殘留的糖類及短鏈脂肪酸等小分子能在電極反應過程中影響鮮味敏感物質N,N′-二苯基硫脲與目標氨基酸結合,從而導致信號發生偏移。另一方面,谷氨酸和天冬氨酸在老湯中存在解離程度強弱的問題[19],且可以結合在寡肽、多肽以及小分子蛋白質,由于蛋白和肽結構復雜且分子內作用力強,在電極反應時目標氨基酸不能準確與N,N′-二苯基硫脲結合從而產生電位變化。同時,N,N′-二苯基硫脲對溶液中鮮味氨基酸的吸附和解離能力也可能會造成影響。
3 結論
通過對不同煮鍋、不同批次扒雞煮制老湯鮮味氨基酸含量進行分析,發現各氨基酸含量變化不受煮鍋的影響;不同批次煮鍋鮮味氨基酸含量基本不存在顯著性差異,說明老湯經過多年煮制后已基本達到標準化與穩定性的要求。將N,N′-二苯基硫脲膜修飾傳感器檢測的鮮味氨基酸理論值與液相色譜檢測結果的實際值進行比較發現,二者檢測結果接近,數據較可靠。綜合以上分析,可認為應用N,N′-二苯基硫脲膜修飾傳感器檢測扒雞老湯中鮮味氨基酸含量的方法準確、可靠,可較好地替代常規方法快速檢測老湯鮮味氨基酸含量。

