肺腺癌表達TRPM8蛋白的意義*
馬洪明, 黃遠順, 黃妙靈, 張 苗, 陳 洋, 黃志宏,崔 淼, 梁婉玲, 劉升明, 蔡興東△
(1暨南大學附屬第一醫院呼吸內科,廣東廣州510630;2暨南大學生命科學技術學院,廣東廣州510632)
肺癌目前仍然是全世界范圍內導致腫瘤性死亡的首要原因[1]。2018年,全球新發肺癌病例約210萬,死亡病例約180萬[1]。目前男性肺癌患者的發病率呈下降趨勢,但在女性中,肺癌的發病率呈上升并年輕化趨勢[2-3]。肺癌目前5年累積生存率約為18%,但仍然有一半以上的肺癌患者在確診時已經處于晚期,其5年累積生存率僅為4%左右[4],主要是由于肺癌的發生發展機制不清楚,仍需探索相關治療和預后預測的靶點。
瞬時受體電位(transient receptor potential,TRP)通道是一類陽離子通道,參與了機體多種生理活動,其中TRPM8屬于TRPM亞家族,被激活后可引起細胞Ca2+內流,Ca2+作為第二信使調控細胞增殖、運動、凋亡等生物學行為。研究表明,TRPM8在前列腺癌[5]、胰腺癌[6]和膀胱尿路上皮癌[7]中高表達,與患者的不良預后有關。TRPM8影響Lewis肺癌細胞的黏附、移動和侵襲能力[8]。但在肺腺癌中TRPM8的表達及其臨床意義尚無文獻報道,因此本研究通過檢測TRPM8在肺腺癌組織中的表達,分析其與患者臨床特征的關系,并通過上調肺腺癌細胞中TRPM8的表達分析其對肺腺癌細胞生物學行為的影響。
材料和方法
1 患者臨床資料、組織標本收集及分析
1.1 患者組織標本、臨床資料收集及隨訪 收集暨南大學附屬第一醫院2007~2012年病理確診肺腺癌患者112例,包括75例肺腺癌及匹配的癌旁組織,癌旁組織定義為肺癌切緣外3 cm處肺組織。其中男66例,平均年齡(59.9±10.6)歲,女 46例,平均(59.8±11.1)歲。所有患者均簽署知情同意書,并經暨南大學附屬第一醫院倫理委員會批準進行研究。術前均未經放療及化療,所有患者術后病理證實為腺癌或支氣管肺泡癌。根據國際肺癌研究學會肺癌第7版TNM分期標準進行分期,所有患者隨訪至死亡或4~5年。
1.2 組織標本免疫組織化學染色分析 采用鏈霉抗生物素蛋白-過氧化物酶(streptavidin-peroxidase,SP)法進行免疫組織化學染色,分析TRPM8在肺腺癌及癌旁組織中的表達。HE染色常規顯示肺實質及間質細胞。兔抗TRPM8多克隆抗體(LifeSpan Biosciences)按 1∶200稀釋,HRP 標記的羊抗兔 IgG(Boster)。采用SP超敏試劑盒,按照說明書操作,以PBS代替I抗,做空白對照。免疫組織化學結果由兩位病理科醫師分別雙盲閱片判定。TRPM8在肺腺癌切片中表達強度參考文獻[9-10]評分。染色強度評分如下:0分(無染色),1分(輕度染色:淺黃色),2分(中度染色:黃棕色),3分(重度染色:棕色)。染色陽性細胞數評分如下:0分(無染色陽性細胞),1分(<10%陽性細胞),2分(10~50%陽性細胞),3分(>50%陽性細胞)。染色指數=染色陽性細胞數×染色強度,共記為0、1、2、3、4、6和9分。表達高低的最佳截斷值基于log-rank檢驗分析肺腺癌患者病理組織中TRPM8蛋白表達與患者預后關系來界定。其中染色指數≤4為低表達,>4為高表達。
2 細胞實驗
2.1 通過慢病毒感染上調A549和H1299細胞TRPM8表達 人肺腺癌細胞A549和H1299購自中國科學院上海細胞庫,以含有10%胎牛血清(Gibco BRL)、1×105U/L青霉素及100 mg/L鏈霉素的DMEM培養液(Gibco BRL)培養,置于5%CO2、37℃培養箱,每2 d更換培養液1次。含重組人TRPM8基因(NM_024080.4)慢病毒顆粒及對照空載體慢病毒顆粒購自吉凱基因,該病毒攜帶篩選基因EGFP及嘌呤霉素。A549及H1299細胞感染病毒72 h后以10μg/L嘌呤霉素(Sigma)終濃度篩選3周,熒光顯微鏡下可見均帶有EGFP的細胞,提示篩選成功。篩選成功后提取細胞總RNA,以T100 PCR儀(Bio-Rad)擴增,循環參數如下:95℃ 30 s;95℃ 30 s,51℃ 30 s,72℃30 s,共35個循環。TRPM8上游引物序列為5′-GAAAACACCCAACCTGGTCATTTC-3′,下游引物序列為 5′-CACCGTGCGGGGTAAAAAGCG-3′;內參照GAPDH上游引物序列為5′-TTGGTATCGTGGAAGGACTC-3′,下游引物序列為 5′-TGCTGTTGAAGTCAGAGGAGAC-3′。凝膠電泳鑒定PCR產物。同時提取細胞總蛋白,按KeyGene蛋白提取試劑盒說明書進行操作。以10%SDS-PAGE分離蛋白后轉印于PVDF膜(Milipore)上。然后以5%的脫脂奶粉封閉1小時,分別剪開PVDF膜(TRPM8,120 kD;GAPDH,45 kD),在4℃冰箱中分別孵育兔抗TRPM8抗體(1∶200,LifeSpan Biosciences)及 GAPDH 抗體(1∶3 000,Boster)過夜,PBST洗膜5次后以HRP交聯的鼠抗兔II抗(CoWin Biosciences)室溫孵育1 h,PBST洗膜3次后滴入ECL發光液進行顯色并曝光拍片,保存以備分析。
2.2 CCK-8法及集落形成試驗 (1)將穩定表達TRPM8蛋白的A549細胞、空載體細胞和親本細胞按每孔8×103個接種至96孔板中,每組設置3個復孔。培養24 h后加入CCK-8(Dojindo),按試劑說明書進行操作,每次加入CCK-8試劑1 h后在酶標儀450 nm波長處讀A值。測定細胞接種后24、48、72、96、120、144和168 h的A值。(2)將對數生長期上述3組細胞用0.25%胰酶消化并吹打成單個細胞,按培養皿4×104個接種培養,每2 d更換培養液一次,待細胞形成顯著的細胞集落后以結晶紫染色,每組重復實驗3次,統計3組細胞集落數的差異。
2.3 細胞劃痕試驗 在6孔板背面劃橫線標記,將穩定表達TRPM8蛋白的A549細胞、空載體細胞和親本細胞按每孔8×103個接種至標記6孔板中,培養24 h后細胞量達90%~95%時,用200μL吸頭及滅菌直尺垂直于6孔板的板底逐個依次劃痕,吸去舊培養液,用PBS輕輕洗滌3次,洗去脫落的細胞碎片,各孔加入2%高糖培養液3 mL,拍照并記錄為0 h圖像,繼續培養,間隔8h后再取出拍照,記錄遷移距離,分別記錄為8、16和24 h圖像,每組重復實驗3次,應用ImageJ軟件分析,并統計結果。
2.4 Transwell實驗 Transwell小室充分水化2 h,上室分別加入200μL穩定表達TRPM8蛋白的A549細胞、空載體細胞和親本細胞的細胞懸液(1×108/L),下室加入10%完全培養液500μL,放入原培養箱中培養,24 h后取出,PBS清洗2次,用棉簽輕輕拭去未穿透的細胞,結晶紫染色液染色15 min,流水緩慢淋洗,室溫晾干,顯微鏡下選擇3個視野拍照并保存,應用Image-Pro Plus 6.0軟件進行計數,并統計分析。
2.5 細胞周期及凋亡檢測 (1)培養穩定表達TRPM8的A549細胞和空載體A549細胞,培養至對數生長期后進行流式細胞術檢測,具體方法參考文獻[11]。記錄細胞在激發波長為488 nm處所得紅色熒光,重復實驗3次,分析不同組在細胞周期分布中的差異。(2)將上述2組細胞在6孔板中培養至對數生長期,以annexin V-FITC及PI雙染色試劑(BD)進行染色后通過流式細胞術檢測早期和晚期凋亡情況,具體方法參考文獻[12],重復實驗3次。
2.6 C57/BL6N重度聯合免疫缺陷小鼠移植瘤實驗 選取5只雌性C57/BL6N重度聯合免疫缺陷小鼠,將穩定表達TRPM8的H1299細胞(H1299-TRPM8)及其對照空載體細胞(H1299-control)培養至對數生長期,用PBS重懸后將100μL含1×107個細胞的懸液分別接種至4周大小C57/BL6N小鼠左右臀部皮下,左側臀部皮下接種H1299-control,右側臀部皮下接種H1299-TRPM8,繼續飼養觀察。待成瘤后用游標卡尺測量腫瘤大小,每周測量1次,計算腫瘤體積(=0.5×長徑×短徑2),并繪制腫瘤增殖曲線。飼養6周后脫頸處死裸鼠,剝離腫瘤組織并稱重。
3 統計學處理
使用SPSS 18.0軟件進行統計分析。計量資料采用均數±標準差(mean±SD)表示。TRPM8蛋白表達在各臨床參數之間的差異分析采用Mann-Whitney U檢驗;多組間均數比較采用單因素方差分析(oneway ANOVA);兩組間均數比較采用獨立樣本t檢驗;采用Kaplan-Meier法及log-rank檢驗分析肺腺癌患者TRPM8不同表達組累積生存率的差異;單因素和多因素Cox回歸模型分析影響肺腺癌患者預后的危險因素。以P<0.05為差異有統計學意義。
結 果
1 肺腺癌患者腫瘤組織中TRPM8蛋白表達情況及對患者預后的影響
免疫組化染色結果顯示,TRPM8在肺腺癌及癌旁組織中均有表達,在肺癌組織中主要定位于癌細胞的胞質中,而癌旁組織中主要定位于肺泡間質巨噬細胞的胞質中,見圖1。患者臨床特征和以染色指數區分的TRPM8高、低表達情況見表1。log-rank檢驗結果顯示,肺腺癌患者總體生存時間在TRPM8蛋白不同表達組存在顯著差異(P=0.017),見圖1F。Kaplan-Meier分析顯示,TRPM8低表達組患者4~5年累積生存率為37.52%(95%CI:0.241~0.412),TRPM8高表達組患者4~5年累積生存率為69.82%(95%CI:0.513~0.874)。TRPM8低表達的患者腫瘤最大徑為(4.29±1.84)cm,而TRPM8高表達的患者腫瘤最大徑為(3.56±1.60)cm,差異有統計學意義(P=0.028),見圖1G。
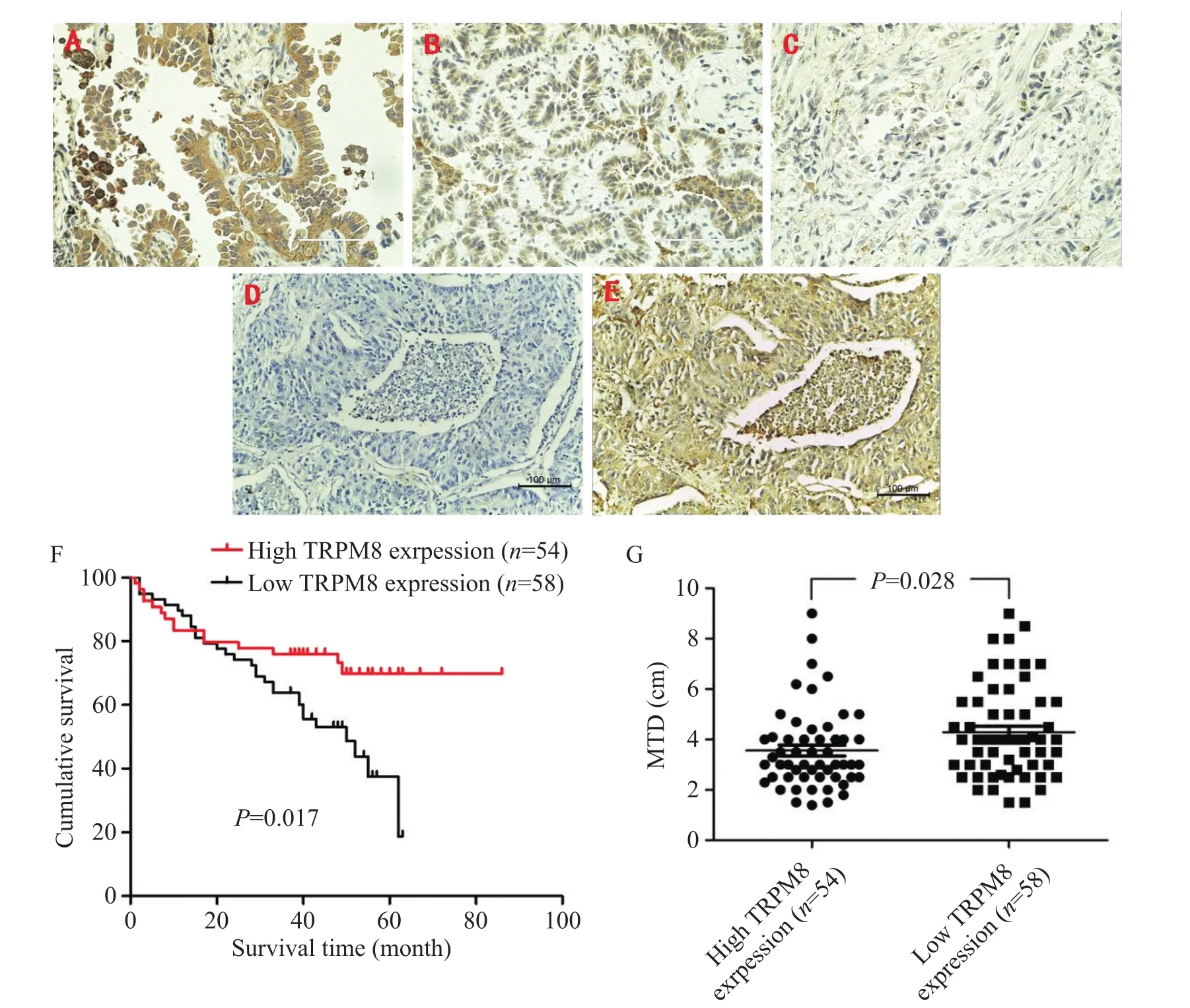
Figure 1.The expression of TRPM8 protein in tumor tissues was correlated with the overall survival time and the tumor size of the patients with lung adenocarcinoma.A~C:strong,moderate and negative immunohistochemical staining of TRPM8 in lung adenocarcinoma tissues,respectively(scale bar=100μm);D,E:a lung adenocarcinoma tissue section immunostained with PBS(negative control)and TRPM8 antibody,respectively(scale bar=100 μm);F:the overall survival time of patients with lung adenocarcinoma was significantly different between high and low TRPM8 expression groups(P=0.017);G:maximum tumor diameter(MTD)of the patients with lung adenocarcinoma was significantly different between high and low TRPM8 expression groups(P=0.028).Mean±SD.圖1 TRPM8在不同肺癌患者腫瘤組織中的表達及其與患者預后和腫瘤最大徑的關系
2 TRPM8表達與肺腺癌患者臨床特征的關系
分析TRPM8蛋白表達在肺腺癌患者臨床參數之間的差異,結果顯示,隨著腫瘤T分期的遞增,高表達TRPM8者呈減少趨勢(P<0.05),而M0期高表達TRPM8者比M1期多(P<0.05),不同年齡段、性別、分化程度、臨床分期和N分期的TRPM8表達差異無統計學意義(P>0.05),見表2。
3 TRPM8低表達是肺腺癌患者預后不良的獨立危險因素
單因素Cox回歸分析顯示,TRPM8蛋白表達水平、臨床病理分期和TNM分期均為影響肺腺癌患者預后的有意義變量(P<0.05);多因素Cox回歸分析顯示,TRPM8蛋白表達水平和腫瘤是否發生遠處轉移是導致患者預后不良的獨立危險因素:TRPM8低表達患者的死亡風險較高表達TRPM8患者增加2.33倍(95%CI:1.109~4.878,P<0.05),發生腫瘤遠處轉移的患者,其死亡風險較未發生遠處轉移者高5.32倍(95%CI:1.531~18.490,P<0.05),見表3。
4 過表達TRPM8對A549細胞增殖能力的影響
首先,通過慢病毒感染穩定上調A549細胞中TRPM8蛋白的表達,RT-PCR及Western blot顯示成功上調A549細胞中TRPM8 mRNA及蛋白的表達,見圖2A、B。CCK-8法結果顯示,過表達TRPM8后,相對于空載體和親本細胞組,A549細胞活力顯著下降(P<0.01),見圖2C。集落形成實驗結果顯示,過表達TRPM8后,A549細胞形成的集落數較親本和空載體組減少(P<0.01),見圖2D。
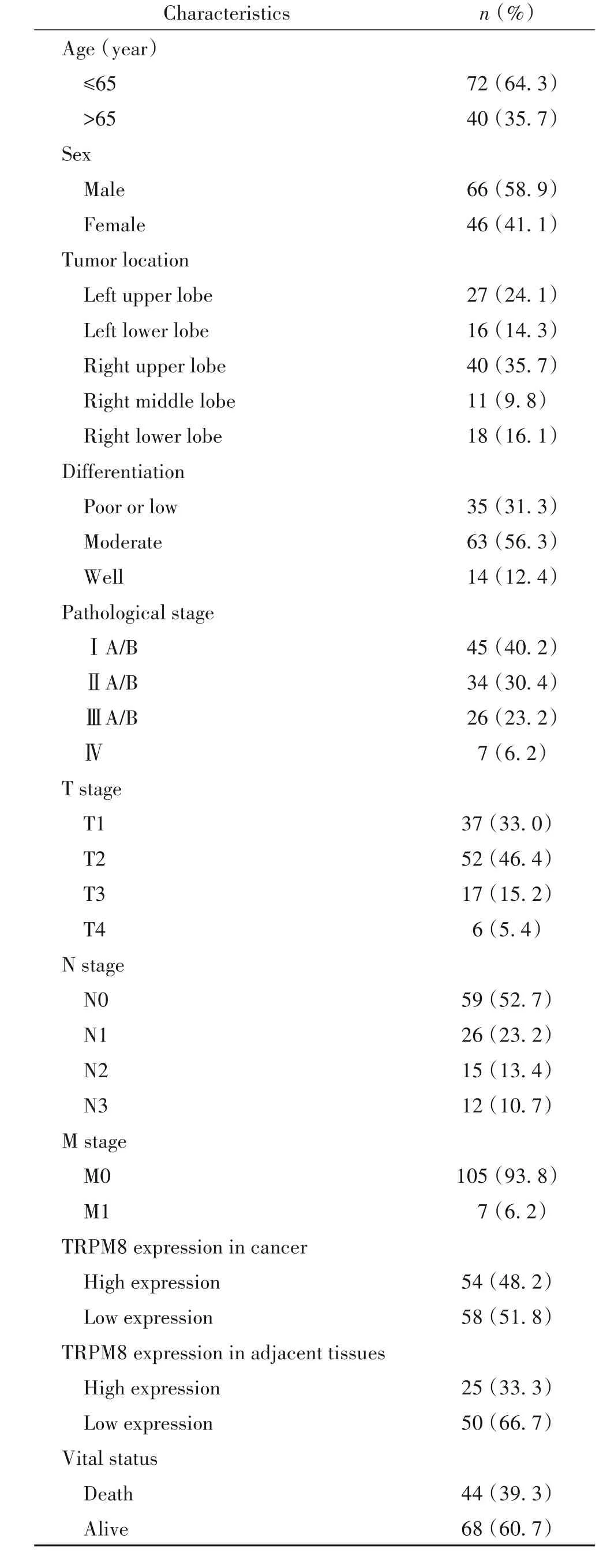
表1 112例肺腺癌患者臨床特征Table 1.The clinical characteristics of 112 patients with lung adenocarcinoma
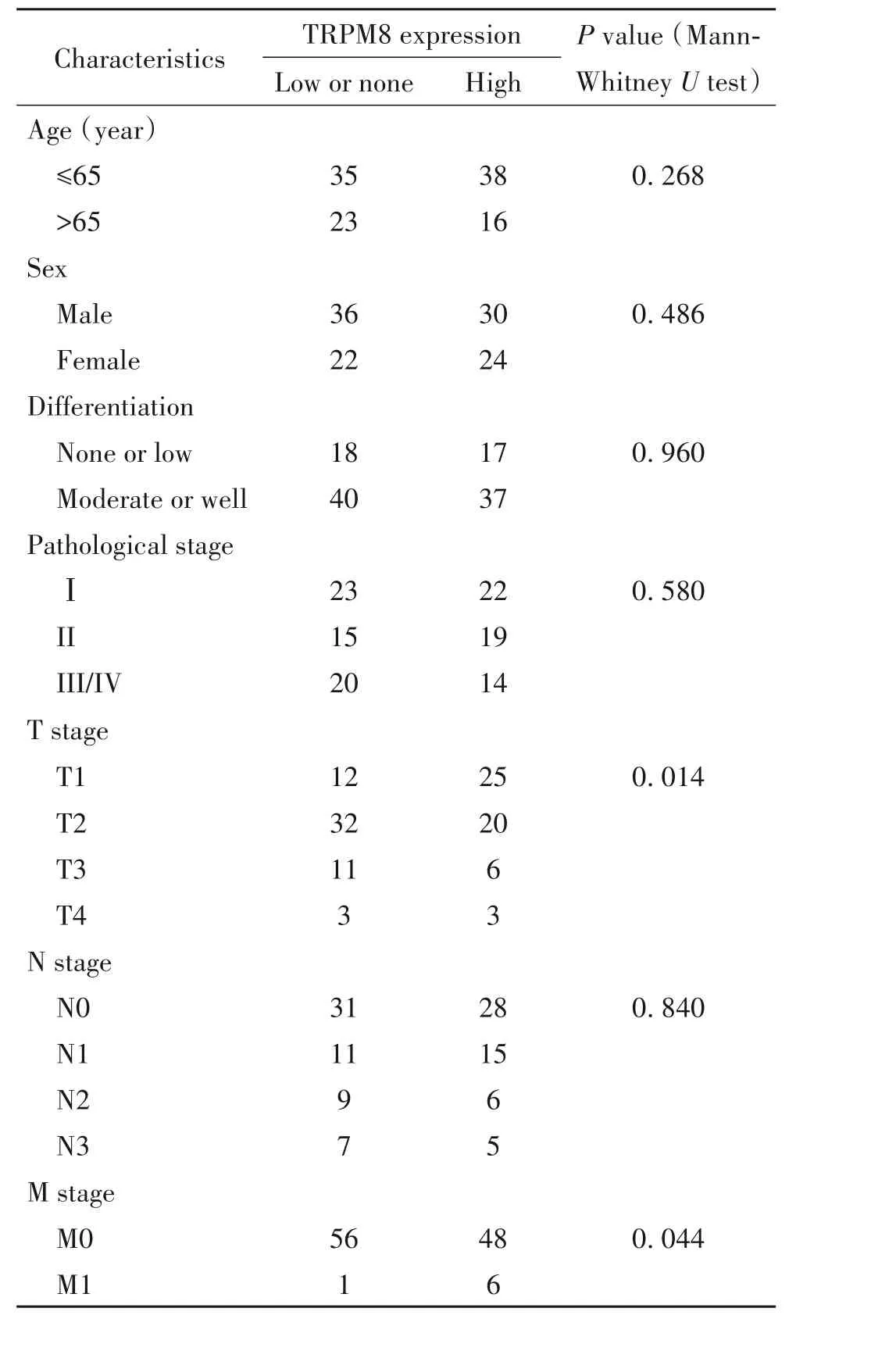
表2 肺腺癌患者臨床特征與TRPM8表達的關系Table 2.The correlation between the TRPM8 protein expression and the clinicopathological characteristics of patients with lung adenocarcinoma
5 過表達TRPM8對A549細胞周期及凋亡的影響
流式細胞術結果顯示,相對于空載體組,過表達TRPM8的A549細胞S期比例顯著升高(P<0.01),見圖3A;而過表達TRPM8的A549細胞與感染空載體的對照細胞的早期及晚期凋亡率差異無統計學顯著性(P>0.05),見圖3B。
6 過表達TRPM8對A549細胞遷移能力的影響
劃痕實驗結果顯示,過表達TRPM8的A549細胞遷移率在劃痕后8 h差異無統計學顯著性(P>0.05),在劃痕后16和24 h顯著降低(P<0.05),而親本和空載體A549細胞在不同時點遷移率的差異均無統計學意義(P>0.05),見圖4。
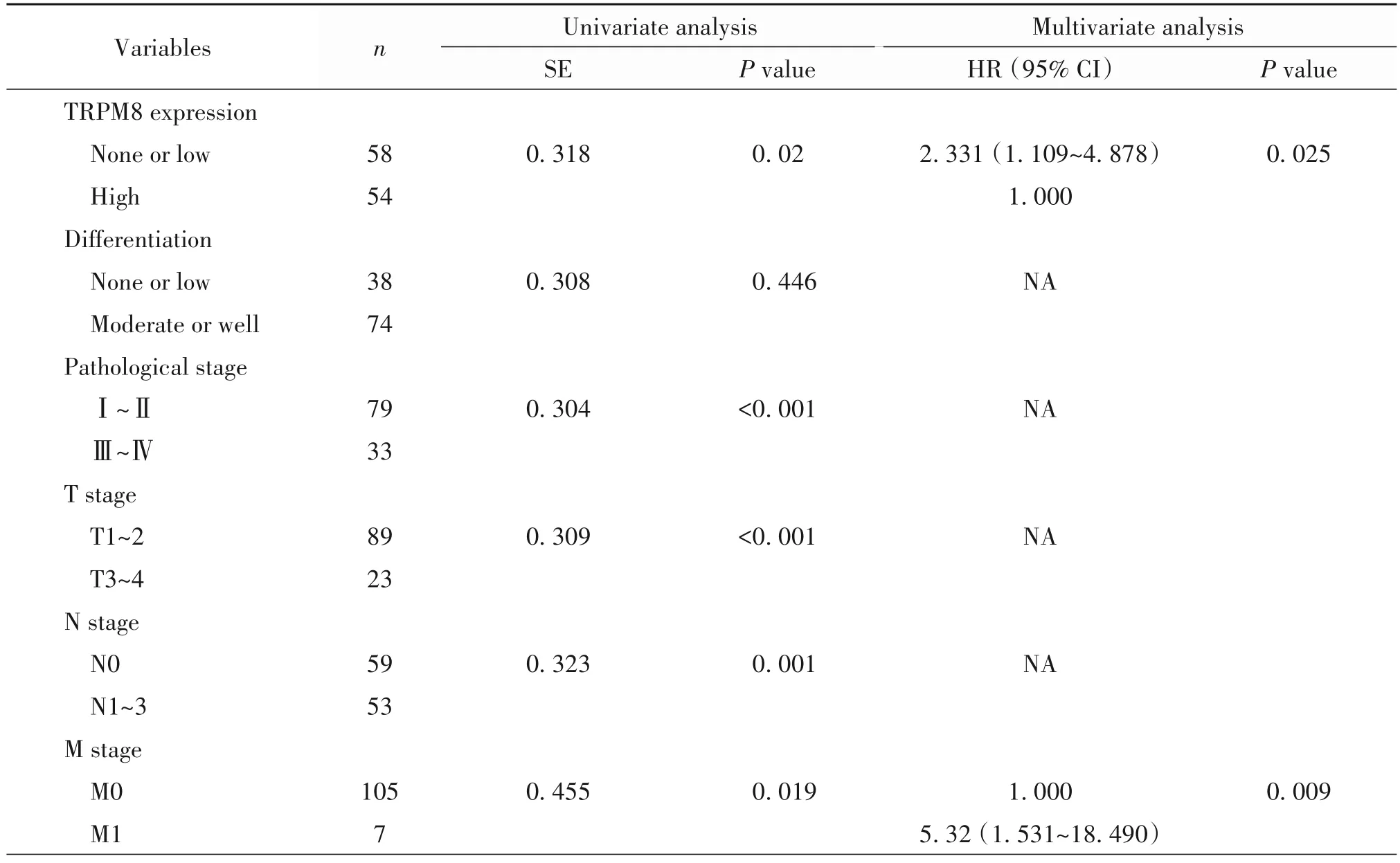
表3 Cox回歸模型單因素和多因素分析肺腺癌患者不良預后的危險因素Table 3.The risk factors for poor prognosis of lung adenocarcinoma patients evaluated by univariate and multivariate Cox regression analysis
7 過表達TRPM8對A549細胞侵襲能力的影響
Transwell侵襲實驗結果顯示,在相同時間內過表達TRPM8的A549細胞侵襲數(121.17±10.97)比親本及空載體A549細胞(618.17±67.52和529.83±45.50)顯著減少(P<0.01),見圖5。
8 過表達TRPM8對免疫缺陷小鼠H1299細胞移植瘤的影響
通過慢病毒感染上調H1299細胞中TRPM8的表達,Western blot結果顯示TRPM8在H1299細胞表達顯著上調,見圖6A。將H1299細胞接種于C57/BL6N免疫缺陷小鼠,構建移植瘤模型,移植瘤生長曲線顯示,TRPM8過表達的H1299細胞移植瘤生長速率顯著低于空載體對照的H1299細胞移植瘤(P<0.01),見圖6B、C。處死免疫缺陷小鼠后稱量移植瘤重量,結果顯示,TRPM8過表達的H1299細胞移植瘤重量較對照組顯著降低(P<0.01),見圖6B、D。
討 論
我們的研究結果首次在肺腺癌患者腫瘤組織中證實TRPM8蛋白的表達,生存分析結果顯示肺腺癌中高表達TRPM8的患者4~5年累積生存率顯著高于TRPM8低表達的患者,單因素和多因素Cox回歸分析都顯示TRPM8低表達與腫瘤患者不良預后有關,而且TRPM8高表達者腫瘤直徑更小,T分期更小,無遠處轉移的患者TRPM8高表達居多。因從,臨床資料提示肺腺癌高表達TRPM8似乎是一個保護因素,這與其他腫瘤中TRPM8的作用是不一致的。
TRPM8參與了前列腺上皮細胞增殖和(或)凋亡的調控,而其表達受雄激素受體調控[13],在雄激素敏感性LNCaP細胞中高表達的TRPM8促進了細胞的增殖,阻斷TRPM8功能或降低TRPM8表達都能誘導LNCaP細胞凋亡。Liu等[14]發現乳腺癌細胞TRPM8過表達促進癌細胞遷移,沉默TRPM8基因抑制高侵襲性乳腺癌細胞的侵襲和轉移能力。Wang等[15]發現,人骨肉瘤中TRPM8表達增加,并與骨肉瘤細胞的增殖和移動有關。這些研究顯示TRPM8促進了腫瘤的增長、侵襲和轉移。我們研究顯示TRPM8在肺腺癌患者腫瘤組織表達,高表達者預后好,提示其作為抑癌基因起作用,與其在前列腺癌,乳腺癌及骨肉瘤中的研究不同,具體機制不清楚。研究發現,早期前列腺癌為雄激素依賴性,TRPM8表達增加,隨著癌轉化為雄激素非依賴性,TRPM8表達降低,前列腺癌惡化進展、轉移,預后變差[16]。在雄激素非依賴的前列腺癌細胞PC-3中上調TRPM8的表達可顯著抑制腫瘤細胞的增殖及遷移能力,誘導細胞G0/G1期阻滯,抑制與腫瘤黏附能力相關的酶[17]。這提示TRPM8在不同腫瘤組織的作用不同,在前列腺癌中可能與激素存在與否相關。但在肺腺癌中,研究發現雄激素受體在不同性別之間表達無顯著差異,且雄激素受體的表達高低與患者的預后無顯著相關性[18],因而TRPM8的表達是否受到雄激素的調控目前還不清楚,需要進一步研究。
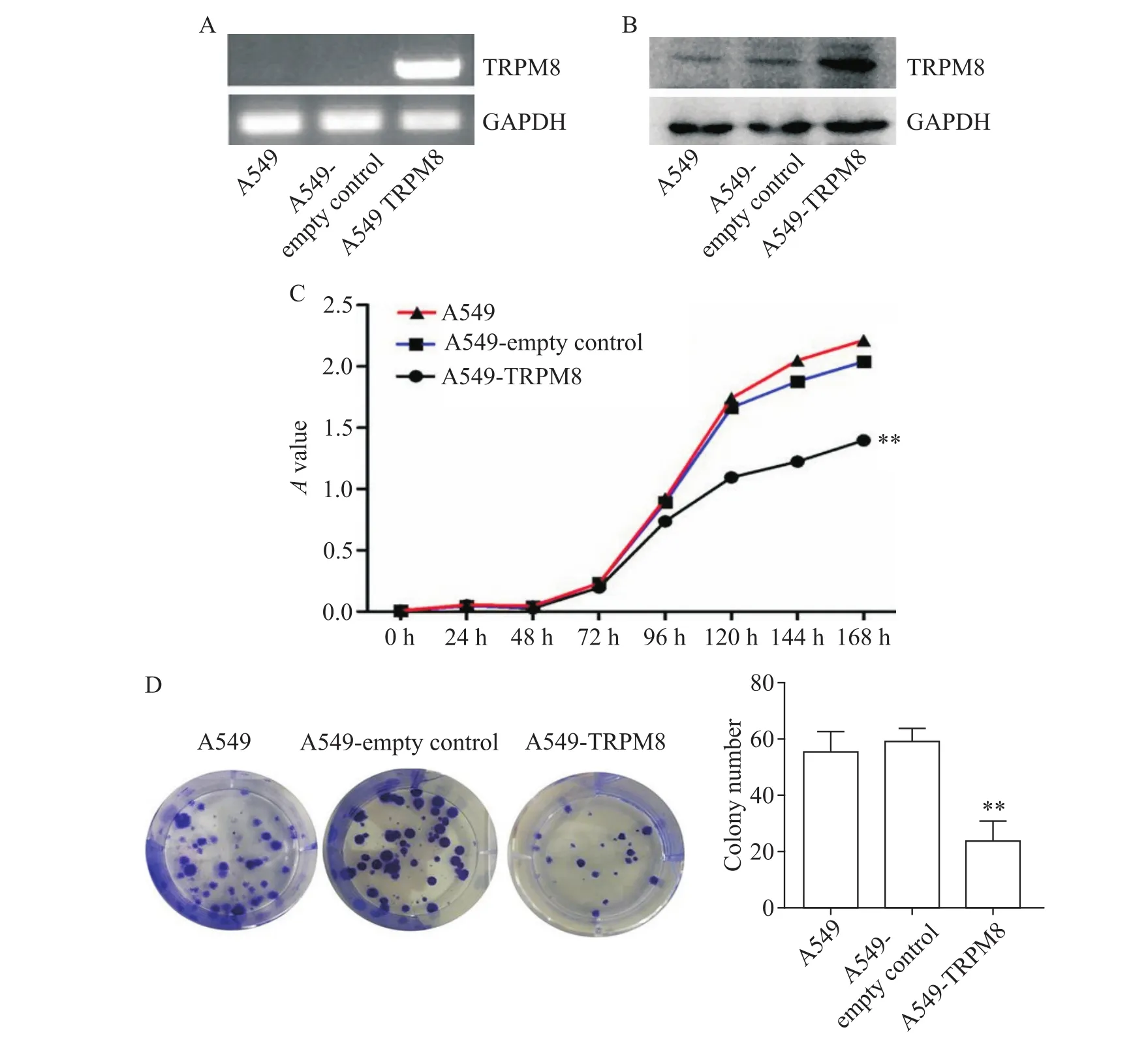
Figure 2.The effects of TRPM8 protein on the proliferation of A549 cells.The A549 cells were infected with lentivirus containing mock vector or TRPM8 cDNA vector.A:the TRPM8 mRNA expression was detected by RT-PCR;B:the TRPM8 protein expression was detected by Western blot;C:CCK-8 assay showed that overexpression of TRPM8 in A549 cells inhibited the viability of the cells;D:colony formation assay showed that overexpression of TRPM8 in A549 cells inhibited the colony-forming ability of the cells.Mean±SD.n=3.*P<0.01 vs A549 group or A549 empty control group.圖2 CCK-8法及集落形成實驗檢測TRPM8蛋白對A549細胞增殖能力的影響
為了進一步探討TRPM8在肺腺癌中的作用,我們選取肺腺癌A549細胞株,采用含重組人TRPM8基因慢病毒顆粒感染A549細胞,上調TRPM8表達。CCK-8法及集落形成實驗結果證實,過表達TRPM8后,A549細胞增殖能力下降。流式細胞術分析過表達TRPM8后,A549細胞S期比例顯著升高,凋亡無顯著變化,提示過表達TRPM8導致增殖能力下降可能是誘導腫瘤細胞S期阻滯所致,而非通過影響凋亡途徑。劃痕實驗結果顯示,過表達TRPM8后,A549細胞移動能力下降。Transwell侵襲實驗結果顯示,過表達TRPM8后,A549細胞侵襲能力下降。而在胰腺導管癌細胞中,沉默TRPM8表達可增強腫瘤的遷移能力,激活TRPM8則抑制其遷移能力[19],與我們的研究結果一致,提示TRPM8抑制肺腺癌細胞的侵襲和遷移能力。為了觀察上調TRPM8對肺腺癌細胞生物學行為的整體影響,我們采用免疫缺陷小鼠移植瘤實驗,觀察TRPM8對腫瘤生長的影響。結果顯示,過表達TRPM8后,H1299細胞所形成腫瘤的生長速率較對照組顯著下降,腫瘤重量較對照組顯著降低。與Zhu等[20]在PC-3前列腺癌細胞中過表達TRPM8抑制裸鼠移植瘤的實驗結果一致。這些研究結合我們的實驗結果表明,過表達TRPM8會影響了肺腺癌的增殖、侵襲和轉移等生物學行為。
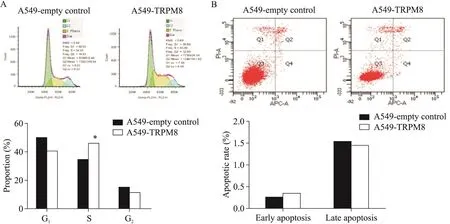
Figure 3.The effects of overexpression of TRPM8 protein on the cell cycle and apoptosis in A549 cells.A:flow cytometry analysis for cell cycle of A549 cells;B:the apoptosis of A549 cells was detected by flow cytometry with annexin V and PI staining,and the early and late apoptotic rates were calculated.Mean±SD.n=3.*P<0.05 vs A549-empty control group.圖3 上調A549細胞中TRPM8的表達對細胞周期及凋亡的影響
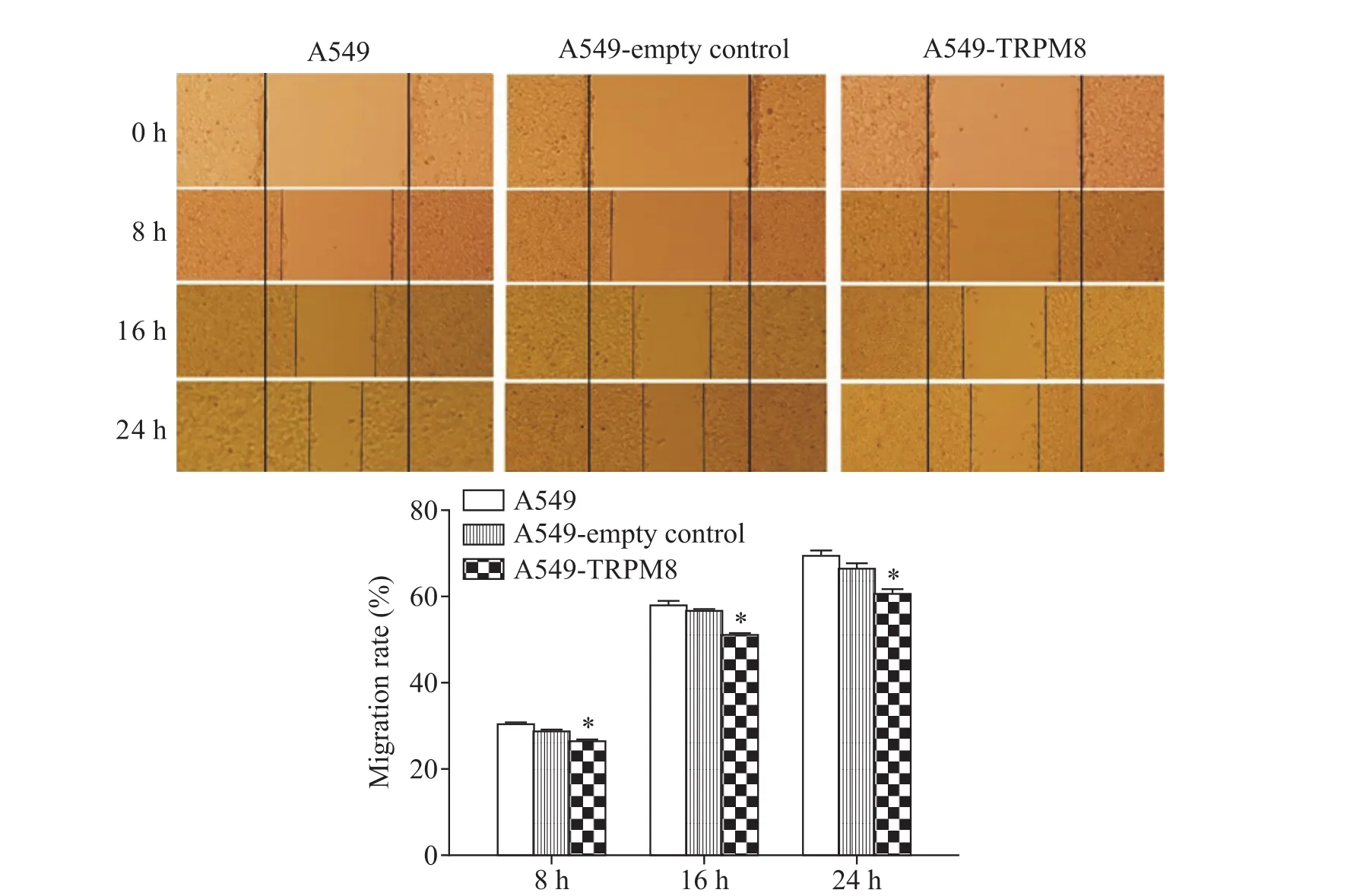
Figure 4.The effects of TRPM8 on the migration ability of A549 cells detected by cell scratch test.Mean±SD.n=3.*P<0.01 vs A549-empty control group.圖4 細胞劃痕實驗檢測上調A549細胞中TRPM8表達對細胞遷移能力的影響
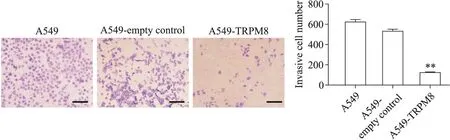
Figure 5.The effects of TRPM8 on the invasiveness of A549 cells.Scale bar=50 μm.Mean±SD.n=3.**P<0.01 vs A549-empty control group.圖5 TRPM8對各組A549細胞侵襲能力的影響
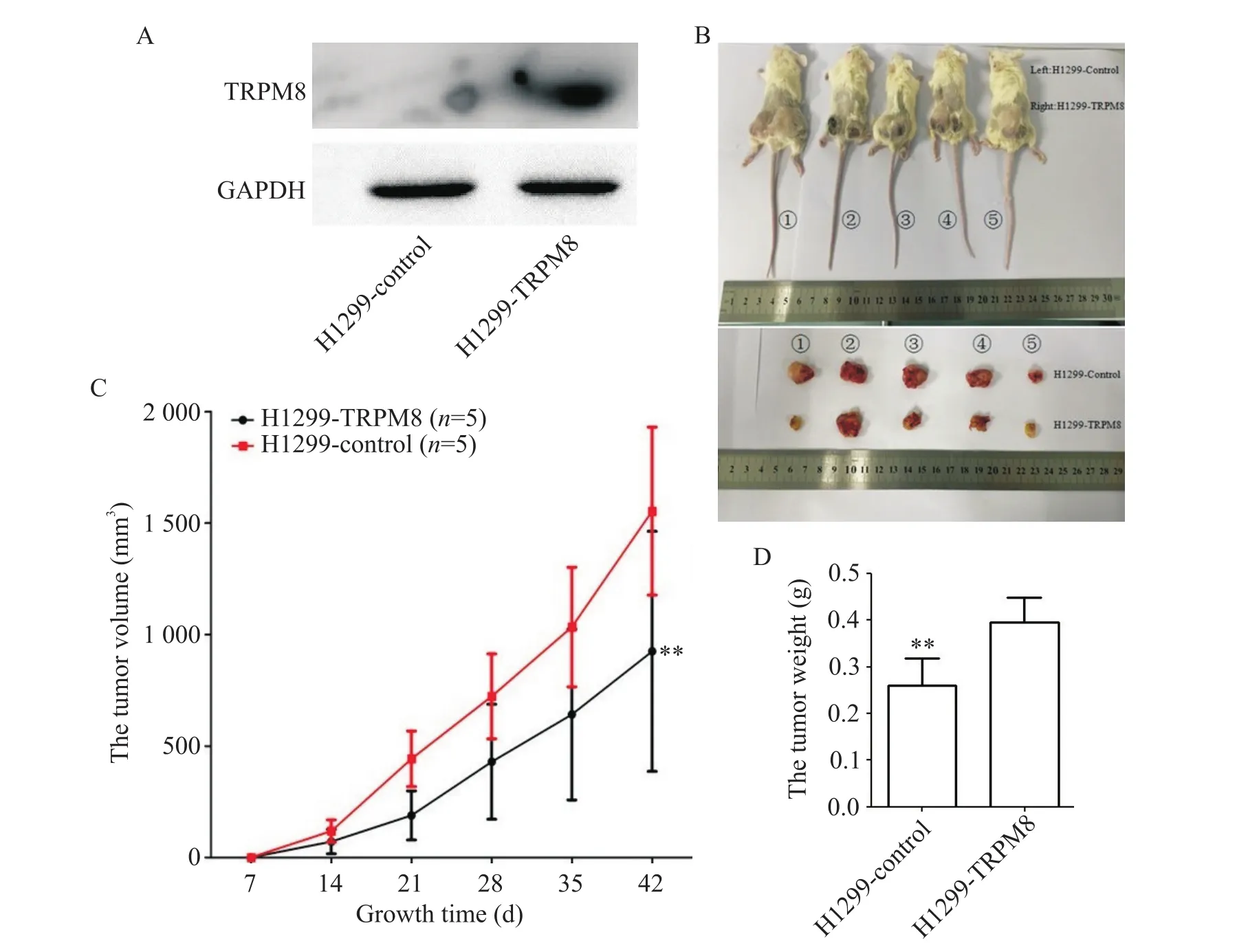
Figure 6.The effects of TRPM8 on the growth and weight of H1299 cell-derived xenograft tumor in C57/BL6N immunodeficient mice.A:Western blot analysis showed that TRPM8 was stably up-regulated in H1299 cells;B:H1299 cell-derived xenograft tumors in C57/BL6N immunodeficient mice and the isolated tumors;C:the tumor growth curves;D:the tumor weight.Mean±SD.n=5.**P<0.01 vs H1299-control group.圖6 TRPM8對C57/BL6N免疫缺陷鼠移植瘤生長的影響
但肺腺癌TRPM8表達的變化及調控腫瘤細胞生物學行為的具體機制尚不清楚。前列腺癌TRPM8的表達受雄激素受體調控[13]。隨著癌轉化為雄激素非依賴性,TRPM8表達降低[16]。TRPM8在乳腺癌中的表達和功能受雌激素受體α調控[21]。似乎性激素參與了TRPM8的表達和功能,但我們的結果顯示肺腺癌患者TRPM8表達與性別無關,亞組生存分析也顯示在男性和女性患者中,高表達TRPM8預后均優于低表達TRPM8的肺腺癌患者,二者之間無顯著差異(資料未提供)。Asuthkar等[22]研究顯示,TRPM8啟動子上存在P53結合位點,過表達P53增加TRPM8的表達,TRPM8可能是P53的下游基因。而作為陽離子通道的TRPM8,激活會引起Ca2+內流,Ca2+作為第二信使調控細胞增殖、運動、凋亡等細胞生物學行為,可能是其作用機制。
總之,本研究在人肺腺癌組織探討TRPM8表達的意義:TRPM8高表達的患者4~5年累積生存率顯著高于TRPM8低表達的患者,TRPM8低表達是影響患者預后的獨立危險因素。在肺腺癌A549細胞過表達TRPM8抑制了其增殖、遷移和侵襲能力;上調肺腺癌H1299細胞中TRPM8蛋白表達抑制其移植瘤的生長。但肺腺癌中TRPM8的作用機制仍需要進一步研究。

