稻縱卷葉螟顆粒體病毒的持續感染及檢測
韓光杰,劉琴,李傳明,祁建杭,徐彬,陸玉榮,徐健
稻縱卷葉螟顆粒體病毒的持續感染及檢測
韓光杰,劉琴,李傳明,祁建杭,徐彬,陸玉榮,徐健
(江蘇里下河地區農業科學研究所/國家農業微生物揚州觀測實驗站,江蘇揚州 225007)
【目的】稻縱卷葉螟顆粒體病毒(granulovirus,CnmeGV)是稻縱卷葉螟的專性病原微生物,病毒持續感染對害蟲種群控制具有重要作用。研究旨在建立CnmeGV持續感染的檢測方法,分析病毒持續感染對害蟲種群的控制作用,為病毒殺蟲劑的應用提供理論依據。【方法】多重比較分析顆粒體病毒基因序列,選擇變異較大區域設計CnmeGV巢式PCR引物并評估探針的靈敏度和可靠性。室內使用玉米苗繁殖稻縱卷葉螟,以106OB/ml的亞致死濃度口服感染4齡幼蟲,并飼養至成蟲階段,統計羽化率。以10%甲醛處理口服感染病毒的昆蟲體表,利用探針分析稻縱卷葉螟持續感染種群中幼蟲、蛹、蛹蛻及成蟲的帶毒率。施用106OB/mL病毒制劑,監測次年稻縱卷葉螟幼蟲發病率,并檢測田間土壤的帶毒率。【結果】建立了CnmeGV的巢式PCR探針,包括外側引物Cm-gran1和內側引物Cm-gran2。巢式PCR探針檢測最低靈敏度為0.85 fg·μL-1,是常規PCR的1 000倍。探針具有較高的可靠性,在稻縱卷葉螟的食物源(水稻、玉米)、其他多角體和顆粒體病毒中,均未檢測到目標片段。使用10%甲醛處理病毒感染的幼蟲體表10、30 min和16 h后,均未檢測到病毒目標片段,但處理16 h后,稻縱卷葉螟蛹不能羽化。亞致死濃度的病毒處理稻縱卷葉螟幼蟲96 h后,未顯癥幼蟲經體表處理后病毒檢出率為100%。待幼蟲化蛹及羽化后,蛹、蛹蛻和成蟲的病毒檢出率分別為87.5%、83.3%和16.7%。經卡方檢測,幼蟲到化蛹階段,病毒感染率未有顯著變化(2=3.2,=0.234);而蛹羽化為成蟲,病毒檢出率顯著降低(2=32.356,=0),表明成蟲在變態過程中,大部分病毒隨蛹蛻一起被排出體外。進一步待蛹羽化,發現和對照群體93.4%的羽化率相比,病毒感染群體成蟲羽化率僅有30.8%。田間調查顯示,已使用CnmeGV的田塊次年稻縱卷葉螟幼蟲病毒顯癥率為4%,土壤帶毒率為58%,病毒可以在土壤中存活并通過水平傳播持續感染稻縱卷葉螟種群。【結論】構建的巢式PCR探針具有較高的靈敏度,可用于CnmeGV持續感染的檢測。CnmeGV的持續感染可有效控制稻縱卷葉螟的發生,成蟲變態在稻縱卷葉螟體內病原物的清除中發揮了重要作用。
稻縱卷葉螟;顆粒體病毒;持續感染;潛伏侵染;分子標記;水平傳播;昆蟲變態
0 引言
【研究意義】稻縱卷葉螟()是水稻上重要的遷飛性害蟲[1],大量化學農藥的使用并未從根本上控制其暴發危害且造成了農藥面源污染風險。稻縱卷葉螟顆粒體病毒(granulovirus,CnmeGV)是稻縱卷葉螟的專性病毒,對稻縱卷葉螟具有較強的致病力,田間應用可以顯著降低害蟲種群增長趨勢指數,有效抑制稻縱卷葉螟種群增長[2]。桿狀病毒的持續感染是一種非顯癥的、但在生物體內存在病毒粒子或遺傳信息的潛伏性感染,其對控制害蟲特別是遷飛性害蟲的暴發危害具有重要的生態意義。但是,目前CnmeGV特異探針的構建工作尚未開展,且對該病毒持續感染的認識也不全面。因此,開發CnmeGV的巢式PCR探針,用于低劑量病毒感染的檢測,對研究CnmeGV的持續感染具有重要的應用價值,同時明確病毒持續感染對害蟲的控制作用,可為CnmeGV病毒殺蟲劑的應用提供理論依據。【前人研究進展】桿狀病毒作為生物控制因子的關鍵在于病毒在自然界中長期存活并持續感染(或稱為covert infection)[3-4]。潛伏侵染是一種狹義的持續感染,是一種可轉化的、非增殖性的感染,病毒基因組在宿主中保留,但通常并不產生感染性的病毒[5]。自然界存在的病毒可以通過接觸感染的水平傳播途徑使敏感害蟲持續感染,也可以通過潛伏侵染長期存在于宿主體內并通過繁殖垂直傳播給子代[6]。潛伏侵染直接影響昆蟲子代的生長發育和產卵繁殖,使幼蟲發育歷期延長、產卵量和卵孵化率顯著下降,對害蟲種群消長發揮重要的調控作用[7-9]。一些常規PCR檢測探針的開發證實了棉鈴蟲()核型多角體病毒(HaNPV)的經卵傳播[10]和家蠶()核型多角體病毒(BmNPV)的跨代傳播[11],從而提高了對于桿狀病毒潛伏侵染的認識。CnmeGV是一種屬桿狀病毒,主要感染稻縱卷葉螟幼蟲脂肪體細胞,表現出顆粒體病毒Ⅱ型特征[12-13]。CnmeGV制劑對田間稻縱卷葉螟控制效果在70%以上,持效期達50 d,且可以保護蜘蛛等天敵[14],發揮了較好的生態效應,但病毒的感染特征還不太明確。【本研究切入點】常規PCR探針對于研究桿狀病毒的潛伏侵染還稍顯不足,巢式PCR具有更高靈敏度可以檢測微量的病毒感染,利用該標記可以分析CnmeGV經蛹傳播的潛伏侵染特征。【擬解決的關鍵問題】建立高靈敏度的CnmeGV病毒檢測探針,利用探針分析CnmeGV在害蟲種群中的持續感染,明確病毒持續感染特征及對稻縱卷葉螟發生的影響。
1 材料與方法
1.1 稻縱卷葉螟飼養
稻縱卷葉螟幼蟲采自揚州市槐泗稻田,在室溫(25±1)℃,相對濕度70%條件下,使用玉米苗飼養[15]。幼蟲飼養多代后,挑選健康,大小一致的2齡或4齡幼蟲供試。
1.2 CnmeGV的增殖與接種
以106OB/ml的CnmeGV病毒口服感染2齡中期的稻縱卷葉螟幼蟲,正常飼養至5齡(顯癥率達90%以上)后收集病蟲尸體,研磨勻漿,過濾經差速離心(12 000 r/min離心10 min,3 000 r/min離心30 s)后,收集發白的顆粒體病毒,用血球計數板計數顆粒體病毒數量。
以106OB/ml(該劑量為實驗室前期試驗結果,未發表,死亡率約30%)的CnmeGV病毒作為亞致死濃度口服感染4齡稻縱卷葉螟幼蟲80頭/重復,共3個重復,正常飼養96 h后,收集部分幼蟲后繼續飼養,后續收集蛹和成蟲,幼蟲和蛹使用10%甲醛處理10 min。
1.3 蛹表面處理方法
使用健康的稻縱卷葉螟蛹作為CnmeGV病毒蛹表面處理的供試蟲。以105OB/ml的CnmeGV病毒液(添加0.1%羧甲基纖維素鈉增加黏性)處理蛹,處理10 min后晾干。晾干的蛹使用10%的甲醛處理10、30 min、16 h及按照蘇志堅等[16]描述的堿液-Dnase酶處理方法處理,提取所有樣本總DNA。同樣的方法適用幼蟲表面處理。
1.4 樣品DNA的提取
昆蟲及病毒DNA的提取:選取經體表處理的不同發育階段的稻縱卷葉螟,經液氮研磨后,使用700 μL裂解液(0.1 mol·L-1Na2CO3,0.1 mol·L-1NaCl,0.008 mol·L-1EDTA,pH 10.7)37℃溫浴裂解10 min,添加7 μL蛋白酶K和1 μL Rnase酶55℃水浴30 min,之后使用酚氯仿抽提一次后等體積異丙醇沉淀,經12 000 r/min離心10 min后,75%乙醇洗滌一次,晾干后在沉淀中加入100 μL ddH2O溶解。病毒DNA的提取不使用液氮研磨,其余方法一致。
土壤總DNA的提取:在2017年施用CnmeGV制劑的田塊(東經119°23′,北緯32°29′),2018年采用5點取樣法選取不同位置的水稻表層土壤為樣本,經室內風干后研磨,按照Solarbio公司土壤基因組DNA提取試劑盒(D2600-50T)方法,提取土壤總DNA。
1.5 病毒granulin巢式PCR引物的設計及檢測
通過NCBI nr/nt數據庫下載CnmeGV等8個顆粒體病毒,利用GENEDOC軟件多重比較分析,設定第1輪PCR上游引物位于該基因5′端200 bp以內,通過Primer 5.0軟件設計巢式PCR外側引物Cm-gran1和內側引物Cm-gran2(表1),建立檢測探針。

表1 引物設計
PCR檢測試劑為諾唯贊公司2×Taq Master Mix產品,PCR儀器為BIO-RAD公司T100。外側引物Cm-gran1和內側引物Cm-gran2使用相同的PCR反應程序,為95℃ 3 min;95℃ 30 s,55℃ 30 s,72℃ 30 s,30個循環;72℃ 5 min。PCR反應體系為20 μL,包括Taq Mix 10 μL,上下游引物各1 μL,模板1 μL,ddH2O 7 μL。每輪PCR檢測需同時至少做8個無DNA模板的陰性對照。
巢式PCR順序為先使用外側引物Cm-gran1進行第1輪PCR擴增,擴展產物稀釋100倍后作為第2輪內側引物Cm-gran2 PCR反應的模板。第2輪PCR產物使用1%的瓊脂糖電泳進行檢測。
1.6 調查及統計分析
田間稻縱卷葉螟幼蟲調查采用5點取樣法,每個點剝查20頭幼蟲,統計幼蟲感病率。室內亞致死濃度病毒處理的稻縱卷葉螟待正常羽化后,統計羽化率。圖形制作使用GraphPad Prism軟件,數據處理使用SPSS 21.0。羽化率和田間幼蟲感病率差異分析采用T-test法,不同蟲態病毒檢出率統計分析采用卡方測驗。
2 結果
2.1 CnmeGV granulin分子標記的建立
多重比較分析來自CnmeGV、AdorGV、ChocGV等8種顆粒體病毒的,CnmeGV與其他7個基因核苷酸一致性為72.3%—75.8%。除5′端200 bp以內,其他區域核苷酸較保守。因此,選擇特異性較高的區段為分子標記位點,建立了巢式PCR探針(圖1),該標記可以有效擴出目標片段。以實驗室常備材料(水稻、玉米、稻縱卷葉螟健康蟲、斜紋夜蛾核型多角體病毒、小菜蛾顆粒體病毒、黏蟲顆粒體病毒、茶尺蠖核型多角體病毒)的DNA為模板,利用該標記均未檢測到目標條帶(圖略)。
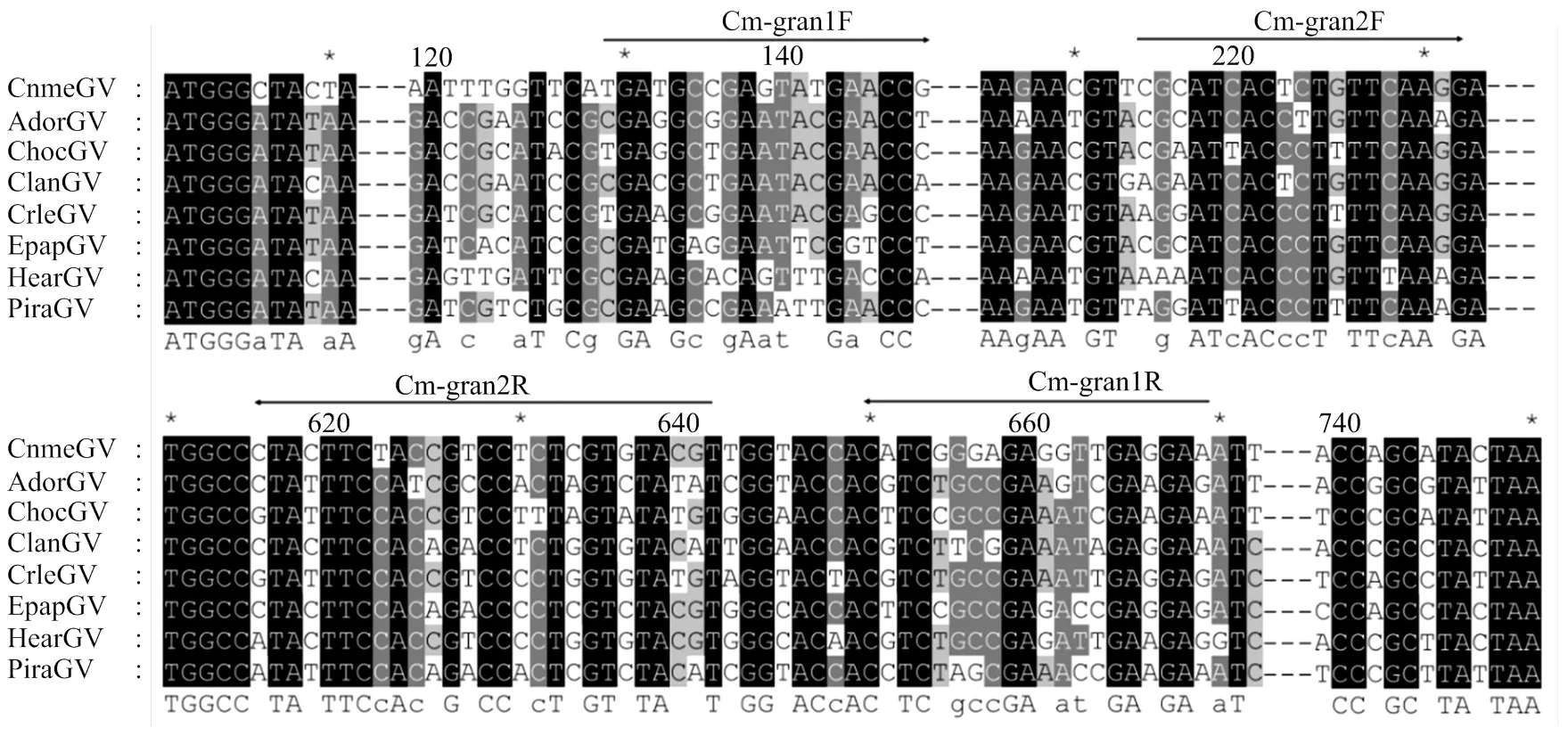
CnmeGV: KP658210.1:1-750; AdorGV: AF547984.1:1-747; ChocGV: NC_008168.1:1-747; ClanGV: HQ116624.1:1-747; CrleGV: AY229987.1:1-747; EpapGV: JN408834.1:1-747; HearGV: EU255577.1:1-747; PiraGV: AY428513.1:1-744
2.2 巢式PCR標記的敏感性
將濃度為85 ng·μL-1的病毒DNA依次10倍稀釋作為模板,檢測分子標記的靈敏度,經4次重復檢測發現病毒DNA的最低檢出限為0.85 fg·μL-1,是常規PCR的1 000倍(圖2)。不同處理方式處理蛹表后,檢測結果發現稻縱卷葉螟健康蛹、10%甲醛處理10 min—16 h的病毒處理蛹均未檢測到病毒,但甲醛處理16 h后的蛹不能正常羽化。參考蘇志堅等[16]方法,使用堿液-Dnase處理30 min,并不能去除蛹表的病毒DNA(圖3)。在增加24個個體的試驗重復后,結果一致。
2.3 CnmeGV經蛹傳播及對蛹羽化的影響
使用亞致死濃度的病毒處理稻縱卷葉螟幼蟲96 h后,挑選24頭未顯癥幼蟲經體表處理后檢測病毒感染率。經巢式PCR檢測發現,幼蟲病毒感染率為100%,表明所有幼蟲均有病毒定殖。待幼蟲成功化蛹后,收集部分蛹進行體表處理后,提取蛹、蛹蛻和成蟲DNA檢測病毒。發現蛹的病毒檢出率為87.5%,蛹蛻為83.3%,成蟲為16.7%。經卡方檢測,幼蟲到化蛹階段,病毒感染率未有顯著變化(2=3.2,=0.234);而蛹羽化為成蟲,病毒檢出率顯著降低(2=32.356,=0)(表2)。
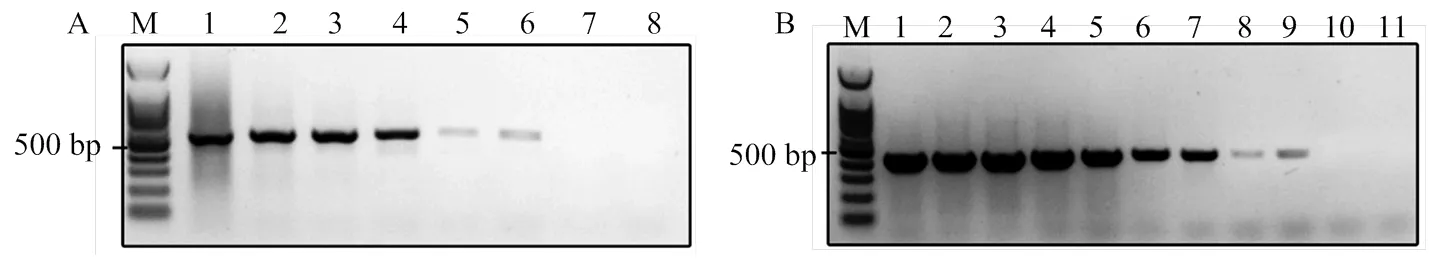
1-11: 85, 8.5, 0.85 ng·μL-1, 85, 8.5, 0.85 pg·μL-1, 85, 8.5, 0.85 fg·μL-1, 85, 8.5 ag·μL-1

1—4:CnmeGV處理的稻縱卷葉螟蛹the pupa of C. medinalis treated with CnmeGV;5—8:稻縱卷葉螟健康蛹the healthy pupa of C. medinalis;9—12:10%甲醛處理稻縱卷葉螟蛹(病毒處理)10 min the infected pupa treated with 10% formaldehyde for 10 min;13—16:10%甲醛處理蛹表30 min the infected pupa treated with 10% formaldehyde for 30 min;17—20:經堿處理并使用DNase處理蛹表30 min the infected pupa treated with Lye-Dnase for 30 min;21—24:10%甲醛處理蛹表16 h the infected pupa treated with 10% formaldehyde for 16 h
進一步待蛹羽化,發現與對照群體93.4%的羽化率相比,病毒感染群體羽化率僅有30.8%(<0.0001)(圖4)。
2.4 CnmeGV田間水平傳播分析
2017年在揚州單一田塊施用106OB/ml病毒制劑后,當代稻縱卷葉螟幼蟲感病率達70%[2]。次年,調查同一田塊,發現稻縱卷葉螟幼蟲的病毒顯癥率仍有4%,而附近田塊未發現感病個體(圖5)。考慮到病毒水平傳播的可能性,檢測了田間土樣帶毒水平。利用該分子標記檢測24份土樣,發現田間土壤帶毒率為58%(圖6)。
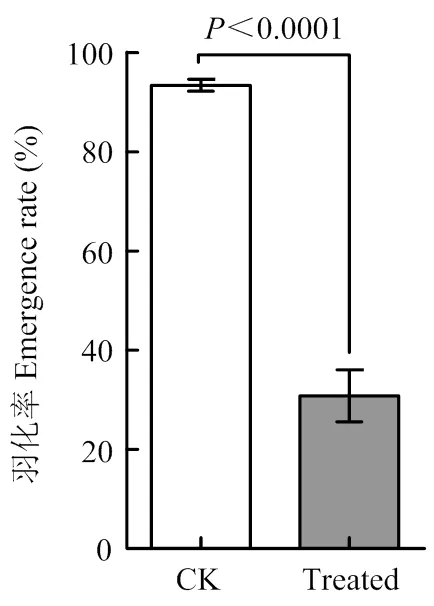
CK:稻縱卷葉螟健康群體healthy population of C. medinalis;Treated:病毒處理群體infected population of C. medinalis
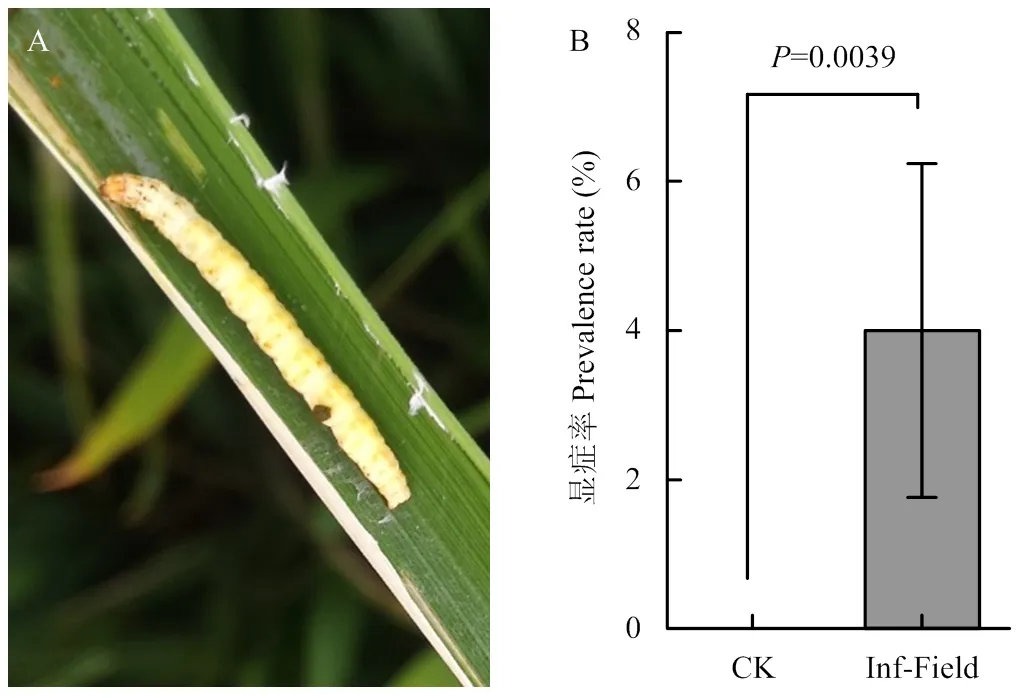
CK:未使用病毒制劑田塊control field without the use of CnmeGV;Inf-Field:使用病毒制劑的田塊,次年稻縱卷葉螟幼蟲顯癥率the prevalence rate of larvae in the next year after using CnmeGV
3 討論
潛伏侵染(狹義的持續感染)在桿狀病毒[4-5]、植物病原細菌[17]、動物病毒[18]等中被廣泛研究,雖然宿主未表現癥狀,但潛伏侵染嚴重影響了宿主種群的健康和病原物的后期流行規模。分子標記的開發對病原微生物潛伏侵染的研究具有重要作用,包括常規PCR探針[10-11]、定量PCR探針[18]、巢式PCR探針[19]等。對葡萄霜霉病菌()的檢測結果顯示定量PCR探針靈敏度是常規PCR探針的100倍[17],對美人蕉黃斑駁病毒(canna yellow mottle virus)的檢測結果顯示巢式PCR探針靈敏度是常規PCR探針的1 000倍[19],二者橫向比較,巢式PCR探針的靈敏度更高。因此,為了更好地檢測病毒的潛伏侵染,筆者選擇開發CnmeGV的巢式PCR探針。該探針檢測CnmeGV的最低限為0.85 fg·μL-1,檢測靈敏度是常規PCR探針的1 000倍。同時,為了保證檢測的特異性,CnmeGV的巢式PCR探針是選取顆粒體病毒變異度較大的區域作為候選區來設計的,且在稻縱卷葉螟的食物源(水稻、玉米)、其他多角體和顆粒體病毒中均未檢測到目標片段。在昆蟲飼養中,甲醛可以使蛋白質變性、DNA分子斷裂,一般被用來蛹表消毒。本研究發現10%的甲醛處理10 min就能完全清除蛹表污染病毒,而參照蘇志堅等[16]的堿液-Dnase酶處理(其主要作用機理為利用堿液裂解病毒蛋白,使病毒DNA暴露,再使用Dnase酶消解DNA)方法未能有效清除病毒,造成這種差異的原因可能是常規PCR靈敏度或者Dnase酶活力不同。因此,在該探針檢測的靈敏度范圍內,10%甲醛可以被認為能夠清除稻縱卷葉螟體表的CnmeGV。

表2 稻縱卷葉螟不同蟲態中稻縱卷葉螟顆粒體病毒檢出率統計分析
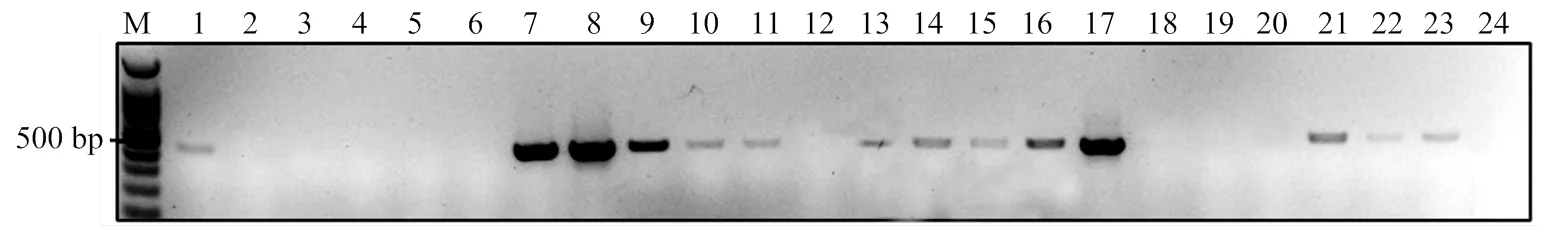
圖6 病毒制劑處理后田間次年土壤帶毒檢測
桿狀病毒潛伏侵染普遍存在,Khurad等以亞致死劑量的家蠶多角體病毒感染幼蟲,存活成蟲和子代幼蟲體內都擴增到473 bp的病毒早期基因[20]。印度谷螟()感染顆粒體病毒后,存活的幼蟲和蛹內檢測到病毒晚期表達顆粒體蛋白基因()mRNA,成蟲卵巢和睪丸中也檢測到該基因的mRNA[21]。本研究使用亞致死濃度的CnmeGV感染稻縱卷葉螟4齡幼蟲,同樣在幼蟲、蛹及成蟲中檢測到病毒,但成蟲的病毒感染率顯著下降。進一步研究發現,蛹蛻的病毒檢出率高達83.3%。昆蟲的細胞凋亡或蛻皮是清除病毒和細菌感染的一個重要防御機制,死亡的細胞被新分化細胞代替,從而降低了感染水平[22]。因此可以推斷,成蟲在變態過程中,大部分病毒隨蛹蛻一起被排出體外,從而降低了后代持續感染病毒的風險。但是筆者也注意到,在幼蟲化蛹的變態中,病毒的感染率未有明顯的下降,幼蟲-蛹的變態在昆蟲病毒清除中的作用目前并不清楚。有研究報道,黏蟲成蟲潛伏的核型多角體病毒多數集中于足、翅和觸角[23]。這些結果是否間接表明昆蟲成蟲體表潛伏病毒的數量遠大于體內,值得進一步去探究。由于鱗翅目昆蟲成蟲鱗片具有疏水特性,10%甲醛體表處理很難有效清除體表病毒,這也是本試驗尚未解決的難題。
潛伏侵染是桿狀病毒與宿主昆蟲協同進化共存的一種方式,同時也是病毒選擇和豐度控制昆蟲種群密度的因素之一[24]。斜紋夜蛾()成蟲感染斜紋夜蛾核型多角體病毒后,平均壽命及單雌產卵量明顯下降,對子代幼蟲種群控制作用干擾指數為0.1807[25]。本研究發現潛伏感染的稻縱卷葉螟可以正常化蛹,但是成蟲羽化率顯著降低,未羽化的蛹呈現發黑狀,顯示CnmeGV對稻縱卷葉螟種群的控制效果顯著。前期研究也發現,CnmeGV對稻縱卷葉螟種群具有明顯的干擾控制作用,種群控制指數為0.31—0.32[2],顯示了其作為生物殺蟲劑的優勢。田間調查發現,使用病毒制劑田塊次年稻縱卷葉螟幼蟲顯癥率仍達4%,而相鄰田塊未發現病毒感染幼蟲,進一步研究發現該發病田塊土壤帶毒率為58%。CnmeGV于1979年首次在廣東恩平縣被分離[26],時隔30年后,該地區仍然存在因感染CnmeGV而死亡的稻縱卷葉螟幼蟲[27]。因此,CnmeGV在土壤中存活,通過水平傳播進行持續感染可能是誘發稻縱卷葉螟感病的主要原因。
無論是桿狀病毒水平傳播造成持續感染還是垂直傳播形成的潛伏侵染,對害蟲種群控制都具有重要的生態意義。稻縱卷葉螟是重要的遷飛性害蟲,潛伏侵染的種群可以將病毒帶到其他地方,并形成種群內的持續感染,從而有效控制種群暴發。一定條件下持續感染能被激發并在宿主體內復制增殖轉化為增殖感染,引起害蟲死亡并形成持續傳播[4,28]。這些激發條件可能包括種群密度[6]、微毒化合物[29]、其他病毒[9,30]等。因此,稻縱卷葉螟持續感染種群病毒激發的條件將是后期研究重點。
4 結論
巢式PCR檢測體系可以應用于CnmeGV的持續感染研究,其靈敏度是常規PCR的1 000倍。CnmeGV在宿主體內可以經蛹傳播,并顯著降低稻縱卷葉螟的羽化率。CnmeGV的持續感染對控制害蟲種群暴發具有重要的生態意義。
[1] 陸明紅, 劉萬才, 胡高, 翟保平, TUAN H A, KHANH D H. 中越水稻遷飛性害蟲稻飛虱、稻縱卷葉螟發生關系分析. 植物保護, 2018, 44(3): 31-36, 60.
LU M H, LIU W C, HU G, ZHAI B P, TUAN H A, KHANH D H. Analysis of the relationships of rice planthopper and rice leaf folder occurrence between China and Vietnam., 2018, 44(3): 31-36, 60. (in Chinese)
[2] 徐健, 李傳明, 韓光杰, 徐彬, 祁建杭, 孫俊, 劉琴. 顆粒體病毒(CnmeGV)對稻縱卷葉螟的感染及害蟲種群增長的影響. 江蘇農業學報, 2018, 34(1): 29-33.
XU J, LI C M, HAN G J, XU B, QI J H, SUN J, LIU Q. The effect ofgranulovirus (CnmeGV) on larva infection and population regulation of rice leaffolder., 2018, 34(1): 29-33. (in Chinese)
[3] ZHOU M Z, SUN X L, SUN X C, VLAK J M, HU Z H, VAN DER WERF W. Horizontal and vertical transmission of wild-type and recombinantsingle-nucleocapsid nucleopolyhedrovirus., 2005, 89(2): 165-175.
[4] Williams T, Virto C, Murillo R, Caballero P. Covert infection of insects by baculoviruses., 2017, 8: 1337.
[5] 翁慶北, 龐義. 桿狀病毒在昆蟲中的持續感染. 環境昆蟲學報, 2010, 32(1): 90-95.
WENG Q B, PANG Y. Persistent infection of baculoviruses in insects., 2010, 32(1): 90-95. (in Chinese)
[6] CORY J, MYERS J H. The ecology and evolution of insect baculoviruses., 2003, 34: 239-272.
[7] 蔣杰賢, 胡頌平, 季香云, 劉勁軍, 袁永達. 甜菜夜蛾核型多角體病毒對宿主種群的控制作用. 植物保護學報, 2004, 31(4): 383-389.
JIANG J X, HU S P, JI X Y, LIU J J, YUAN Y D. The control effect ofnuclear polyhedrosis virus on its host population., 2004, 31(4): 383-389. (in Chinese)
[8] IL’INYKH A V, POLENOGOVA O V. Demonstration of the remote effect of baculovirus vertical transmission, with gypsy mothL. (Lepidoptera, Lymantriidae) as an example., 2012, 73(5): 389-395.
[9] LAREM A, BEN TIBA S, FRITSCH E, UNDORF-SPAHN K, WENNMANN J T, JEHLE J A. Effects of a covert infection withgranulovirus in insect populations of., 2019, 11(4): 337.
[10] 曲良建, 張永安, 王玉珠, 王登元. PCR法證實棉鈴蟲核型多角體病毒對棉鈴蟲經卵和蛹的垂直傳播. 中國生物防治學報, 2005, 21(1): 45-48.
QU L J, ZHANG Y A, WANG Y Z, WANG D Y. Identification of the vertical transmission of HaNPV inby PCR assay., 2005, 21(1): 45-48. (in Chinese)
[11] 張彥. 家蠶核型多角體病毒在家蠶中的垂直傳播及檢測技術研究[D]. 合肥: 安徽農業大學, 2014.
ZHANG Y. Study on vertical transmission and detection technique of BmNPV in the silkworm,L.[D]. Hefei: Anhui Agricultural University, 2014. (in Chinese)
[12] HAN G J, XU J, LIU Q, LI C M, XU H X, LU Z X. Genome ofgranulovirus, the first Crambidae-infecting betabaculovirus isolated from rice leaffolder to sequenced., 2016, 11(2):e0147882.
[13] 王艷, 劉琴, 徐健, 李傳明, 韓光杰, 徐彬, 祁建杭, 孫俊. 顆粒體病毒(CnmeGV)對稻縱卷葉螟的感染及影響因素研究. 揚州大學學報(農業與生命科學版), 2019, 40(1): 107-111.
WANG Y, LIU Q, XU J, LI C M, HAN G J, XU B, QI J H, SUN J. The infectivity and influence factors ofgranulovirus (CnmeGV) to larva of rice leaffolder., 2019, 40(1): 107-111. (in Chinese)
[14] XU J, LIU Q, LI C M, HAN G J. Field effect ofgranulovirus (CnmeGV) on the pest of rice leaffolder., 2019, 18(9): 2115-2122.
[15] XU J, LI C M, YANG Y J, QI J H, ZHENG X S, HU R L, LU Z X, LIU Q. Growth and reproduction of artificially fed., 2012, 19(3): 247-251.
[16] 蘇志堅, 龐義, 余健秀, 陳其津, 毛文富, 李廣宏. 污染寄主卵面的斜紋夜蛾核型多角體病毒PCR檢測及其消除. 農業生物技術學報, 2001, 9(2): 119-122.
SU Z J, PANG Y, YU J X, CHEN Q J, MAO W F, LI G H. PCR- detection and Dnase-elimination ofnucleopolyhedrovirus attached to host-eggs surface., 2001, 9(2): 119-122. (in Chinese)
[17] 李文學, 肖瑞剛, 呂苗苗, 丁寧, 石華榮, 顧沛雯. 葡萄霜霉病菌實時熒光定量PCR檢測體系的建立和應用. 中國農業科學, 2019, 52(9): 1529-1540.
LI W X, XIAO R G, Lü M M, DING N, SHI H R, GU P W. Establishment and application of real-time PCR for quantitatively detectingin., 2019, 52(9): 1529-1540. (in Chinese)
[18] 陳俊杰, 李媛媛, 陽瑞雪, 古晶晶, 汪開毓, 耿毅, 歐陽萍. 錦鯉皰疹病毒潛伏感染實時熒光定量PCR檢測方法的建立. 湖南農業大學學報(自然科學版), 2017, 43(3): 310-314.
CHEN J J, LI Y Y, YANG R X, GU J J, WANG K Y, GENG Y, OUYANG P. Method of real-time PCR for the detecting latent infection of koi herpesvirus., 2017, 43(3): 310-314. (in Chinese)
[19] 陳細紅, 楊小龍, 廖富榮, 高芳鑾, 沈建國. 美人蕉黃斑駁病毒巢式PCR檢測方法的建立. 植物保護, 2019, 45(4): 162-165.
CHEN X H, YANG X L, LIAO F R, GAO F L, SHEN J G. Development of nested PCR assay for detection of canna yellow mottle virus., 2019, 45(4): 162-165. (in Chinese)
[20] KHURAD A M, MAHULIKAR A, RATHOD M K, RAI M M, KANGINAKUDRU S, NAGARAJU J. Vertical transmission of nucleopolyhedrovirus in the silkworm,L., 2004, 87(1): 8-15.
[21] BURDEN J P, GRIFFITHS C M, CORY J S, SMITH P, SAIT S M. Vertical transmission of sublethal granulovirus infection in the Indian meal moth,., 2002, 11(3): 547-555.
[22] HAKIM R S, BALDWIN K, SMAGGHE G. Regulation of midgut growth, development, and metamorphosis., 2010, 55: 593-608.
[23] GRAHAM R I, TUMMALA Y, RHODES G, CORY J S, SHIRRAS A, GRZYWACZ D, WILSON K. Development of a real-time qPCR assay for quantification of covert baculovirus infections in a major African crop pest., 2015, 6(3): 746-759.
[24] ILYINYKH A V. Vertical transmission of baculoviruses., 2019, 46(3): 302-310.
[25] 肖留斌, 柏立新, 譚永安, 趙洪霞. 核多角體病毒對斜紋夜蛾成蟲及其后代的影響. 中國生物防治學報, 2011, 27(1): 136-139.
XIAO L B, BAI L X, TAN Y A, ZHAO H X. Effects of SpltMNPV on survival, fecundity, development ofadults and their progeny., 2011, 27(1): 136-139. (in Chinese)
[26] 龐義, 賴涌流, 劉炬, 葉育昌. 稻縱卷葉螟幼蟲顆粒體病毒. 微生物學通報, 1981(3): 103-104.
PANG Y, LAI Y L, LIU J, YE Y C. A new granulovirus from naturally-infected Asiatic rice leafroller,., 1981(3): 103-104. (in Chinese)
[27] 張珊, 賈茜雯, 孫士鋒, 龐義, 陳其津, 楊凱. 一株稻縱卷葉螟顆粒體病毒的系統發育分析和流行病學調查. 環境昆蟲學報, 2014, 36(5): 756-762.
ZHANG S, JIA X W, SUN S F, PANG Y, CHEN Q J, YANG K. Phylogenetic analysis and epidemiologic investigation of agranulovirus strain., 2014, 36(5): 756-762. (in Chinese)
[28] SINGH J, SINGH C P, BHAVANI A, NAGARAJU J. Discovering microRNAs fromnucleopolyhedrosis virus., 2010, 407(1): 120-128.
[29] VIRTO C, NAVARRO D, TELLEZ M M, MURILLO R, WILLIAMS T, CABALLERO P. Chemical and biological stress factors on the activation of nucleopolyhedrovirus infections in covertly infected., 2017, 141(5): 384-392.
[30] Murillo R, Hussey M S, Possee R D. Evidence for covert baculovirus infections in alaboratory culture., 2011, 92(5): 1061-1070.
the persistent infection and Detection ofgranulovirus in
HAN GuangJie, LIU Qin, LI ChuanMing, QI JianHang, XU Bin, LU YuRong, XU Jian
(Jiangsu Lixiahe District Institute of Agricultural Sciences/National Agricultural Experimental Station for Agricultural Microbiology, Yangzhou, Yangzhou 225007, Jiangsu)
【Objective】granulovirus (CnmeGV) is a specific pathogenic microorganism of. Persistent infection of baculovirus plays an important role in pest population control. The objective of this study is to construct the detection method of persistent infection with CnmeGV, analyze the control effect of viral persistent infection on pest population, and to provide a theoretical basis for the application of viral pesticides.【Method】The largely diverged regions were selected to design CnmeGV nested PCR primers based on multiple comparisons ofgene sequences of granulovirus. The sensitivity and reliability of probes were further evaluated. The maize leaves were used to feedin the laboratory. The 4th instar larvae were singled out, and then fed with maize leaves soaked by CnmeGV with a sublethal concentration of 106OB/ml. The infectedwere reared to adult stage, and the emergence rate was counted. After treating the insect body surface with 10% formaldehyde, the carrying CnmeGV rates of larvae, pupae, pupal molts and adults in persistent infection population ofwere analyzed using these probes.The prevalence rate of larvae and carrying rate of soil in the next year after using CnmeGV were also detected.【Result】The probes of CnmeGV nested PCR were constructed including the outer primer Cm-gran1 and the inner primer Cm-gran2. The sensitivity of nested PCR was 0.85 fg·μL-1genomic DNA, which was 1 000 times higher than that of the conventional PCR. The probes were highly reliable, and no target fragment was detected in the food sources of(rice and maize), other polyhedrosis and granulosis viruses. The target fragments of CnmeGV were not detected in larvae after treated with 10% formaldehyde for 10, 30 min and 16 h, respectively. However, the pupa ofcould not emerge after 16 h of treatment. The detection rate of CnmeGV was 100% in the larvae of infected population treated with sublethal concentration of CnmeGV for 96 h. After pupation and emergence, the detection rates of pupae, pupal molts and adults were 87.5%, 83.3% and 16.7%, respectively. The detection rate of CnmeGV had no significant change from larva to pupa stage (2=3.2,=0.234) by Chi-square test. However, the detection rate of CnmeGV decreased significantly (2=32.356,=0) from pupa to adult stage, indicating that most of the viruses were excreted from the body with pupal molt during metamorphosis. The emergence rate of adult in infected population (30.8%) was significantly lower than that of the control (93.4%). Field tests showed that the prevalence rate oflarvae in the field at one year following CnmeGV treatment was 4%, and the rate of soil carrying CnmeGV was 58%, suggesting that CnmeGV could survive in the soil and continue to infectthrough horizontal transmission.【Conclusion】The sensitivity of constructed nested PCR probes is high and can be used for the detection of CnmeGV persistent infection. Persistent infection of CnmeGV can effectively control the population development of, and adult metamorphosis plays an important role in removing pathogens.
; granulovirus; persistent infection; latent infection; molecular marker; horizontal transmission; insect metamorphosis
2020-02-15;
2020-03-16
國家自然科學基金(31701792)、江蘇省自然科學基金(BK20181215)、江蘇省農業科學院顛覆性計劃項目[ZX(17)2002]
韓光杰,E-mail:hanguangjie177@163.com。通信作者徐健,Tel:0514-87302019;E-mail:bio-xj@163.com
(責任編輯 岳梅)

