海洋來源雜色曲霉次級代謝產物及其抗植物病原細菌活性
付兵,王美,劉建陽,林偉,張成省,趙棟霖
海洋來源雜色曲霉次級代謝產物及其抗植物病原細菌活性
付兵1,2,王美1,劉建陽2,林偉2,張成省1,趙棟霖1
(1中國農業科學院煙草研究所海洋農業研究中心,山東青島 266101;2福建省煙草公司南平市公司,福建南平 353000)
【目的】針對植物細菌病害日趨嚴重,并缺少有效防治藥劑的問題,從前期篩選獲得的具有抗菌活性且次級代謝產物豐富的海洋雜色曲霉()D5發酵提取物中分離純化單體化合物,分析鑒定其化學結構,并進行抗菌活性評價,闡明目標真菌的抗菌活性成分,為新穎結構抗細菌生物農藥的研發提供先導化合物。【方法】綜合運用正/反相硅膠柱層析、Sephadex LH-20凝膠柱層析和半制備高效液相色譜(HPLC)等方法分離純化單體化合物,采用核磁、質譜等現代波譜分析方法對單體化合物進行結構鑒定;采用微量稀釋法對化合物進行抗6種植物病原細菌燕麥食酸菌()、胡蘿卜軟腐歐文氏菌()、密執安棒形桿菌()、丁香假單胞菌()、青枯雷爾氏菌()和野油菜黃單胞菌()活性評價,獲得活性化合物的最小抑菌濃度(MIC)。【結果】從海洋雜色曲霉D5馬鈴薯葡萄糖液體發酵培養基乙酸乙酯提取物中分離鑒定了12個化合物,包括4個2-羰基-4-苯基喹啉生物堿,viridicatin(1)、3--methylviridicatin(2)、3,6--dimethylviridicatin(3)和3--methylviridicatol(4);2個雙氧代哌嗪生物堿,(+)-cyclopenol(5)和(?)-cyclopenol(6);3個喹唑啉fumiquinazolines生物堿及其衍生物,versicoloid A(7)、chrysopiperazine C(8)和cottoquinazoline A(9);以及3個蒽醌類化合物,versiconol(10)、averufin(11)和noraverufanin(12)。抗菌活性結果表明,2-羰基-4-苯基喹啉生物堿3,6--dimethylviridicatin(3)具有顯著的抗植物病原細菌活性,對青枯雷爾氏菌和野油菜黃單胞菌的MIC分別為50和100 μg·mL-1。初步的構效關系分析表明,C-6位置的甲氧基可能是該類化合物發揮抗植物病原細菌作用的關鍵基團。【結論】海洋雜色曲霉D5代謝產物豐富,能夠產生結構多樣的生物堿和蒽醌類化合物。從其發酵產物中分離鑒定了9個生物堿類化合物和3個蒽醌類化合物,其中3,6--dimethylviridicatin(3)對青枯雷爾氏菌和野油菜黃單胞菌具有顯著的抗菌活性,有開發成為抗細菌生物農藥的潛力。
海洋真菌;雜色曲霉;生物堿;蒽醌;結構鑒定;植物病原細菌
0 引言
【研究意義】隨著世界人口數量的不斷增長,避免饑餓、保障糧食安全顯得尤為重要,因此,需要控制植物病害的發生,增加和保證糧食的產量[1-2]。植物病原細菌在世界農業生產歷史上曾經多次造成重大影響,作物細菌病害是導致農作物減產、人口數量下降和社會動蕩的客觀因素之一[3]。已知的植物病原細菌有200多個屬,其中最重要的包括假單胞菌屬()、雷爾氏菌屬()、農桿菌屬()、黃單胞菌屬()、歐文氏菌屬()、木質部小菌屬()和果膠桿菌屬()[4-6]。目前防治植物細菌病害的方法主要是采用抗病品種、加強田間管理和輪作等方式,但效果有限[4];防治的藥劑主要為化學農藥,容易造成環境污染、食品安全和病原抗性等一系列問題[4,7]。一直以來,農用硫酸鏈霉素都是我國農作物細菌病害防治的主力軍,而隨著我國停止使用農用硫酸鏈霉素,植物細菌病害的防治面臨巨大挑戰。隨著國家大力推行發展綠色農業,更加注重環境友好,研發新型高效低毒的抗細菌生物農藥迫在眉睫。【前人研究進展】眾所周知,海洋真菌由于生活在高鹽、高壓、低溫、低氧、少光和寡營養的海洋環境中,擁有獨特的生存策略,經過長期的進化演變形成了不同于陸地真菌的特殊代謝機制,能夠產生種類繁多、結構新穎、生物活性顯著的次級代謝產物,因而近年來成為研究的熱點[8]。許多海洋真菌次級代謝產物具有明顯的抗細菌活性,顯示出了作為新型抗細菌農藥的巨大開發潛力[9]。然而,對于這些化合物的抗細菌活性研究大多集中在人類醫學領域,關于農業領域的研究和應用還很少,但僅有的少量研究展現了極其可觀的研究價值和前景。UCHIDA等[10]從一株未鑒定的海洋真菌發酵粗提物中分離獲得了兩個聚酮類化合物chlorogentisylquinone和gentisylquinone,它們在10 μg/disk的濃度下對水稻黃單胞菌()的抑菌圈分別為9和10 mm,表現出了較強的抑菌活性;SWatHI等[11]對海洋來源的一株曲霉(sp.)發酵提取物進行抗菌活性研究,發現其對野油菜黃單胞菌()具有較強的抑菌活性,在100 μg·mL-1的濃度下抑菌圈達到12 mm,有望從中發現強活性抗菌化合物;SILBER等從一株海水來源的真菌sp. KF525發酵液中分離獲得了一個二十四元大環內酯類化合物calcaride A,其對野油菜黃單胞菌顯示了中等強度的抑菌活性,最小抑菌濃度(MIC)為5.5μmol·L-1[12];隨后,該小組發現分離自波羅的海和南極海域的兩株Lindgomycetaceae所產聚酮類化合物lindgomycin和ascosetin,對野油菜黃單胞菌的IC50分別為17.8和14.8 μmol·L-1[13];HENRIQUEZ等[14]從南極海域采集的海綿中分離獲得了101株真菌,發現其中11株真菌的發酵提取物對密執安棒形桿菌()具有抑菌活性,22株真菌的提取物對野油菜黃單胞菌表現出了明顯的抑菌活性;NIU等[15]對分離自深海來源真菌sp. MCCC 3A00308的多酚類化合物進行研究,發現spiromastols A和C表現出極強的抗植物病原細菌活性,對野油菜黃單胞菌、假單胞菌()、根癌農桿菌()和青枯雷爾氏菌()的MIC達到0.25—0.5 μmol·L-1,活性強于陽性藥氯霉素,具有開發成為抗細菌農藥的潛力;WANG等[16]對一株海膽來源的亮白曲霉()HDf2進行研究,從中獲得了兩個具有抗菌活性的刺孢青霉酸類化合物spiculisporic acid F和G,它們對青枯雷爾氏菌顯示了中等強度的抑菌活性;CHEN等[17]對一株海藻來源的格孢腔菌(sp.)所產混源萜類次級代謝產物進行研究,發現pleosporallins D和E對密執安棒形桿菌顯示了中等活性的抑菌活性,MIC為9.48 μg·mL-1。【本研究切入點】筆者課題組在前期研究中,從山東沿海和海南海洋特殊紅樹林生境中分離純化了200余株海洋真菌,通過初步的形態學排重后,對其進行了種屬鑒定。對其中近80株真菌進行小規模發酵,測試其發酵產物乙酸乙酯提取物的抗植物病原細菌活性,篩選得到多株抗菌活性顯著的海洋真菌[18-19]。其中,一株海藻來源的雜色曲霉()D5,其發酵提取物對青枯雷爾氏菌等植物病原細菌表現出了明顯的抗菌活性。HPLC指紋圖譜分析發現,D5次級代謝產物豐富,結構類型多樣,產量較大,有望從中發現抗菌活性化合物。【擬解決的關鍵問題】從雜色曲霉D5發酵產物中分離、純化單體化合物,并采用多種譜學方法對其進行結構鑒定,進而對單體化合物進行抗植物病原細菌活性測試并分析構效關系,闡明目標菌株的活性成分及活性化合物的關鍵作用基團,為海洋真菌來源高效低毒生物農藥的研發提供化合物基礎。
4.創新活動載體。要提高黨組織的凝聚力和戰斗力,創新活動載體、保證活動成效十分關鍵。結合社會組織主要分布在油田各行各業、在職黨員具有較強的業務知識等特點,引導社會組織“適時、適宜、適度”地參與油田各項建設,引導他們參與油田的各項便民利民服務,如定期不定期舉辦法律、醫療保健,家庭理財等方面的咨詢服務等,并通過建立服務志愿者隊伍,把參與結果作為吸收入黨、評選先進的一項重要參考指標,吸引更多的新社會組織從業人員投入到油田發展,使越來越多的員工群眾從中受益。
1 材料與方法
試驗于2017—2019年在中國農業科學院煙草研究所海洋農業研究中心/灘涂生物資源保護利用創新團隊完成。
Monographic report: Screening and prevention of chronic kidney disease in Shanghai
1.1 儀器與試劑
核磁共振波譜儀Agilent DD2 500(美國安捷倫公司);質譜儀ESI-MS Q-TOF Ultima Global GAA076(美國Waters公司)和Q-TOF maXis(美國Bruker公司);高效液相色譜儀(日本日立公司);C18柱:(5 μm,10 mm×250 mm,美國Waters公司);旋轉蒸發儀Hei-VAP Industrial-glassware set R(德國Heidoph公司);LRH-250生化培養箱(上海一恒科學儀器有限公司);正相柱層析硅膠100—200、200—300目(青島海洋化工廠);凝膠Sephadex LH-20(美國GE公司);正相TLC預制板(煙臺匯有硅膠開發有限公司);馬鈴薯葡萄糖水培養基(青島海博生物技術有限公司);馬鈴薯葡萄糖瓊脂培養基(青島海博生物技術有限公司);HPLC用甲醇和乙腈為色譜純(國藥集團),其他試劑均為分析純。
1.2 菌株發酵與培養
化合物3為白色晶體,ESIMS質譜中在m/z 282.1 [M + H]+處給出分子離子峰,結合氫譜和碳譜,推測分子式為C17H15NO3,不飽和度為11。仔細分析其1H-NMR和13C NMR數據,發現3的核磁數據與2十分相似。與2相比,3少了1個芳香氫信號,同時增加了1個甲氧基信號H3.67,C55.5,提示該分子中的1個芳香氫被甲氧基取代。經過與文獻數據比對,確定化合物3為3,6--dimethylviridicatin[23](圖1)。
1.2.2 菌株發酵與培養 500 mL的發酵瓶中倒入250 mL馬鈴薯葡萄糖水(PDW)培養基,滅菌。挑取生長于馬鈴薯葡萄糖瓊脂(PDA)培養基上的目標菌株加入其中,共發酵10瓶。搖床(180 r/min,28℃)振蕩培養72 h,獲得種子液。將400 mL PDW培養基加入容量為1 L的發酵瓶中,加入粗海鹽使其濃度為3%,滅菌,共發酵80 L。取種子液5 mL分別加入400 mL PDW培養基中,于28℃靜置培養30 d。
加強“吃住行游購娛”硬件設施建設,優化健康旅游服務軟環境,構筑全區域、全方位、全覆蓋、全過程的配套服務體系。推進“互聯網+健康旅游”,打造智慧旅游服務,實現信息數據共享,建立標準化電子健康檔案,保障游客享受旅游服務的延續性。構建“快進慢游”交通網絡,運用北斗、大數據分析等技術,開展旅游交通精準信息服務,依托高鐵、民航、高等級公路等建立“快進”網絡,增強通達性和便捷性;建設風景道、自行車道、步行道等“慢游”設施,打造健康主題線路[17]。
1.3 化合物分離純化
化合物9為淡黃色粉末,ESIMS:m/z 430.2 [M + H]+,結合其1H-NMR和13C-NMR數據,推斷其分子式為C23H19N5O4。1H-NMR在H8.10(1H,d,=8.0 Hz),7.83(1H,t,=7.5 Hz),7.72(1H,d,=8.0 Hz),7.52(1H,t,=7.0 Hz)給出信號,以及7.39(1H,d,=7.5 Hz),7.27(2H,m),7.07(1H,dd,=7.0,4.5 Hz)給出信號,提示分子中存在2個1,2-二取代苯環。13C-NMR中C167.8、165.6和159.4給出3個酰胺碳信號;低場區給出13個芳香碳信號;此外還給出了4個次甲基信號,1個亞甲基信號和1個甲基信號。以上數據經過與文獻進行比對,確定化合物9為cottoquinazoline A[26](圖1)。
1.4 抗菌活性測定
病原細菌:燕麥食酸菌()、胡蘿卜軟腐歐文氏菌()、密執安棒形桿菌、丁香假單胞菌()、青枯雷爾氏菌和野油菜黃單胞菌。
Divas’ Dream超薄三問腕表采用極其纖薄的37毫米18K玫瑰金表殼,精巧靈動,而圓潤飽滿的扇形表耳則平添了溫婉韻致。表耳上排布著明亮式切割鉆石更顯雍容矚目。18K玫瑰金表冠上鑲嵌著華美的多面切割鉆石,與柔和溫婉的線條相映成輝。這款精美的珠寶腕表,傳承了Divas’ Dream系列以美學技法與精致格調為主題不斷演化的魅力,自然需配以華彩奪目的表盤。
采用微量稀釋法,測試化合物對幾種植物病原細菌的MIC[20]。病原菌振蕩培養至對數期,并稀釋至106cfu/mL。將待測化合物用DMSO配成10 mg·mL-1母液。每種病原菌采用單獨的96孔板進行測試。在96孔板第1列的第1孔加198 μL菌液,余下2—8孔各加100 μL菌液。吸取2 μL化合物母液加入第1孔,混合均勻。采用二倍稀釋法將1—8孔依次稀釋,即從第一孔中吸取100 μL含藥菌液加入第2孔混勻后,從第2孔吸取100 μL含藥菌液加入第3孔,并混勻,以此類推。到第8孔混勻后,移除100 μL含藥菌液,使每孔都含有100 μL含藥菌液,后再每孔加入100 μL菌液,使每孔體積達到200 μL。每個化合物重復3列。用無菌培養基作空白對照,并設立未加化合物的菌液對照,DMSO作陰性對照,空白對照和陰性對照分別做3個孔,硫酸鏈霉素做陽性對照,測試方法與化合物相同。將96孔板放入生物培養箱中,37℃培養24 h,酶標儀600 nm波長下測量吸光度,并結合肉眼觀察,以吸光度出現大幅度變化,且最后一個澄清的孔對應的濃度,作為化合物MIC值。
2 結果
2.1 結構鑒定
核磁波譜數據:1H-NMR(500 MHz,CDCl3):H12.11(1H,s,NH-1),7.53(2H,t,=7.5 Hz,H-13,H-15),7.47(1H,t,=7.5 Hz,H-14),7.41(1H,d,=8.5 Hz,H-8),7.37(2H,m,H-12,H-16),7.07(1H,dd,=8.5,2.5 Hz,H-7),6.65(1H,d,=2.5 Hz,H-5),3.83(3H,s,3-OCH3),3.67(3H,s,6-OCH3);13C-NMR(125 MHz,CDCl3):C160.3(C-2),155.2(C-6),145.7(C-3),138.9(C-4),133.5(C-11),129.9(C-9),129.3(C-12,C-16),128.5(C-13,C-15),128.3(C-14),121.7(C-10),117.5(C-7),117.0(C-8),108.6(C-5),60.3(3-OCH3),55.5(6-OCH3);ESIMS:m/z 282.1 [M + H]+。
(3)注意整個施工過程的維護工作,尤其是進行防滲漏施工時,涂刷好防水涂料后必須要進行一定的防護,防止后期出現其他問題,影響施工質量。
12月13日上午,省自然資源廳召開慶祝改革開放40周年座談會,回顧自然資源工作歷程,展望發展前景。省自然資源廳黨組書記、廳長李琥參加會議并講話。廳一級巡視員王桂鵬主持。廳領導、廳機關和各直屬事業單位主要負責同志、退休老干部及基層代表共130余人參加會議。
核磁波譜數據:1H-NMR(500 MHz,CD3OD):H7.34(2H,m,H-7,H-8),7.31(1H,d,=8.0 Hz,H-15),7.24(1H,d,=8.0 Hz,H-6),7.11(1H,m,H-5),6.87(1H,m,H-14),6.80—6.82(2H,m,H-12,H-16);13C-NMR(125 MHz,CD3OD):C160.5(C-2),158.7(C-13),143.0(C-3),136.1(C-4),134.3(C-9),130.6(C-11),128.0(C-15),127.3(C-7),126.3(C-5),123.8(C-6),123.0(C-10),122.1(C-16),117.9(C-12),116.5(C-8),116.0(C-14);ESIMS:m/z 254.1 [M + H]+。
他在云游時曾發現,江浙一帶部分僧人宗教生活的全部就是幫人做法事,明碼標價,談攏動身,缽滿盈滿的他們不喜歡公開,最直接的一條理由無關貪腐,而是數目之咋舌,可能會帶來競爭,“都來當和尚怎么辦?”
化合物2為白色晶體,ESIMS:m/z 252.1 [M + H]+,結合其氫譜和碳譜,推測分子式為C16H13NO2,不飽和度為11。1H NMR譜H12.66處給出1個酰胺氫特征信號,低場區給出了9個芳香氫信號,以上信息結合TLC特征,推測2與1為同系列化合物。在13C-NMR中,C161.1提示酰胺碳的存在;在低場區給出了14個碳信號,包括5個季碳和9個叔碳;C60.4處的信號提示分子中存在1個甲氧基。以上數據經過與文獻對比,確定化合物2為3-- methylviridicatin[22](圖1)。
核磁波譜數據:1H-NMR(500 MHz,CDCl3):H12.66(1H,s,NH-1),7.53(2H,t,=7.5 Hz,H-13,H-15),7.49(1H,d,=7.5 Hz,H-14),7.45(1H,t,=7.5 Hz,H-7),7.38(2H,d,=7.5 Hz,H-12,H-16),7.23(1H,d,=7.5 Hz,H-5),7.12(1H,t,=7.5 Hz,H-6),3.85(3H,s,3-OCH3);13C-NMR(125 MHz,CDCl3):C161.1(C-2),145.2(C-3),139.4(C-4),135.5(C-9),133.5(C-11),129.4(C-12,C-16),128.8(C-14),128.4(C-13,C-15),128.2(C-7),126.4(C-5),122.6(C-6),120.9(C-10),116.0(C-8),60.4(3-OCH3);ESIMS:m/z 252.1 [M + H]+。
1.2.1 菌株來源 海洋真菌分離自山東青島沿海一種未鑒定的海藻,通過形態學及分子生物學鑒定方法確定為雜色曲霉D5。菌種于中國微生物菌種保藏管理委員會普通微生物中心保藏,保藏編號為CGMCC NO. 15386。
化合物1為白色晶體,質譜ESIMS給出分子離子峰m/z 254.1 [M + H]+,結合其氫譜和碳譜,推測其分子式為C15H11NO3,不飽和度為11。在1H NMR中給出了8個芳香氫信號,提示分子中存在2個苯環。在13C NMR中,低場區給出了14個芳香碳和烯碳信號以及1個酰胺碳信號C160.5,其中包括2個連氧的sp2雜化碳信號C158.7和143.0,結合其分子式,提示分子中存在2個羥基。以上數據與文獻報道的化合物viridicatol數據一致[21],故鑒定化合物1為 viridicatol(圖1)。
除了在磷石膏綜合利用方面的協同發展外,何光亮還提到兩家企業還會在磷礦石開采進行協同發展,他說:“把開磷的采礦技術和甕福的選礦技術結合起來,創造的價值將成倍增長。”同時,甕福集團的氟提取技術也會在開磷集團應用,提高開磷集團在氟化工方面的效益。
核磁波譜數據:1H-NMR(500 MHz,DMSO-6):H12.07(1H,s,NH-1),9.64(1H,s,15-OH),7.41(1H,t,=7.5 Hz,H-7),7.34(1H,d,=7.5 Hz,H-8),7.30(1H,t,=7.5 Hz,H-13),7.09(1H,t,=7.5 Hz,H-6),7.04(1H,d,=7.5 Hz,H-5),6.85(1H,d,=7.5 Hz,H-14),6.71(1H,d,=7.5 Hz,H-12),6.68(1H,s,H-16),3.69(3H,s,3-OCH3);13C-NMR(125 MHz,DMSO-6):C158.5(C-2),157.3(C-15),144.9(C-3),137.6(C-4),135.7(C-9),134.7(C-11),129.5(C-13),128.6(C-7),125.8(C-5),121.9(C-6),119.9(C-10),119.7(C-12),116.0(C-16),115.1(C-8),115.0(C-14),59.5(3-OCH3);ESIMS:m/z 268.1 [M + H]+。
化合物5為白色晶體,ESIMS:m/z 311.1 [M + H]+,結合化合物1H和13C NMR,推斷分子式為C17H14N2O4,不飽和度為12。1H-NMR中給出了8個芳香氫信號,1個連氧次甲基H4.07和1個氮甲基信號H3.19;13C-NMR中給出12個芳香碳信號包括1個連氧芳香碳信號,提示分子中存在2個苯環;另外還給出2個酰胺碳信號C168.6和168.4以及1個氮甲基碳信號C31.7。以上數據表明化合物5為dioxopiperazine類衍生物,經過與文獻進行比對,確定化合物5為(+)-cyclopenol[24](圖1)。
化合物4為白色粉末,ESIMS:m/z 268.1 [M + H]+,結合氫譜和碳譜,推測其分子式為C16H13NO3。1H-NMR中H12.07和9.64處給出2個活潑氫信號,分別對應酰胺氫和羥基氫;低場區給出8個芳香氫信號;H3.69信號提示分子中存在1個甲氧基。1C-NMR中C158.5和157.3證明了酰胺碳和連氧芳香碳的存在;C59.5證明了甲氧基的存在。化合物4與2十分相似,不同之處在于多了1個苯環上的羥基。經過與文獻數據比對,確定化合物4為3--methylviridicatol[23](圖1)。
核磁波譜數據:1H-NMR(500 MHz,CD3OD):H7.55(1H,m,H-8),7.15(3H,m,H-6,H-7,H-9),7.01(1H,t,=7.5 Hz,H-17),6.71(1H,d,=7.5 Hz,H-16),6.12(2H,m,H-14,H-18),5.48(1H,s,15-OH),4.07(1H,s,H-10),3.19(3H,s,H-19);13C-NMR(125 MHz,CD3OD):C168.6(C-2),168.4(C-5),158.4(C-15),136.4(C-11),134.0(C-8),133.5(C-13),132.2(C-6),130.2(C-17),128.0(C-12),126.1(C-7),122. 3(C-9),118.5(C-18),117.0(C-16),113.9(C-14),71.6(C-3),65.9(C-10),31.7(C-19);ESIMS:m/z 311.1 [M + H]+。
化合物6為白色晶體,HRESIMS:m/z 311.1028 [M + H]+,分子式為C17H14N2O4,不飽和度為12。1H NMR中H7.52(1H,dt,=8.0,1.5 Hz),7.14(1H,d,=8.0 Hz),7.09(1H,dt,=8.0,1.0 Hz),7.01(1H,dd,=8.0,1.0 Hz)提示分子中存在1,2-二取代苯環;H6.97(1H,t,=8.0 Hz),6.66(1H,dd,=8.0,1.5 Hz),6.11(1H,m),6.00(1H,d,=8.0 Hz)提示分子中存在1,3-二取代苯環;13C NMR中給出2個酰胺碳信號C166.0和165.4,1個氮甲基信號即與氫譜對應的芳香碳信號。以上數據與化合物5極為相似,且分子量相同,仔細與文獻比對其核磁數據,確定化合物6為(-)-cyclopenol[23](圖1)。
核磁波譜數據:1H-NMR(500 MHz,DMSO-6):H7.52(1H,dt,=8.0,1.5 Hz,H-8),7.14(1H,d,=8.0 Hz,H-9),7.09(1H,dt,=8.0,1.0 Hz,H-7),7.01(1H,dd,=8.0,1.0 Hz,H-6),6.97(1H,t,=8.0 Hz,H-17),6.66(1H,dd,=8.0,1.5 Hz,H-16),6.11(1H,m,H-14),6.00(1H,d,=8.0 Hz,H-18),4.23(1H,s,H-10),3.06(3H,s,H-19);13C-NMR(125 MHz,DMSO-6):C166.0(C-2),165.4(C-5),156.9(C-15),135.1(C-11),132.4(C-8),132.3(C-13),130.5(C-6),128.9(C-17),126.5(C-12),124.3(C-7),121.1(C-9),117.0(C-18),115.7(C-16),112.8(C-14),70.1(C-3),63.8(C-10),30.9(C-19);HRESIMS:m/z 311.1028 [M + H]+,333.0849 [M + Na]+。
化合物7為黃色粉末,結合其ESIMS、1H和13C NMR,判斷分子式為C19H25N3O4,不飽和度為9。1H NMR中H7.54(1H,s)給出1個NH信號,6.16(1H,d,=6.0 Hz,H-8),5.77(1H,s,H-11),5.49(1H,d,=6.0 Hz,H-9),給出3個芳香氫信號;H5.10給出1個連氮氫信號;H3.69給出1個甲氧基氫信號;H1.13、1.11、0.98和0.84處給出4個甲基信號。13C-NMR給出2個酰胺碳信號C167.3和161.4,4個季碳信號,7個次甲基碳信號,1個亞甲基碳信號,1個甲氧基碳信號和4個甲基碳信號。以上數據與文獻報道的versicoloid A極為相似,仔細對比核磁數據,確定化合物7為versicoloid A[23](圖1)。
核磁波譜數據:1H-NMR(500 MHz,CDCl3):H7.54(1H,s,NH-2),6.16(1H,d,=6.0 Hz,H-8),5.77(1H,s,H-11),5.49(1H,d,=6.0 Hz,H-9),5.10(1H,d,=5.5 Hz,H-15),4.46(1H,s,H-3),3.69(3H,s,H-20),2.62(1H,m,H-16),2.26(1H,m,H-21),1.20(2H,m,H-17),1.13(3H,d,=7.5 Hz,H-19),1.11(3H,d,=7.0 Hz,H-23),0.98(3H,d,=7.0 Hz,H-22),0.84(3H,t,=7.0 Hz,H-18);13C-NMR(125 MHz,CDCl3):C167.3(C-1),161.4(C-13),159.6(C-6),156.8(C-10),152.9(C-4),144.3(C-8),115.5(C-9),109.3(C-12),94.8(C-11),60.6(C-15),59.2(C-3),55.1(C-20),36.9(C-16),32.4(C-21),23.0(C-17),20.0(C-22),17.8(C-23),15.8(C-19),12.0(C-18);ESIMS:m/z 360.2 [M + H]+。
化合物8為白色粉末,根據HRESIMS數據,判斷分子式為C20H27N3O4。化合物8的核磁數據與7很相似,主要的區別在于2個化合物的1,2,4-三取代芳香環(8:C/HC/H-7,C/H-8,C/H-10,129.6/7.65, 125.1/7.38,106.4/7.657:C/H-8,C/H-9,C/H-11,144.3/6.16,115.5/5.49,94.8/5.77)。同時,化合物8中多了1個甲氧基信號C/HC/H-7,51.1/3.92。進一步仔細分析其核磁數據,并與文獻進行比對,確定化合物8為chrysopiperazine C[25](圖1)。
核磁波譜數據:1H-NMR(500 MHz,CDCl3):H7.65(2H,d,=9.0 Hz,H-7,H-10),7.38(1H,d,=9.0 Hz,H-8),6.99(1H,s,NH-2),5.23(1H,d,=9.0 Hz,H-14),3.92(3H,s,H-22),3.27(3H,s,H-23),2.96(1H,m,H-18),2.53(1H,m,H-15),1.27(1H,m,H-20b),1.23(3H,m,H-17),1.10(3H,d,= 7.0 Hz,H-19),1.04(1H,m,H-20a),0.95(6H,m,H-16,H-21);13C-NMR(125 MHz,CDCl3):C170.3(C-1),161.5(C-12),159.2(C-9),144.9(C-4),140.6(C-6),129.6(C-7),125.1(C-8),121.5(C-11),106.4(C-10),88.7(C-3),60.9(C-14),56.0(C-22),51.1(C-23),36.4(C-18),33.6(C-15),25.3(C-20),20.2(C-17),19.8(C-16),12.6(C-21),11.1(C-19)。HRESIMS:m/z 374.2078 [M + H]+,396.1897 [M + Na]+。
將發酵提取物進行減壓硅膠柱層析,以乙酸乙酯-石油醚(0—100%)、甲醇-乙酸乙酯(0—100%)為流動相進行梯度洗脫,分為7個組分(Fr.1—Fr.7)。Fr.2(1.6 g)經ODS反相硅膠柱層析梯度洗脫(甲醇-水,60%—100%),后經過Sephadex LH-20凝膠柱層析(二氯甲烷-甲醇,1/1)得到Fr.2-1—Fr.2-5。Fr.2-5經反相HPLC(70%乙腈-水加0.1%三氟乙酸,2 mL·min-1)純化制備后得到11(28.1 mg)和12(11.5 mg)。Fr.3(4.5 g)經正相硅膠柱層析(乙酸乙酯-石油醚,5%—100%)分離,后經過ODS反相硅膠柱層析梯度洗脫,流動相采用30%—100%甲醇-水,得到Fr.3-1—Fr.3-6。Fr.3-2經過Sephadex LH-20凝膠柱層析(二氯甲烷-甲醇,1/1),得到6(236.3 mg)。Fr.3-4經過與Fr.3-2相同的分離步驟后,得到1(38.1 mg)。Fr.3-5經過Sephadex LH-20凝膠柱層析(二氯甲烷-甲醇,1/1),后經過100﹕1二氯甲烷/甲醇正相硅膠柱層析純化,得到Fr.3-5-1—Fr.3-5-3。Fr.3-5-1經HPLC(60%甲醇-水,2 mL·min-1)分離純化后得到7(46.7 mg)。Fr.3-5-2和Fr.3-5-3分別在二氯甲烷-甲醇=1/1溶液中重結晶,得到2(13.6 mg)和3(5.4 mg)。Fr.3-6經過反復的正相硅膠柱層析,最后通過HPLC制備,流動相為75%甲醇-水,得到8(14.0 mg)。Fr.4(3.3 g)經過30%—90%甲醇-水ODS反相硅膠柱梯度洗脫,后經過Sephadex LH-20凝膠柱層析(二氯甲烷-甲醇,1/1)純化,得到Fr.4-1—Fr.4-4。Fr.4-2在二氯甲烷-甲醇混合液中重結晶,得到5(118.4 mg)。Fr.4-3經過HPLC純化,流動相為45%甲醇-(水+0.1%三氟乙酸),得到4(5.1 mg)。Fr.4-3經HPLC 50%甲醇-水制備,得到10(35.8 mg)。Fr.5(2.4 g)經過ODS反相硅膠柱層析梯度洗脫(甲醇-水,30%—90%),然后通過Sephadex LH-20凝膠柱層析(二氯甲烷-甲醇,1/1)分離,最后經反相HPLC(55%甲醇-水,2 mL·min-1)制備,得到9(48.0 mg)。
核磁波譜數據:1H-NMR(500 MHz,DMSO-6):H9.05(1H,d,=4.0 Hz,NH-2),8.10(1H,d,=8.0 Hz,H-10),7.83(1H,t,=7.5 Hz,H-8),7.72(1H,d,=8.0 Hz,H-7),7.52(1H,t,=7.0 Hz,H-9),7.39(1H,d,=7.5 Hz,H-27),7.27(2H,m,H-24,H-25),7.07(1H,dd,=7.0,4.5 Hz,H-26),5.57(1H,s,17-OH),5.24(2H,m,H-3,H-14),4.85(1H,s,H-18),4.07(1H,q,=6.5 Hz,H-20),3.05(1H,dd,=15.0,5.0 Hz,H-15b),2.40(1H,d,=15.0 Hz,H-15a),1.47(3H,d,=6.5 Hz,H-29);13C-NMR(125 MHz,DMSO-6):C167.8(C-1),165.6(C-21),159.4(C-12),147.5(C-4),146.7(C-6),139.8(C-28),136.0(C-23),134.5(C-8),129.3(C-25,C-26),127.3(C-7),127.2(C-9),126.2(C-10),124.4(C-27),120.7(C-11),113.8(C-24),79.8(C-18),74.1(C-17),65.5(C-3),63.4(C-20),53.9(C-14),36.1(C-15a),14.8(C-29);ESIMS:m/z 430.2 [M + H]+。
發酵結束后,用紗布將菌體和發酵液過濾分開,發酵液采用乙酸乙酯萃取兩遍,濃縮至干;菌體采用乙酸乙酯浸泡菌體一次,后采用二氯甲烷﹕甲醇=1﹕1浸泡一遍,濃縮后,將未干的溶液用乙酸乙酯萃取3遍,濃縮至干,與菌液提取物合并,得到發酵提取物26.8 g。
化合物10為橘紅色粉末,質譜中在m/z 361.1處給出 [M + H]+分子離子峰,結合1H-NMR和13C-NMR數據,推斷其分子式為C18H16O8,不飽和度為11。其HPLC吸收與TLC特征提示該10為蒽醌類化合物。1H-NMR中低場區給出3個芳香氫信號,高場區給出1個亞甲基、1個次甲基信號和1個甲基信號,同時給出2個連氧亞甲基信號。13C-NMR中給出2個羰基碳信號,12個芳香碳信號,2個連氧碳信號。以上數據經過與文獻進行比對,確定化合物10為versiconol[27](圖1)。
核磁波譜數據:1H-NMR(500 MHz,DMSO-6):H12.74(1H,s,1-OH),12.09(1H,s,8-OH),11.17(2H,s,3-OH,6-OH),7.14(1H,s,H-5),7.02(1H,s,H-4),6.50(1H,s,H-7),3.67(2H,m,H-1′),3.45(1H,m,H-2′),3.28(2H,m,H-4′),1.90(2H,s,H-3′);13C-NMR(125 MHz,DMSO-6):C189.0(C-9),181.3(C-10),165.0(C-6),164.2(C-8),163.5(C-3),163.1(C-1),135.0(C-11),132.2(C-14),122.9(C-2),108.8(C-4),108.6(C-5,C-8a),108.2(C-9a),108.1(C-7),62.8(C-1′),60.1(C-4′),35.3(C-2′),32.6(C-3′);ESIMS:m/z 361.1 [M + H]+。
(1)標題序號:引言部分序號為0。正文標題序號分別用阿拉伯數字依次編寫,如“1”“1.1”“1.1.1”,四級以下可用(1),①等劃分層次。
化合物11為橘紅色粉末,通過HRESIMS:m/z 367.0819 [M - H]?,判斷分子式為C20H16O7,不飽和度為13。其HPLC吸收提示11與10為同系列蒽醌化合物,但不飽和度和碳個數均多了2。1H-和3C-NMR顯示2個化合物蒽醌骨架一致,區別僅在于11的分子中多了2個環結構(C101.1(C-5′),66.1(C-1′),35.2(C-2′),27.4(C-4′),26.9(C-6′),15.4(C-3′)H5.15(H-1′),1.40—1.92(H-2′,3′,4′),1.50(H-6′))。仔細分析其核磁數據,確定化合物11為averufin[27](圖1)。
核磁波譜數據:1H-NMR(500 MHz,DMSO-6):H12.29(1H,s,1-OH),11.92(1H,s,8-OH),11.30(1H,s,6-OH),6.95(1H,s,H-5),6.83(1H,s,H-4),6.46(1H,s,H-7),5.15(1H,s,H-1′),1.40—1.92(6H,m,H-2′,3′,4′),1.50(3H,s,H-6′);13C-NMR(125 MHz,DMSO-6):C188.6(C-9),180.5(C-10),165.2(C-8),164.2(C-1),159.8(C-6),158.1(C-3),134.6(C-4a),132.9(C-10a),115.9(C-2),108.9(C-5),108.4(C-9a),108.2(C-8a),107.9(C-7),107.1(C-4),101.1(C-5′),66.1(C-1′),35.2(C-2′),27.4(C-4′),26.9(C-6′),15.4(C-3′)。HRESIMS:m/z 367.0819 [M - H]?。
中藥學是研究中藥的基本理論和常用中藥的性能、功效與臨床應用規律等知識的一門學科。中藥學在高等中醫藥院校課程體系中具有承前啟后的獨特作用和地位[1],是學生由理論基礎邁向臨證實踐的橋梁課,其授課水平將對學生今后的從醫之路產生較為直接而深遠的影響。中藥學體系完整、內容豐富、縱貫古今,對主講教師而言是一個可以“大有作為”的重要平臺。筆者認為,在著力提升中藥學教學質量的問題上,授課教師應盡全力打造精彩、非凡、卓越的中藥課堂,使學生收獲知識、思維、技能、文化等多方面、多層次的情感體驗,實現專業教育與德育的“雙豐收”,為進一步提升教育教學水平提供有益的嘗試和探索。
化合物12為橘紅色粉末,通過高分辨質譜,推斷其分子式為C20H18O7,不飽和度為12。仔細分析12的1H-NMR和13C-NMR數據,發現其也是一個蒽醌類化合物,比10多了1個不飽和度,碳個數比10多了2個,提示10比12多了1個環結構。化合物12蒽醌骨架的核磁數據與10十分相似,不同之處在于兩個化合物的高場區。經過與文獻進行比對,確定化合物12為noraverufanin[28](圖1)。
核磁波譜數據:1H-NMR(500 MHz,DMSO-6):H12.78(1H,s,1-OH),12.10(1H,s,8-OH),11.27(1H,s,6-OH),10.72(1H,s,3-OH),7.11(1H,s,H-5),7.09(1H,s,H-4),6.58(1H,s,H-7),4.96(1H,d,=14.0 Hz,H-1′),3.61(1H,m,H-5′),1.30—1.97(6H,m,H-2′,3′,4′),1.16(3H,d,=7.5 Hz,H-6′);13C-NMR(125 MHz,DMSO-6):C188.8(C-9),181.1(C-10),165.1(C-6),164.2(C-8),162.7(C-3),161.6(C-1),134.9(C-10a),133.3 (C-4a),120.0(C-2),108.8(C-5),108.7(C-9a),108.7(C-8a),108.4(C-4),108.1(C-7),74.6(C-1′),73.0(C-5′),32.4(C-2′),28.2(C-4′),23.4(C-3′),21.9(C-6′)。HRESIMS:m/z 369.0987 [M - H]?。
2.2 抗菌活性
對化合物1—12進行抗燕麥食酸菌胡蘿卜軟腐歐文氏菌密執安棒形桿菌丁香假單胞菌青枯雷爾氏菌和野油菜黃單胞菌活性測試,發現在初篩濃度為200和100 μg·mL-1濃度下,僅3,6--dimethylviridicatin(3)對青枯雷爾氏菌和野油菜黃單胞菌表現出了顯著的抗植物病原細菌活性。進一步測試其MIC,化合物3對青枯雷爾氏菌和野油菜黃單胞菌的MIC分別為50和100 μg·mL-1(表1),陽性藥硫酸鏈霉素的MIC為25 μg·mL-1。3,6--dimethylviridicatin(3)對其余4種植物病原細菌沒有明顯的抑菌活性。
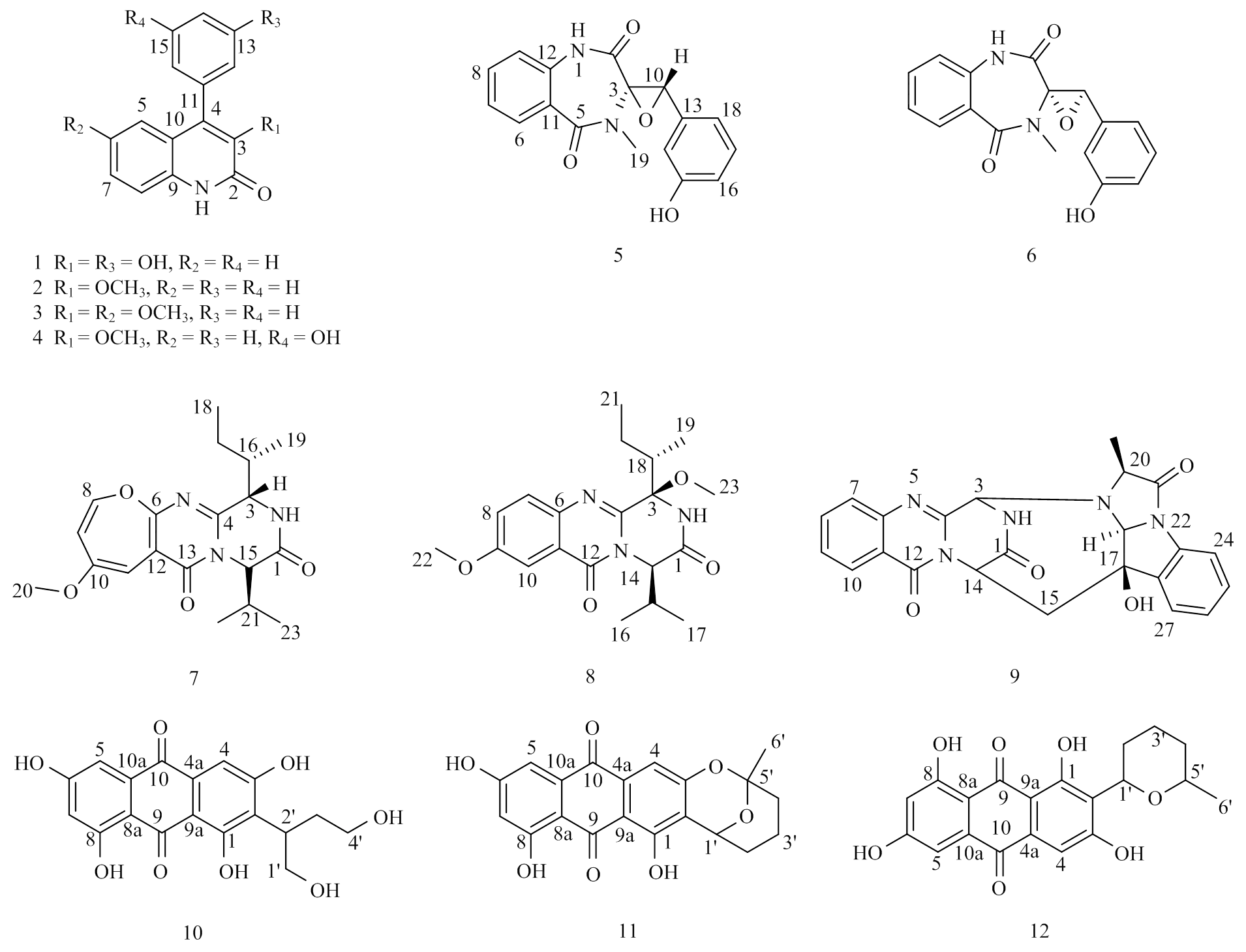
圖1 化合物1—12的化學結構圖
3 討論
本研究從一株海洋雜色曲霉D5發酵提取物中分離鑒定了12個化合物,包括4個2-羰基-4-苯基喹啉生物堿(1—4)、2個雙氧代哌嗪生物堿(5—6)、3個喹唑啉fumiquinazolines生物堿及其衍生物(7—9)和3個蒽醌類化合物(10—12)。曲霉是重要的海洋真菌類群,在海洋真菌中占有很大比例,天然產物研究最多的海洋真菌是海洋曲霉。海洋曲霉源天然產物的研究始于1992年,NUMATA等[29]報道了首例海洋曲霉來源的新天然產物fumiquinazolines A-C,至2014年8月,已報道512個海洋曲霉來源的新天然產物。此后,越來越多的化合物從海洋曲霉中分離出來。2015—2018年,共報道了389個海洋曲霉來源新化合物,這不包括紅樹林來源的海洋曲霉,這些化合物結構類型多樣,包括聚酮、生物堿、萜類、甾體、肽類等,且有多種生物活性,包括抗菌、細胞毒、抗氧化等[8,30-32]。本文所獲得的4種結構類型化合物在海洋曲霉中均有過報道。
自然界中的2-羰基-4-苯基喹啉生物堿只由真菌產生,生源途徑是由鄰氨基苯甲酸衍生而來,目前發現的該類化合物大部分來自于青霉菌,亞熱帶、溫帶、寒帶環境的青霉中均發現了該類化合物的存在,其中也包括海洋青霉[33]。2-羰基-4-苯基喹啉生物堿的生物活性報道較少,多數研究沒有發現其明顯的生物活性,但該類化合物抗腫瘤活性顯著。Wei等[21]從一株紅樹來源的青霉sp.發酵提取物中分離鑒定了一個新的2-羰基-4-苯基喹啉生物堿viridicatol,通過核磁及單晶衍射確定了其結構,并發現該化合物對人非小細胞肺癌細胞A549、人肝癌細胞HepG2、人乳腺癌細胞MCF7、人白血病細胞K56具有顯著的抑制活性,IC50在16.5—80.0 μg·mL-1;He等[34]從一株海水來源的楊奇青霉()中獲得了4種化合物,測試了它們對8種腫瘤細胞的細胞毒活性,其中3*,4*-dihydroxy-4-(4′-methoxyphenyl)- 3,4-dihydro-2(1)- quinolinone對人卵巢癌細胞SKOV-3表現出了中等的毒性,quinolinonepeniprequinolone表現出了強的非選擇性細胞毒活性。也有研究報道了2-羰基-4-苯基喹啉生物堿對革蘭氏陽性菌中等的抑制活性,Pan等[35]從螃蟹來源的雜色曲霉XZ-4發酵物中分離鑒定出3,6-odimethylviridicatin和9-hydroxy-3- methoxyviridicatin,發現它們對大腸桿菌()具有中等的抗菌活性,MIC為32 μg·mL-1。在本研究中所獲得的4個2-羰基-4-苯基喹啉生物堿中,只有3,6--dimethylviridicatin(3)表現了顯著的抗植物病原細菌活性。分析其結構特征發現,3與1、2、4結構上的不同之處主要體現在C-6多了1個甲氧基,該甲氧基可能是化合物發揮抗植物病原細菌作用的關鍵基團。同時,文獻中報道了9-hydroxy-3- methoxyviridicatin對大腸桿菌的抑菌作用,表明8-OH可能也是該類化合物發揮抗菌作用的重要基團。
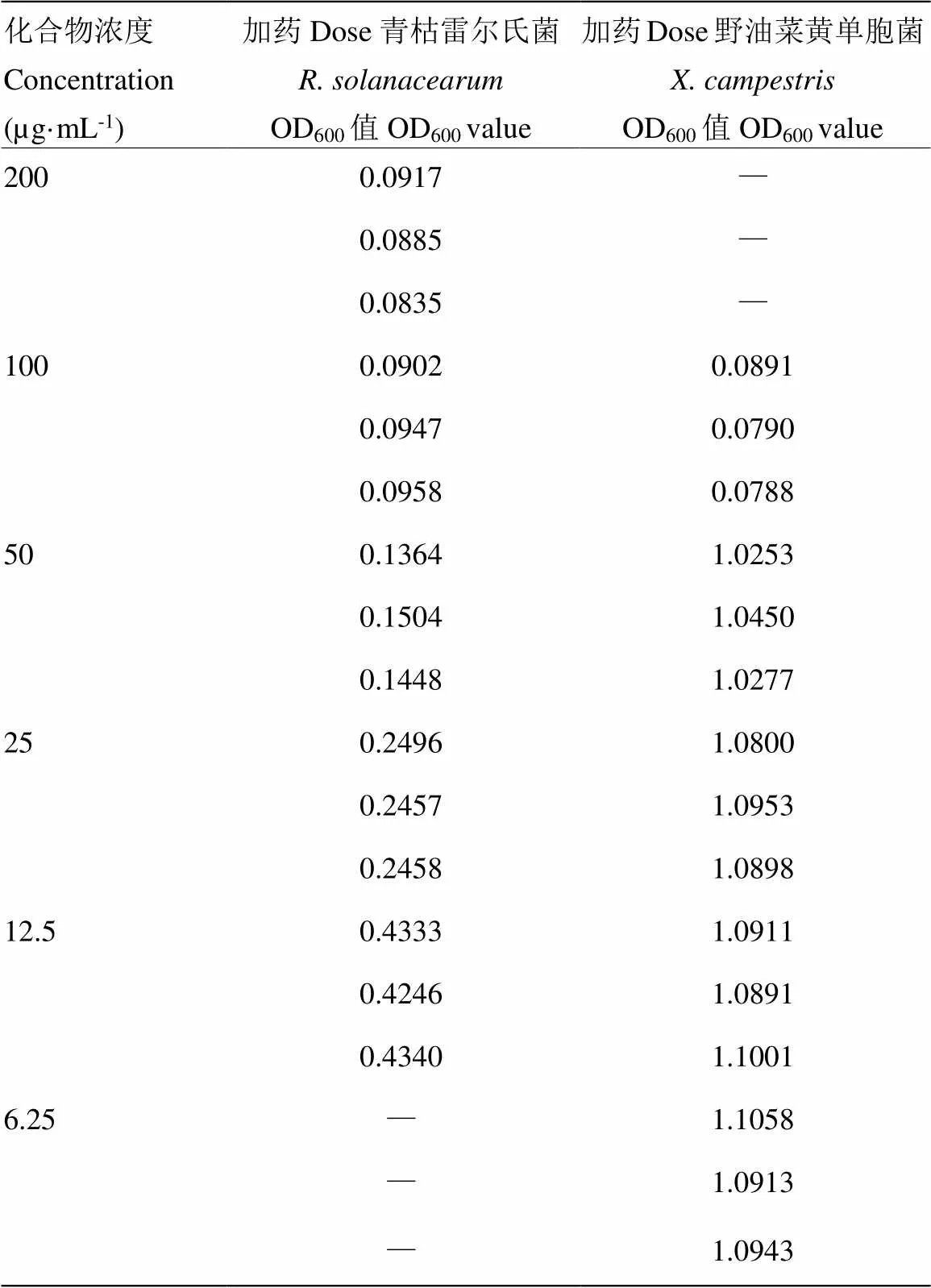
表1 化合物3對青枯雷爾氏菌和野油菜黃單胞菌抑菌數據
未加藥菌液OD600分別為0.4733(青枯雷爾氏菌)、1.1362(野油菜黃單胞菌)The OD600of un-treated bacteria solution is 0.4733 () and 1.1362 (), respectively;空白對照OD600分別為0.0711(青枯雷爾氏菌)、0.0763(野油菜黃單胞菌)The OD600of blank control is 0.0711 () and 0.0763 (), respectively。“—”:未測試No test喹唑啉fumiquinazolines生物堿是一類結構新穎獨特的化合物,結構特征為包含一個pyrazino [2,1-b] quinazoline-3,6-dione母核,并連接一個吲哚。自1992年首次發現以來,目前共發現了80多個該類化合物,主要由陸地和海洋真菌代謝產生,這類化合物及其前體具有十分顯著的生物活性,包括抗腫瘤、抗菌,尤其是在化療藥物方面具有顯著療效[36]。本研究獲得了一個喹唑啉fumiquinazolines生物堿(9)和兩個未連吲哚的喹唑啉生物堿(7、8),據文獻報道,其中8和9的生物活性顯著,而并未發現7明顯的生物活性。Fremlin等[26]從澳大利亞海沙來源的雜色曲霉中分離獲得化合物9,通過核磁及Marfey反應確定了它的結構,活性測試發現了其抗菌作用;Wang等[23]從一株深海來源的雜色曲霉發酵液中獲得了化合物8和9,對幾種植物病原菌尖孢炭疽菌()、稻瘟病菌()和尖鐮孢()表現出了顯著的抑菌活性,特別是化合物8對尖孢炭疽菌的抑制效果強于陽性藥放線菌酮。本研究發現,所獲得的喹唑啉fumiquinazoline生物堿及其衍生物均沒有抗植物病原細菌活性,該類化合物結構復雜,新穎度高,且文獻報道了它們的抗植物病原真菌活性。因此,值得繼續挖掘該類化合物的結構多樣性,從中發現抗真菌生物農藥先導化合物。
4 結論
從一株海藻來源的雜色曲霉D5發酵培養基中分離鑒定了9個生物堿類化合物(1—9)和3個蒽醌類化合物(10—12)。其中,2-羰基-4-苯基喹啉生物堿3,6--dimethylviridicatin(3)對青枯雷爾氏菌和野油菜黃單胞菌等植物病原細菌具有顯著的抗菌活性,6-OCH3可能是該類化合物抗菌作用的關鍵基團。
[1] GODFRAY H C J, BEDDINGTON J R, CRUTE I R, HADDAD L, LAWRENCE D, MUIR J F, PRETTY J, ROBINSON S, THOMAS S M, TOULMIN C. Food security: The challenge of feeding 9 billion people.,2010, 327(5967): 812-818.
[2] LAMBERTH C, JEANMART S, LUKSCH T, PLANT A. Current challenges and trends in the discovery of agrochemicals.,2013, 341(6147): 742-746.
[3] 錢韋. 《微生物學通報》與中國植物相關細菌研究40年. 微生物學通報, 2014, 41(3): 445-449
QIAN W. Microbiology China and 40 years study on plant-associated bacteria.,2014, 41(3): 445-449. (in Chinese)
[4] SUNDIN G W, CASTIBLANCO L F, YUAN X, ZENG Q, YANG C H. Bacterial disease management: challenges, experience, innovation and future prospects.,2016, 17(9): 1506-1518.
[5] BUTTIMER C, MCAULIFFE O, ROSS R P, HILL C, O’MAHONY J, COFFEY A. Bacteriophages and bacterial plant diseases.,2017, 8: 34.
[6] 馮潔. 植物病原細菌分類最新進展. 中國農業科學,2017, 50(12): 2305-2314.
FENG J. Recent advances in taxonomy of plant pathogenic bacteria.,2017, 50(12): 2305-2314. (in Chinese)
[7] GUAN A, LIU C, YANG X, DEKEYSER M. Application of the intermediate derivatization approach in agrochemical discovery.,2014, 114(14): 7079-7107.
[8] CARROLL A R, COPP B R, DAVIS R A, KEYZERS R A, PRINSEP M R. Marine natural products.,2020, 37(2): 175-223.
[9] WIESE J, IMHOFF J F. Marine bacteria and fungi as promising source for new antibiotics.,2019, 80(1): 24-27.
[10] UCHIDA R, TOMODA H, ARAI M, OMURA S. Chlorogentisylquinone, a new neutral sphingomyelinase inhibitor, produced by a marine fungus.,2001, 54(11): 882-889.
[11] SWATHI J, SOWJANYA K M, NARENDRA K, REDDY K V N R, SATYA A K. Isolation, identification & production of bioactive metabolites from marine fungi collected from coastal area of Andhra Pradesh, India., 2013, 6(6): 663-666.
[12] SILBER J, OHLENDORF B, LABES A, ERHARD A, IMHOFF J F. Calcarides A-E, antibacterial macrocyclic and linear polyesters from astrain.,2013, 11(9): 3309-3323.
[13] WU B, WIESE J, LABES A, KRAMER A, SCHMALJOHANN R, IMHOFF J F. Lindgomycin, an unusual antibiotic polyketide from a marine fungus of the lindgomycetaceae.,2015, 13(8): 4617-4632.
[14] HENRIQUEZ M, VERGARA K, NORAMBUENA J, BEIZA A, MAZA F, UBILLA P, ARAYA I, CHAVEZ R, SAN-MARTIN A, DARIAS J, DARIAS M J, VACA I. Diversity of cultivable fungi associated with Antarctic marine sponges and screening for their antimicrobial, antitumoral and antioxidant potential., 2014, 30(1): 65-76.
[15] NIU S, LIU D, PROKSCH P, SHAO Z, LIN W. New polyphenols from a deep seasp. fungus, and their antibacterial activities.,2015, 13(4): 2526-2540.
[16] WANG R, GUO Z K, LI X M, CHEN F X, ZHAN X F, SHEN M H. Spiculisporic acid analogues of the marine-derived fungus,strain HDf2, and their antibacterial activity.,2015, 108(1): 215-219.
[17] CHEN C J, ZHOU Y Q, LIU X X, ZHANG W J, HU S S, LIN L P, HUO G M, JIAO R H, TAN R X, GE H M. Antimicrobial and anti-inflammatory compounds from a marine fungus,sp..,2015, 56(45): 6183-6189.
[18] ZHAO D L, WANG D, TIAN X Y, CAO F, LI Y Q, ZHANG C S. Anti-phytopathogenic and cytotoxic activities of crude extracts and secondary metabolites of marine-derived fungi.,2018, 16(1): 36.
[19] HUANG R H, GOU J Y, ZHAO D L, WANG D, LIU J, MA G Y, LI Y Q, ZHANG C S. Phytotoxicity and anti-phytopathogenic activities of marine-derived fungi and their secondary metabolites.,2018, 8(66): 37573-37580.
[20] OPPONG-DANQUAH E, BUDNICKA P, BLUMEL M, TASDEMIR D, TASDEMIR D. Design of fungal co-cultivation based on comparative metabolomics and bioactivity for discovery of marine fungal agrochemicals.,2020, 18(2): 73.
[21] WEI M Y, YANG R Y, SHAO C L, WANG C Y, DENG D S, SHE Z G, LIN Y C. Isolation, structure elucidation, crystal structure, and biological activity of a marine natural alkaloid, viridicatol., 2011, 47(2): 322-325.
[22] HODGR R P, HARRIS C M, HARRIS T M. Verrucofortine, a major metabolite ofvar., the fungus that produces the mycotoxin verrucosidin.,1988,51(1): 66-73.
[23] WANG J, HE W, HUANG X, TIAN X, LIAO S, YANG B, WANG F, ZHOU X, LIU Y. Antifungal new oxepine-containing alkaloids and xanthones from the deep-sea-derived fungusSCSIO 05879.,2016, 64(14): 2910-2916.
[24] LI J, WANG J, JIANG C S, LI G, GUO Y W. (+)-Cyclopenol, a new naturally occurring 7-membered 2,5-dioxopiperazine alkaloid from the fungusendogenous with the Chinese mangrove.,2014, 16(5): 542-548.
[25] XU W F, MAO N, XUE X J, QI Y X, WEI M Y, WANG C Y, SHAO C L. Structures and absolute configurations of diketopiperazine alkaloids chrysopiperazines A-C from the gorgonian-derivedfungus.,2019, 17(5): 250.
[26] FREMLIN L J, PIGGOTT A M, LACEY E, CAPON R J. Cottoquinazoline A and cotteslosins A and B, metabolites from an Australian marine-derived strain of.,2009, 72(4): 666-670.
[27] FREDENHAGEN A, HUG P, SAUTER H, PETER H H. Paeciloquinones A, B, C, D, E, and F: new potent inhibitors of protein tyrosine kinase produced by. II. Characterization and structure determination.,1995, 48(3): 199-204.
[28] BRAUERS G, EDRADA R A, EBEL R, PROKSCH P, WRAY V, BERG A, GRAEFE U, SCHAECHTELE C, TOTZKE F, FINKENZELLER G, MARME D, KRAUS J, MUENCHBACH M, MICHEL M, BRINGMANN G, SCHAUMANN K. Anthraquinones and betaenone derivatives from the sponge-associated fungusspecies: Novel inhibitors of protein kinases.,2000, 63(6): 739-745.
[29] NUMATA A, TAKAHASHI C, MATSUSHITA T, MIYAMOTO T, KAWAI K, USAMI Y, MATSUMURA E, INOUE M, OHISHI H, SHINGU T. Fumiquinazolines, novel metabolites of a fungus isolated from a saltfish., 1992, 33(12): 1621-1624.
[30] CARROLL A R, COPP B R, DAVIS R A, KEYZERS R A, PRINSEP M R. Marine natural products.,2019, 36(1): 122-173.
[31] BLUNT J W, CARROLL A R, COPP B R, DAVIS R A, KEYZERS R A, PRINSEP M R. Marine natural products.,2018, 35(1): 8-53.
[32] BLUNT J W, COPP B R, KEYZERS R A, MUNRO M H G, PRINSEP M R. Marine natural products.,2017, 34(3): 235-294.
[33] MICHAEL J P. Quinoline, quinazoline, and acridone alkaloids.,2008, 25(1): 166-187.
[34] HE J, LION U, SATTLER I, GOLLMICK F A, GRABLEY S, CAI J, MEINERS M, SCHUENKE H, SCHAUMANN K, DECHERT U, KROHN M. Diastereomeric quinolinone alkaloids from the marine-derived fungus.,2005, 68(9): 1397-1399.
[35] PAN C, SHI Y, CHEN X, CHEN C T A, TAO X, WU B. New compounds from a hydrothermal vent crab-associated fungusXZ-4., 2017, 15(5): 1155-1163.
[36] RESENDE D I S P, BOONPOTHONG P, SOUSA E, KIJJOA A, PINTO M M M. Chemistry of the fumiquinazolines and structurally related alkaloids.,2019, 36(1): 7-34.
Secondary Metabolites from a Marine-Derived Fungusand Their Anti-Phytopathogenic Bacterial Activity
FU Bing1,2, WANG Mei1, LIU JianYang2, LIN Wei2, ZHANG ChengSheng1, ZHAO DongLin1
(1Marine Agriculture Research Center, Tobacco Research Institute, Chinese Academy of Agricultural Sciences, Qingdao 266101, Shandong;2Nanping Branch, Fujian Tobacco Company, Nanping 353000, Fujian)
【Objective】Plant bacterial diseases are becoming more and more serious, and lack of control pesticides. The objective of this study is to isolate bioactive compounds from the previously obtained marine-derived fungusD5 with antibacterial activity and abundant secondary metabolites, identify their chemical structures, evaluate their anti-phytopathogenic bacterial activity, so that to clarify the antibacterial components of the target fungus. This research will provide lead compounds for the discovery of new antibacterial pesticides.【Method】The compounds were isolated by silica gel column chromatography (CC), octadecylsilyl silica gel CC, Sephadex LH-20 CC, and semipreparative HPLC, and were identified by modern spectral analysis methods including NMR and MS spectra. In addition, the actibacterial activity of the isolated compounds towards six phytopathogenic bacteria, including,,,,and, was evaluated by double dilution method to obtain the minimum inhibitory concentration (MIC).【Result】Twelve compounds were isolated and identified from the ethyl acetate extract of the marine-derived fungusD5 fermented by potato dextrose water media, including four 4-aryl-quinolin-2-one alkaloids, viridicatin (1), 3--methylviridicatin (2), 3,6--dimethylviridicatin (3), and 3--methylviridicatol (4), two dioxopiperazine alkaloids, (+)-cyclopenol (5) and (-)-cyclopenol (6), three fumiquinazolines alkaloids and their derivatives, versicoloid A (7), chrysopiperazine C (8), and cottoquinazoline A (9), and three anthraquinone derivatives, versiconol (10), averufin (11), and noraverufanin (12). Among them, a 4-aryl-quinolin-2-one alkaloid, 3,6--dimethylviridicatin (3) exhibited an obvious antibacterial activity againstandwith MIC values of 50 and 100 μg·mL-1, respectively. The structure activity relationship analysis revealed that the methoxy group at C-6 might play an important role in anti-phytopathogenic bacterial activity.【Conclusion】The metabolites ofD5 are abundant, which can produce alkaloids and anthraquinones with various structures. Among them, nine alkaloids and three anthraquinones were obtained from cultures of D5. 3,6--dimethylviridicatin (3) exhibited clear antibacterial activities towardsand.
marine-derived fungus;; alkaloid; anthraquinone; structural identification; phytopathogenic bacteria
2020-02-29;
2020-05-08
國家自然科學基金(41806194)、山東省農業重大應用技術創新項目(SD2019ZZ002)、福建省農業科技項目(201735070024072,201735000024112)
付兵,E-mail:fb1501@163.com。通信作者趙棟霖,E-mail:zhaodonglin@caas.cn
(責任編輯 岳梅)

