果膠-乳清蛋白混合比例和pH值對體系流變學特性的影響
白英,楊月嬌,謝瑞鵬
(內蒙古農業大學 食品科學與工程學院,內蒙古 呼和浩特,010018)
由于具有明顯的凝膠特性,乳清蛋白(whey protein,WP)常被用做發酵乳制品加工中的增稠劑,提高發酵乳的持水力,改善組織狀態,提高產品的蛋白質含量。研究者將熱聚合乳清濃縮蛋白添加到發酵酸豆奶中,改善了產品的黏度和硬度,提高了產品的穩定性[1]。通過添加變性乳清蛋白,改善發酵羊奶的穩定性和脫水收縮作用[2]。以聚合乳清蛋白作為增稠劑,改善燕麥飲料的加工特性[3]。多糖是一種食品中常見的大分子組分,能夠影響蛋白凝膠的形成過程,從而影響食品的質構特性。果膠具有良好的膠凝特性,廣泛應用于發酵乳及飲料制品的加工中,提高產品的穩定性。分離乳清蛋白與甜菜果膠共價復合,可形成較穩定的β-胡蘿卜素乳液[4]。聚合乳清蛋白與多糖相互作用形成絡合物,影響體系中乳清蛋白聚集體存在情況[5]。多糖的添加,增加了凝膠的孔隙度。導致持水能力的降低,同時改變了流變學特性[6]。但有研究顯示,明膠的添加并不會明顯增加凝膠的緊實度[7]。凝膠化過程是一個復雜的過程,受多種因素影響,如乳清蛋白初始濃度、多糖的添加量、加熱時間、加熱溫度、pH值和離子強度等。
本文以果膠-乳清蛋白凝膠體系為研究對象,對鈣離子誘導條件下,乳清蛋白濃度、果膠濃度和pH值對果膠-乳清蛋白體系凝膠形成及流變學特性的影響進行了研究。
1 材料與方法
1.1 材料與試劑
恒天然乳清蛋白(蛋白含量80%),鄭州萬博化工產品有限公司;食品級果膠(半乳糖醛酸含量66.7%),河南恒銳食品添加劑有限公司;CaCl2(分析純)、NaOH(分析純),國藥集團化學試劑有限公司。
1.2 儀器與設備
Haake RS6000旋轉流變儀,Thermo Fisher 公司;HJ-6多頭磁力加熱攪拌器,江蘇杰瑞爾電器有限公司。
1.3 實驗方法
1.3.1 乳清蛋白和果膠貯備液的制備
乳清蛋白溶液(200 g/L):稱取20 g乳清蛋白粉緩慢加入超純水中,連續攪拌2 h,充分溶解后,待用。
果膠溶液(10 g/L):稱取1 g果膠加入超純水中,加熱至50 ℃,保持攪拌2 h至完全溶解,待用。
以上溶液貯藏于4 ℃條件下,待用。
1.3.2 乳清蛋白-果膠混合液的制備
參照王翠娜[5]的方法,分別取20%的乳清蛋白溶液和1.0%的果膠混合,使最終混合體系中乳清蛋白質量濃度40~100 g/L,果膠質量濃度1~5 g/L,攪拌2 h充分溶解,制備果膠-乳清蛋白混合溶液。用0.5 mol/L NaOH調整體系pH值。85 ℃加熱30 min,冷卻至室溫。
試驗中乳清蛋白體系質量濃度分別為4%、8%和10%, pH值分別為7、8和9,果膠體系質量濃度分別為1、2、3、4和5 g/L,CaCl2體系濃度分別為50、100、150和200 mmol/L。實驗組設計如表1所示。
1.3.3 流變學特性的測定
參照白英等[8]的流變參數,在 Haake RS6000 流變儀中以旋轉和振蕩模式進行混合體系的初始黏度等流變學指標檢測。通過在固定頻率(1 Hz)下的應力掃描,測試確定線性黏彈性區域。在線性范圍內的應變(0.01%~100%)下評價儲能模量(G′)和損耗模量(G″)。

表1 實驗組設計Table 1 Experimental design
2 結果與分析
2.1 聚合乳清蛋白液的初始黏度
如圖1所示,乳清蛋白溶液在85 ℃下,受熱30 min后,100 g/L乳清蛋白溶液黏度明顯高于未受熱100 g/L乳清蛋白溶液(100 g/L-NH)。蛋白質的重組結構以及蛋白質分子之間的相互作用決定了乳清蛋白的凝膠特性。α-乳白蛋白存在半胱氨酸殘基,其熱變性與β-乳球蛋白相似[9]。研究表明,溫度大于60 ℃時,乳清蛋白的球狀結構發生改變,折疊結構打開,巰基(—SH)外露。當溫度達到75 ℃時,隨著β-乳球蛋白折疊結構的進一步打開[10]。當溫度為85 ℃ 時,超過了蛋白質的耐受溫度,其結構和生物活性或溶解度發生了改變,二硫鍵斷裂,分子內疏水基團暴露,α-螺旋內部含有的半胱氨酸殘基暴露,易與其他分子交聯成二硫鍵[11]。而加熱引起的去折疊化β-乳球蛋白與α-乳白蛋白也能發生巰基-二硫化物交換反應,發生乳清蛋白間變性[12-13]。
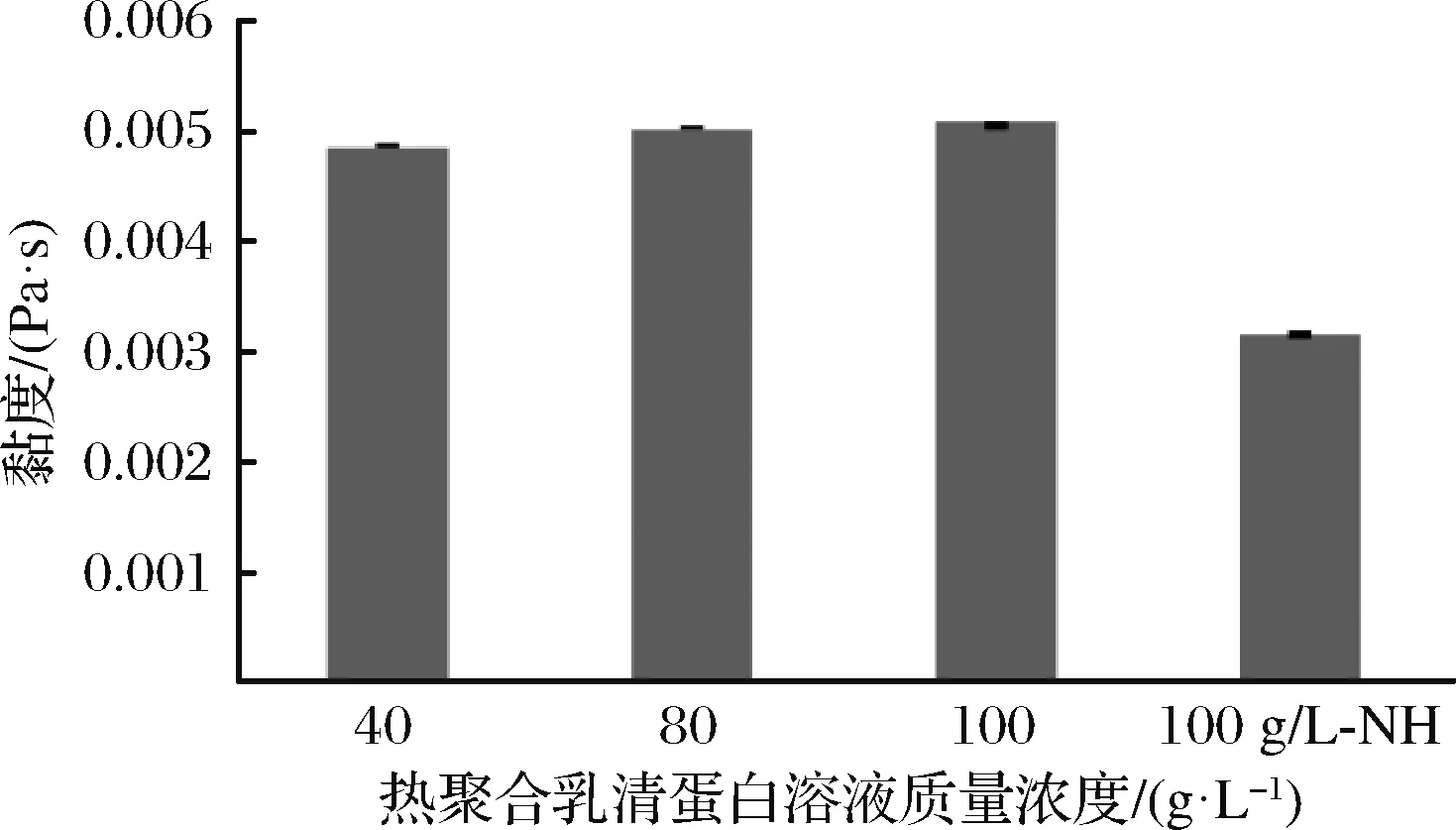
圖1 聚合乳清蛋白黏度Fig.1 Viscosity of polymerized whey protein
溶液中蛋白聚集體尺寸會隨著乳清蛋白濃度的升高而增加[14]。JU等[15]研究表明,隨著乳清蛋白濃度的增大,聚合乳清蛋白的平均粒徑也相應增大從而導致熱聚合溶液黏度會隨著乳清蛋白濃度的增大逐漸增加。
2.1 果膠-乳清蛋白混合體系初始黏度的影響因素
果膠是一種帶有負電荷的陰離子多糖[16]。它可以與熱誘導聚合乳清蛋白(polymerized whey protein, PWP) 的陽離子區域發生連接并形成堅實的網狀結構[17]。乳清蛋白濃度達到一定程度時才能形成熱誘導凝膠[18]。pH值影響聚合乳清蛋白溶液的形成以及熱誘導凝膠的特性。通常情況下,乳清蛋白在遠離β-乳球蛋白等電點處進行加熱聚合[19]。由圖2~圖4可看出,混合體系的初始黏度在不同pH值條件下,隨著果膠濃度的增加,呈現不同程度的增加。然而,隨著pH值的升高和乳清蛋白濃度的增大,混合體系的初始黏度呈下降趨勢。在pH=7時,疏水性作用相對于堿性pH值小,混合液初始黏度值最大,為2.304 Pa·s。pH=8和pH=9時,黏度較小且數值接近。在堿性條件下,靜電斥力較中性條件下大,阻礙了分子間的接近,進而影響凝聚作用的發生。當pH值較小破壞了蛋白聚合體的穩定性,減少了乳體系中酪蛋白表面的靜電荷,最終導致了蛋白質凝聚沉淀[20]。在適宜pH值下,蛋白質分子才能相互接近到有利于分子間發生疏水性鍵結合的距離,形成分子間交聯,生成不可逆性的蛋白質凝膠[6]。

圖2 果膠-乳清蛋白體系初始黏度的變化曲線(pH=7)Fig.2 Curves of initial viscosity on mixed pectin- WP system (pH=7)
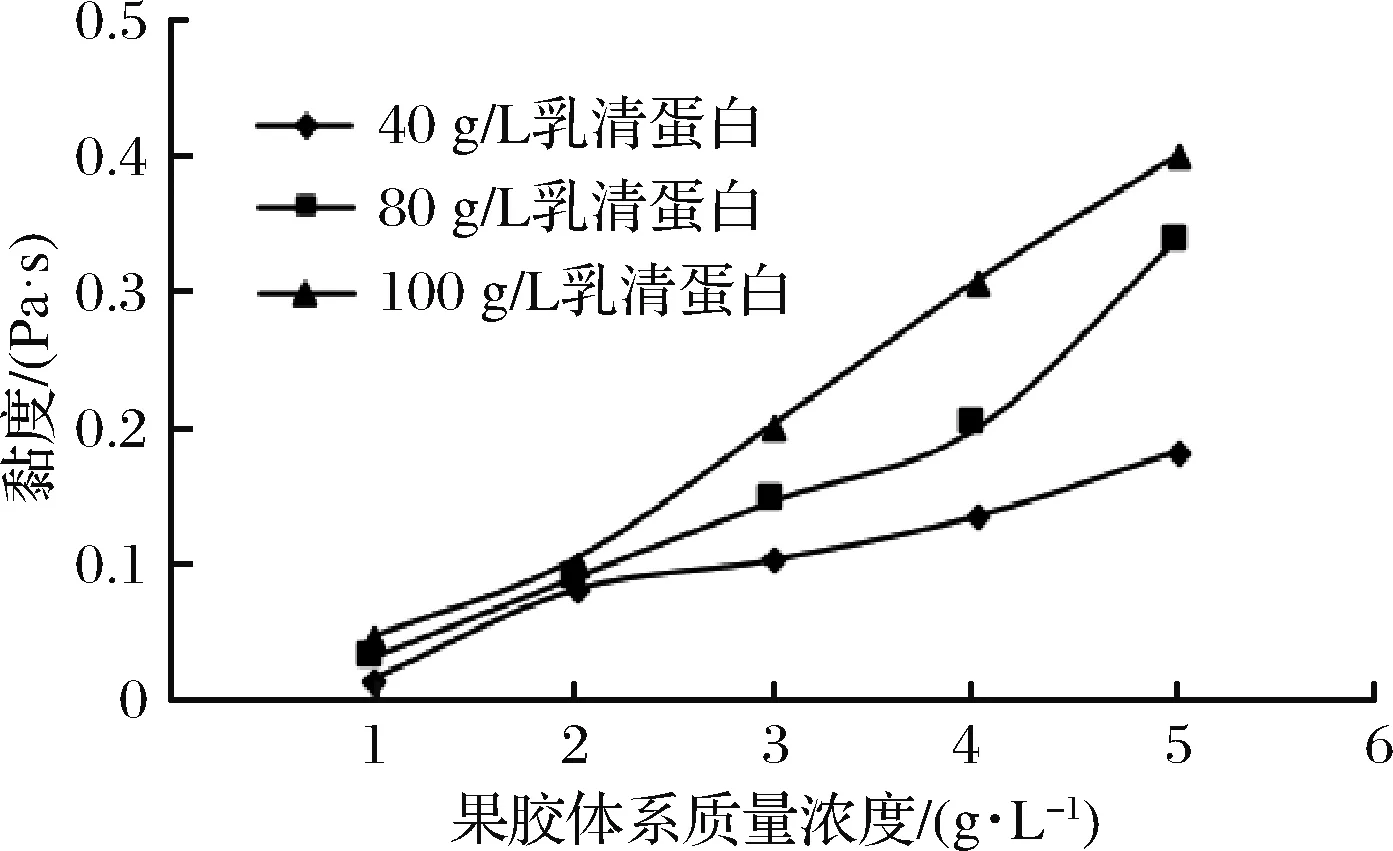
圖3 果膠-乳清蛋白混合體系初始黏度的變化曲線(pH=8)Fig.3 Curves of initial viscosity on mixed pectin- WP system (pH=8)

圖4 果膠-乳清蛋白體系初始黏度的變化曲線(pH=9)Fig.4 Curves of initial viscosity on mixed pectin- WP system (pH=9)
2.2 鈣離子對果膠-乳清蛋白體系黏度的影響
有研究表明,85 ℃及以上溫度進行熱處理時,蛋白構象展開,活性氨基酸暴露,對鈣離子敏感的 ɑs-酪蛋白暴露,疏水作用增強,與游離的鈣離子結合,從而減少表面電荷量,產生活性位點,膠束平衡發生破壞,促進乳清蛋白與鈣離子結合形成Ca2+-蛋白復合物,分子間的靜電斥力減小,溶液產生絮凝,乳清蛋白熱穩定性降低[21]。40~100 g/L體系的純乳清蛋白溶液在低離子強度條件下,可以形成較小的聚集顆粒,但不會出現大規模的凝膠現象[22]。一般情況下,當體系pH=7時,離子強度為50 mmol/L NaCl或者10 mmol/L CaCl2時,在較低濃度乳清蛋白條件下加熱即可形成熱誘導凝膠[23]。對于熱誘導凝膠,離子強度對凝膠強度的影響表現在,當CaCl2濃度為11 mmol/L,而NaCl濃度為200 mmol/L 時,凝膠強度達到最大值[24]。從圖5可以看出,在pH=7,乳清蛋白質量濃度40 g/L的條件下,隨果膠濃度的增大,混合體系的初始黏度值逐漸增大。在較低的Ca2+濃度下,其誘導形成的凝膠主要是通過分子間電荷量的相互損耗作用,分子間結合的比較充分;較高的Ca2+濃度下,破環了分子間的電荷量平衡,分子間聚集的體系結構不穩定,從而導致黏度逐漸減小[25]。本實驗結果顯示,在同一果膠濃度的條件下,當Ca2+濃度為100 mmol/L時,黏度值均達到最大值,隨著Ca2+體系濃度的繼續增大,黏度趨于平穩。
2.3 pH值及果膠濃度對果膠-乳清蛋白混合體系剪切流變特性的影響
在以剪切速率為變量,添加果膠未影響40 g/L乳清蛋白體系濃度的果膠-乳清蛋白的流體類型,混合體系表現出剪切稀變的特性(圖6~圖8)。在pH=7時,體系黏度最大,說明對于果膠-乳清蛋白混合體系來說,在溶液呈中性的條件下,溶液有最好的膠凝性。pH為8和9時,黏度差異較小。隨著剪切速率的加大,果膠和乳清蛋白之間形成的微弱結構被破壞,使溶液中的微小顆粒之間的摩擦作用變小,從而降低了黏度值[26]。在一定的pH值條件下,隨著剪切速率的增加,對于果膠-乳清蛋白混合體系中果膠的體系濃度越大,黏度變化越大,最終趨勢平緩。其中1 g/L果膠體系變化較小,因為果膠濃度低,與乳清蛋白之間分子斥力較小,結合充分,體系相對比較穩定[27]。
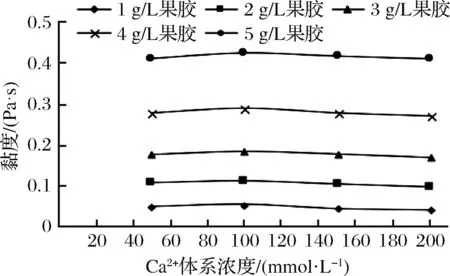
圖5 Ca2+濃度對果膠-40 g/L乳清蛋白混合體系黏度的影響Fig.5 Effect of Ca2+ concentration on viscosity of mixed pectin-40 g/L WP system

圖6 果膠質量濃度對剪切黏度的影響(pH=7)Fig.6 Effect of pectin concentration on shear viscosity (pH=7)
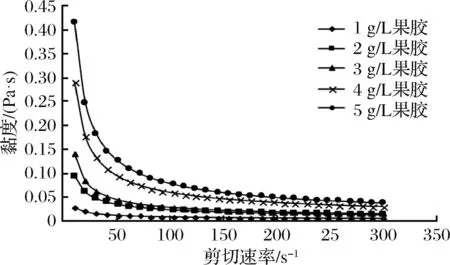
圖7 果膠質量濃度對剪切黏度的影響(pH=8)Fig.7 Effect of pectin concentration on shear viscosity (pH=8)

圖8 果膠質量濃度對剪切黏度的影響(pH=9)Fig.8 Effect of pectin concentration on shear viscosity (pH=9)
2.4 pH值及果膠濃度對果膠-乳清蛋白混合體系動態流變特性的影響
物料體系在受到外力的作用下會發生形變,由于彈性(可逆)形變而儲存能量的大小叫作彈性模量(G′),又稱儲能模量,以后可以恢復;由于黏性形變(不可逆)而引起損耗能量的大小叫作黏性模量(G″),又稱損耗模量,初始流動所用能量轉變為剪切熱;當彈性模量G′大于黏性模量G″時,物料主要發生彈性形變,會表現出固態特性;反之,物料主要發生黏性形變,則會呈現液態特性[28]。為了考察果膠的添加量對果膠-乳清蛋白混合體系凝膠進程的影響,對果膠-乳清蛋白混合體系進行了動態模量測定。不同pH值及果膠的添加量對40 g/L乳清蛋白體系G′和G″的影響如圖9~圖11所示,果膠含量對混合體系的損耗模量影響趨勢與彈性模量趨勢相類似。在同等pH值條件下,隨著果膠體系質量濃度的增大(1~5 g/L),果膠-乳清蛋白混合體系的彈性模量(G′)逐漸增加,體系黏度增大。隨著剪切時間的延長,所有樣品的損耗模量有明顯的上升趨勢,這說明果膠的濃度增加,樣品黏度增大,需更大的能量消耗,因此損耗模量(G″)變大。pH值的變化對模量有很大影響。由初始黏度可知pH值可改變體系的黏性,隨著pH值的增加,損耗模量先上升再下降。在pH=7的條件下,彈性模量遠遠大于損耗模量,混合體系的彈性遠遠大于樣品的黏性。在pH=8和pH=9時,樣品損耗模量大于彈性模量,說明此時樣品的黏性流動性逐漸加強。由實驗結果可知,隨著體系pH值的增加,混合體系的黏性流動性加強。隨著果膠濃度的增大,出現明顯觸變環(圖11)。升速與降速剪切曲線所圍成的觸變環(又稱滯后環),即物料在剪切作用下組織結構會發生變化,撤去剪切作用后體系結構需要滯后一段時間才會恢復到原來的狀態[29]。觸變環的面積大小表示破壞觸變結構所需要能量的大小[30]。從觸變環面積可知,隨著果膠濃度的增加,破壞混合體系觸變結構所需要的能量增大,體系穩定性增強。
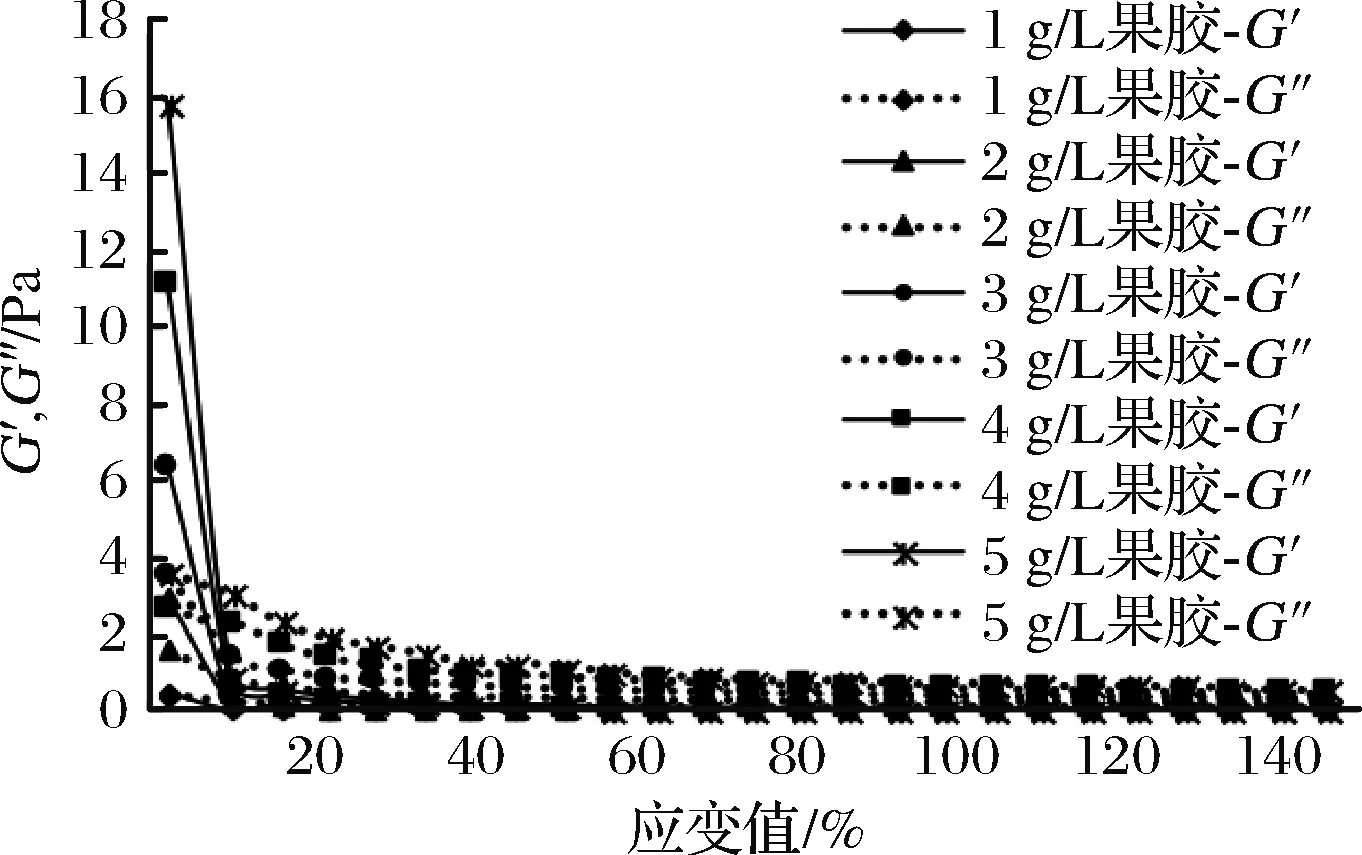
圖9 果膠質量濃度對果膠-40 g/L乳清蛋白混合體系G′和G″的影響(pH=7)Fig.9 Effect of pectin concentration on G′and G″of mixed pectin-40 g/L whey protein system (pH=7)

圖10 果膠質量濃度對果膠-40 g/L乳清蛋白混合體系G′和G″的影響(pH=8)Fig.10 Effect of pectin concentration on G′and G″of mixed pectin-40 g/L whey protein system (pH=8)

圖11 果膠質量濃度對果膠-40 g/L乳清蛋白混合體系G′和G″的影響(pH=9)Fig.11 Effect of pectin concentration on G′and G″of mixed pectin-40 g/L whey protein system (pH=9)
3 結論
當混合體系pH=7時,Ca2+可誘導果膠-40 g/L乳清蛋白混合體系形成凝膠。果膠-乳清蛋白混合體系表現出剪切稀化的流體特征。在同等pH值條件下,隨著果膠體系濃度的增大,果膠-乳清蛋白混合體系的G′和G″都有明顯的上升趨勢。在pH=7的條件下,G′>G″;在pH=8和pH=9時,樣品G′

