高糖化力白曲霉的復合誘變及固態(tài)發(fā)酵條件優(yōu)化
趙志軍,李 敏,劉延波,劉 寧,葛少華,潘春梅,孫西玉,4*
(1.河南牧業(yè)經濟學院 食品與生物工程學院(酒業(yè)學院),河南 鄭州 450046;2.河南牧業(yè)經濟學院 河南省白酒風格工程技術研究中心,河南 鄭州 450046;3.寶豐酒業(yè)有限公司,河南 寶豐 467500;4.河南張弓老酒酒業(yè)有限公司,河南 寧陵 476733)
白酒是以高粱等淀粉質原料為主料,加入酒曲為糖化發(fā)酵劑,經蒸煮、糖化、發(fā)酵、蒸餾、儲存、勾調而成的蒸餾酒[1]。酒曲作為中國白酒釀造的糖化、發(fā)酵和生香劑,其品質對酒的產率和風格有極大的影響[2-3]。麩曲是以麩皮為原料制成的散曲。麩曲能提供大量的休眠釀酒微生物,具有制作周期短、出酒率高、節(jié)約糧食、成本低的優(yōu)點[4-5]。
白曲霉具有糖化能力強、耐酸度高、培養(yǎng)條件粗放等特點[6]。白曲霉麩曲在高酸度、高蛋白酒醅環(huán)境中可發(fā)揮其糖化酶、酸性蛋白酶高的優(yōu)勢,有利于提高白酒出品率及風味物質的生成[7-9]。糖化酶作為淀粉的水解酶,對白酒產量和質量均有重大影響[10]。糖化酶活力低往往會導致白酒出酒率低,丟糟中淀粉含量高,不僅造成浪費而且加重了副產物處理負擔[11-12]。
常壓室溫等離子體(atmospheric and room temperature plasma,ARTP)誘變通過發(fā)射均勻且粒子豐富的等離子體射流,使活性粒子透過細胞膜作用于脫氧核糖核酸(deoxyribonucleic acid,DNA)物質,引起DNA的多樣性損傷,細胞啟動SOS修復機制,在修復過程中產生種類豐富的錯配位點,最終穩(wěn)定遺傳進而獲得大量突變株,是一種獲得安全性高的優(yōu)良菌種的可靠方法[13-14]。紫外線誘變(ultraviolet,UV)是常用的誘變手段之一,具有操作簡便、效率高、安全性好、突變的性狀不易恢復等優(yōu)點,應用較為廣泛[15]。采用復合誘變技術往往比單一誘變效果更好[16]。
該研究以實驗室保藏的白曲霉菌株為出發(fā)菌株,采用UV-ARTP復合誘變技術進行菌種選育,獲得糖化酶活力較高的菌株,并對其進行固態(tài)發(fā)酵條件優(yōu)化,旨在進一步提高該菌株的產糖化酶能力,為白酒、食醋等產品的發(fā)酵生產提供優(yōu)質菌種資源,為規(guī)模化制曲提供理論依據。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株與試劑
白曲霉(Aspergillus candidus)Nz 3.602:由河南牧業(yè)經濟學院河南省白酒風格工程技術研究中心保藏;
麩皮、糠殼、土豆:市售;2 mol/L乙酸-乙酸鈉緩沖溶液(pH 4.6)、斐林試劑、1 mol/L氫氧化鈉溶液、1 g/L葡萄糖標準溶液、20 g/L可溶性淀粉溶液、0.9%無菌生理鹽水等(均為分析純):國藥集團化學試劑有限公司。
1.1.2 培養(yǎng)基
種子液態(tài)培養(yǎng)基:將去皮切塊后的馬鈴薯200 g,加1 000 mL蒸餾水,煮沸20 min。用八層紗布過濾,補加蒸餾水至1 000 mL。加入葡萄糖20 g,攪拌溶解后分裝。固態(tài)基礎培養(yǎng)基為在種子液態(tài)培養(yǎng)基的基礎上補加瓊脂20 g。
篩選培養(yǎng)基:可溶性淀粉2.0 g,氯化鈉5.0 g,牛肉膏5.0 g,蛋白胨10 g,脫氧膽酸鈉2.0 g,瓊脂20 g,水1 000 mL。
以上培養(yǎng)基均在121 ℃條件下高壓蒸汽滅菌20 min。
固態(tài)發(fā)酵培養(yǎng)基:250 mL三角瓶裝入25 g調整含水率為65%的麩皮,121 ℃高壓蒸汽滅菌30 min[9]。
1.2 儀器與設備
ZQLY-300S振蕩培養(yǎng)箱:上海知楚儀器有限公司;HH-6數顯恒溫水浴鍋:常州方科儀器有限公司;GH-500隔水式培養(yǎng)箱:北京科偉永興儀器有限公司;JY2002電子天平:上海菁華科技儀器有限公司;PHS-3C pH計:上海雷磁儀器廠;LDZX-50KBS立式高壓滅菌鍋:上海申安醫(yī)療器械廠;常壓室溫等離子體誘變育種儀ⅡS:無錫源清天木生物科技有限公司。
1.3 方法
1.3.1 菌株活化、發(fā)酵培養(yǎng)及糖化力測定
菌株活化:將-20 ℃甘油管保存的菌株取出在固態(tài)基礎培養(yǎng)基上劃線于28 ℃培養(yǎng),連續(xù)劃線培養(yǎng)3代,使菌落形態(tài)發(fā)育穩(wěn)定。
種子液培養(yǎng)及三角瓶制曲:挑取一環(huán)斜面或平板中菌落直徑大且顏色分布均勻的單菌落,接種到含有50 mL種子液態(tài)培養(yǎng)基的250 mL三角瓶中,150 r/min、28 ℃培養(yǎng)48 h[17]。取4%的菌液接種于固態(tài)發(fā)酵培養(yǎng)基中,每隔24 h搖瓶一次,培養(yǎng)3 d,待表面長滿孢子時即為三角瓶麩曲[4]。倒于滅菌的牛皮紙上于35 ℃快速烘干,密封袋保存。
糖化力測定:用斐林法[9]測定糖化酶的酶活。糖化酶的酶活定義為:1 g干曲在30 ℃、pH 4.6條件下,反應1 h,將可溶性淀粉分解為1 mg葡萄糖所需要的糖化酶量為1個酶活力單位(U/g)。
1.3.2 UV誘變及篩選
孢子懸浮液的制備:取1支保藏菌株的試管,用適量無菌生理鹽水將菌株洗到50 mL含有玻璃珠的三角瓶中,在150 r/min搖床上振蕩10 min,以三層無菌擦鏡紙將孢子懸浮液過濾至無菌試管并稀釋至孢子含量為106個/mL,備用[18]。
UV誘變處理:取10 mL稀釋好的菌懸液置入無菌培養(yǎng)皿,開啟磁力攪拌器,于15 W紫外線滅菌燈垂直下方30 cm處,分別處理2min、4min、6min、8min、10min、12min、14min、16 min。照射結束后,避光穩(wěn)定5 min。取適當稀釋度的孢子懸浮液0.1 mL,與未誘變的孢子懸浮液分別涂布于固態(tài)基礎培養(yǎng)基,平行3組,28 ℃培養(yǎng)3 d觀察菌落,計數并計算致死率,制作致死曲線,從而得到最佳誘變時間(以致死率為80%~90%所需的照射時間作為參照)[19]。
UV誘變篩選:將誘變處理后的孢子懸浮液涂布于固態(tài)基礎培養(yǎng)基中,28 ℃避光培養(yǎng)后把單菌落分別挑出編號劃線培養(yǎng),純培養(yǎng)后將菌株以三點法[20]點種于篩選培養(yǎng)基中,28 ℃培養(yǎng)3 d后用碘液染色,測定菌落直徑與透明圈直徑,計算透明圈與菌落直徑比(HC值),篩選出HC值大的菌株,對其進行固態(tài)發(fā)酵培養(yǎng)測定糖化酶活力。
1.3.3 ARTP誘變及篩選
孢子懸浮液的制備:將經過UV誘變處理的酶活最高的菌株制備孢子懸浮液,方法同1.3.2。
ARTP誘變處理及篩選方法:將菌懸液均勻涂抹在金屬載片表面,用鑷子將菌物載片轉移到載物臺,設定參數為誘變功率120 W、氦氣流量10 L/min,等離子體發(fā)射源與樣品距離為2 mm,操作溫度由25 ℃逐步升至35 ℃,分別照射10 s、20 s、30 s、40 s、50 s、60 s,處理后將載片轉移到裝有1 mL生理鹽水的EP管中,振蕩洗脫形成新的菌懸液,與未誘變的菌懸液稀釋相應倍數分別涂布于固態(tài)基礎培養(yǎng)基上,28 ℃培養(yǎng)至出現單菌落,計數并計算致死率[14]。選取致死率在80%左右的時間作為誘變處理時間。篩選方法同UV誘變,得到酶活提高的菌株。
1.3.4 傳代培養(yǎng)
將誘變篩選出的突變株進行連續(xù)6次傳代培養(yǎng),測定各批次糖化酶酶活力,以確定突變菌株的遺傳穩(wěn)定性。
1.3.5 誘變菌株固態(tài)發(fā)酵產糖化酶條件的優(yōu)化
單因素試驗:固定糠殼添加量5%、原料含水量65%、接種量4%、培養(yǎng)時間3 d和培養(yǎng)溫度28 ℃為單因素試驗基礎條件,以糖化酶活力值為評價指標,選擇糠殼添加量(5%、10%、15%、20%、25%)、原料含水量(60%、65%、70%、75%、80%)、接種量(4%、8%、12%、16%、20%)、培養(yǎng)時間(3 d、4 d、5 d、6 d、7 d)、培養(yǎng)溫度(28 ℃、30 ℃、32 ℃、34 ℃、36 ℃)5個因素進行單因素試驗,考察各因素對產酶能力的影響。
響應面優(yōu)化:根據單因素結果,選擇對發(fā)酵產酶影響最顯著的3個因素為變量,酶活大小為響應值,運用Design Expert 8.0.6設計3因素3水平共17個試驗點的Box-Behnken響應面分析試驗。根據響應面分析的結果,配制最佳固態(tài)發(fā)酵培養(yǎng)基做驗證試驗。
2 結果與分析
2.1 初始酶活測定
以菌株Nz 3.602作為出發(fā)菌株,將其活化后按4%的接種量接種于固態(tài)發(fā)酵培養(yǎng)基中相同條件下培養(yǎng)3 d,測定菌株糖化酶酶活為566.11 U/g。
2.2 UV誘變選育
以菌株Nz 3.602孢子懸浮液為材料,對最佳的UV照射時間進行探索,得到誘變致死曲線,結果見圖1。
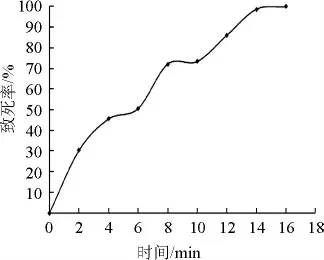
圖1 菌株Nz 3.602紫外誘變致死曲線Fig.1 Lethal curve of strain Nz 3.602 induced by ultraviolet mutagenesis
由圖1可知,隨著照射時間的增長,菌株的致死率增大,當照射時間為12 min時,菌株致死率為86.08%,故選擇12 min作為UV誘變照射時間。以菌株Nz 3.602作為出發(fā)菌株,經過UV照射12 min后涂布于固態(tài)基礎培養(yǎng)基上,暗條件下28 ℃培養(yǎng)3 d,將單菌落分別挑出,編號為A1~A57。從中挑選出HC值較高的突變株并測定其酶活,結果見表1。
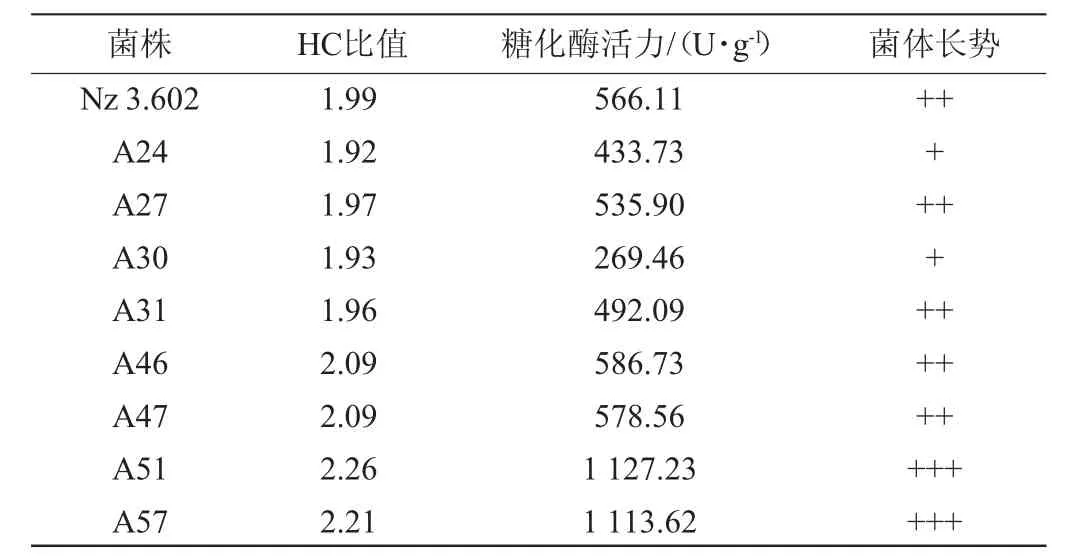
表1 紫外誘變糖化酶高產突變株的HC值及糖化酶活力Table 1 HC value and glucoamylase activity of high yield glucoamylase mutant induced by ultraviolet
由表1可知,菌株A51發(fā)酵產糖化酶活力最高,達1 127.23 U/g,較出發(fā)菌株提高了99.12%。以糖化酶酶活作為篩選指標,將菌株A51作為ARTP誘變的出發(fā)菌株。
2.3 ARTP誘變選育
對菌株A51進行ARTP誘變,測定ARTP致死曲線,結果見圖2。
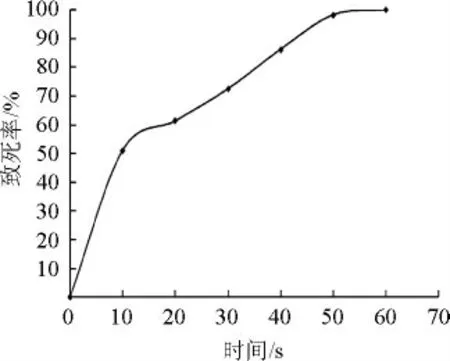
圖2 菌株A51的ARTP誘變致死曲線Fig.2 Lethal rate curve of strain A51 induced by ARTP
由圖2可知,ARTP處理時間越長致死率越大。在處理40 s時致死率為86.22%,在80%~90%范圍內,因此選擇40 s作為ARTP誘變的處理時間。
將菌株A51在ARTP儀上誘變處理40 s,稀釋涂布于固態(tài)基礎培養(yǎng)基上,28 ℃培養(yǎng)3 d后將單菌落挑出繼續(xù)劃線純化培養(yǎng),共計菌株30株,編號為B1~B30。從中挑選出HC比值較高的突變株并測定其酶活,結果見表2所示。
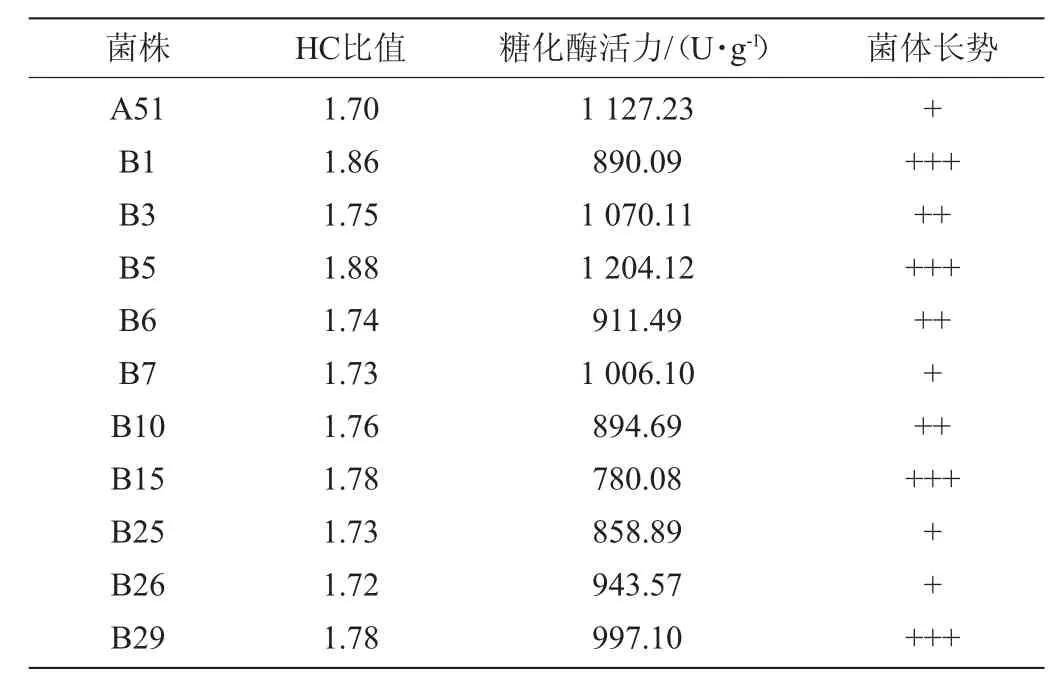
表2 ARTP誘變糖化酶高產突變株的HC值及糖化酶活力Table 2 HC value and glucoamylase activity of high yield glucoamylase mutant induced by ARTP
由表2可知,菌株B5產糖化酶活力最高,達1 204.12 U/g,較菌株A51提高了6.82%,較菌株Nz 3.602提高了112.70%。
2.4 遺傳穩(wěn)定性試驗
將高產糖化酶的突變株B5于固態(tài)發(fā)酵培養(yǎng)基中連續(xù)傳代培養(yǎng)6次,每批次3個平行,測定每批次的糖化酶酶活力,結果如圖3所示。
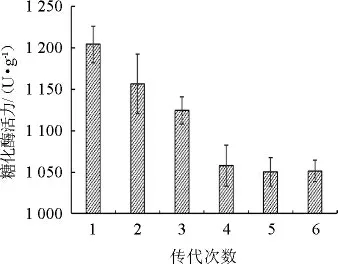
圖3 高產糖化酶突變株的遺傳穩(wěn)定性Fig.3 Genetic stability of high yield glucoamylase mutant strain
由圖3可知,突變株B5在第5代時的糖化酶活力趨于穩(wěn)定,為1 050.32 U/g,較出發(fā)菌株酶活提高了85.53%。故經UV-ARTP誘變后的菌株B5具有較好的遺傳穩(wěn)定性,可以進行后續(xù)發(fā)酵試驗。同時表明,利用UV-ARTP復合誘變技術是一種能在短時間內選育出遺傳穩(wěn)定的高產糖化酶白曲霉菌株的優(yōu)良方法,且復合誘變更具優(yōu)勢。
2.5 固態(tài)發(fā)酵產糖化酶條件優(yōu)化單因素試驗結果
2.5.1 糠殼添加量對產酶活性的影響
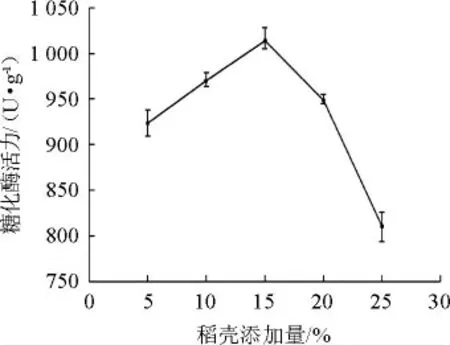
圖4 糠殼添加量對產酶活性的影響Fig.4 Effect of bran shell addition on enzyme activity
由圖4可知,隨著糠殼添加量的增加,糖化酶活力先增大后減小。在糠殼添加量為15%時糖化酶活力最大,為1 014.30 U/g。此時曲料疏松度較好,氧氣含量高,利于微生物前期增殖和酶的合成。隨著糠殼添加量的增加,固態(tài)發(fā)酵培養(yǎng)基的碳、氮源的分布降低,不利于菌體的生長。故選擇最佳的糠殼添加量為15%。
2.5.2 原料含水量對產酶活性的影響
由圖5可知,糖化酶活力隨著原料含水量的增加呈先增加后降低的趨勢。當原料含水量為70%時,糖化酶活力達到最大值為1 243.07 U/g。水分含量過低,培養(yǎng)基后期會較干燥,不利于微生物的生長繁殖及產酶;水分含量過高不利于酶活積累,同時又導致曲料結合緊密,無法充分散熱,影響菌株的生長和產酶。故選擇原料最佳含水量為70%。
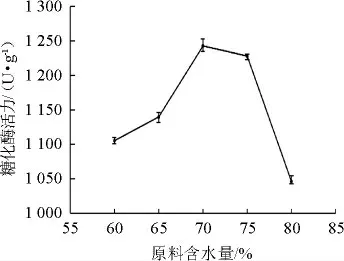
圖5 原料含水量對產酶活性的影響Fig.5 Effect of water content of raw materials on enzyme activity
2.5.3 接種量對產酶活性的影響
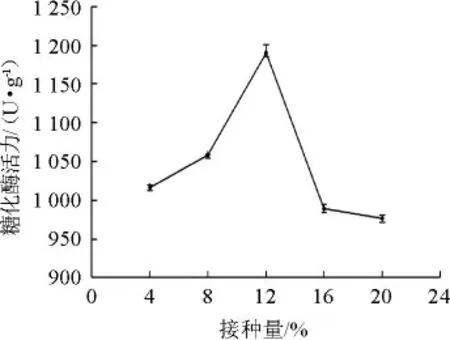
圖6 接種量對產酶活性的影響Fig.6 Effect of inoculum on enzyme activity
由圖6可知,糖化酶活力隨著接種量的增加先增加后降低。在接種量為12%時,糖化酶活力達到最大值為1 190.60 U/g。當接種量繼續(xù)增加時,微生物菌絲生長過快,基質消耗大,培養(yǎng)基中營養(yǎng)物質有限,產酶量急劇下降。故選擇最佳接種量為12%。
2.5.4 培養(yǎng)時間對產酶活性的影響
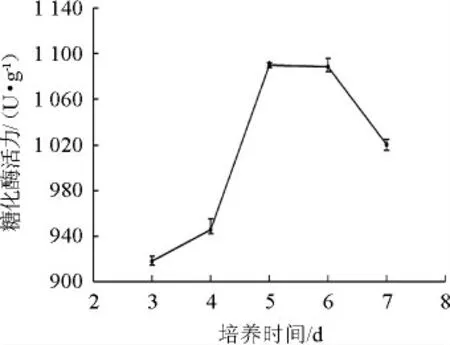
圖7 培養(yǎng)時間對產酶活性的影響Fig.7 Effect of culture time on enzyme activity
由圖7可知,糖化酶活力隨著培養(yǎng)時間的增加先增加后降低。在培養(yǎng)時間為5 d時,糖化酶活力達到最大值為1 190.33 U/g。當時間繼續(xù)增加時,受微生物生長周期和培養(yǎng)基中營養(yǎng)成分含量的限制,出現酶大量失活現象,產酶總量下降。故選擇最佳培養(yǎng)時間為5 d。
2.5.5 培養(yǎng)溫度對產酶活性的影響
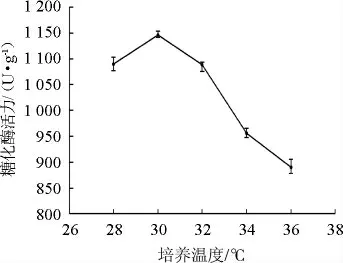
圖8 培養(yǎng)溫度對產酶活性的影響Fig.8 Effect of incubation temperature on enzyme activity
由圖8可知,白曲霉糖化酶活力伴隨著溫度的上升呈現出先增加后降低的趨勢。在培養(yǎng)溫度為30 ℃時,糖化酶活力達到最大值為1 146.34 U/g。當溫度繼續(xù)升高時,微生物的生長和產酶受較大限制,產酶量下降。故選擇最佳培養(yǎng)溫度為30 ℃。
2.6 響應面試驗優(yōu)化
2.6.1 響應面試驗設計與結果
以固態(tài)發(fā)酵培養(yǎng)基中的原料含水量、接種量和培養(yǎng)溫度為因素,糖化酶活力為響應值進行優(yōu)化試驗。響應面Box-Behnken試驗設計及結果見表3。
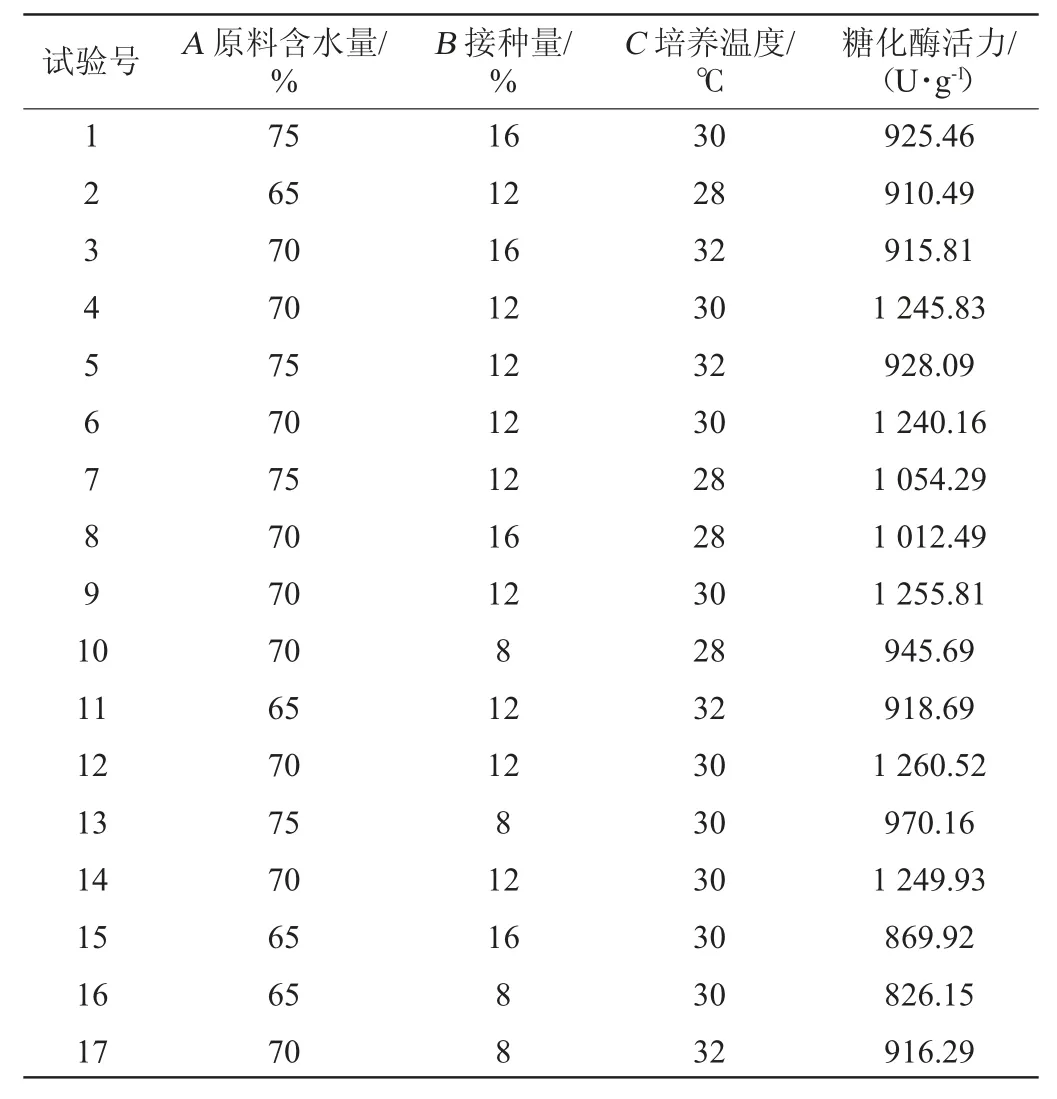
表3 發(fā)酵條件優(yōu)化Box-Behnken試驗設計及結果Table 3 Design and results of Box-Behnken experiments for fermentation conditions optimization
2.6.2 模型方差分析及響應面分析
采用Design Expert 8.0.6軟件對表4數據進行二次回歸方程擬合,得到糖化酶活力(Y)對原料含水量(A)、接種量(B)及培養(yǎng)溫度(C)的多元二次回歸方程:Y=1 250.45+44.09A+8.17B-30.51C-22.12AB-33.60AC-16.82BC-173.60A2-178.92B2-123.96C2。
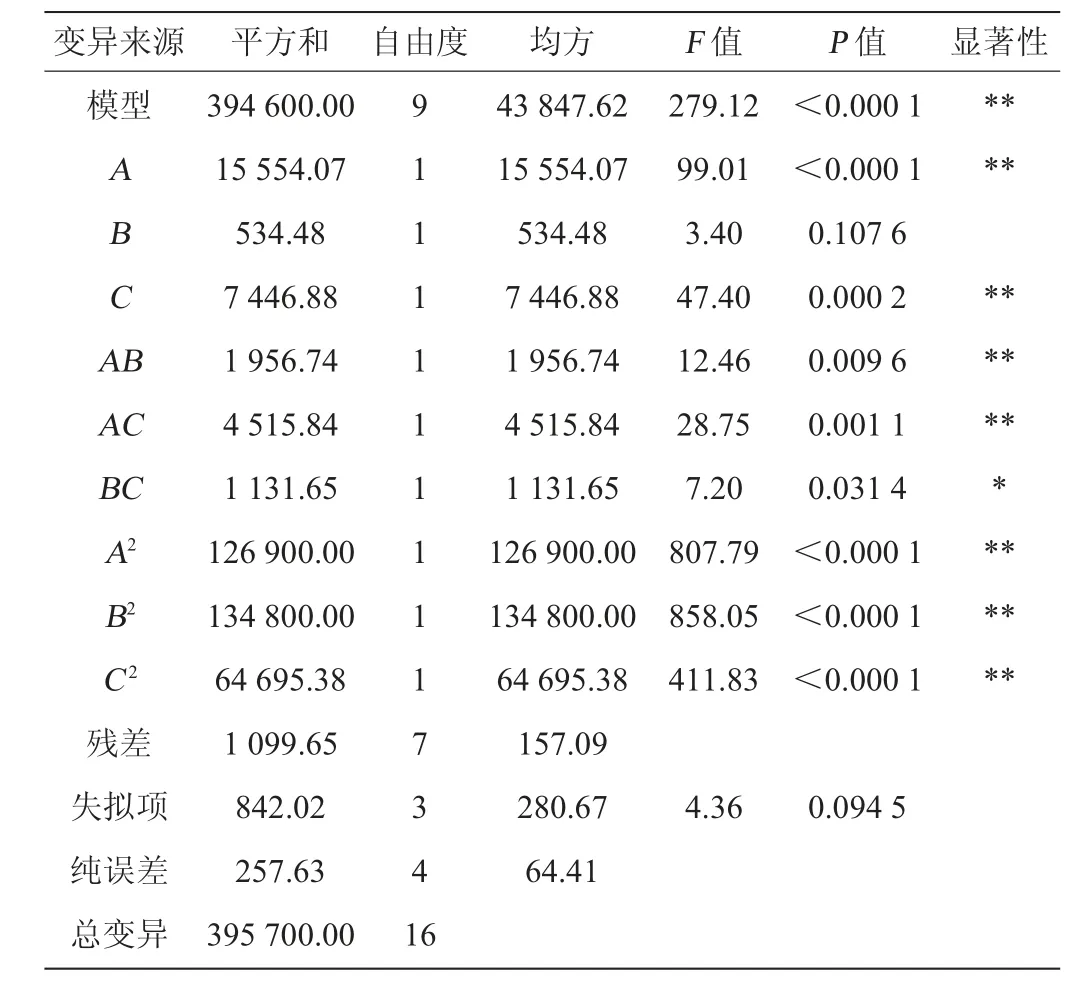
表4 響應面試驗回歸模型方差分析Table 4 Variance analysis of regression mode for response surface experiments
從表4可看出,模型極顯著(P<0.000 1),失擬項不顯著(P=0.094 5>0.05),決定系數R2=0.964 9,說明有96.49%的響應值變化可以用模型來解釋;變異系數(coefficient of variation,CV)為1.22%,說明變異(偏離)程度較小。因此,該回歸模型預測值與實測值有較好的擬合水平,適用于對白曲霉固態(tài)發(fā)酵條件進行分析和預測。
2.6.3 各因素響應面交互作用分析
根據回歸方程繪制響應面分析圖,以確認原料含水量、接種量和培養(yǎng)溫度對糖化酶活力的影響,響應面曲面和等高線見圖9。
通過Design Expert 8.0.6軟件分析,在250 mL三角瓶中加入麩皮25 g、糠殼15%、培養(yǎng)時間5 d的基礎條件下,最佳發(fā)酵條件為原料含水量70.70%、接種量12.08%、培養(yǎng)溫度29.71 ℃,此時糖化酶活力的理論值為1 255.80 U/g。
考慮到實際操作可行性,本試驗在250 mL三角瓶中加入麩皮25 g、糠殼15%、培養(yǎng)時間5 d的基礎條件下調整發(fā)酵最優(yōu)條件為原料含水量70%、接種量12%、培養(yǎng)溫度30 ℃。
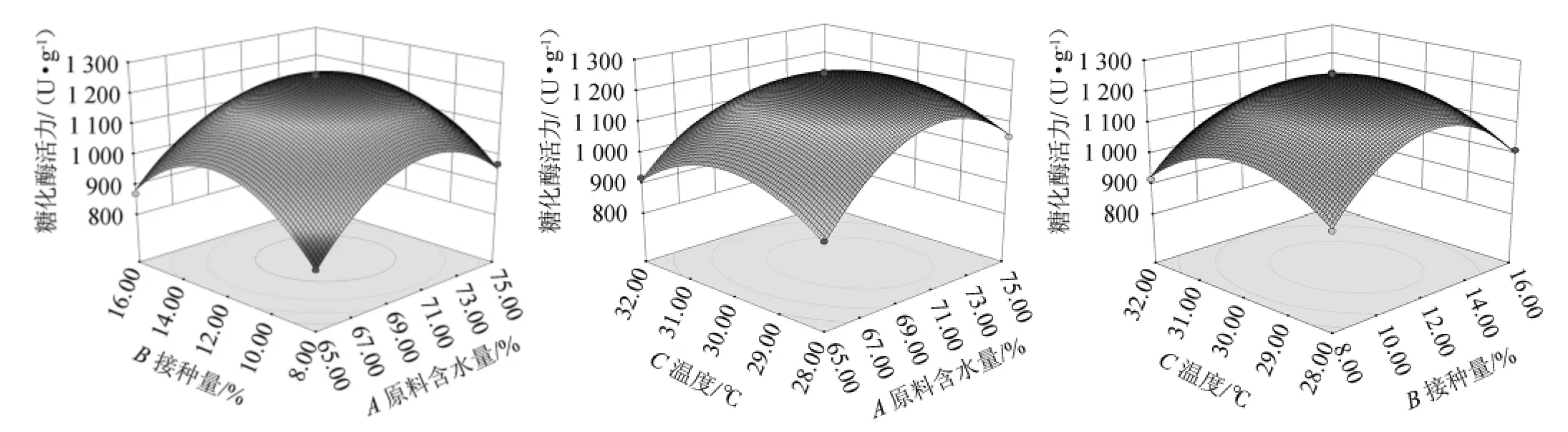
圖9 各因素交互作用對曲糖化酶活力影響的響應面和等高線圖Fig.9 Response surface plots and contour lines of effects of interaction between each factor on glucoamylase activity
2.6.4 模型驗證
依據上述通過響應面分析獲得的最優(yōu)發(fā)酵條件方案對突變株B5進行發(fā)酵試驗驗證,測得的糖化酶活力為(1254.17±6.14)U/g,較優(yōu)化前提高了19.41%,驗證結果與響應面試驗預測結果基本一致,說明所構建模型能夠較真實反映各因素對糖化酶活力的影響,優(yōu)化條件方案可行。
3 結論
本研究利用UV-ARTP對白曲霉Nz 3.602進行復合誘變處理,在紫外線照射12 min,ARTP處理40 s的條件下,獲得了一株高產糖化酶白曲霉菌株B5。經響應面優(yōu)化菌株的發(fā)酵條件,結果表明,在250 mL三角瓶中加入麩皮25 g,糠殼15%、培養(yǎng)時間5 d的基礎條件下,獲得最優(yōu)發(fā)酵條件為原料含水量70%、接種量12%和培養(yǎng)溫度30 ℃。在此條件下菌株B5糖化酶活力達到(1 254.17±6.14)U/g,較出發(fā)菌株提高了121.54%,且遺傳穩(wěn)定性能良好。為白曲霉在生產實踐中的應用提供了優(yōu)良菌種來源和理論依據。

