不同成瘤性MDCK細胞中SQSTM1的差異表達驗證
敖慧娟,郭壽清,阿依木古麗·阿不都熱依木,楊 琨,喬自林,王家敏*
(1.西北民族大學 生物醫學研究中心 甘肅省動物細胞技術創新中心,甘肅 蘭州 730030 ;2.西北民族大學 生物醫學研究中心 生物工程與技術國家民委重點實驗室,甘肅 蘭州 730030 ;3.西北民族大學 生命科學與工程學院,甘肅 蘭州 730030 )
MDCK細胞系由Madin和Darby于1958年從美國Cocker Spaniel 母曲架犬的腎臟中分離培育建立,通常是以貼壁方式生長的上皮樣細胞。由于其病毒感染效率高、增殖快,不易變異,且適應與無血清的生長條件,MDCK細胞系被公認為最適于甲、乙型流感病毒疫苗生產的3種細胞系之一[1-3]。由于MDCK細胞本身具有較高的成瘤性,用其生產疫苗的安全性一直存在著爭議[4,5]。據報道,MDCK細胞的成瘤表型是未知的,在誘發上皮-間充質轉化和間充質-上皮轉化的過程中都在誘導干細胞特性,且在腫瘤發生發展,遷移侵襲和轉移中起作用[6]。近年來,科學家一直在嘗試確定MDCK細胞作為流感疫苗基質的安全性,以便獲得無腫瘤/低腫瘤的MDCK單克隆細胞株用于流感疫苗的開發,本課題組通過單細胞克隆培養和篩選,得到了數株低成瘤性的MDCK細胞株,將其與實驗室已有的高成瘤性細胞株一并做高通量分析發現,某些經典的腫瘤通路被靶基因激活,其中lncRNA MSTRG.1056.2直接調控ERBB3激活PI3K-Akt通路,促進腫瘤發生[7,8]。
SQSTM1蛋白被證實與腫瘤的發生、發展密切有關,該蛋白包含促進與許多信號激活因子相互作用的結構域。3LC3相互作用區域(LIR)的存在使SQSTM1與LC3結合,泛素相關結構域(UBA)與泛素結合以介導選擇性降解,SQSTM1的這種細胞質活性取決于其UBA結構域,但不依賴于其與自噬蛋白LC3的相互作用[9]。研究發現SQSTM1聚集于肝細胞癌、胰腺癌、腎癌、肺腺癌以及結直腸癌等多種腫瘤中,且SQSTM1參與多種信號通路,因此其細胞水平至關重要[10]。
SQSTM1在乳腺癌腫瘤干細胞高表達進而誘導腫瘤復發和耐藥,在腫瘤細胞和腫瘤基質中的表達相反,高表達于腫瘤細胞中,而在腫瘤基質中表達水平下調,提示SQSTM1在腫瘤微環境中發揮了重要作用[10]。因此,對不同成瘤性MDCK細胞中SQSTM1的差異表達及功能的研究具有重要意義。
1 方法
1.1 不同成瘤性細胞的復蘇與培養
本實驗所選取的不同成瘤性細胞株是由課題組在前期實驗中馴化所得。前期裸鼠成瘤性實驗中發現:從ATCC引進的貼壁型MDCK-A和由其馴化所得懸浮型MDCK-B在裸鼠成瘤性實驗中的成瘤率均高達100%(10/10);而將MDCK-A通過有限稀釋法制備得到的貼壁型單克隆細胞株MDCK-C的裸鼠成瘤率為10%(1/10);MRC-5細胞由蘭州民海生物工程有限公司贈送,其裸鼠成瘤率為0%(0/10)。因此,選用MRC-5作為陰性對照。
將本實驗室已有的不同成瘤性MDCK細胞從液氮罐中取出,置于37℃溫水中直至完全融化,將懸浮型MDCK-B用無血清培養基置于37℃,5%二氧化碳,轉速為120 r/min的搖床上培養,并將貼壁型細胞MDCK-A,MDCK-C,用含10%新生牛血清的DMEM完全培養基,對照組MRC-5細胞含10%新生牛血清的MEM培養基,用置于37℃,5%二氧化碳恒溫培養箱中培養。
1.2 TRIzol Reagent 總RNA提取
棄掉細胞培養瓶中的培養液,用PBS洗3遍,并吸去殘余的PBS。加入TRIzol試劑,用槍尖用力吸打裂解細胞,室溫放置5 min以徹底解離蛋白復合體。將細胞與裂解液分裝至2個1.5 ml的已高壓的無RNA酶PE管中,加入氯仿使其與TRIzol的體積比為1:5。用力上下搖20 s左右,室溫靜置3~5 min,再用4℃離心機12 000×g離心10~15 min,并小心吸取上層水相到新的已高壓的無RNA酶PE管中,加入100%異丙醇到水相中,使得異丙醇與TRIzol的體積比為1:2。室溫放置8~10 min以沉淀RNA。再用4℃離心機12 000×g離心8~12 min后,小心棄上清,防止將RNA沉淀一并棄掉。同1 ml75%的無水乙醇漂洗RNA沉淀,即無水乙醇與TRIzol的體積比為1:1。將無水乙醇中的RNA在4℃離心機中以7 500~8 000×g離心5~6 min。小心吸去無水乙醇,并打開EP管的蓋子,室溫干燥RNA沉淀5~8,注意不可完全干燥。用DEPC水30~50μl溶解RNA沉淀,用槍尖反復吹打以徹底增加RNA溶解。吸取1~3μl RNA測量所提RNA樣品A260/A280的OD值。
1.3 Real Time PCR
在做Real Time PCR 之前,需要將樣品RNA反轉錄為cDNA,艾科瑞生物公司的EVO M-MLV反轉錄試劑盒,具體反應體系見表1、表2。

表1 去除gDNA試劑及反應體系
混勻后短暫的離心,再將樣品放入PCR 儀中42 ℃2 min。取出樣品放置在冰上加入發轉錄試劑。

表2 反轉錄試劑及反應體系
混勻后短暫的離心,再將樣品放入PCR 儀中37℃15 min,85℃5 s,以上過程就是將樣品RNA反轉錄為cDNA的全過程。將得到的cDNA保存于零下20℃。利用Primer 5.0軟件根據目的基因設計所需要的引物,基因引物信息見表3。

表3 基因引物序列信息
將引物系列送到甘肅一棵樹生物有限公司合成后,再用GeneCopoeia,Inc.的All-in-OneTMqPCR Mix-實時熒光定量PCR檢測試劑盒對目的基因進行檢測。其反應體系見表4。反應條件為:95℃預變性10 min,95℃變性10 s,60℃退火20 s,72℃延伸15 s,95℃10 s到72℃ 15 s 40個循環,溶解曲線分析為65 ℃ 10 s,95 ℃ 20 s,每個樣品至少做了3個平行組。隨后搖勻,瞬時離心后,用BIO-RAD CFX96TMReal-Time System 分析目的基因在不同成瘤性MDCK 細胞中的表達量。2 h后可以根據反應結果使用相對定量分析 F=2-ΔΔCt進行數據分析。其計算方法為ΔCt=目的基因 Ct 值 - 內參基因 Ct 值 ;-ΔΔCt=對照組ΔCt平均值-各樣品ΔCt值;最后2-ΔΔCt反映各樣品相對對照組樣品目的基因的相對表達水平。利用GraphPad Prism 5作圖分析目的基因的表達量并作差異性分析。
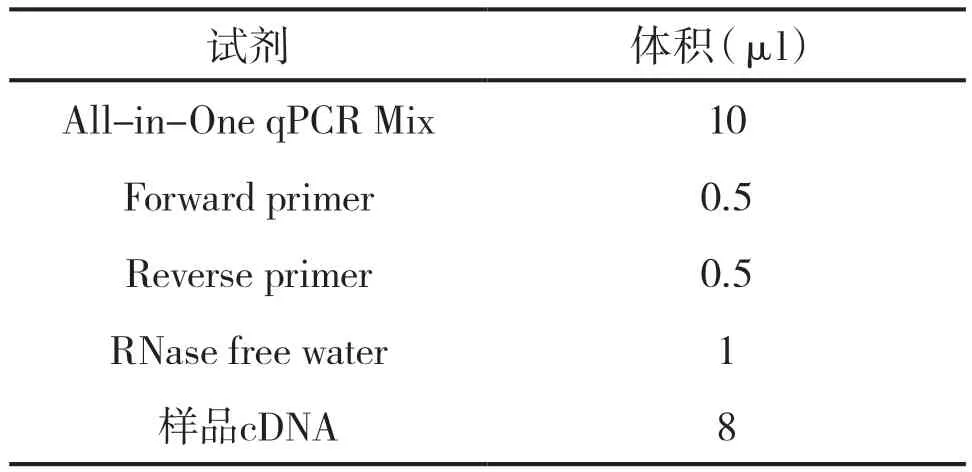
表4 熒光定量PCR反應體系
2 結果
2.1 不同成瘤性細胞的復蘇與培養
根據細胞生長條件需要,對不同細胞采用不同的培養條件進行培養。將貼壁細胞培養48 h后置于顯微鏡下用4倍目鏡觀察細胞的生長狀況,如圖1所示,發現所培養細胞生長狀態良好,細胞輪廓清晰,懸浮細胞的活力高、結團少、均一性好。其中MRC-5(圖A)成纖維狀生長;貼壁型MDCK-A(圖B)成上皮樣生長;懸浮型MDCK-B(圖C)呈圓形懸浮生長于無血清培養基中,MDCK-C(圖D)成上皮樣生長;可用于后續實驗。

圖1 細胞的復蘇與培養結果
2.2 TRIzol Reagent 提取不同成瘤性細胞總RNA的純度分析
將提取的RNA進行純度分析發現,所有樣品OD值均在1.8~2.0之間,可用于后續實驗。具體結果見表5。
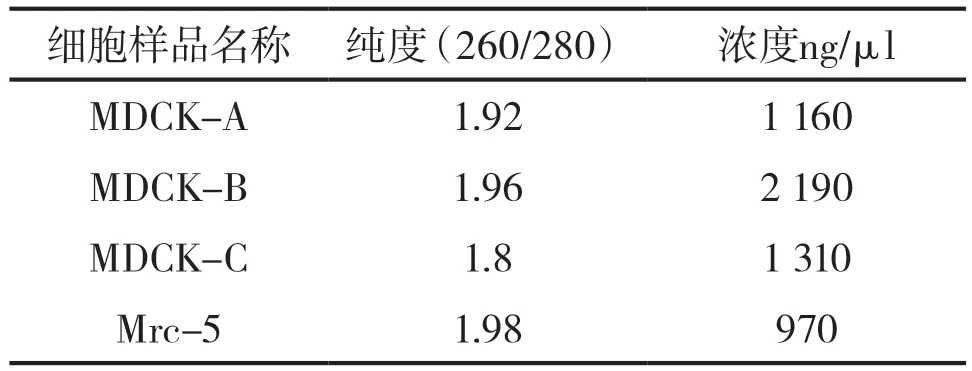
表5 樣品純度檢測結果
2.3 不同成瘤性細胞中SQSTM1基因表達量的分析
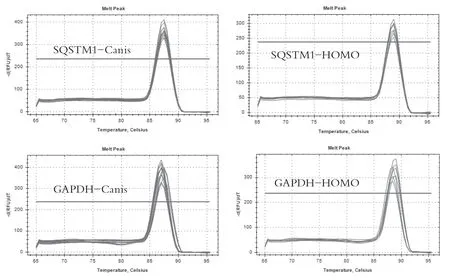
圖2 引物特異性結果
RT-PCR檢測結果顯示:所設計的引物特異性高,定量結果重復性好(見圖2),以MRC-5為對照組,發現SQSTM1在高成瘤性MDCK-A和MDCK-B中高表達,而在低成瘤性細胞株MDCK-C中較高成瘤性組大大降低(見圖3)。說明SQSTM1在細胞內的表達量可能與細胞成瘤性成正相關,可為進一步研究SQSTM1在MDCK細胞成瘤性的作用機制研究提供理論參考。
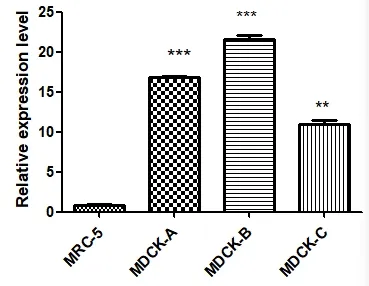
圖3 不同成瘤性細胞中SQSTM1的表達結果
3 討論
在本研究中,挑選了前期實驗室凍存的不同成瘤性細胞,旨在探究SQSTM1在不同成瘤性細胞中的表達量關系,進而為利用基因工程手段構建穩定的低成瘤細胞系奠定基礎。結果表明:SQSTM1在高成瘤性MDCK細胞株MDCK-A和MDCK-B中的表達量遠高于低成瘤性細胞株MDCK-C。這由MDCK細胞群的多樣性擴展到了其成瘤性蛋白表達的差異,并為進一步開展SQSTM1在MDCK細胞中的成瘤性機制研究提供了參考信息。
MDCK細胞的成瘤性包括多個成瘤相關基因和抑癌基因的參與,從而導致細胞機制發生改變。據報道,將癌基因v-src轉染到MDCK細胞后下調了細胞間的粘附,并刺激膠原凝膠的侵襲,導致細胞表型發生上皮-間充質的轉變[11]。檢測細胞表面明膠酶A其受體MT1-MMP的表達。發現MDCK細胞中原明膠酶A由潛伏狀態變為活化狀態,進而促進裸鼠成瘤[12]。另外ADAMTS12在MDCK細胞中可通過阻斷Ras-MAPK信號通路的激活來阻止肝細胞生長因子(HGF)的成瘤作用,并且該調控涉及金屬蛋白酶的血小板反應蛋白域。揭示ADAMTS12金屬蛋白酶通過調節依賴于Ras的ERK信號通路顯示抗腫瘤作用[13]。Galectin-8是在人類組織和癌癥中表達最廣泛的半乳糖凝集素之一。在之前的研究中Galectin-8具有抗腫瘤作用,誘導腫瘤細胞生長停滯和凋亡或抑其遷移和腫瘤的生長。但是將Galectin-8轉染至MDCK中發現,Galectin-8可以通過FAK/EGFR/蛋白酶體途徑誘導部分上皮-間質轉化,具有侵襲性成瘤能力[14]。
SQSTM1 在轉移性乳腺癌中高表達,可促進乳腺癌細胞的侵襲表型,其過表達與不良預后相關,干擾 SQSTM1可抑制乳腺癌的轉移,并降低體內成瘤性[15]。SQSTM1的過表達可導致異常信號的激活和包括腫瘤發生的疾病。在生長因子誘導的正常細胞和腫瘤細胞EMT中積累。SQSTM1增加了參與EMT的TGFb信號和轉錄因子介體的穩定性[9]。但SQSTM1在MDCK細胞成瘤性的研究中少有報道。本研究結果可用于將來表征不同MDCK細胞的克隆及馴化,為研究MDCK細胞腫瘤生物學特征,以及評估MDCK細胞作為疫苗生產的試劑等目的提供了基礎。

