蒸煮溫度對羊肉肌原纖維蛋白特性的影響
陳春梅 陸辰燕 沈銀涵 劉玥 劉瑞 于海 席軍 林廣桃


摘 要:通過測定羊肉的蒸煮損失率、pH值、色澤、質構、蛋白降解狀況、脂肪氧化情況及微觀結構,研究不同蒸煮溫度(中心溫度分別為20、50、60、70、80、90 ℃)對羊肉肌原纖維蛋白特性的影響。結果表明:蒸煮損失率隨著蒸煮溫度的升高而升高,由20 ℃處理組的0.90%升至90 ℃處理組的最高值41.47%;硬度、內聚力和咀嚼性均在80 ℃時出現峰值;硫代巴比妥酸反應物值在中心溫度升高至70 ℃后呈下降趨勢;亮度值(L*)和黃度值(b*)分別在70、60 ℃時達到最大,紅度值(a*)呈下降趨勢;十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)圖譜中,分子質量36~130 kDa的蛋白質發生降解產生小分子肽;掃描電子顯微鏡觀察結果表明,隨著中心溫度的升高,肌纖維之間的間隙逐漸增大,70 ℃時最大,之后隨中心溫度的升高逐漸縮小,且造粒和崩解現象加劇。因此,羊肉蛋白結構及微觀結構在蒸煮過程中會因蒸煮溫度變化而發生改變,從而對羊肉品質造成影響。
關鍵詞:羊肉;溫度;嫩度;十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳;微觀結構
Abstract: The effects of different cooking temperatures (internal temperatures of 20, 50, 60, 70, 80 and 90 ℃) on the properties of mutton myofibrillar proteins were studied by measuring the cooking loss rate, pH value, color, texture, protein degradation, fat oxidation and microstructure. The results showed that the cooking loss rate increased from 0.90% to 41.47% with increasing cooking temperature from 20 to 90 ℃. The hardness, cohesion and chewiness all peaked at 80 ℃. The thiobarbituric acid reactive substances (TBARs) value reached the maximum value at 70 ℃ and then decreased at higher temperatures. The brightness value (L*) and yellow value (b*) reached the maximum value at 70 and 60 ℃, respectively, while the redness value (a*) always showed a downward trend. Sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE) showed that the proteins with molecular mass of 36–130 kDa were degraded into small peptides. The results of scanning electron microscope (SEM) showed that the gap between muscle fibers gradually increased with increasing temperature up to 70 ℃, and then decreased at higher temperatures. Moreover, the degree of phenomenon of granulation and disintegration was aggravated. Therefore, during the cooking process of mutton, its protein structure and microstructure will change due to the change of temperature, affecting the change of mutton quality.
Keywords: mutton; temperature; tenderness; sodium dodecyl sulfate-polyacrylamide gel electrophoresis; microstructure
DOI:10.7506/rlyj1001-8123-20200426-104
中圖分類號:TS251.53? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? 文獻標志碼:A 文章編號:1001-8123(2020)07-0040-06
引文格式:
陳春梅, 陸辰燕, 沈銀涵, 等. 蒸煮溫度對羊肉肌原纖維蛋白特性的影響[J]. 肉類研究, 2020, 34(7): 40-45. DOI:10.7506/rlyj1001-8123-20200426-104.? ? http://www.rlyj.net.cn
CHEN Chunmei, LU Chenyan, SHEN Yinhan, et al. Effect of cooking temperature on the characteristics of mutton myofibrillar proteins[J]. Meat Research, 2020, 34(7): 40-45. DOI:10.7506/rlyj1001-8123-20200426-104.? ? http://www.rlyj.net.cn
隨著我國經濟的快速發展,羊肉消費量顯著提高。羊肉富含水分、蛋白質、脂肪、礦物質以及維生素等營養成分。羊肉中脂肪以及膽固醇含量顯著低于豬肉,是不飽和脂肪酸的良好來源[1]。同時羊肉的多汁性以及嫩度已成為現代消費者選擇羊肉的主要原因[2]。肉在食用前通常需要煮熟,因此了解煮熟過程中肉質的變化非常重要。烹煮羊肉的過程中,高溫促使蛋白質變性,從而影響營養和口感風味。Combes[3]、董晗[4]及王兆明[5]等研究不同蒸煮溫度下兔肉嫩度的變化發現,蒸煮溫度升高導致兔肉品質下降。吳利芬等[6]在研究加熱溫度和水分含量對豬肉品質的影響時發現,加熱溫度越高、水分含量越低,豬肉硬度越大。Roldán等[7]研究溫度對低溫真空蒸煮羊肉品質的影響,結果表明溫度越高羊肉品質越差,在掃描電子顯微鏡(scanning electron microscope,SEM)圖像中觀察到60 ℃時結締組織造粒、70 ℃時出現凝膠化。目前,對羊肉的研究主要集中在風味和貯藏品質等[8-9]方面,而羊肉在加熱過程中所發生的一系列變化并未詳細闡明。本實驗以蘇州湖羊為研究對象,分析不同蒸煮溫度對羊肉蒸煮損失率、pH值、色澤、質構、蛋白降解狀況、脂肪氧化及微觀結構的影響,旨在進一步闡明蒸煮溫度對羊肉肌原纖維蛋白特性的影響。
1 材料與方法
1.1 材料與試劑
8 月齡湖羊(公羊)后腿肉 蘇州太湖東山湖羊產業發展有限公司。
磷酸鹽緩沖溶液(pH 7.0) 賽默飛世爾科技公司;10%十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)凝膠超快速配制試劑盒?上海碧云天生物技術有限公司;體積分數25%戊二醛、0.02 mol/L硫代巴比妥酸(thiobarbituric acid,TBA)?上海源葉生物科技有限公司;考馬斯亮藍染色溶液、0.1%乙二胺四乙酸(ehylene diamine tetraacetic acid,EDTA)、7.5%三氯乙酸(trichloroacetic acid,TCA) 生工生物工程(上海)股份有限公司。
1.2 儀器與設備
HH-ZK1單孔數顯水浴鍋 南京科爾儀器設備有限公司;Ultra TurraxT25 BASIS高速勻漿機 德國IKA公司;Infinite 200 PRO多功能酶標儀 瑞士Tecan公司;Sorvall ST16R高速冷凍離心機 美國賽默飛世爾科技公司;XL-30環境掃描電子顯微鏡 荷蘭皇家飛利浦公司;TMS-PRO食品質構儀 美國FTC公司;SC-80C全自動色差計 北京康光光學儀器有限公司;Gel Doc XR凝膠成像系統 美國Bio-Rad公司。
1.3 方法
1.3.1 樣品前處理
使用前將羊后腿肉于4 ℃解凍24 h,去除可見結締組織、脂肪和筋膜,切成長×寬×高為50 mm×50 mm×20 mm的肉塊并裝入蒸煮袋中。樣品分別浸入溫度(T+2) ℃(T為中心溫度)的水浴鍋中進行加熱,使用插入式溫度計測定肉樣中心溫度,當肉樣中心溫度分別達到50、60、70、80、90 ℃時,立即浸入冰水中降溫至中心溫度20 ℃。每個處理組3 個平行。
1.3.2 蒸煮損失率測定
將樣品修整后使用濾紙擦干表面水分,稱質量,然后將樣品按1.3.1節方法處理,取出處理后的樣品用濾紙擦干表面水分并記錄質量。根據式(1)計算蒸煮損失率。
式中:m1為蒸煮前質量/g;m2為蒸煮后質量/g。
1.3.3 pH值測定
稱取2.0 g樣品切碎后置于裝有20 mL 4 ℃蒸餾水的50 mL離心管中,經勻漿機高速(10 000 r/min)勻漿30 s后靜置30 min。pH計經過調零后置于樣品中,待數值穩定后記錄pH值。
1.3.4 質構特性測定
將樣品沿肌纖維方向切成10 mm×10 mm×10 mm的小方塊,平行測定3 次。參數如下:圓柱形P/50A探頭,感應源25 N,壓頭直徑41 mm,測試速率120 mm/min,觸發力0.8 N,壓縮比50%,停留時間5 s。
1.3.5 色澤測定
肉樣切成長×寬×高為5 cm×5 cm×1 cm的肉塊,使用色差計進行測定。測定前使用標準白色樣品板及黑色樣品板調零,然后測定樣品紅度值(a*)、黃度值(b*)及亮度值(L*),每個樣品測定3 次,結果取平均值。
1.3.6 肌原纖維蛋白的提取
參考Wu Mangang等[10]的方法并稍作修改。稱取2.0 g肉切碎放入50 mL離心管中,加入10 倍體積的4 ℃磷酸鹽緩沖溶液(pH 7.0)勻漿2 次,每次15 s,間歇30 s,2 000×g離心20 min,棄上清液。重復上述步驟,共離心3 次。用0.1 mol/L NaCl溶液洗滌3 次,相同條件下再次離心,沉淀即為肌原纖維蛋白。
1.3.7 肌原纖維蛋白的十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析將6 mg/mL肌原纖維蛋白樣品與2×上樣緩沖液以體積比1∶1混勻,于100 ℃下水浴10 min。采用4%濃縮膠、15%分離膠,上樣量為15 μL。濃縮膠電壓90 V、電泳時間30 min,分離膠電壓120 V、電泳時間60 min。電泳結束后,取下膠使用考馬斯亮藍染色溶液進行染色、搖床脫色,拍照成像。
1.3.8 硫代巴比妥酸反應物(thiobarbituric acid reactive substances,TBARs)值測定參考李夢琪等[11]的方法并稍作修改。取5.0 g肉樣切碎后置于藍帽瓶中并加入30 mL 7.5% TCA溶液(含0.1% EDTA),7 000 r/min高速勻漿2 min,雙層濾紙抽濾2 次;取5 mL濾液加入5 mL 0.02 mol/L TBA溶液,90 ℃水浴40 min;冷卻后2 000×g離心5 min,取上清液并加入5 mL氯仿搖勻,靜置后取上清液分別于532、600 nm波長處測定吸光度。結果以每千克肉樣中所含丙二醛質量表示,TBARs值按式(2)計算。
式中:A532 nm為樣品在532 nm波長處吸光度;A600 nm為樣品在600 nm波長處吸光度;m為樣品質量/g。
1.3.9 SEM觀察肌原纖維蛋白微觀結構
羊肉蒸煮后沿肌纖維方向切成長×寬×高為1 cm×1 cm×3 cm的條狀,將切好的樣品置于-196 ℃液氮中迅速冷凍。冷凍后垂直于肌纖維方向迅速切成厚5 mm的片狀,置于2.5%戊二醛溶液(由0.1 mol/L磷酸鹽緩沖液配制)中,4 ℃下固定3 d。固定完成后使用0.1 mol/L磷酸鹽緩沖液清洗3 次,每次15 min,用體積分數30%、50%、70%、80%、90%、95%乙醇、無水乙醇、無水乙醇(含無水硫酸鈉)逐級脫水,每次15 min,干燥、噴金處理。
1.4 數據分析
采用Excel軟件統計數據;采用SPSS 16.0軟件進行結果統計分析,采用Duncans新復極差法進行多重比較,在0.05水平上進行顯著檢驗(P<0.05);使用Origin 18.5軟件進行繪圖。
2 結果與分析
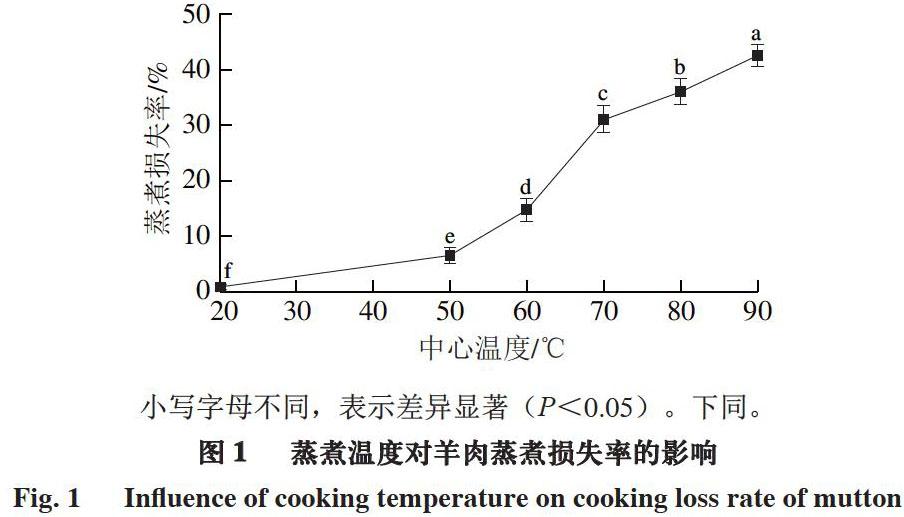
2.1 蒸煮溫度對羊肉蒸煮損失率的影響
加熱導致羊肉中水分含量降低汁液流失和體積變小。系水力是影響肉品多汁性以及嫩度的重要因素,主要通過蒸煮損失率來體現。蒸煮過程中羊肉汁液大量損失,并以溫度和時間為依賴因素[12]。由圖1可知,隨著中心溫度的升高,羊肉的蒸煮損失率顯著增大。中心溫度20 ℃時,羊肉的蒸煮損失率最小(0.90%),之后隨中心溫度的升高不斷增大,中心溫度90 ℃時達到最大(41.47%)。這與Vaudagna等[13]的研究結果一致,即低溫真空蒸煮過程中,牛肉的蒸煮損失率在45~80 ℃范圍內隨溫度的升高而增大,80 ℃后蒸煮損失率逐漸減小。肉品在熱處理過程中的汁液流失現象與肌原纖維蛋白變性有關[14]。研究發現,溫度低于60 ℃的肉類汁液流失主要與熱變性肌漿蛋白等物質隨自由水分流出以及膠原蛋白收縮有關[15]。溫度高于60 ℃的汁液流失一部分是由于肌動蛋白、肌球蛋白變性,另一部分是由于膠原蛋白交聯度降低形成明膠析出所致[16-17]。
2.2 蒸煮溫度對羊肉pH值的影響
由圖2可知,隨著中心溫度的升高,羊肉pH值整體呈上升趨勢。在50~60 ℃期間,pH值呈下降趨勢,隨后在60~90 ℃呈上升趨勢。pH值與肉中水分含量相關,在蒸煮過程中水分流失會帶走一部分乳酸,可能會對羊肉pH值造成影響[18]。加熱過程中羊肉pH值的增大可能是由于加熱導致蛋白變性引起酸性基團減少,也可能是由于肌肉中的水分被蛋白束縛住[19-20]。50~60 ℃期間pH值下降可能與脂肪水解形成脂肪酸有關。
2.3 蒸煮溫度對羊肉質構的影響
質構特性是評價肉品品質尤其是嫩度的重要指標[21]。硬度是肌肉保持形狀的結合力,彈性是肌肉經外力作用后的復原能力,內聚力是肌肉抵抗咀嚼受損保證其完整性的能力,咀嚼性則是上述三者的綜合表現[22]。由表1可知,羊肉硬度隨中心溫度的升高呈現先升高后下降的趨勢,在80 ℃時達到最大(P<0.05)。羊肉彈性隨著中心溫度的升高呈現上升的趨勢。黏附性、內聚力、膠黏性和咀嚼性的變化趨勢和硬度相似。影響肉品質構特性的因素很多,但主要因素為水分含量、蛋白質組分、肌纖維特性和溫度[12]。中心溫度低于80 ℃時,咀嚼性增大的原因可能是由于結締組織和肌原纖維蛋白變性增加了膠原蛋白含量以及縮小了肌纖維空隙[23]。當中心溫度超過80 ℃后,結締組織降解使肌肉組織變得松散,硬度下降[23]。
2.4 蒸煮溫度對羊肉脂肪氧化的影響
TBARs值作為衡量脂質氧化的標準之一,通過量化脂肪氧化次級產物丙二醛的含量來檢測肉類脂質氧化程度[20]。由圖3可知,中心溫度低于70 ℃時,TBARs值呈上升趨勢,當中心溫度高于70 ℃時,TBARs值呈下降趨勢。李夢琪等[11]研究表明,加熱導致真空低溫烹飪雞胸肉TBARs值增加,且在65~85 ℃范圍內隨加熱溫度的升高TBARs值呈下降趨勢,這可能是由于丙二醛與羊肉中蛋白質、氨基酸等含氨基化合物作用導致丙二醛含量下降。
2.5 蒸煮溫度對羊肉色澤的影響
肉色是影響消費者食欲的重要因素,溫度會影響肉色的變化。羊肉色澤主要受肌紅蛋白的影響。由圖4可知,隨著中心溫度的上升L*整體呈上升趨勢,70 ℃時達到最大。a*整體呈下降趨勢,b*整體呈上升趨勢且在60 ℃最大。這可能是由于隨著中心溫度的升高,羊肉蛋白變性,蒸煮損失率增大,汁液流失增大,水分聚集在肉樣表面,光照反射力增強,L*增大[22]。隨著中心溫度的升高肌肉中氧合肌紅蛋白中Fe2+被氧化成Fe3+,形成使肉色變成褐色的高鐵肌紅蛋白,使得a*下降、b*整體上升[27]。
2.6 蒸煮溫度對肌原纖維蛋白的影響
通過SDS-PAGE圖可以觀察不同蒸煮溫度下羊肉肌原纖維蛋白的變化。由圖5可知,隨著中心溫度的升高,分子質量36~130 kDa的部分蛋白發生降解,并產生了新的小分子肽。中心溫度70~90 ℃分子質量55~72 kDa、80~90 ℃分子質量10~17 kDa均出現了新的肽片段。同時,在250 kDa處出現蛋白條帶聚集的現象,這可能是由蛋白質氧化與脂質氧化和/或肌紅蛋白氧化結合所致[24-25]。
2.7 蒸煮溫度對羊肉微觀結構的影響
不同中心溫度對羊肉微觀結構的影響程度不同。由圖6可知,新鮮羊肉肌纖維結構完整,排列整齊。隨著中心溫度的升高,肌纖維間隙逐漸增大,70 ℃時間隙最大,隨后間隙逐漸縮小。隨著內部溫度升高,纖維排列緊湊主要歸因于水分流失、細胞膜破壞、纖維橫向收縮、凝膠形成以及結締組織收縮[26]。除了明顯的間隙變化外,結締組織的變化也尤為明顯。中心溫度60 ℃后,肌纖維表面出現顆粒物質,可能是由肌內膜和肌膜結構開始破裂引起。隨著溫度升高,造粒和崩解現象加劇。90 ℃時顆粒填充于肌肉纖維之間和肌肉纖維束之間[28]。Roldán等[7]發現隨著烹飪溫度的升高和時間的延長,結締組織會發生嚴重的變性進而形成凝膠,變性凝膠和其他微粒物質填補了空隙,導致肌肉緊繃。Qi Jun[12]和Benjakul[29]等研究發現,一些殘留的不溶性膠原蛋白會擠壓熱變性肌原纖維,使肌肉纖維間隙減小,光線照射時反射光增加,導致肉色更加明亮,與L*結果基本相似。
3 結 論
不同蒸煮溫度下羊肉蛋白的相關特性發生了顯著變化:蒸煮損失率隨著羊肉中心溫度的升高顯著增大(P<0.05);TBARs值、pH值、色澤、質構特性以及微觀結構均隨中心溫度的增加而發生變化,造成這些變化最主要的原因可能是肌原纖維蛋白的變化。肌原纖維蛋白作為肌肉中的主要結構蛋白,能夠通過毛細作用保持肉中水分。當肌肉被加熱時,蛋白變性并釋放出被包裹的汁液,影響熟肉的色澤。結締組織的增溶作用和肌原纖維蛋白的熱變性共同改善了肉的嫩度。脂肪氧化產物可以直接或間接與蛋白質發生反應,如脂肪氧化產物氫過氧化物和醛類可以與賴氨酸反應生成吡咯衍生物,脂質氧化產物與氨基酸殘基反應所生成的產物會引起蛋白質交聯。由于蛋白質的交聯與聚集會對隨后的蛋白質消化率產生負面影響,因此進一步研究蛋白質的變化將是很有意義的。
參考文獻:
[1] OBERT C C, PAYAM V, VOSTER M, et al. Nutritional enhancement of sheep meat fatty acid profile for human health and wellbeing[J]. Food Research International, 2018, 104: 25-38. DOI:10.1016/j.foodres.2017.05.005.
[2] ERIN L V B, CHARLES S F, DONNA N, et al. Marine ω-3 polyunsaturated fatty acid and fish intake after colon cancer diagnosis and survival: CALGB 89803 (Alliance)[J]. Cancer Epidemiology, Biomarkers and Prevention, 2018, 27(4): 438-445. DOI:10.1158/1055-9965.EPI-17-0689.
[3] COMBES S, LEPETIT J, DARCHE B, et al. Effect of cooking temperature and cooking time on Warner-Bratzler tenderness measurement and collagen content in rabbit meat[J]. Meat Science, 2004, 66(1): 91-96. DOI:10.1016/S0309-1740(03)00019-6.
[4] 董晗, 張牧焓, 諸永志, 等. 不同加熱溫度對兔肉肉質的影響[J].?江西農業學報, 2012, 24(5): 167-169. DOI:10.3969/j.issn.1001-8581.2012.05.052.
[5] 王兆明, 賀稚非, 余力, 等. 加熱后兔肉中心溫度的變化對其品質特性的影響[J]. 食品科學, 2015, 36(19): 67-71. DOI:10.7506/spkx1002-6630-201519012.
[6] 吳利芬, 張立彥, 汪媛, 等. 加熱溫度和含水量對豬肉及其蛋白質特性的影響[J]. 肉類研究, 2018, 32(10): 12-18. DOI:10.7506/rlyj1001-8123-201810003.
[7] ROLD?N M, ANTEQUERA T, MART?N A, et al. Effect of different temperature-time combinations on physicochemical, microbiological, textural and structural features of sous-vide cooked lamb loins[J]. Meat Science, 2013, 93(3): 572-578. DOI:10.1016/j.meatsci.2012.11.014.
[8] ARSHAD M S, SOHAIB M, AHMAD R S, et al. Ruminant meat flavor influenced by different factors with special reference to fatty acids[J]. Lipids in Health and Disease, 2018, 17(1): 1-13. DOI:10.1186/s12944-018-0860-z.
[9] MUELA E, MONGE P, SA?UDO C, et al. Sensory quality of lamb following long-term frozen storage[J]. Meat Science, 2016, 114: 32-37. DOI:10.1016/j.meatsci.2015.12.001.
[10] WU Mangang, XIONG YoulingL., CHEN Jie. Rheology and microstructure of myofibrillar protein-plant lipid composite gels: effect of emulsion droplet size and membrane type[J]. Journal of Food Engineering, 2011, 106(4): 318-324. DOI:10.1016/j.jfoodeng.2011.05.022.
[11] 李夢琪, 孫思遠, 劉敏, 等. 加熱溫度和時間對真空低溫烹飪雞胸肉脂肪與蛋白質氧化的影響[J]. 肉類研究, 2018, 32(10): 6-11. DOI:10.7506/rlyj1001-8123-201810002.
[12] QI Jun, LI Xiao, ZHANG Wenwen, et al. Influence of stewing time on the texture, ultrastructure and in vitro digestibility of meat from the yellow-feathered chicken breed[J]. Animal Science Journal, 2018, 89(2): 474-482. DOI:10.1111/asj.12929.
[13] VAUDAGNA S R, S?NCHEZ G, NEIRA M S, et al. Sous vide cooked beef muscles: effects of low temperature-long time (LT-LT) treatments on their quality characteristics and storage stability[J]. International Journal of Food Science and Technology, 2002, 37(4): 425-441. DOI:10.1046/j.1365-2621.2002.00581.x.
[14] 鄭皎皎, 吳瓊, 王垚, 等. 鯉魚肌肉蒸制過程中的品質變化[J]. 食品與發酵工業, 2015, 41(1): 90-95. DOI:10.13995/j.cnki.11-1802/ts.201501018.
[15] 田旭, 何航, 揭曉蝶, 等. 不同煮制時間對豬肉品質及營養成分的影響[J]. 肉類工業, 2018(6): 25-29.
[16] KIM K H, KIM Y S, LEE Y K, et al. Postmortem muscle glycolysis and meat quality characteristics of intact male Korean native (Hanwoo) cattle[J]. Meat Science, 2000, 55(1): 47-52. DOI:10.1016/S0309-1740(99)00124-2.
[17] KONDJOYAN A, KOHLER A, REALINI C E, et al. Towards models for the prediction of beef meat quality during cooking[J]. Meat Science, 2014, 97(3): 323-331. DOI:10.1016/j.meatsci.2013.07.032.
[18] 計紅芳, 張令文, 王方, 等. 加熱溫度對鵝肉理化性質、質構與微觀結構的影響[J]. 食品與發酵工業, 2017, 43(3): 89-93. DOI:10.13995/j.cnki.11-1802/ts.201703016.
[19] SILVA J A, PATARATA L, MARTINS C. Influence of ultimate pH on bovine meat tenderness during ageing[J]. Meat Science, 1999, 52(4): 453-459. DOI:10.1016/S0309-1740(99)00029-7.
[20] 王海超, 張德權, 曹立創, 等. 質量等級對白羽肉雞肌肉質構特性的影響[J]. 食品科技, 2018, 43(4): 102-108.
[21] 章海風, 周曉燕, 鈐莉妍, 等. 煮制時間對驢肉不同部位食用品質的影響[J]. 美食研究, 2018, 35(4): 37-40. DOI:10.3969/j.issn.1009-4717.2018.04.008.
[22] LEWIS G J, PURSLOW P P. The strength and stiffness of perimysial connective tissue isolated from cooked beef muscle[J]. Meat Science, 1989, 26(4): 255-269. DOI:10.1016/0309-1740(89)90011-9.
[23] TAMILMANI P, PANDEY M C. Thermal analysis of meat and meat products[J]. Journal of Thermal Analysis and Calorimetry, 2016, 123(3): 1899-1917. DOI:10.1007/s10973-015-4696-8.
[24] PARK D, XIONG YoulingL., ALDERTON A L, et al. Biochemical changes in myofibrillar protein isolates exposed to three oxidizing systems[J]. Journal of Agricultural and Food Chemistry, 54(12): 4445-4451. DOI:10.1021/jf0531813.
[25] RIPOLL G, LOB?N S, JOY M. Use of visible and near infrared reflectance spectra to predict lipid peroxidation of light lamb meat and discriminate dams feeding systems[J]. Meat Science, 2018, 143: 24-29.?DOI:10.1016/j.meatsci.2018.04.006.

