基于生物金屬有機骨架封裝亞甲基藍復合材料和信號放大策略高靈敏檢測microRNA-141
王存 劉蕃鑫 惠俊敏 鄒曉川 鄧明川 鄭天平 劉林


摘?要?MicroRNA-141(miRNA-141)的檢測對相關癌癥的早期診斷和預后評估具有重要意義。本研究建立了一種無酶的生物傳感器,用于高靈敏檢測miRNA-141。首先,合成了具有多孔結構和良好生物相容性的生物金屬有機骨架(bio-MOF),通過離子交換的方式,bio-MOF可以封裝大量亞甲基藍(MB)信號分子,并保持其生物活性。其次,利用目標物循環信號放大策略中的催化發夾自組裝(CHA)、輔助目標miRNA-141循環,實現信號放大,進一步提高了傳感器的靈敏度。在1.0×1016~1.0×106 mol/L范圍內,目標miRNA-141濃度的對數與傳感器電化學信號呈線性相關,檢出限為3.3×1017 mol/L(S/N=3)。將此方法應用于健康人血清中miRNA-141檢測,加標回收率為99.9%~102.0%(RSD≤2.1%)。此生物傳感器簡單、可靠、靈敏度高、線性范圍寬,為高靈敏檢測其它miRNA提供了參考。
關鍵詞?生物傳感器; 催化發夾自組裝; 信號放大策略; MicroRNA-141; 生物金屬有機骨架; 亞甲基藍
1?引 言
MicroRNA-141(miRNA-141)是一種具有22個核苷酸的內源性、單鏈、非編碼RNA,參與細胞增殖、分化和凋亡過程[1]。miRNA-141的異常表達(下調或上調)通常與多種癌癥相關,如乳腺癌、胰腺癌、卵巢癌和前列腺癌等[2]。但是,miRNA-141具有分子量小和超低表達的特征,難以檢測。盡管傳統的分析方法,如Northern印跡雜交法[3]、熒光法[4]、微陣列分析法[5]和實時定量聚合酶鏈式反應(RT-PCR)[6]等,可以定量檢測miRNA-141,但這些方法通常存在費用高、耗時長、樣品前處理過程繁瑣和儀器操作步驟復雜等問題[7]。電化學生物傳感器具有靈敏度高、特異性好、操作簡單和背景信號低等優點[8],在檢測微量甚至痕量miRNA-141方面效果良好。Mo等[7]以Mn摻雜的CdS@ZnS量子點和卟啉錳(MnPP)為信號探針和敏化劑,結合雜交鏈式反應(HCR)信號放大策略,構建了無酶生物傳感器,實現了對miRNA-141的高靈敏檢測,檢出限達到3.3×1012 mol/L。Liu等[9]以9,10-二苯基蒽(DPA)納米立方體為信號探針,將DNA納米機器和目標物循環放大策略相結合,進一步提高了傳感器的靈敏度,該方法具有靈敏度高和選擇性好等優點,miRNA-141的檢出限為3.0×1017 mol/L。
生物金屬有機骨架(bio-MOF),作為金屬有機骨架(MOF)的一個新分支,屬于超分子化學和生物科學交叉學科研究范疇[10]。bio-MOF不僅具有MOF的周期性重復的通道結構、孔徑可調等優點,還具有環境友好、低毒、良好的生物相容性和獨特的仿生特性等優點[11]。特別是當bio-MOF孔徑和形狀與客體分子(如染料分子)相匹配時,可以將客體固定到bio-MOF骨架內。基于此,bio-MOF已成功應用于生物馬達[12]、藥物輸送[13]、電化學傳感器[14]、催化[15]和環境保護材料[16]等領域。如Chen等[17]將羅丹明封裝到bio-MOF的骨架中,用于二極管發光。Wang等[18]將熒光染料封裝到bio-MOF中,合成了熒光復合材料,可作為雙發射平臺,識別不同種類硝基爆炸物。Zhang等[19]通過調節bio-MOF中Tb3+和Eu3+的能量轉移過程,構建了用于檢測炭疽生物標志物的傳感器,具有生物相容性好、靈敏度高和選擇性好等優點。因此,bio-MOF替換傳統MOF應用于電化學生物傳感器具有重要的理論和實際研究意義。
近年來,各種核酸信號放大策略(如酶輔助的DNA納米機器[20]和核酸外切酶誘導的目標物循環放大策略[21]等)被用于傳感器的研制中,以提高傳感器的靈敏度。然而,這些酶輔助的核酸信號放大策略受緩沖液pH值和溫度等因素的影響較大。因此,發展高效、無酶、低成本的目標物循環放大策略具有重要意義。催化發夾自組裝(CHA)作為一種目標物循環放大策略,不需要任何酶的參與即可實現目標物循環放大,具有成本低和操作簡單等優點,在生物分析和生物傳感領域引起了廣泛關注。Xu等[22]制備了氮化碳納米片-金納米粒子(C3N4-AuNPs)納米復合材料修飾電極,結合CHA信號放大策略,實現了對miRNA-141的高靈敏檢測。Zhang等[23]設計了基于雙CHA信號放大策略的傳感器,實現了對miRNA-21和miRNA-155的同時檢測。
本研究合成了骨架內封裝了大量亞甲基藍信號分子的bio-MOF復合材料(MB@bio-MOF),通過聚乙烯亞胺(PEI)將金納米粒子引入到MB@bio-MOF表面(AuNPs-MB@bio-MOF)。隨后,通過Au-S鍵將發夾DNA 1(H1)和DNA 2(H2)分別固定到Au修飾的玻碳電極表面(H1/Au/GCE)和AuNPs-MB@bio-MOF表面(H2/AuNPs-MB@bio-MOF)。己硫醇(HT)封閉H1/Au/GCE中Au的非特異性吸附位點。當miRNA-141存在時,miRNA-141通過堿基互補配對將H1的發夾結構打開,使H1莖部的堿基序列暴露出來,暴露出來的堿基序列可以打開H2發卡結構,H1、H2進一步堿基互補配對可以將miRNA-141替換下來,使其進入下一個循環過程,如此不斷循環。目標物濃度越大,大量帶有MB信號分子的AuNPs-MB@bio-MOF復合材料被引入到電極表面,傳感器的電化學信號增大,基于此可實現miRNA-141的高靈敏檢測。
2?實驗部分
2.1?儀器與試劑
CHI66E電化學工作站(上海辰華儀器有限公司)。JSM-7800F掃描電子顯微鏡(日本電子株式會社)。實驗采用三電極系統:玻碳電極(GCE,直徑4 mm)為工作電極,鉑絲為對電極,飽和甘汞電極為參比電極。
腺嘌呤(Adenine,≥99%)、4,4′-聯苯二甲酸(BPDC,97%)、N,N-二甲基甲酰胺(DMF,99.5%)、三乙胺(TEA,≥99%)、二水合醋酸鋅(Zn(Ac)2·2H2O,99.99%)、HNO3(99%)、檸檬酸鈉(AA,98%)、亞甲基藍(MB,≥90%)、聚乙烯亞胺(PEI,50%)和HAuCl4·3H2O(99.9%)購自上海阿拉丁試劑公司。其它試劑均為分析純。健康人血清樣品來源于重慶市第九人民醫院。0.1 mol/L磷酸鹽緩沖溶液(PBS,pH 7.4)由Na2HPO4和KH2PO4配制,支持電解質為0.1 mol/L KCl。用DNA雜交和保存用緩沖液為含140 mmol/L NaCl、5 mmol/L KCl、1 mmol/L MgCl2的Tris-HCl緩沖液(0.1 mol/L,pH 7.4)。實驗用水為二次蒸餾水。所有寡聚核苷酸均由上海生工生物工程有限公司提供,具體序列詳見表1。所有發卡DNA使用之前均在95℃變性5 min,緩慢冷卻到室溫。
2.2?實驗方法
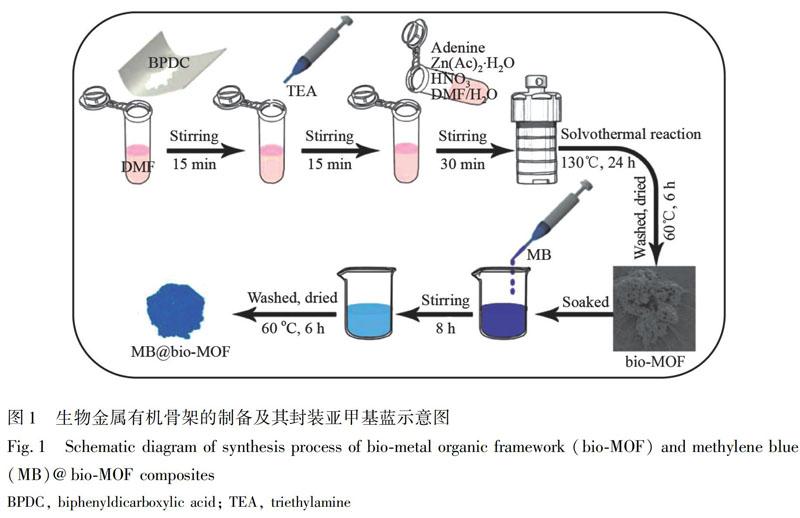
2.2.1?Bio-MOF的制備[17] BPDC(0.1211 g)加入到5 mL DMF中,攪拌15 min,然后加入TEA(4 mmol),繼續攪拌15 min。完全溶解后,加入腺嘌呤(0.0338 g)、Zn(Ac)2·2H2O(0.1646 g)、HNO3(0.125 mL)、DMF(22 mL)和水(2 mL),持續攪拌30 min后,將上述混合物轉移到50 mL 不銹鋼高壓反應釜中,130℃下反應24 h,得到白色的固體。冷卻至室溫,分別用DMF和無水乙醇離心洗滌5次,所得樣品置于60℃烘箱中干燥6 h,得到白色粉末,記為bio-MOF。
2.2.2?MB@bio-MOF的制備[24] 25 mg bio-MOF置于5 mL 5.0×103 mol/L MB溶液(溶劑為DMF)中,攪拌8 h,用DMF和無水乙醇各離心洗滌5次后,置于60℃烘箱中干燥6 h,得到藍色固體,記為MB@bio-MOF。 bio-MOF和MB@bio-MOF復合材料的制備過程如圖1所示。
2.2.3?AuNPs的制備[25] 在劇烈攪拌條件下,將1 mL AA(1%)迅速加入到100 mL沸騰的HAuCl4溶液(0.01%)中。持續攪拌10 min后,溶液變為酒紅色,冷卻,于4℃保存,備用。
2.2.4?AuNPs-MB@bio-MOF的制備?將20 μL PEI(1%)加入到1 mL水中,攪拌15 min。將5 mg MB@bio-MOF加入上述溶液中,室溫攪拌8 h。12000 r/min離心5 min,除去游離的PEI,將得到的固體重新分散到1 mL PBS(0.1 mol/L,pH 7.4)中。加入5 mL AuNPs溶液,攪拌30 min,通過AuN鍵將AuNPs固定到PEI修飾的MB@bio-MOF表面,離心,并重新分散到1 mL PBS中,得到AuNPs-MB@bio-MOF復合材料,室溫下保存。
2.2.5?信標復合物(H2/AuNPs-MB@bio-MOF)的制備
向1 mL含有5 mg AuNPs-MB@bio-MOF的PBS中加入100 μL發卡DNA 2(H2,10 μmol/L),4℃下攪拌過夜,通過AuS鍵將H2固定到AuNPs-MB@bio-MOF表面,得到H2/AuNPs-MB@bio-MOF復合物。
2.3?傳感器的構建
將GCE依次用0.3和0.05 μm的A12O3粉末打磨、拋光成鏡面,然后分別用無水乙醇和水超聲清洗,室溫下晾干,浸入1% HAuCl4溶液,0.2 V恒電位沉積30 s,得到納米金修飾電極(Au/GCE)。滴加10 μL 發卡DNA 1(H1,2 μmol/L),4℃孵育過夜,通過AuS鍵將H1修飾到Au/GCE表面。隨后,滴加10 μL己硫醇(HT,20 mmol/L)于電極表面,4℃孵育2 h,封閉Au的非特異性吸附位點(記為H1/Au/GCE)。將不同濃度miRNA-141(10 μL)和上述H2/AuNPs-MB@bio-MOF復合物(10 μL)先后滴到H1/Au/GCE表面,37℃下分別孵育2 h。miRNA-141濃度越大,電極表面引入的AuNPs-MB@bio-MOF信標復合物越多,傳感器的峰電流響應值越大,從而實現對miRNA-141的靈敏檢測(見圖2)。
3?結果與討論
3.1?bio-MOF的表征
由bio-MOF的掃描電鏡圖(圖3)可見,bio-MOF由若干花狀結構的球體組成,直徑約100 μm,此結果與文獻[12]一致。與陰離子型MOFs相似,本研究合成的bio-MOF骨架同樣帶負電荷[17,18,25]。其中,內源性的二甲銨陽離子(DMF分解的產物(CH3)2NH2+)易與外源性陽離子發生離子交換[17,26]。因此,本研究通過陽離子交換實驗將MB封裝到bio-MOF骨架內。
采用能量色散X射線光譜(EDX)進一步研究bio-MOF的組成及元素質量百分比。如圖4所示,bio-MOF由C、N、O和Zn元素組成,質量百分比分別為39.05%、5.48%、24.38%和31.10%。結果表明,bio-MOF成功合成。
采用X射線光電子能譜(XPS)分別研究了MB@bio-MOF和AuNPs-MB@bio-MOF的元素組成。由圖5可見,284.7、398.7、530.4和168.7 eV分別為C1s、N1s、O1s、和S2p的特征峰,1043.7和1020.9 eV屬于Zn2P3特征峰,89.4和92.2 eV屬于Au4f特征峰。結果表明,MB@bio-MOF和AuNPs-MB@bio-MOF復合材料成功合成。
3.2?傳感器組裝過程表征
在5 mmol/L Fe(CN)3/46的溶液中,采用循環伏安法(CV)和電化學阻抗譜(EIS)對不同修飾電極進行了表征。由圖6A可知,與裸GCE(曲線a)相比,Au/GCE(曲線b)峰電流值明顯增大,這主要歸因于Au的良好導電性。與H1孵育后,由于帶負電荷的探針Fe(CN)3/46與相同帶負電荷H1之間的靜電斥力作用[7],相比曲線a和b,H1/Au/GCE(曲線c)峰電流值明顯下降。滴加HT封閉Au非特異性結合位點后,由于HT導電性差,進一步阻礙了電子傳遞,峰電流值繼續下降(曲線d)。
EIS圖譜主要由高頻區的半圓和低頻區的直線組成,分別對應電子轉移(或動力學)控制過程和擴散控制過程,其中半圓直徑大小對應電子轉移電阻(Ret)[27]。由圖6B可知,Au/GCE(Ret=37 Ω,曲線b)阻抗小于裸GCE(Ret=73 Ω,曲線a),與H1和HT孵育后,H1/Au/GCE(Ret=570 Ω,曲線c)和HT/H1/Au/GCE(Ret=732 Ω,曲線d)的阻抗值依次增大。EIS圖譜與CV表征結果一致,表明目標電極制備成功。
3.3?可行性實驗
圖7為傳感器在目標物miRNA-141存在和不存在條件下的電化學響應曲線。當目標物不存在時(曲線a),傳感器沒有明顯的電化學響應。當目標物存在時(曲線b和c),在0.231和0.261 V產生一對明顯的氧化還原峰,且隨著目標物濃度增大,峰電流值逐漸增強,說明本方法可用于mRNA-141的檢測。miRNA-141存在時,H1的發卡結構被打開,觸發CHA循環,暴露出來的H1莖部堿基序列可以打開H2發卡結構,AuNPs-MB@bio-MOF復合物被引入到電極表面,傳感器出現較強的電化學響應信號。H1、H2進一步反應,可將miRNA-141替換下來,使其進入下一個CHA循環過程中,以此不斷循環,提高傳感器的檢測靈敏度。
3.4?傳感器的分析性能
不同濃度miRNA-141的差分脈沖伏安(DPV)響應曲線和線性關系曲線如圖8所示,隨著miRNA-141濃度增加,DPV峰電流值隨之增大。在1.0×1016~1.0×106 mol/L濃度范圍內,miRNA-141濃度與傳感器響應呈現良好的線性關系,線性回歸方程為Ip=42.91 + 1.805 lgC(R2=0.992),檢出限為3.3×1017 mol/L(S/N=3)。與其它方法相比,此生物傳感器具有更寬的線性范圍和更高的靈敏度(表2)。
3.5?傳感器的抗干擾能力和穩定性
在相同檢測條件下,通過比較空白樣品、目標miRNA-141、干擾物質(凝血酶(TB)、miRNA-182-5P、miRNA-21和miRNA-155)和混合樣品(由目標miRNA-141和干擾物質組成)的峰電流值大小,考察傳感器的抗干擾能力。由圖9可知,1.0×109 mol/L干擾物質的響應電流值與空白樣品相近,分別為1.0×1016 mol/L 目標miRNA-141檢測信號的15.9%、21.3%、5.0%和10.1%。相反,目標miRNA-141和混合樣品(由1.0×109 mol/L干擾物質和1.0×1016 mol/L miRNA-141組成)的響應電流值明顯增大,表明所制備的傳感器具有較高的選擇性。此外,考察了傳感器的穩定性。連續測量8次后,傳感器峰電流值沒有明顯變化(RSD=0.7%),表明此傳感器具有良好的穩定性。
3.6?實際樣品分析
采用本方法對健康人血清樣品中的miRNA-141進行檢測,考察此生物傳感器的實用性。將人血清樣品(重慶市第九人民醫院提供,患者均知情同意)離心10 min,取上清液,用0.1 mol/L PBS(pH 7.4)稀釋50倍。分別將1.00×1017 mol/L,1.00×1016mol/L和1.00×1010 mol/L的miRNA-141加入到處理好的血清樣品中,采用本方法進行測定,檢測結果如表3所示。 miRNA-141的回收率在99.9%~102.0%之間,RSD≤2.1%,表明此傳感器具有良好的實用性。
4?結 論
基于生物金屬有機骨架封裝MB復合材料和目標物循環擴增策略,構建了用于高靈敏檢測miRNA-141的生物傳感器。通過bio-MOF固載大量MB信號分子并保持其生物活性,結合目標物循環擴增策略,實現信號放大,提高傳感器靈敏度。此傳感器為各種miRNA的高靈敏檢測提供了平臺,有望為癌癥等重大疾病的早期診斷和預后評價提供參考。
References
1?Tian L,Sun S,Li W,Yuan L,Wang X Q. Cell Cycle,?2020,19(7): 772-786
2?Nie Y M,Zhang P,Wang H J,Zhuo Y,Chai Y Q,Yuan R. Anal. Chem.,2017,89(23): 12821-12827
3?Jin,S,Furtaw M D,Chen H X,Lamb D T,Ferguson S A,Arvin N E,Dawod M,Kennedy R T. Anal. Chem.,2016,88(13): 6703-6710
4?Wang W,Kong T,Zhang D,Zhang J N,Cheng G S. Anal. Chem.,2015,87(21): 10822-10829
5?Roy S,Soh J H,Ying J Y. Biosens. Bioelectron.,2016,75: 238-246
6?Guo H,Ingolia N,Weissman J,Bartel D P. Nature,2010,466(7308): 835-840
7?Mo F J,Wu J L,Chen M,Meng H,Han Q,Fu Y Z. Sens. Actuators B,2019,289(15): 269-276
8?Jia M,Sha J Y,Li Z H,Wang W J,Zhang H Y. Food Chem.,2020,317: 126459
9?Liu J L,Tang Z L,Zhang J Q,Chai Y Q,Zhuo Y,Yuan R. Anal. Chem.,2018,90(8): 5298-5305
10?Héctor Martínez P C,Marta M,Jesús F S,Emilio P,Donatella A,Ernesto F S A,José Manuel H M. Microchim. Acta,2020,187(4): 201-208
11?Yao A N,Jiao X L,Chen D R,Li C. ACS Appl. Mater. Interfaces,2020,12(16): 18437-18445
12?Ikezoe Y,Washino G,Uemura T,Kitagawa S,Matsui H. Nat. Mater.,2012,11(12): 1081-1085
13?Sun R W Y,Zhang M,Li D,Zhang Z F,Cai H,Li M,Xian Y J,Ng S W,Wong A S T. Chem. Eur. J.,2015,21(51): 18534-18538
14?Ma Y,Su H,Kuang X,Li X,Zhang T,Tang B. Anal. Chem.,2014,86(22): 11459-11463
15?Zhao M,Wu C D. ChemCatChem,2017,9(7): 1192-1196
16?Yang J J,Trickett C A,Alahmadi S B,Alshammari A S,Yaghi O M. J. Am. Chem. Soc.,2017,139(24): 8118-8121
17?Chen W W,Zhuang Y X,Wang L,Lv Y,Liu J B,Zhou T L,Xie R J. ACS Appl. Mater. Interfaces,2018,10(22): 18910-18917
18?Wang C,Tian L,Zhu W,Wang S Q,Wang P,Liang Y,Zhang W L,Zhao H W,Li G T. ACS Appl. Mater. Interfaces,2017,9(23): 20076-20085
19?Zhang Y H,Li B,Ma H P,Zhang L M,Zheng Y X. Biosens. Bioelectron.,2016,85: 287-293
20?Feng C,Wang Z H,Chen T S,Chen X X,Mao D S,Zhao J,Li G X. Anal. Chem.,2018,90(4): 2810-2815
21?Cheng H,Liu J,Ma W,Duan S,Huang J,He X,Wang K. Anal. Chem.,2018,90(21): 12544-12552
22?Xu Z H,Wang H,Wang J,Zhao W,Xu J J,Chen H Y. Anal. Chem.,2019,91(18): 12000-12005
23?Zhang Y,Li X,Xu Z Q,Chai Y Q,Wang H J,Yuan R. Chem. Commun.,2018,54(1039): 10148-10151
24?Xie W,Qin J S,He W W,Shao K Z,Su Z M,Du D Y,Li S L,Lan Y Q. Inorg. Chem. Front.,2017,4(3): 547-552
25?Turkevich J,Stevenson P C,Hillier J. Discuss. Faraday Soc.,1951,11(11): 55-75
26?Genna D T,Wong-Foy A G,Matzger A J,Sanford M S. J. Am. Chem. Soc.,2013,135(29): 10586-10589
27?Song J Y,Yang C C,Ma J,Han Q,Ran P Y,Fu Y Z. Microchim. Acta,2018,185(4): 230-239
28?Lu J,Wu L,Hu Y,Wang S,Guo Z Y. Biosens. Bioelectron.,2018,109: 13-19
29?Wang F F,Fu C P,Huang C,Li N,Wang Y H,Ge S H,Yu J H. Biosens. Bioelectron.,2020,150: 111917
30?Tang Y J,Dai S Y,Zhou Y T,Cheng G F,He P G,Fang Y Z. Anal. Chem.,2019,47(7): 1029-1034
31?Ge L,Wang W,Hou T. Biosens. Bioelectron.,2016,77: 220-226

