芝麻肌醇半乳糖苷合成酶基因SiGolS6的克隆及功能分析
劉愛麗,魏夢園,黎冬華,周瑢,張秀榮,游均
芝麻肌醇半乳糖苷合成酶基因的克隆及功能分析
劉愛麗,魏夢園,黎冬華,周瑢,張秀榮,游均
(中國農業科學院油料作物研究所/農業農村部油料作物生物學與遺傳育種重點實驗室,武漢 430062)
【】是芝麻肌醇半乳糖苷合成酶家族成員,在植物抗旱過程中可能發揮重要作用。研究在植物干旱脅迫抗性中的功能,以期為芝麻抗旱遺傳改良提供理論基礎和基因資源。利用反轉錄PCR(reverse transcription PCR,RT-PCR)方法從芝麻中克隆獲得肌醇半乳糖苷合成酶基因。使用InterProScan、ClustalX2和MEGA5.2等生物信息學軟件對序列進行分析。通過對轉擬南芥材料的表型分析和生理指標測定,研究在植物抗旱性中的功能及作用機理。克隆獲得的全長CDS序列為921 bp,編碼306個氨基酸,其蛋白質分子量為35.07 kD,等電點為4.75。序列分析顯示SiGolS6蛋白含有糖基轉移酶保守結構域(IPR002495),屬于糖基轉移酶超家族。與其他物種GolS蛋白構建的系統進化樹中,SiGolS6與馬鈴薯中的同源基因相似度較高。利用潮霉素篩選和PCR鑒定,獲得6個獨立的轉基因擬南芥株系;qRT-PCR分析篩選出表達量較高的3個轉基因株系(OE-2、OE-3和OE-4)用于后續試驗分析,檢測發現這三個轉基因株系的棉子糖含量顯著高于野生型植株。干旱脅迫下,轉基因株系萎蔫程度較野生型輕,干旱脅迫28 d和復水恢復生長5 d后,轉基因株系的鮮重均顯著高于野生型,而正常供水條件下無明顯差異;干旱脅迫28 d后復水生長5 d,50%的轉基因植株基本恢復,而野生型植株存活率不到10%。干旱脅迫21 d,轉基因植株的相對電導率,活性氧積累和相對MDA含量均顯著低于野生型,而相對SOD、POD活性則顯著高于野生型。在擬南芥中超量表達芝麻,能夠提高植物在干旱脅迫中的耐受性。
芝麻;肌醇半乳糖苷合成酶;轉基因擬南芥;耐旱性;功能分析
0 引言
【研究意義】芝麻(L.)是中國重要的傳統油料作物之一,具有頗高的經濟效益,在國內外都具有重要地位。干旱是限制各種農作物生產的主要逆境之一[1],近年來,中國芝麻產區干旱發生的范圍呈現擴大的趨勢,旱害造成芝麻減產20%以上,嚴重時甚至絕收[2]。因此,加強芝麻抗旱功能基因發掘,明確相關基因的調控機理,對培育抗旱芝麻新品種十分必要。棉子糖系列寡糖(raffinose family oligosaccharides,RFOs)是一種小分子滲透調節物[3],其代謝與植物的生長發育、抗逆反應等關系密切。肌醇半乳糖苷合成酶(galactinol synthase,GolS)是催化RFOs合成的關鍵酶[3],在植物非生物逆境抗性中發揮重要作用。【前人研究進展】植物在受到干旱、高鹽和低溫等多種逆境形成的滲透脅迫時,體內會積累滲透調節物使細胞液濃度升高,降低滲透勢,使細胞吸水或保水能力得到提高,從而適應不利環境。RFOs就是其中一種小分子滲透調節物,它由一系列α-1,6-半乳糖連接到蔗糖上的6-葡萄糖基組成,主要包括棉子糖、水蘇糖和毛蕊花糖[4]。RFOs廣泛分布在植物的不同組織部位,在高等植物種子中含量相對較高[5-6]。有研究表明,一些體內不含RFOs或含量極低的植物,受到逆境脅迫后RFOs會迅速積累,植株抗逆性也隨之增強[7-8],這一響應逆境的生理現象在番茄[9]、苜蓿[10]、辣椒[11]等植物中均存在。近年來,還發現棉子糖系列寡糖代謝與植物生長發育和種子活力建成關系密切[12]。GolS參與RFOs合成的第一步,該步驟是RFOs家族中各物質合成積累的關鍵步驟[13],因此,其在植物抗逆應答中的作用重大。大多數GolS基因受多種脅迫誘導表達,據報道,在擬南芥中鑒定了7個GolS基因()[8],其中,和的表達分別受干旱和高鹽脅迫誘導,受冷脅迫誘導,說明它們均與抗逆應答相關。研究還發現超表達的擬南芥材料對干旱脅迫的耐受性顯著增強[14],有報道還指出能夠提高單子葉模式植物二穗短柄草的抗旱性[15]。另外,有研究發現木薯的表達量在干旱脅迫下會迅速上升,在大腸桿菌和擬南芥中過量表達該基因均能提高抗旱能力,說明GolS在植物抗旱調節中起著重要作用[3,16]。將牛耳草肌醇半乳糖苷合成酶基因(在煙草中超表達,也顯著提高了轉基因植株的抗旱能力[17]。另外,玉米受DREB2A轉錄因子調控,與超表達均可提高擬南芥抗逆性,并且對植株在正常條件下的生長沒有任何負效應[18]。可見GolS在作物抗旱遺傳改良中具有廣闊的應用前景。前期工作中,在芝麻全基因組范圍內鑒定了7個GolS基因(—),表達分析顯示,、和受干旱脅迫的強烈誘導[19]。【本研究切入點】雖然GolS基因在植物的干旱抗性中具有重要作用,芝麻的表達也受干旱脅迫誘導,但能否提高植物抗逆性,目前仍鮮見報道。【擬解決的關鍵問題】本研究從芝麻中分離,并利用農桿菌花序浸染法將其在擬南芥中超量表達,通過鑒定超量表達轉擬南芥的抗旱性,分析其在干旱抗性中的功能,以期為芝麻抗旱遺傳改良提供理論基礎和基因資源。
1 材料與方法
1.1 試驗材料
所用芝麻品種為晉芝2號,菌株為大腸桿菌DH5α和農桿菌LBA4404,植物表達載體pCAMBIA1301S是在pCAMBIA1301基礎上改建而成[20]。
1.2 基因的克隆及序列分析
使用EASYspin Plus植物RNA提取試劑盒(北京艾德萊生物科技有限公司)提取干旱脅迫處理7 d的初花期抗旱芝麻品種晉芝2號葉片組織總RNA,用HiScipt II One Step RT-PCR Kit反轉錄試劑盒(南京諾唯贊生物科技有限公司)逆轉錄合成cDNA。
根據前期對芝麻GolS基因家族的分析[19],通過登錄號SIN_1022774在芝麻基因組數據庫(http://ocri- genomics.org/Sinbase/index.html)中獲得的cDNA序列信息,利用引物GolS6FL-F和GolS6FL-R(表1)進行PCR擴增,分離獲得。引物由北京擎科新葉生物技術有限公司合成。
同源基因序列下載自NCBI(http://www. ncbi.nlm.nih.gov/);運用Expy Protparatam(https://web. expasy.org/protparam/)在線預測編碼蛋白的理化性質;采用InterProScan(http://www.ebi.ac.uk/ InterProScan/)程序分析保守結構域;用ClustalX2程序對不同植物的GolS序列進行多序列比對;用MEGA5.2程序構建系統進化樹[21]。

表1 本研究中所用引物序列
1.3 植物表達載體的構建
用HⅠ和Ⅰ對pCAMBIA1301S表達載體進行雙酶切獲得線性化載體,將其通過瓊脂糖凝膠電泳和瓊脂糖凝DNA回收試劑盒(天根生化科技有限公司)純化后獲得高純度線性化載體。將同樣純化后的片段與線性化pCAMBIA1301S載體通過同源重組的方法進行連接,獲得植物表達載體pCAMBIA1301S-。
1.4 轉化擬南芥及陽性植株的鑒定
通過凍融法將pCAMBIA1301-植物表達載體轉化LBA4404農桿菌感受態,挑取陽性克隆,菌落PCR鑒定后,將其接種到含有利福平(Rif)和卡那霉素(kana)的LB液體培養基上,28℃振蕩培養至OD600為0.4—0.6。然后采用花序浸染法浸染擬南芥花序,進行遺傳轉化[22]。浸染后的植株繼續在室溫22℃、12 h光照/12 h黑暗的培養間培養至收獲種子(T0代)。將T0代種子消毒后播種于含潮霉素(30 mg·L-1)的MS培養基(添加25 mg·L-1頭孢霉素抑菌)上篩選,將能正常生長的轉基因植株移栽到含泥炭土、蛭石(體積比為1﹕3)的花缽中,同時以野生型擬南芥作為對照,繼續生長收種,用于后續PCR試驗鑒定篩選[23]。
待上述初步篩選得到的陽性苗長至8片真葉后,用天根生化科技(北京)有限公司的植物DNA提取試劑盒提取葉片基因組DNA,以野生型擬南芥DNA為陰性對照,利用PCR方法鑒定是否獲得T1代陽性轉基因植株。
將T1代陽性轉基因植株單株收獲的T1代種子繼續進行潮霉素篩選,獲得T2代陽性植株,選取上述獲得部分陽性株系將其移栽生長,再次提取葉片基因組DNA進行PCR分子鑒定,確定T2代陽性植株。
1.5 實時熒光定量PCR(qPCR)檢測
取轉基因T2代陽性植株和野生型植株幼嫩葉片,用EASYspin Plus植物RNA提取試劑盒(北京艾德萊生物科技有限公司)提取葉片總RNA,使用微量分光光度計測定RNA濃度和質量,反轉錄獲得cDNA。利用Beacon Designer8.14設計熒光定量PCR引物SiGolS6q-F/R。擬南芥持家基因()作為內參基因,實時熒光定量PCR分析在轉基因和野生型植株中的表達水平。實時熒光定量PCR試劑盒ChamQ Universal SYBR qPCR Master Mix購自南京諾唯贊生物科技有限公司,按照試劑盒說明書配置熒光定量PCR反應體系,實時熒光定量PCR分析平臺為Roche LightCycler 480,基因特異性引物見表1。采用2-ΔΔCT法分析相對表達水平[24]。
1.6 轉基因擬南芥的耐旱性分析
在溫室中,將不同株系的轉基因擬南芥種子和野生型擬南芥種子直接點播于含3﹕1(v/v)蛭石和營養土的花缽(直徑10 cm)中,先用保鮮膜保濕48 h,揭膜后置于室溫22℃、12 h光照/12 h黑暗的培養間中繼續培養,定期澆水。種子點播7 d后,間苗,每缽留苗3—4棵,再用保鮮膜保濕1 d。
種子點播至土里第14 d,開始干旱處理。干旱處理前給所有植株澆足水,待吸水至飽和后,將放置花缽的大盤子里多余的水全部倒掉,以這一天計為干旱處理第1 d。干旱處理28 d后,復水生長5 d,觀察表型并拍照(含復水5 d后表型),并統計2種材料的存活數,計算存活率。選取正常生長、干旱脅迫28 d及復水5 d材料的地上部分,用清水沖洗其表面雜物,吸水紙吸干水分,在天平上稱重,測定其鮮重變化情況。隨機摘取15片大小相對一致的葉片,混合均勻后分成3份即時稱量其鮮重,之后室溫放置在濾紙上,每間隔0.5 h稱重1次,計算其離體葉片失水率。取正常生長14 d的轉基因和野生型植株,檢測二者的棉子糖含量。棉子糖含量采用內標法由武漢邁特維爾生物科技有限公司(http://www.metware.cn/)基于Agilent7890B-7000D GC-MS/MS平臺檢測。取正常供水對照和干旱脅迫21 d后轉基因與野生型植株的葉片,檢測二者的相對電導率、過氧化物酶(peroxidase,POD)和超氧化物歧化酶(superoxide dismutase,SOD)活性,以及丙二醛(malondialdehyde,MDA)含量變化和O2-產生情況,每個指標每個株系取3—4個重復進行測定。使用浸泡法測定相對電導率[25]。POD、SOD活性測定試劑盒和MDA含量測定試劑盒購自南京建成生物工程研究所,具體試驗流程及計算方法參照南京建成(www.njjcbio.com)丙二醛(MDA)測定試劑盒(TBA法)、總超氧化物歧化酶(T-SOD)測試盒(羥胺法)及過氧化物酶(POD)測定試劑盒(測植物)(比色法)說明書完成。
1.7 數據分析
試驗數據用Microsoft Excel 2010和 SPSS11.5軟件進行整理和統計分析。
2 結果
2.1 SiGolS6序列分析
克隆獲得全長CDS,序列長度為921 bp,編碼306個氨基酸,蛋白分子量為35.07 kD,等電點為4.75。多序列比對和保守結構域分析發現芝麻SiGolS6與其他植物中的同源基因都含有一個糖基轉移酶保守結構域(glycosyl transferase,family 8,IPR002495),屬于糖基轉移酶超家族(圖1-A)。
為了進一步研究芝麻SiGolS6蛋白在物種中的進化位置及親緣關系,應用MEGA5.2程序構建了多物種的系統進化樹(圖1-B)。結果表明,芝麻SiGolS6和馬鈴薯中的同源基因親緣關系較近。
2.2 轉基因擬南芥陽性植株鑒定
將pCAMBIA1301S-轉化擬南芥,T1轉基因材料經潮霉素篩選,共獲得6個獨立的轉基因植株。22℃光照培養箱培養7—10 d,T2轉基因株系在含潮霉素的MS篩選培養基上生長狀況良好(圖2-A),而野生型(wild type,WT)擬南芥根系較短,均黃化死去(圖2-B)。提取WT和T2轉基因植株的DNA,進行目的基因的分子驗證,除WT外,均能擴增出目的條帶(圖2-C)。隨機選擇3個獨立的轉基因株系OE-2、OE-3、OE-4進行qPCR檢測,結果顯示,3個轉基因株系中的表達顯著高于野生型(圖2-D)。GolS是催化棉子糖合成的關鍵酶[3]。進一步檢測了超表達T3轉基因株系及野生型中的棉子糖含量,結果表明,轉基因擬南芥的棉子糖含量顯著高于野生型植株(圖3)。
2.3 轉基因擬南芥的抗旱性分析
為了研究轉擬南芥的抗旱性,對正常培養14 d的T3轉基因植株和野生型植株進行干旱脅迫處理(不澆水)。結果表明,正常供水條件下,轉基因株系和野生型植株均正常生長,二者長勢無明顯區別;干旱脅迫處理28 d,野生型植株萎蔫程度較轉基因株系嚴重(圖4-A),復水處理(恢復正常供水)5 d后,50%的轉基因植株基本恢復,而野生型植株存活率不到10%(圖4-A和圖4-C)。
離體葉片失水率試驗顯示,野生型植株的失水率始終高于轉基因株系(圖4-B)。選取正常生長、干旱脅迫28 d及復水5 d的材料,分別測量其鮮重。結果顯示,正常供水條件下,轉基因材料的鮮重與野生型無明顯差異。干旱脅迫及復水處理后,轉基因植株的鮮重則顯著高于野生型(圖4-D)。電導率測定結果顯示,干旱處理21 d后,轉基因株系的相對電導率也顯著低于野生型植株(圖4-E)。
活性氧(ROS)和MDA含量、SOD及POD活性是衡量植物抗逆性狀的重要生理指標。氮藍四唑(nitrobluetetrazolium,NBT)染色結果顯示,正常供水條件下,轉基因材料染色程度和野生型材料基本一致,說明二者在正常條件下產生的超氧自由基差異不大。而干旱脅迫下,轉基因材料較野生型材料染色面積小,說明脅迫條件下,轉基因株系積累的活性氧明顯低于野生型材料(圖5-A)。取干旱脅迫21 d的擬南芥植株,分別檢測其MDA含量、SOD及POD活性,發現轉基因株系的相對MDA含量明顯低于野生型植株(圖5-B),相對SOD活性和POD活性則明顯高于野生型擬南芥植株(圖5-C和圖5-D)。

SiGolS6:芝麻Sesamum indicum,XP_011087512.1;CsGolS:甜橙Citrus sinensis,XP_006444560.1;PtGolS:毛果楊Populus trichocarpa,XP_011087512.1;AtGolS1:擬南芥Arabidopsis thaliana,NP_182240.1;GrGolS:棉花Gossypium raimondii,XP_012490292.1;VvGolS:葡萄Vitis vinifera,XP_002281369.1;SlGolS:番茄Solanum lycopersicum,NP_001234668.2;StGolS:馬鈴薯Solanum tuberosum,ADW78838.1;SbGolS:高粱Sorghum bicolor,XP_002467954.1;BdGolS:二穗短柄草Brachypodium distachyon,XP_003558046.1;SitGolS:谷子Setaria italica,XP_004984579.1;OsGolS:水稻Oryza sativa,XP_015628833.1;ZmGolS:玉米Zea mays,NP_001105748.2。劃線處為Glycosyl transferase, family 8(IPR002495)保守結構域The line marks the Glycosyl transferase, family 8 (IPR002495) conserved domain
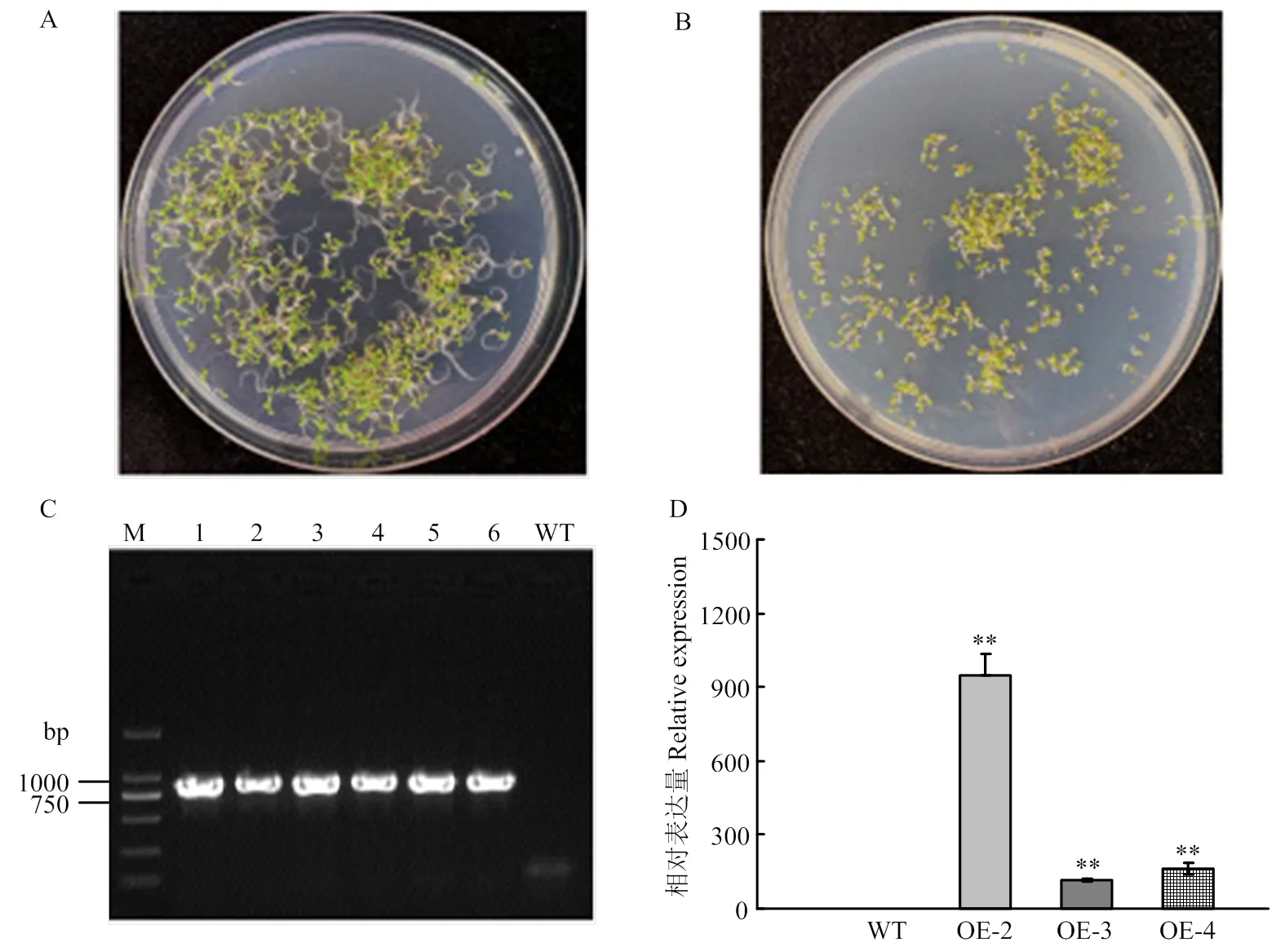
A、B:含潮霉素的MS篩選培養基上生長的T2轉基因(A)和野生型(B)植株;C:T2陽性轉基因植株鑒定,1—6:轉基因株系;WT:野生型對照;D:轉基因株系中SiGolS6的表達量檢測。*表示在P<0.05水平上差異顯著;**表示在P<0.01水平上差異顯著。下同
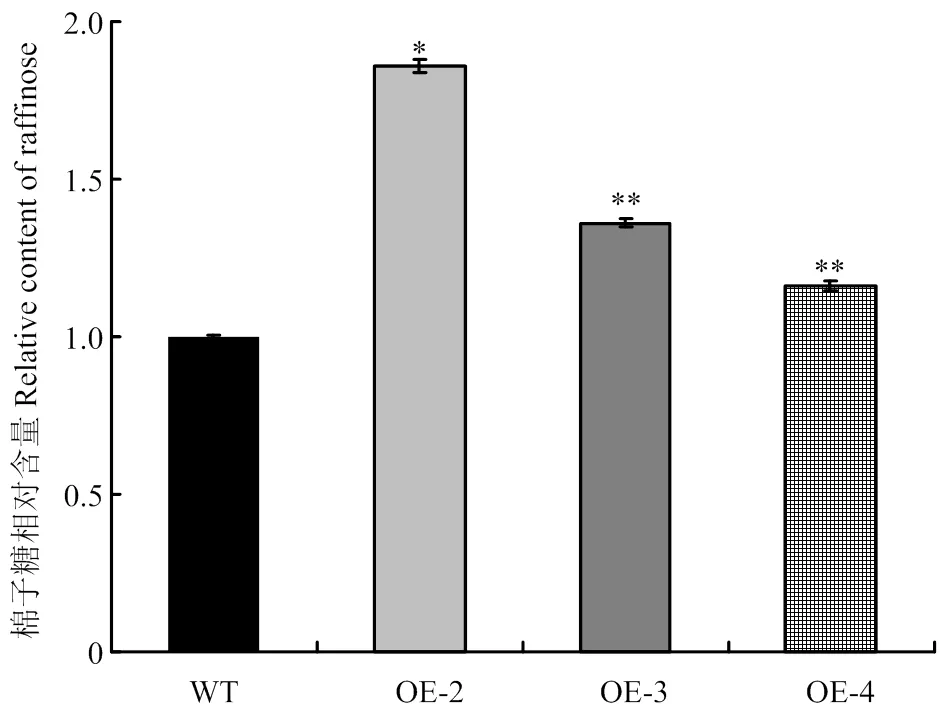
圖3 轉基因株系中棉子糖含量檢測
3 討論
3.1 芝麻SiGolS6序列分析
SiGolS6是芝麻糖基轉移酶超家族中的一員,通過對芝麻SiGolS6和其他物種GolS進行多序列比對并構建系統進化樹,表明SiGolS6與馬鈴薯同源基因的親緣關系較近。有研究發現,RFOs對馬鈴薯在脅迫條件下的耐受能力起著關鍵作用[26],而GolS是馬鈴薯RFOs合成過程中的關鍵酶,可見GolS對馬鈴薯在逆境下的抗性也至關重要。同源性分析發現芝麻SiGolS6與馬鈴薯親緣關系較近,說明SiGolS6可能也參與植物逆境脅迫抗性。前期研究工作中,我們在芝麻基因組中鑒定了7個GolS基因(—),表達分析發現,受干旱脅迫的強烈誘導[19]。而前人研究表明,擬南芥、水稻、玉米、白楊和番茄中GolS基因的表達在干旱、高鹽等非生物脅迫條件下上升[14,27-29]。通過進一步研究證明了上述一些基因在逆境脅迫中發揮了重要作用,如擬南芥的表達受干旱脅迫誘導,而超表達不僅能夠增強擬南芥的抗旱、抗鹽以及抗氧化脅迫的能力[14,30],而且能夠提高單子葉模式植物二穗短柄草以及水稻的抗旱性[15,31]。以上結果表明芝麻可能參與植物抗逆反應。
3.2 芝麻SiGolS6對轉基因擬南芥耐旱性的影響
植物在正常條件下RFOs含量很少,但在逆境脅迫下,RFOs的積累會被誘導,從而增強植株的抗逆性[7-8,32]。GolS是催化RFOs合成的關鍵酶[3],其活性會影響RFOs的積累水平[33]。檢測轉基因和野生型植株的棉子糖含量發現,轉基因擬南芥的棉子糖含量顯著高于野生型植株,說明GolS表達量的升高確實導致了RFOs的積累。通過對轉基因擬南芥材料在正常及干旱脅迫條件下的表型鑒定發現,在正常條件下,轉基因植株與野生型植株的生長(鮮重)無顯著差異,但在干旱脅迫處理及復水后,轉基因植株的鮮重顯著高于野生型植株。干旱脅迫過程中,轉基因植株的萎蔫程度較野生型輕;復水5 d后,大約50%的轉基因植株基本恢復正常生長狀態,而野生型植株死亡率則達到90%以上。進一步分析發現,轉基因植株的離體葉片失水速率低于野生型;干旱脅迫下,轉基因植株的相對電導率也顯著低于野生型。以上結果都說明在干旱脅迫下,提高了轉基因植株的耐旱能力。此外,轉基因擬南芥植株的抗旱性可能與表達量水平存在一定的關系。如表達量較高的OE-2家系在脅迫復水后,長勢較OE-3和OE-4更好。存活率、鮮重和相對電導率等指標也顯示OE-2家系的耐旱性強于OE-3和OE-4。
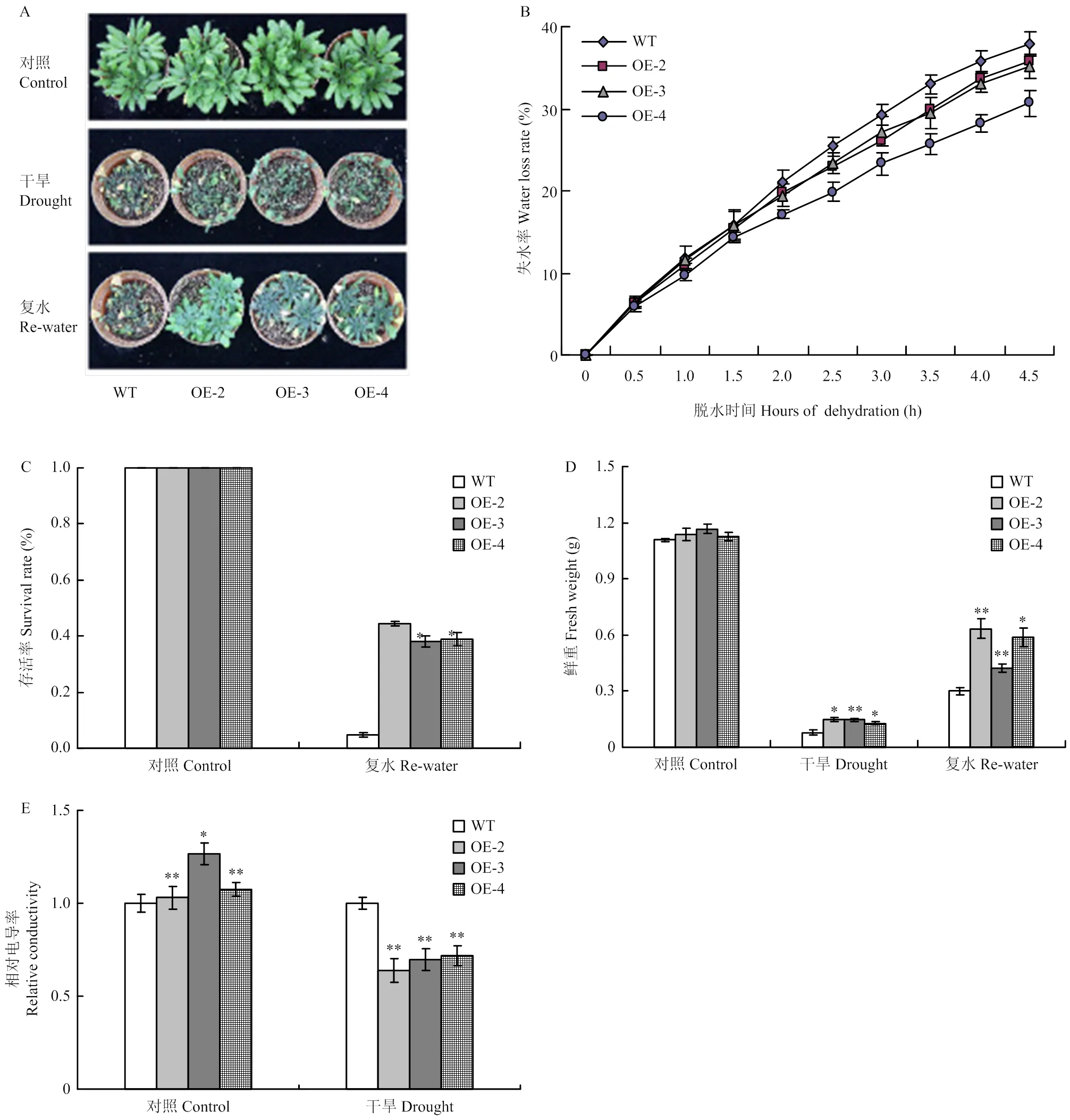
A:干旱脅迫下野生型和轉基因植株的表型;B:野生型和轉基因植株離體葉片失水速率,3次重復;C:干旱脅迫復水后野生型和轉基因植株的存活率;D—E:干旱脅迫下野生型和轉基因植株鮮重(D)和相對電導率(E)
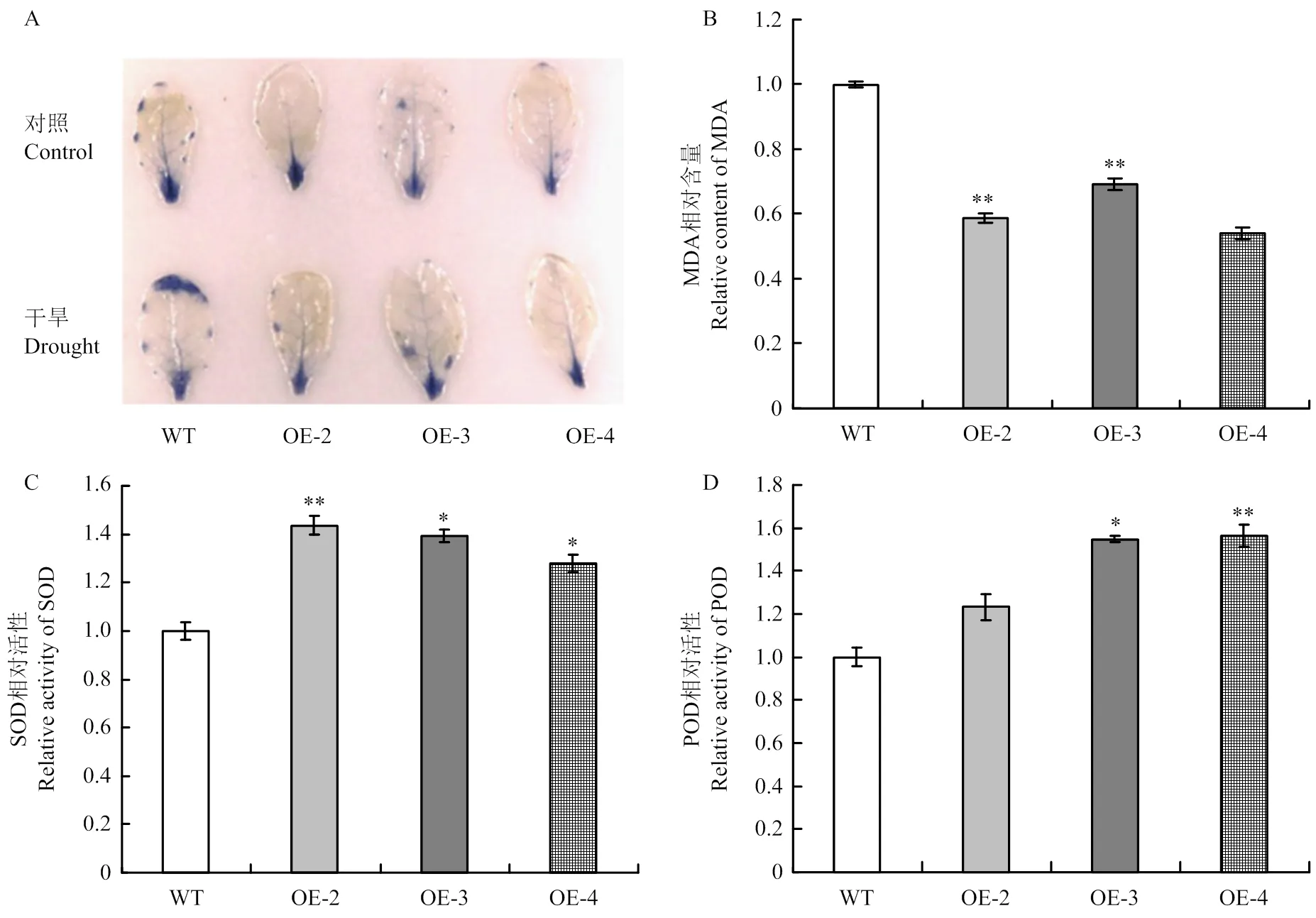
A:正常供水和干旱脅迫下離體葉片的氮藍四唑(NBT)染色;B—D:干旱脅迫下野生型和轉基因植株相對MDA含量(B)、相對SOD活性(C)和相對POD活性(D)
3.3 芝麻SiGolS6對轉基因擬南芥抗氧化能力的影響
在逆境脅迫條件下,植物體內的ROS會大量積累,導致細胞受到損害,并對植物生長發育產生不利影響[34]。有研究表明,RFOs可以作為抗氧化劑,限制ROS過量積累,保護細胞免受氧化損傷[35-36]。超量表達擬南芥和鷹嘴豆GolS基因的轉基因材料均表現出RFOs含量上升,在逆境脅迫條件下ROS積累較少,氧化損傷較小,對逆境脅迫抗性顯著增強[35,37]。本研究中,NBT染色結果表明,干旱脅迫下轉基因株系積累的O2-低于野生型材料,轉基因株系的MDA含量也顯著低于野生型,說明轉基因植株在干旱脅迫下ROS積累較少,受到的氧化損傷相對較低。SOD和POD是植物酶促抗氧化系統的重要組分,在活性氧清除和非生物逆境抗性中發揮著重要作用[34]。超量表達南極發草()和水稻都可以提高轉基因水稻中ROS清除相關酶基因的表達,降低脅迫條件下ROS積累水平,顯著增強轉基因材料對干旱和低溫的抗性[38]。本研究也發現轉基因擬南芥株系中SOD和POD活性顯著高于野生型。綜上所述,轉基因植株通過提高抗氧化能力增強了對干旱脅迫的抗性。
4 結論
在擬南芥中超量表達芝麻肌醇半乳糖苷合成酶基因,提高了轉基因植株棉子糖含量和抗氧化酶活性,增強了轉基因植株干旱脅迫耐受性。推測可能參與植物對干旱脅迫的應答過程。
[1] 武新娟. 馬鈴薯不同品種的抗旱性評價及Fe-SOD基因的研究[D]. 哈爾濱: 東北農業大學, 2008.
WU X J. Evaluation of drought tolerance and clone of gene Fe-SOD in potato varieties [D]. Harbin: Northeast Agricultural University, 2008. (in Chinese)
[2] 王林海, 張艷欣, 危文亮, 張秀榮. 中國芝麻濕害和旱害發生調查與分析. 中國農學通報, 2011, 27(28): 301-306.
WANG L H, ZHANG Y X, WEI W L, ZHANG X R. Investment of waterlogging and drought effect on the sesame production in China.,2011, 27(28): 301-306. (in Chinese)
[3] 范潔. 木薯肌醇半乳糖苷合成酶基因的抗旱功能研究[D]. 海口: 海南大學, 2015.
FAN J.Functional characterization involved in drought stress of galactinol synthase genefromCrantz [D].Haikou: Hainan University, 2015. (in Chinese)
[4] 李芳, 汪曉峰. 植物中棉子糖系列寡糖代謝及其調控關鍵酶研究進展. 西北植物學報, 2008, 28(4): 4852-4859.
LI F, WANG X F. Advance in raffinose family oligosaccharides metabolism and the key enzymes in plants.,2008, 28(4): 4852-4859. (in Chinese)
[5] HORBOWICZ M, OBENDORF R L. Seed desiccation tolerance and storability: Dependence on flatulence-producing oligosaccharides and cyclitols-review and survey., 1994, 4(4): 385-405.
[6] MUZQUIZ M, BURBANO C, PEDROSA M M, FOLKMAN W, GULEWICZ K. Lupins as a potential source of raffinose family oligosaccharides., 1998, 9(3): 183-188.
[7] 林世鋒, 王仁剛, 任學良, 王東茂, 張拓, 黃亞娟. 煙草肌醇半乳糖苷合成酶基因的克隆及序列分析. 東北農業大學學報, 2012, 43(7): 113-118.
LIN S F, WANG R G, REN X L, WANG D M, ZHANG T, HUANG Y J.Cloning and sequence analysis of a galactinol synthase gene).,2012, 43(7): 113-118.(in Chinese)
[8] 王毅, 肖良俊, 馬婷, 寧德魯. 泡核桃肌醇半乳糖苷合成酶基因克隆及表達分析. 基因組學與應用生物學, 2018, 37(5): 2029-2033.
WANG Y, XIAO L J, MA T, NING D L. Cloning and expression analysis of inositol galactinol synthase gene in., 2018, 37(5): 2029-2033. (in Chinese)
[9] DOWNIE B, GURUSINGHE S, DAHAL P, THACKER R R, SNYDER J C, NONOGAKI H, YIM K, FUKANAGA K, ALVARADO V AND KENT J. Bradford expression of a GALACTINOL SYNTHASE gene in tomato seeds is up-regulated before maturation desiccation and again after imbibition whenever radicle protrusion is prevented., 2003, 131(3): 1347-1359.
[10] CUNNINGHAM S M, NADEAU P, CASTONGUAY Y, LABERGE S, VOLENEC J. Raffinose and stachyose accumulation, galactinol synthase expression, and winter injury of contrasting alfalfa germplasms., 2003, 43(2): 562-570.
[11] 繆旻珉, 李娜, 任旭琴, 張宗東, 程皓, 曹碚生. 一個辣椒肌醇半乳糖苷合成酶同源基因全長cDNA的克隆與低溫表達分析. 園藝學報, 2008(11): 1671-1675.
MIAO M M, LI N, REN X Q, ZHANG Z D, CHENG H, CAO B S. Cloning, characterization and expression of a putative galactinol synthase gene from cold stressed pepper (L.)., 2008(11): 1671-1675.(in Chinese)
[12] 李濤. 棉子糖系列寡糖(RFOs)在玉米與擬南芥植株抗旱及種子活力中的功能研究[D]. 楊凌: 西北農林科技大學, 2017.
Li T.The function of raffinose family oligosaccharides in plant drought stress tolerance and seed vigor of maize and[D]. Yangling: Northwest A&F University, 2017. (in Chinese)
[13] SARAVITZ D M, PHARR D M, CARTER T E. Galactinol synthase activity and soluble sugars in developing seeds of four soybean genotypes., 1987, 83: 185-189.
[14] TAJI T, OHSUMI C, IUCHI S,SEKI M, KASUGA M, KOBAYASHI M, SHINOZAKI K Y, SHINOZAKI K. Important roles of drought- and cold-inducible genes for galactinol synthase in stress tolerance in., 2002, 29(4): 10.
[15] HIMURO Y, ISHIYAMA K, MORI F, GONDO T, TAKAHASHI F, SHINOZAKI K, KOBAYASHI M, AKASHI R.galactinol synthaseimproves drought tolerance in the monocot model., 2014, 171(13): 1127-1131.
[16] 范潔, 王雨晴, 李瑞梅, 張帆, 段瑞軍, 符少萍, 劉姣, 胡新文, 郭建春. 木薯中肌醇半乳糖苷合成酶基因在大腸桿菌中的表達. 分子植物育種, 2015, 13(5): 1027-1032.
FAN J, WANG Y Q, LI R M, ZHANG F, DUAN R J, FU S P, LIU J, HU X W, GUO J C.Expression of recombinant galactinol synthase ofGrantz in., 2015, 13(5): 1027-1032.(in Chinese)
[17] WANG Z, ZHU Y, WANG L L, LIU X, LIU Y X, PHILLIPS J, DENG X. A WRKY transcription factor participates in dehydration tolerance inby binding to the W-box elements of the galactinol synthase () promoter., 2009, 230(6): 1155-1166.
[18] GU L, ZHANG Y, ZHANG M, LI T,DIRK L M A, DOWNIE B, ZHAO T Y., a target of transcription factor ZmDREB2A, offers similar protection against abiotic stress as., 2016, 90(1/2): 157-170.
[19] YOU J, WANG Y Y, ZHANG Y J, DOSSA K, LI D H, ZHOU R, WANG L H, ZHANG X R. Genome-wide identification and expression analyses of genes involved in raffinose accumulation in sesame., 2018, 8(1): 4331.
[20] 肖本澤. 抗旱候選基因和啟動子的水稻遺傳轉化分析和田間抗旱性鑒定[D]. 武漢: 華中農業大學, 2007.
XIAO B Z. Transformation study and field testing of candidate genes and promoters for drought resistance in rice[D].Wuhan: Huazhong Agricultural University, 2007.(in Chinese)
[21] TAMURA K, PETERSON D, PETERSON N, STECHER G, NEI M, KUMAR S. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods., 2011, 28: 2731-2739
[22] 劉慧娟, 馮志國, 李先文, 李濤, 何光源. 采用農桿菌花序浸染法獲得轉crtB基因擬南芥. 湖北農業科學, 2013, 52(1): 200-202.
LIU H J, FENG Z G, LI X W, LI T, HE G Y.Obtaining crtB transgenicby agrobacterium tumefaciens-floral dip method.,2013, 52(1): 200-202.(in Chinese)
[23] 周瑢, 劉盼, 黎冬華, 張艷欣, 王林海, 張秀榮, 魏鑫. 芝麻硬脂酸脫飽和酶基因SiSAD的克隆及功能驗證.中國農業科學, 中國農業科學, 2019, 52(10): 1678-1685.
ZHOU R, LIU P, LI D H, ZHANG Y X, WANG L H, ZHANG X R, WEI X. Cloning and Functional Characterization of Sesame SiSAD Gene., 2019, 52(10): 1678-1685. (in Chinese)
[24] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method., 2001, 25: 402-408.
[25] 陳建勛, 王曉峰. 植物生理學實驗指導. 第二版. 廣州: 華南理工大學出版社, 2006: 64-66.
CHEN J X, WANG X F.. Guangzhou: South China University of Technology Press, 2006: 64-66. (in Chinese)
[26] FOLGADO R, PANIS B, SERGEANT K, RENAUT J, SWENNEN R, HAUSMAN J F. Unravelling the effect of sucrose and cold pretreatment on cryopreservation of potato through sugar analysis and proteomics., 2015, 71(3): 432-441.
[27] SAITO M, YOSHIDA M. Expression analysis of the gene family associated with raffinose accumulation in rice seedlings under cold stress., 2011, 168(18): 2268-2271.
[28] ZHOU M L, ZHANG Q, ZHOU M, SUN Z M, ZHU X M, SHAO J R, TANG Y X, WU Y M. Genome-wide identification of genes involved in raffinose metabolism in maize.,2012, 22(12): 1775-1785.
[29] ZHOU J, YANG Y, YU J, WANG L K, YU X,OHTANI M, KUSANO M, SAITO K,DEMURA T,ZHUGE Q. Responses ofgalactinol synthase genes to abiotic stresses., 2014, 127(2): 347-358.
[30] NISHIZAWA A, YABUTA Y, SHIGEOKA S. Galactinol and raffinose constitute a novel function to protect plants from oxidative damage., 2008, 147(3): 1251-1263.
[31] SELVARAJ M G, TAKUMA ISHIZAKI T, VALENCIA M, OGAWA S, DEDICOVA B, OGATA T, YOSHIWARA K, MARUYAMA K, KUSANO M, SAITO K, TAKAHASHI F, SHINOZAKI K, NAKASHIMA K, ISHITANI M. Overexpression of angalactinol synthase gene improves drought tolerance in transgenic rice and increased grain yield in the field., 2017, 15(11): 1465-1477.
[32] 左靜. 梅花肌醇半乳糖苷和棉子糖合成酶基因的克隆與功能初探[D]. 武漢: 華中農業大學, 2017.
Zuo J. Cloning and functional analysis of galactinol and raffinose synthase genes in[D].Wuhan: Huazhong Agricultural University, 2017.(in Chinese)
[33] THOMAS P, ANDREAS R. Biochemistry and physiology of raffinose family oligosaccharides and galactosyl cyclitols in seeds., 2001, 11(3): 185-197.
[34] YOU J, CHAN Z. ROS regulation during abiotic stress responses in crop plants., 2015, 6: 1092.
[35] NISHIZAWA A, YABUTA Y, SHIGEOKA S. Galactinol and raffinose constitute a novel function to protect plants from oxidative damage., 2008, 147(3): 1251-1263.
[36] VAN DEN ENDE W. Multifunctional fructans and raffinose family oligosaccharides., 2013, 4: 247.
[37] SALVI P, KAMBLE N U, MAJEE M. Stress-inducible galactinol synthase of chickpea (CaGolS) is Implicated in heat and oxidative stress tolerance through reducing stress-induced excessive reactive oxygen species accumulation., 2018, 59(1): 155-166.
[38] CUI L H, BYUN M Y, OH H G, KIM S J, LEE J, PARK H, LEE H, KIM W T. Poaceae type II galactinol synthase 2 from Antarctic flowering plantand rice improves cold and drought tolerance by accumulation of raffinose family oligosaccharides in transgenic rice plants., 2020,61(1): 88-104.
Cloning and Function Analysis of Sesame Galactinol Synthase Gene
LIU AiLi, WEI MengYuan, LI DongHua, ZHOU Rong, ZHANG XiuRong, YOU Jun
(Oil Crops Research Institute of the Chinese Academy of Agricultural Sciences/Key Laboratory of Biology and Genetic Improvement of Oil Crops, Ministry of Agriculture and Rural Affairs, Wuhan 430062)
【】is a member of galactinol synthase family in sesame,which may play important role in drought stress resistance. Studying the function of【】The galactinol synthase gene,, was isolated from sesame through reverse transcription PCR (RT-PCR). The sequence was analyzed by bioinformatics tools such as InterProScan, ClustalX2 and MEGA5.2. Then the function of SiGolS6 in plant drought resistance was characterized by phenotype analysis and physiological index measurement oftransgenic. 【】The total length of the CDS sequence ofwas 921 bp, encoding a polypeptide of 306 amino acids. The molecular weight of SiGolS6 is 35.07 kD and its isoelectric point is 4.7. Sequence analysis showed that SiGolS6 protein contained conserved glycosyl transferase domain (IPR002495), belonging to the glycosyl transferase superfamily. Based on phylogenetic tree constructed with GolS proteins from sesame and other species, SiGolS6 was highly similar to the homologous genes in potato. Six independent transgeniclines were identified by hygromycin screening and PCR. Three transgenic lines (OE-2, OE-3, and OE-4) with high expression levels were identified by qRT-PCR, and used for subsequent experiment. Raffinose content in those transgenic plants was higher than that in wild-type (WT) plants. Under drought stress, the wilting degree of transgenic lines was less than that of WT lines. After 28 d of drought stress and 5 d of recovery, the fresh weight of transgenic lines was significantly higher than that of WT, but there was no significant difference under normal conditions. After 5 d of recovery, 50% of transgenic plants recovered, while the survival rate of WT was less than 10%. After 21 d of drought stress, the relative electrical conductivity, ROS accumulation and MDA content of transgenic plants were significantly lower than those of WT, while the relative activities of SOD and POD were significantly higher than those of WT.【】Overexpression ofcould improve the drought tolerance of transgenic plant.
sesame; galactinol synthase; transgenic; drought tolerance; functional analysis

10.3864/j.issn.0578-1752.2020.17.002
2019-12-30;
2020-03-08
國家特色油料產業技術體系(CARS-14)、中國農業科學院科技創新工程(CAAS-ASTIP-2016-OCRI)、中央級公益性科研院所基本科研業務費專項(Y2019XK15-02)
劉愛麗,E-mail:liuailihappy@126.com。通信作者游均,E-mail:junyou@caas.cn
(責任編輯 李莉)

