丙二醛氧化對核桃分離蛋白結構及乳化性的影響
王耀松,張唯唯,馬天怡,蔡敏,張怡帆,胡榮蓉,唐長波
(1南京林業大學輕工與食品學院,南京 210037;2南京農業大學食品科學技術學院/肉品加工與質量控制教育部重點實驗室/農業農村部肉品加工重點實驗室/江蘇省肉類生產加工與質量控制協同創新中心,南京 210095)
0 引言
【研究意義】核桃含有豐富的蛋白質、不飽和脂肪酸、維生素、礦物質和多酚類物質[1],具有極高的營養價值和生理活性[2]。在核桃這種多組分構成的食品物料體系中,隨著食品物料生產、貯藏和加工過程中經歷不同的環境(比如內源性因素中的脂氧合酶和外源性因素中的紫外線、氧氣、溫度、輻射和相對濕度等),而使各個組分內和組分間發生潛在的各類氧化反應[3]。一方面內源性脂肪酶啟動氧化不飽和脂肪酸[4]及脂肪酸自動氧化[5],這些反應產生各類自由基及醛類等物質,進而在共組分體系中氧化蛋白[6];另一方面是蛋白質的自發氧化反應[7]。蛋白質相對于脂類物質更易被氧化[3],而對于核桃原料體系高不飽和脂類含量和蛋白作為乳狀液重要功能組分的特點,在脂肪氧合酶作用下發生次級氧化反應[4]進而影響核桃組分的感官品質、營養性及加工功能性的下降,從而直接影響核桃蛋白的各類功能性;而蛋白原料承載食品的營養性和各類加工性能,特別是乳化功能性[8],它為核桃蛋白的應用和飲料制造提供了基礎。中國是核桃生產大國,2017年核桃產量約為384.55萬 t干果,種植面積仍不斷在擴大,產量還有持續增產的趨勢,可見它是大宗的林下經濟產品。對其進行產品品質保藏的研究具有重要的理論價值和現實意義。【前人研究進展】目前對核桃中重要組分蛋白開展研究,采用不同氧化體系模擬核桃仁體系中發生的各類蛋白氧化,取得了一定的進展。孫領鴿等[9]采用丙烯醛模擬脂肪氧合酶誘導脂類氧化成小分子醛類物質,發現這類氧化修飾核桃蛋白的結構并引起溶解度、乳化性能的顯著下降。王丹丹等[10]采用2,2'-鹽酸脒基丙烷熱降解形成烷過氧自由基模擬脂質過氧化反應過程中產生的脂質自由基對蛋白的氧化,發現這類氧化降低蛋白結構有序性,形成以疏水作用力、氫鍵和離子鍵等作用力為基礎的高分子聚集體。該研究組[11-12]又采用脂肪氧合酶/亞油酸體系構建脂質氫過氧化物對核桃蛋白進行不同程度的氧化,發現氧化形成不同類蛋白聚集體,通過對蛋白結構的修飾,在低濃度氧化作用下促使蛋白結構展開,形成可溶性聚集體并提高蛋白乳化功能性;而高濃度氧化則增大蛋白粒徑、形成不溶性聚集體進而降低蛋白乳化功能性。【本研究切入點】雖然采用不同氧化體系對核桃蛋白結構與功能的影響有一些研究,但作為脂質過氧化產物的MDA對核桃蛋白氧化的影響尚未見報道。【擬解決的關鍵問題】通過構建MDA氧化模擬多不飽和脂肪酸在脂肪氧合酶作用下及其自發氧化的產物對核桃蛋白的氧化,研究核桃蛋白物理化學性質、結構和乳化功能,從分子水平上探討蛋白結構與其乳化功能性之間的內在關系,為揭示不飽和脂類氧化物質對蛋白功能性的影響機制提供參考。
1 材料與方法
試驗于2018年7月至2019年6月在南京林業大學輕工與食品學院進行。
1.1 材料與試劑
核桃2018年3月購于南京玄武區鎖金村菜市場(產地新疆);1,1,3,3-四乙基環丙烷(分析純),購于美國Sigma Chemical公司;其他化學試劑均為分析純,購于國藥集團化學試劑有限公司。
1.2 主要儀器與設備
FE28型pH計,梅特勒-托利多儀器(上海)有限公司;Avanti JXN-26高速冷凍離心機,美國貝克曼庫爾特有限公司;SCIENTZ-18N冷凍干燥機,寧波新芝生物科技股份有限公司;UVmini-1240紫外可見分光光度計,島津企業管理(中國)有限公司;SpectraMax?i3x多功能酶標儀,美谷分子儀器(上海)有限公司;Mos-45圓二色譜儀,法國 Bio-Logic公司;Mini-Protean? Tetra Cell電泳儀,美國 BIO-RAD公司;Nanoplus-2 Zeta電位儀,麥克默瑞提克(上海)儀器有限公司;BT-90納米激光粒度分布儀,丹東百特儀器有限公司;H1-16KR臺式高速微量冷凍離心機,湖南可成設備儀器有限公司。
1.3 試驗方法
1.3.1 核桃蛋白的提取 參考 MAO 等[13]的方法做適當修改。將核桃去殼、去種皮后50℃烘干,用高速粉碎機磨碎成漿糊狀(時間60 s);為了減少油脂含量,在10℃下10 000 r/min離心50 min以得核桃粕。加入正己烷,按料液質量體積比1﹕10處理1 h以脫除核桃中的油脂;使用中速定性濾紙抽濾得到濾餅,將濾餅用正己烷再次處理,直到濾液呈無色為止。收集濾餅,并攤平置于通風櫥內揮發干溶劑以備用(脫脂塊狀物);最后用高速粉碎機將脫脂塊狀物磨成粉,即得到脫脂粉。采用堿溶酸沉法制備核桃分離蛋白。將脫脂后的粗核桃粉加去離子水(質量/體積為1﹕60)溶解,調節核桃蛋白溶液pH至11,攪拌1 h后在10 000 r/min、4℃條件下離心20 min取上清液。將上清液pH調為4.5后攪拌1 h,再次在同等條件下離心取沉淀,將沉淀物水洗至中性;所提取核桃蛋白冷凍干燥后放置-20℃冰箱備用。
1.3.2 MDA氧化體系的構建 參照 ADAMS等[14]的方法。稱取0.44 g 1,1,3,3-四乙基環丙烷溶于20 mL 0.1 mol·L-1HCl溶液中,水浴50℃加熱1 h,直至溶液顏色變為深黃色,冷卻后置于4℃冰箱冷藏備用。MDA濃度可在267 nm波長處測定,摩爾吸光度系數為31 500 L·mol-1·cm-1。
1.3.3 MDA氧化核桃蛋白的制備 稀釋MDA儲備溶液,使其終濃度分別為 0、0.1、1、5、10 和 20 mmol·L-1,將溶液pH調為8.0,加入核桃蛋白使蛋白濃度為10 mg·mL-1,在室溫下反應24 h。之后將上述樣品在4℃超純水中透析72 h,真空冷凍干燥得到MDA氧化核桃蛋白,置于4℃下貯存備用。
1.3.4 濁度、溶解度的測定 將不同MDA氧化度的核桃蛋白樣品溶解于去離子水中,使蛋白濃度為 10 mg·mL-1,再用1 mol·L-1NaOH將pH均調至8.0后,在600 nm處直接測定其吸光度,其值表示為蛋白濁度。參考WANG等[15]方法測定溶解度,將濃度為10 mg·mL-1、pH 8.0的不同MDA氧化度溶液樣品,在室溫下12 000×g離心20 min。采用雙縮脲法測定上清液中蛋白濃度,再與初始蛋白濃度之比表示為蛋白溶解度。
1.3.5 總巰基、二硫鍵的測定 參考 LIU等[16]測定方法并略作修改。使用濃度為10 mmol·L-1pH 8.0的磷酸鹽緩沖液將氧化后的核桃蛋白溶液樣品稀釋到濃度為2 mg·mL-1,然后取0.5 mL稀釋后的核桃蛋白溶液,加入2.0 mL的10 mmol·L-1的磷酸鹽緩沖液(pH 8.0,含 8 mol·L-1尿素、3% SDS);再加入 50 μL 10 mmol·L-15,5'-二硫代二硝基苯甲酸鹽,充分混合后在室溫下放置15 min,最后在412 nm波長下測定其吸光值。在二硫鍵的測定中,取0.1 mL稀釋液加入1.5 mL新鮮制備的 2-硝基-5-硫代磺酸基苯甲酸(NTSB),避光環境中反應25 min,空白對照組用0.1 mL去離子水代替,在412 nm波長下進行比色。巰基和二硫鍵的含量使用摩爾吸光系數13 600 M-1·cm-1計算。
1.3.6 自由氨基的測定 參考WANG等[17]測定方法略作修改,將核桃蛋白溶液稀釋到0.4%,取稀釋后的蛋白溶液 125 μL,加入 2 mL 0.1 mol·L-1磷酸鹽緩沖液(pH 8.0)和 1 mL 0.01%(v/v)的三硝基苯磺酸(TNBS)溶液,充分振蕩混勻后在 50℃的水浴中避光反應 30 min,再加入 2 mL 0.1 mol·L-1Na2SO3以終止反應;冷卻15 min左右至室溫,在420 nm處測定其吸光值。空白對照為相同操作下,用去離子水代替樣液。自由氨基含量根據 L-亮氨酸(L-Leu)含量的標準曲線來確定。
1.3.7 羰基的測定 參考LEVINE等[18]的測定方法,略作修改,取50 μL 1%的核桃蛋白溶液,加入2 mL 10 mmol·L-12,4,-二硝基苯肼(溶解于 2 mol·L-1鹽酸中),避光條件下反應1 h,每隔10 min使用渦旋儀混勻樣品一次。之后加入2 mL 20%(w/v)三氯乙酸沉淀蛋白,5 000×g離心10 min,棄去上清液,將沉淀物攪碎后加入4 mL脫色液(乙醇/乙酸乙酯體積比為1﹕1),再靜置 10 min,按同樣的方法反復清洗沉淀 3次,最終棄去上清液,用空氣吹干樣品。吹干后的樣品中加入1.5 mL的6 mol·L-1鹽酸胍,混勻后在50℃水浴中反應30 min,在370 nm條件下測定吸光度。蛋白的濃度采用雙縮脲法測定,標準曲線用BSA作為反應蛋白。羰基含量使用摩爾吸光系數 22 400 M-1·cm-1計算。
1.3.8 聚丙烯酰胺凝膠電泳 參考 LAEMMLI法[19]進行電泳。采用 5%濃縮膠和 10%分離膠;樣品制備采用還原和非還原兩種方式,還原劑β巰基乙醇(β-ME)濃度為 5%(v/v),非還原劑采用加入 1 mmol·L-1N-乙基順丁烯二酰亞胺來抑制在制備樣品中可能生成的二硫鍵。上樣量為 15 μg;開始電泳時電流設定為20 mA,待樣品越過濃縮膠和分離膠之間的界限后調為40 mA。用考馬斯亮藍R250染色3 h或者過夜染色,之后脫色直至無背景色。
1.3.9 熒光光譜的測定 根據1.3.4中測定的蛋白溶解度,并參考WANG等[20]的方法,用10 mmol·L-1pH 8.0的磷酸鹽緩沖液將蛋白溶液稀釋至0.5 mg·mL-1,在多功能酶標儀上設定激發波長λex為280 nm,發射波長λem為300—500 nm,掃描樣品熒光強度。
1.3.10 蛋白二級結構的測定 采用遠紫外區圓二色譜法測定核桃蛋白的二級結構含量。參照 HARLEY等[21]測定方法略作修改。將上述冷凍干燥的核桃蛋白溶于10 mmol·L-1磷酸(pH 8.0)緩沖液中充分溶解后,在室溫下10 000 ×g離心10 min,取上清液并調整濃度為0.1 mg·mL-1,室溫下190—250 nm掃描;樣品池光程長為2 mm,靈敏度為100 mdeg·cm-1,試驗值為8次掃描的均值。采用曲線擬合軟件CDpro計算蛋白質的二級結構組成。
1.3.11 疏水性的測定 參考 KATO 等的[22]測定方法,采用8-苯胺基-1-萘磺酸鎂(ANS-Mg)熒光探針測定。將濃度為1%的核桃蛋白溶液在22℃、12 000×g條件下離心20 min,取1 mL上清液和4 mL雙縮脲混勻后測定蛋白含量。用10 mmol·L-1pH 8.0的磷酸鹽緩沖液將蛋白溶液稀釋到0.5—4.0 mg·mL-1,分別取不同濃度的樣液 2 mL與 20 μL 8 mmol·L-1ANS-Mg混合,充分振蕩后采用多功能酶標儀測定其熒光強度。空白為不加核桃蛋白溶液的2 mL 0.01 mol·L-1磷酸鹽緩沖液(pH 8.0),其余操作均相同。設定激發波長λex=365 nm,發射波長λem=484 nm,狹縫校正均為5 nm。以熒光強度對蛋白濃度作曲線,得到回歸線方程的斜率即為蛋白的表面疏水性指數值。
1.3.12 ζ-電位和粒徑的測定 參考 WANG 等[21]方法,使用10 mmol·L-1磷酸鹽緩沖液(pH 8.0)稀釋新鮮制備的氧化核桃蛋白溶液濃度至5 mg·mL-1,采用納米激光粒度分布儀BT-90和Nanoplus 2 Zeta電位儀分別測定蛋白粒徑和Zeta電位。
1.3.13 乳化活性和乳化穩定性的測定 參考WANG等[15]方法,取氧化后的蛋白溶液15 mL(濃度為10 mg·mL-1)和5 mL大豆油混合,在13 000 r/min速度下均質2 min,立即倒入25 mL燒杯中,在距離燒杯底部5 cm處取20 μL的乳狀液與5 mL質量/體積為0.1% SDS溶液混合,測定其在500 nm處的吸光值,記為A0,乳狀液靜置30 min后采用相同的方法測定乳狀液的吸光值,記為At。空白對照用 0.1% SDS溶液。
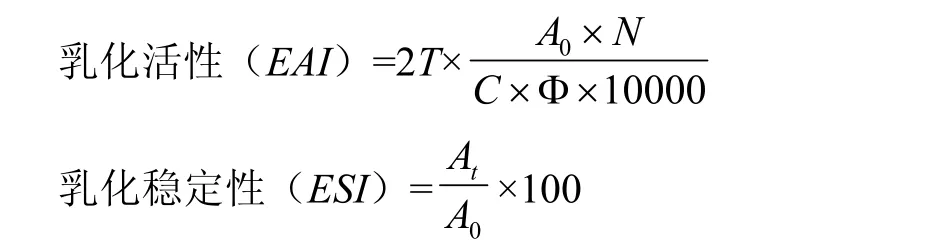
式中,T=2.303;N:稀釋倍數為250;C:配置的蛋白質水溶液中的蛋白濃度(g·mL-1);Φ:乳化液中油的體積分數(25%);A0:0 min吸光值;At:30 min吸光值。
1.4 數據統計分析
所有數據至少平行3次,且試驗重復了2次,結果表示為“平均值±標準差”。數據處理采用Statistix軟件進行統計分析,顯著性水平為α=0.05;用LSD檢驗數據間的差異顯著性,用P<0.05表示。
2 結果
2.1 MDA氧化對WPI溶解度和濁度的影響
從圖1可以看出,核桃蛋白的溶解度隨著 MDA濃度提高而顯著下降(P<0.05),其值從 68.74%下降到11.88%。蛋白溶解度降低的趨勢可分為兩個主要下降階段,在0.1—1 mmol·L-1MDA對核桃蛋白的溶解度影響較大;當MDA濃度超過5 mmol·L-1時,氧化對核桃蛋白溶解度降低的影響則極為顯著(P<0.05),且呈現近線性關系下降。對于不同MDA氧化度核桃蛋白的濁度,在0.1—20 mmol·L-1內的MDA氧化對核桃蛋白濁度的降低影響不顯著;所有氧化蛋白樣品的濁度在0.32左右,比對照組(0 mmol·L-1)下降約 0.05;5 mmol·L-1MDA 氧化度的蛋白溶液濁度最低。相比于0.1—5 mmol·L-1氧化度核桃蛋白的溶解度和濁度,基本呈現一致的變化規律;然而當 MDA濃度超過5 mmol·L-1時,核桃蛋白的溶解度與濁度變化速度規律不再平行一致,核桃蛋白溶解性的下降速率顯著加大,而其溶液的濁度變化則不顯著。綜上,MDA氧化顯著影響核桃蛋白溶解度,其中最大氧化度的 MDA致使核桃蛋白溶解度降低約82.8%,然而MDA對核桃蛋白溶液的濁度影響不顯著。
2.2 MDA氧化對WPI分子基團的修飾
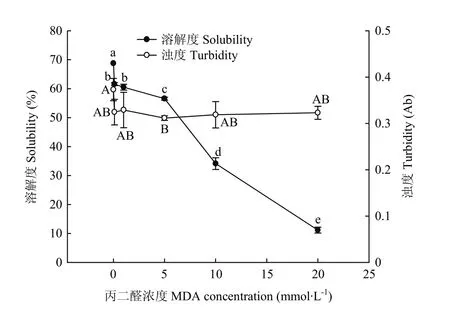
圖1 MDA氧化對核桃分離蛋白溶解度和濁度的影響Fig.1 Effect of MDA-induced protein oxidation on the solubility and turbidity of walnut protein isolate
從分子結構上來分析核桃蛋白分子作為氧化標記性的基團,測定了總巰基、二硫鍵、羰基和自由氨基含量變化如圖 2所示。在 0.1—5 mmol·L-1濃度內的MDA氧化對總巰基含量影響不顯著,而當MDA濃度超過10 mmol·L-1則顯著降低總巰基含量(P<0.05)。對應的二硫鍵在1 mmol·L-1MDA以上濃度時,其含量即顯著增加(P<0.05);在高于此濃度中,總巰基含量的下降、二硫鍵含量的上升,幾乎呈現線性變化。在最高氧化度時,它們含量分別對應地降低了55.93%和上升了188.46%。對于不同氧化核桃蛋白的羰基含量,在低于5 mmol·L-1濃度時,MDA對其含量上升沒有顯著性影響(P>0.05),當 MDA濃度在5—10 mmol·L-1則顯著增加了羰基含量(P<0.05),之后隨著 MDA濃度的增加而趨于平穩。在 0.1—5 mmol·L-1濃度內的MDA對自由氨基含量沒有顯著影響(P>0.05),而高于此濃度時,MDA顯著降低自由氨基含量(P<0.05)。與未氧化核桃蛋白相比,蛋白中的羰基和氨基含量在MDA濃度20 mmol·L-1時分別上升了705.50%和下降了51.38%。以上這些代表性化學基團含量變化表示了MDA對核桃蛋白的氧化程度。
2.3 MDA氧化對WPI交聯性的影響
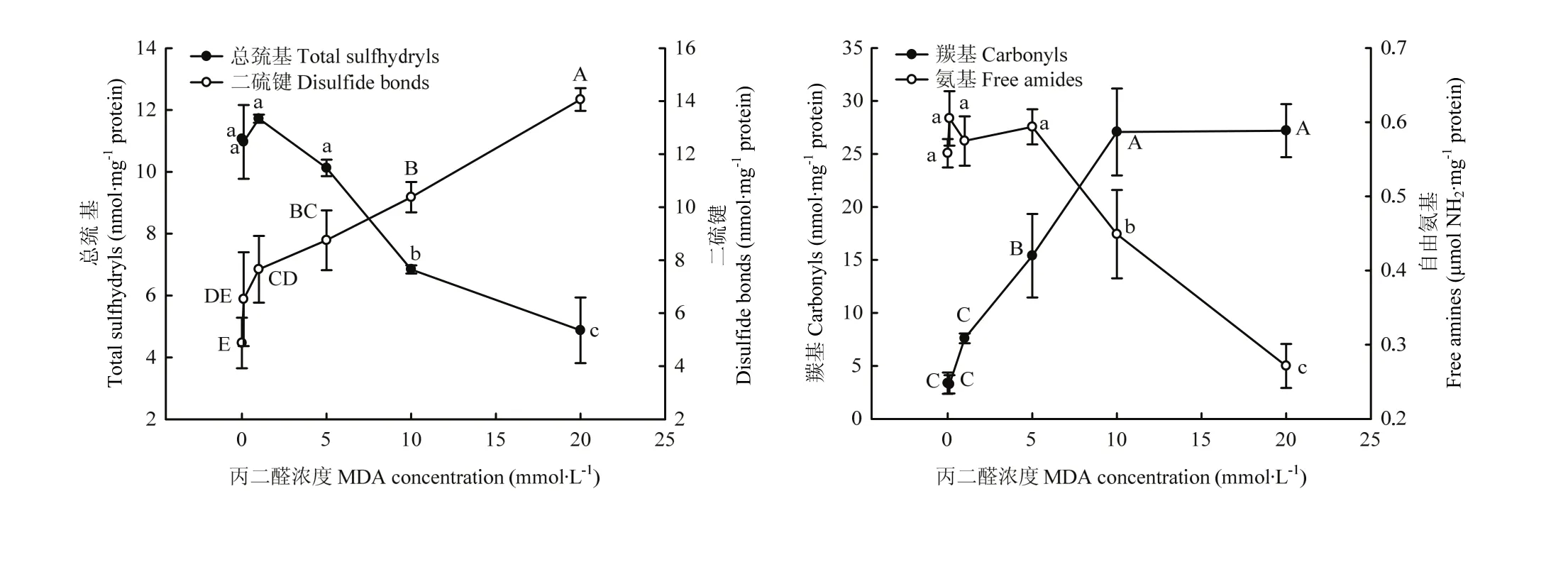
圖2 MDA氧化對核桃分離蛋白總巰基、二硫鍵、羰基及自由氨基含量的影響Fig.2 Effect of MDA-induced protein oxidation on total sulfhydryls, disulfide bonds, carbonyls and free amines in walnut protein isolate

圖3 不同MDA氧化度的核桃分離蛋白的聚丙烯酰胺凝膠電泳圖Fig.3 Sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE) patterns of walnut protein isolate treated with MDA at various concentrations
蛋白交聯是其氧化的一個重要結果。采用SDS-PAGE對MDA氧化核桃蛋白的分離結果如圖3所示。在非還原條件下,隨著氧化劑MDA濃度的上升,發現進入膠體的內蛋白量開始降低,特別是當MDA濃度為1 mmol·L-1時,進入膠體的蛋白總量開始顯著減少;從膠體上可分離的核桃蛋白組分來看,每個條帶的含量都在降低(非還原膠-βME,主要可分為14個組分),含量下降比較明顯的組分是1、6、7、8、9、10,另外10和20 mmol·L-1MDA氧化的組分4和5消失,而此濃度下組分11、12、13、14含量顯著降低。為了驗證這些條帶中可能存在是的二硫鍵,在還原膠+βME中發現,樣品中加入還原劑后出現在膠體上條帶數明顯增多,圖3中將變化較為明顯的組分作了標記,主要為組分b、d、e、f、g、h和i隨著氧化濃度的升高而降低,組分k在氧化濃度超過5 mmol·L-1后消失;組分a和c則隨著氧化劑濃度升高而較為明顯的升高;在5—20 mmol·L-1濃度下的MDA氧化,出現新組分j。以上這些變化說明MDA氧化將蛋白分子間也引入了非還原性共價鍵,進一步驗證了氧化對核桃蛋白的修飾。
2.4 MDA氧化WPI的熒光光譜
MDA氧化對核桃蛋白結構影響的熒光光譜見圖4,可以看出總體上隨著氧化度的增加,核桃蛋白強度不斷下降。0.1 mmol·L-1MDA氧化對核桃蛋白結構的影響不顯著,而當MDA濃度為1 mmol·L-1時則較為明顯地降低核桃蛋白的熒光強度;當被超過 5 mmol·L-1濃度的MDA氧化,蛋白熒光強度顯著降低,直到MDA濃度增加到20 mmol·L-1時,核桃蛋白的熒光強度趨于0。從蛋白二級結構數據(表1)可以看出,低濃度氧化(比如:0.1 mmol·L-1時)對核桃蛋白二級結構無顯著影響(P>0.05),隨著MDA濃度增加至較低濃度1 mmol·L-1時,則顯著降低核桃蛋白二級結構α-螺旋、β-折疊和β-轉角的相對含量(P<0.05),相應地顯著增加無規則卷的相對含量(P<0.05)。較高濃度的MDA(>1 mmol·L-1)進一步顯著降低有序結構α-螺旋、β-折疊和β-轉角的相對含量(P<0.05),進一步顯著提高無規則卷曲的含量(P<0.05)。這些變化體現了MDA氧化對核桃蛋白分子結構的修飾并進而影響蛋白功能性。
2.5 MDA氧化對WPI疏水性的影響
MDA氧化對核桃蛋白疏水性的影響如圖 5所示。MDA在較低濃度(<1 mmol·L-1)時對核桃蛋白疏水性的影響不顯著(P>0.05);當MDA濃度超過1 mmol·L-1時,核桃蛋白的疏水性顯著下降(P<0.05)。在10 mmol·L-1以下的濃度時,核桃蛋白疏水性要比在高濃度時(10—20 mmol·L-1)時的下降速率大。在MDA最高濃度為20 mmol·L-1時,疏水性指數為32.1,僅為對照組(即未氧化核桃蛋白,0 mmol·L-1)樣品疏水性的1/10。疏水性的降低暗示著蛋白疏水性氨基酸可能被修飾或蛋白構象發生改變。

圖4 不同MDA氧化度的核桃分離蛋白的熒光光譜Fig.4 Fluorescence spectrum of walnut protein isolate treated with different MDA oxidation degree

圖5 MDA氧化對核桃分離蛋白疏水性的影響Fig.5 Effect of MDA-induced protein oxidation on surface hydrophobicity of walnut protein isolate

表1 MDA氧化核桃分離蛋白的二級結構含量Table 1 Secondary structure content of MDA-induced walnut protein isolate
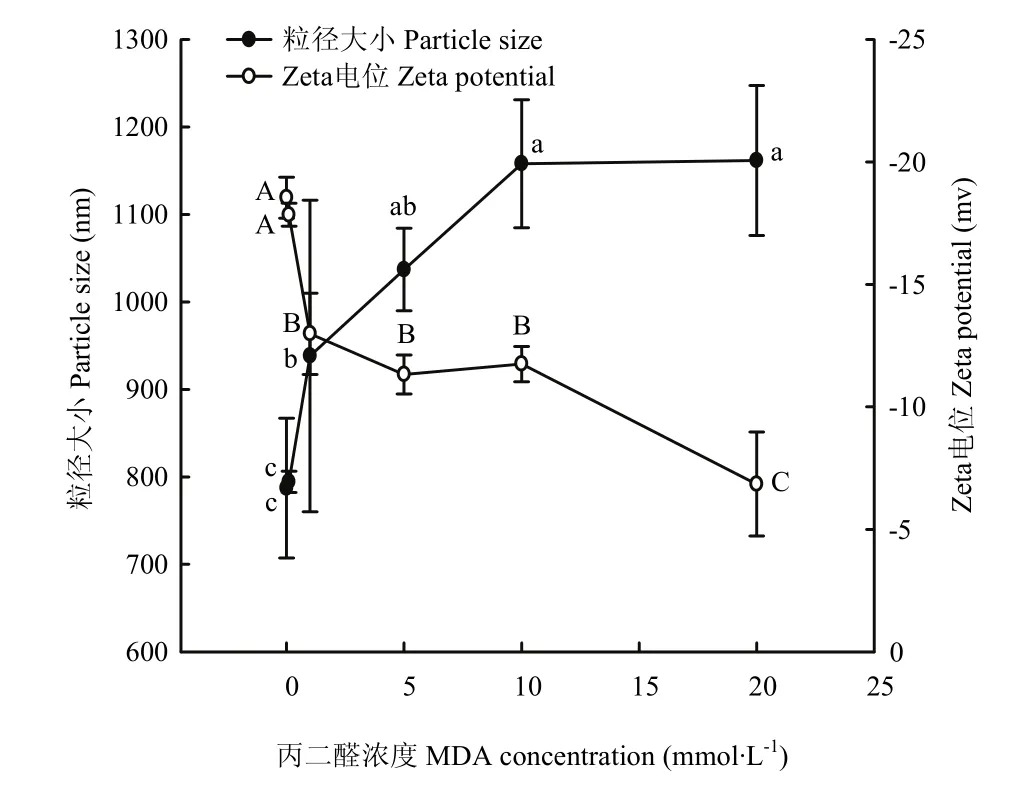
圖6 MDA氧化對核桃分離蛋白粒徑和電位的影響Fig.6 Effect of MDA-induced protein oxidation on particle size and Zeta potential of walnut protein isolate
2.6 MDA氧化對WPI粒徑和Zeta電位的影響
從圖6可以看出,0.1 mmol·L-1以下濃度的MDA對核桃蛋白平均粒徑無顯著性影響(P>0.05),其大小約為790 nm;當MDA濃度在1—5 mmol·L-1時,氧化顯著增加蛋白粒徑(P<0.05),達到1 000 nm左右;隨著MDA濃度增加到10 mmol·L-1時,蛋白粒徑增大至約1 158 nm,但當MDA濃度增加到最大濃度20 mmol·L-1時,蛋白粒大小幾乎不再增加。對于蛋白粒子帶電量,0.1 mmol·L-1MDA氧化沒有造成蛋白Zeta電位的顯著性變化(P>0.05),1—5 mmol·L-1MDA濃度則顯著降低蛋白 Zeta電位(P<0.05),其值下降到-12 mv左右;當濃度從 10 mmol·L-1增大到 20 mmol·L-1時,核桃蛋白的Zeta電位從-11.75 mv降至-6.85 mv,僅為未被MDA氧化(0 mmol·L-1)核桃蛋白Zeta電位值的1/3,這大幅降低了蛋白的帶電量(P<0.05)。在從低濃度到高濃度的MDA氧化過程中,核桃蛋白的帶電性一直未改變,始終為負電但其絕對值在降低。
2.7 MDA氧化對WPI乳化性的影響
圖7顯示了不同濃度MDA氧化對核桃蛋白乳化功能性的影響。低濃度MDA(0.1 mmol·L-1)使核桃蛋白乳化活性顯著降低(P<0.05),但對核桃蛋白乳化穩定性沒有顯著影響(P>0.05)。在1—10 mmol·L-1內,核桃蛋白乳化活性幾乎呈現直線顯著性下降,而在 10 mmol·L-1至最高濃度時,乳化活性降低速率變慢,最終乳化活性值為未氧化蛋白的1/3。MDA濃度在1 mmol·L-1以上時,核桃蛋白乳化穩定性也是保持降低的趨勢,最終乳化穩定性值不及未氧化蛋白的1/2。說明低濃度MDA氧化對核桃蛋白乳化功能性影響不顯著,而MDA濃度超過1 mmol·L-1時,極顯著降低核桃蛋白乳化功能性。

圖7 MDA氧化對核桃分離蛋白乳化性的影響Fig.7 Effect of MDA-induced protein oxidation on the emulsifying properties of walnut protein isolate
3 討論
3.1 MDA氧化對WPI修飾的分子基礎
MDA是脂類氧化的產物,它的結構上存在兩個醛基/羰基,這決定了它與核桃蛋白分子反應基礎;另外從蛋白氨基酸殘基組成與結構來看,它也有與MDA的醛基/羰基反應的基團,比如 His、Lys、Arg、Glu及蛋白分子N-末端[15,23-24]。對于其他氨基酸,比較典型的是 Cys,它有一個自由巰基,對氧化反應比較敏感,易形成對蛋白質物化性質和功能性有比較重要影響的二硫鍵和其他含硫的多種產物[25]。本研究發現隨著MDA濃度的增加,巰基含量顯著降低,這一方面是巰基基團與MDA反應過程中被消耗[26];另一方面是在氧化作用下轉化為二硫鍵[27]及其他含硫產物[28]。在大豆蛋白[29-30]、米蛋白[31]和乳清蛋白[32]的MDA氧化體系中也發現巰基含量下降的現象;而二硫鍵含量變化不盡相同,在米蛋白MDA氧化體系中二硫鍵的含量也提高[31],然而在大豆蛋白體系中,MDA氧化卻降低了二硫鍵的含量,認為是構象改變導致二硫鍵的斷裂[29-30]。
核桃蛋白分子中的氨基含量也在氧化后顯著下降,這暗示著蛋白中來自氨基酸殘基中的氨基在減少,比如Lys中的ε-氨基酸和N-末端的氨基;它們與來自 MDA中的羰基相互作用,最為典型的是羰氨反應(美拉德反應)[33],或與組氨酸(His)、賴氨酸(Lys)和Cys形成Schiff堿[24,34]。作為蛋白氧化修飾最為代表性的反應是蛋白羰基化[18],在本試驗中也得到了反映,發現核桃蛋白羰基含量隨著MDA含量增加而顯著增加。在肌纖維蛋白中,也發現有類似的現象[35]。MDA通過與蛋白親和加成反應形成Schiff堿或Michael加成反應而使蛋白引入羰基[36],抑或蛋白直接氧化形成羰基[37]。相比于核桃蛋白中的羰基濃度與加入的 MDA濃度值,顯然是 MDA對核桃蛋白羰基的主要貢獻來自于它對蛋白的直接氧化。
以上這些 MDA與核桃蛋白分子相互之間潛在的化學反應以及分子間的巰基/二硫鍵轉化反應,通過測定它們的含量得到了驗證;在SDS-PAGE試驗中也得到了驗證。加入還原劑β巰基乙醇(βME)后,位于非還原性膠體上端大分子量的大部分聚合物被還原,致使分子量顯著降低;然而仍然有部分相對高分子量的聚合物無法被還原成低分子量的條帶,這意味著MDA與核桃蛋白反應生成非可還原性共價鍵,比如MDA的兩個醛基與核桃蛋白中的兩個Lys反應而橋接分子[23],或通過其他加合物的方式[33]。
3.2 MDA氧化修飾WPI結構
以上潛在的分子間反應在核桃蛋白結構變化上得到進一步的反映和驗證。采用熒光強度來表征氧化對蛋白結構的影響,而對熒光強度貢獻最大的是色氨酸(Trp)[38]。有文獻報道,MDA可與Trp殘基的吲哚環反應[39]從而破壞Trp的含量,降低熒光強度。如果核桃蛋白與MDA形成加合物,那么加合物的熒光強度會隨著MDA升高而顯著升高[40];然而當前數據顯示,MDA顯著降低核桃蛋白的熒光強度,即MDA對核桃蛋白的修飾主要是破壞氨基酸殘基結構而不是與其形成加合物質。在牛血清蛋白與MDA研究中,認為MDA與蛋白反應削減Trp熒光強度是因為Trp的破壞或其所在的微環境發生了改變[41],然而核桃蛋白羰基含量在增加,因此認為MDA是直接破壞Trp而降低樣品的熒光強度。
在核桃蛋白二級結構上,表現出有序結構的喪失及無序結構的提高。在丙烯醛氧化米蛋白研究中[31],發現α-螺旋結構含量隨著氧化度的增加顯著損失;在肌纖維蛋白中也發現此現象[42],然而β-折疊結構含量卻在提高。本研究結果與孫領鴿等[9]利用丙烯醛氧化核桃蛋白所獲得的二級結構含量變化類似。也就是說,不同蛋白可能對氧化應激反應不同。而蛋白二級結構的變化則影響蛋白氫鍵、疏水性作用和范德華力,進而為蛋白聚集提供了條件[43]。
蛋白在結構上的變化為其行為的變動提供了基礎,特別是蛋白理化性質方面的變化[44]。疏水性的變化與蛋白結構、聚集行為有很大的內在聯系。氧化使疏水性下降,可能正如前面所討論,MDA與具有一定疏水性的Trp和Cys反應而破壞它的疏水性,或因為氧化形成的蛋白聚集體而包埋疏水性基團有關[45]。從氧化蛋白的溶解度下降和帶電量的減少來看,對應著的是維系蛋白有序結構的氫鍵及靜電作用力的弱化,進而未能提高蛋白疏水性,因此,蛋白疏水性的下降是氧化破壞Trp、形成聚集體造成的。維系蛋白二級結構的氫鍵弱化則降低蛋白結構的有序性,也就是說蛋白溶解度的下降與其二級結構含量減少有關[46]。
氧化誘導作用引起的蛋白分子交聯[47]和聚集作用使其粒徑變大。MDA氧化過程中產生的二硫鍵和非還原性共價鍵為交聯提供了基礎作用力,這可能很大程度上影響著蛋白分子粒徑大小,在MDA氧化米蛋白、米糠蛋白過程中也有類似的現象[31,48]。在氧化過程中,也有溶解性差的聚集體產生,這部分聚集體貢獻了蛋白分子粒徑大小[40]。在測定蛋白質溶解度過程中,發現離心之后樣品中的蛋白含量顯著下降,這也驗證了蛋白溶解度下降的事實。
蛋白分子的帶電性是其在不同食品體系中穩定性的重要基礎[49],比如凝結和聚集等失穩現象,通常使用Zeta電位來表示。它反映帶電粒子表面電荷狀態;在膠體體系中,一般其值絕對值越大表示體系越傾向穩定[50]。蛋白的帶電性取決于所在體系的pH及自身氨基酸殘基的電離特性。在MDA氧化過程中,通常涉及的氨基酸是Lys、His和Cys[51]以及Arg、Gln和Asn[24],特別對于堿性氨基酸Arg、Lys和His,它們遭到破壞則降低蛋白的電離和等電點進而降低蛋白的帶電性。
3.3 MDA氧化修飾WPI乳化功能性
蛋白溶解度可作為蛋白變性或聚集的一個重要標志[52],也是作為蛋白的功能性之一及其他功能性的基礎[53]。MDA氧化蛋白的結果雖然降低了本身的疏水性,然而氧化反應形成的微溶性聚合物,顯著降低了聚合體的帶電量,側鏈修飾而改變蛋白的等電點等因素顯著降低了蛋白溶解性。大豆蛋白[29]、米糠蛋白[48]、肌纖維蛋白[54]等蛋白在 MDA氧化中均引起溶解度的顯著下降。同時本試驗中使用濁度方法對因氧化而導致蛋白聚集對其在溶液中的分散性影響進行了評估,反映了蛋白量和聚集體大小及其分布情況。從測定結果看,MDA氧化核桃蛋白的濁度呈現下降趨勢,意味著蛋白發生了聚集或聚結并引起聚集體或聚結體溶解性能的下降。在一些由pH或熱誘導的蛋白聚集體系中[55-56],用此法或能表征蛋白構象變化。
蛋白乳化活性取決于蛋白分子的形狀、帶電量和疏水性以及偶極子中性、極性基團的水化作用以及乳狀液制備加工工藝(比如溫度、設備選型);而乳化穩定性取決于以上這些因素相互作用的程度[57]。球蛋白的溶解度、表面疏水性、分子柔性等因素對其乳化性行為的影響顯得更為重要[58]。MDA氧化對蛋白分子修飾和結構的影響進而改變了其物理化學性質,特別是因氧化形成共價交聯的聚集體粒徑變大,降低了蛋白的溶解度和分子柔韌性,同時也顯著降低了表面疏水性和帶電量,這顯然弱化了蛋白分子間的靜電相互作用和乳狀液界面膜與水的相互作用,在物理結構上也降低了乳狀液界面膜的厚度且不能形成緊密結構。因此,上述因MDA氧化造成對乳化活性有重要影響的因素調低而顯著降低了乳化能力。從蛋白聚集物尺度上看,氧化顯著削弱了這些聚集體的溶解度和帶電量,從而降低它們之間的相互作用,而傾向于聚集體間的分子聚結、絮凝等作用,這不僅僅降低了核桃蛋白的乳化性,也降低了其乳化穩定性。
MDA氧化雖然增加了蛋白中二硫鍵及其他非還原性共價鍵的含量,但這不足以補償對乳化功能性起支配因素(比如帶電量、疏水性)所產生的正面效應,為此總體上降低了核桃蛋白的乳化功能性。然而在一些氧化體系中發現,低濃度氧化能夠通過促進蛋白疏水基團展開,結合高壓均質處理誘導蛋白柔韌性可顯著提高氧化蛋白的乳化活性[59-60]。在羥基氧化體系中,對氧化程度的控制可提高蛋白乳化功能性[61]。也就是說,通過對氧化劑濃度或對蛋白界面起支配性的作用力進行調節可獲得蛋白乳化功能性的提升;從蛋白抗氧化角度來看,對一些蛋白,控制其氧化可避免乳化功能性的損失。
4 結論
丙二醛(MDA)氧化引起核桃蛋白分子中巰基和自由氨基含量的顯著降低,二硫鍵和羰基含量增加;形成還原性和非還原性共價鍵,促進蛋白分子聚集和交聯;從而顯著提高蛋白分子粒徑大小,降低分子帶電性和疏水性;打亂蛋白分子有序的二級結構,提高了其無序性;進而造成核桃蛋白溶解性和乳化功能性的顯著降低。尤其是5 mmol·L-1以上的MDA氧化度,對核桃蛋白分子修飾、結構改造和功能性損失等影響顯著;而1 mmol·L-1以下的MDA氧化對核桃蛋白上述這些性質影響不顯著。研究結果為核桃蛋白在加工和貯藏過程中,避免因MDA氧化而造成核桃蛋白功能性的損失提供重要參考。

