一種新型含硫曼尼希堿的合成與緩蝕性能研究
胡閃,王任芳,石東坡,楊婷,李克華,蘇鐵軍
(1.長江大學 化學與環境工程學院,湖北 荊州 434023;2.長江大學 工程技術學院,湖北 荊州 434020)

1 實驗部分
1.1 試劑與儀器
苯乙酮、苯甲醛、氨基硫脲、無水乙醇、丙酮等均為分析純。
DF-101S集熱式恒溫磁力攪拌器;NICOLET6700型紅外光譜儀;HH-4數顯恒溫水浴鍋;CHI600E型電化學工作站。
1.2 緩蝕劑的合成
向溶有少量無水乙醇的氨基硫脲中依次加入一定比例的苯甲醛和苯乙酮,用鹽酸調節溶液的pH,在80 ℃下反應6 h后即得緩蝕劑溶液。冷卻,進行減壓蒸餾,得到粗產品,再用無水乙醇重結晶,即得最終產品。緩蝕劑的合成式如下:
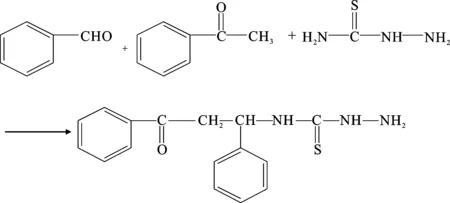
1.3 緩蝕性能評價
1.3.1 失重法 N80鋼進行打磨、清洗后,冷風吹干于干燥器備用。腐蝕介質為加有1%質量分數緩蝕劑的10%HCl溶液,水浴溫度為60 ℃,腐蝕時間為4 h。根據鋼片的失重量,計算腐蝕速率、緩蝕率。
(1)
式中ν——鋼片的腐蝕速率,g/(m2·h);
m0——腐蝕前鋼片的質量,g;
m1——腐蝕后鋼片的質量,g;
S——鋼片表面積,m2;
t——腐蝕時間,h。
(2)
式中η——緩蝕率,%;
ν0——純腐蝕介質時鋼片的腐蝕速率,g/(m2·h);
ν1——腐蝕介質中加入緩蝕劑后鋼片的腐蝕速率,g/(m2·h)。
1.3.2 電化學法 電化學測試主要涉及極化曲線測試和交流阻抗譜兩部分,均通過電化學工作站進行。實驗使用標準的三電極體系,分別為工作電極(N80鋼)、輔助電極(鉑電極)和參比電極(飽和甘汞電極)[7]。測試前工作電極需浸入溶液中,待開路電位達到穩定不變后方可開始測試。極化曲線測試掃描電壓范圍為-1~0 V,電位掃描速率范圍為5 mV/s,電化學阻抗譜測量頻率為0.1~100 kHz,交流激勵信號幅值為5 mV[8]。
2 結果與討論
2.1 合成條件的優化
設計5因素4水平正交實驗,對其合成條件進行優化,因素與水平見表1,結果見表2。
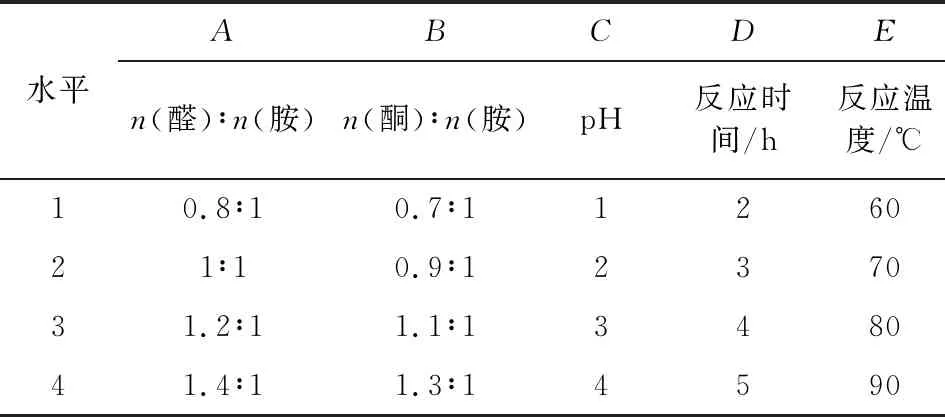
表1 因素水平表
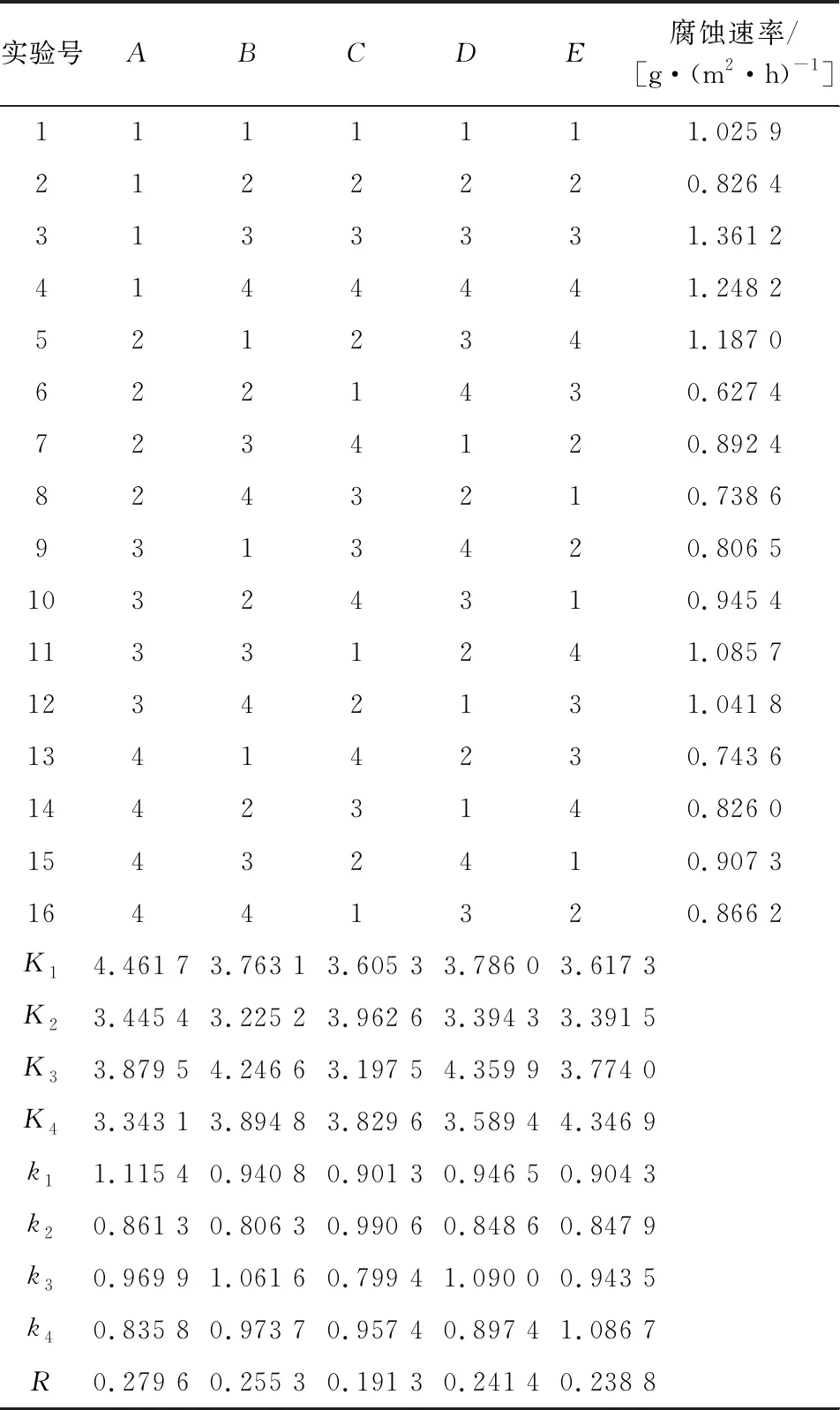
表2 正交實驗結果
由表2可知,對緩蝕劑腐蝕速率影響最大的因素為合成反應物質的摩爾比,其次為時間和溫度,pH對其影響最小。合成反應條件最佳為A4B2C3D2E2,即n(醛)∶n(胺)=1.4∶1,n(酮)∶n(胺)=0.9∶1,pH=3,3 h,70 ℃,方案進行后續的緩蝕性能評價。
2.2 合成產物的表征
產物的紅外光譜圖見圖1,采用kBr壓片法。

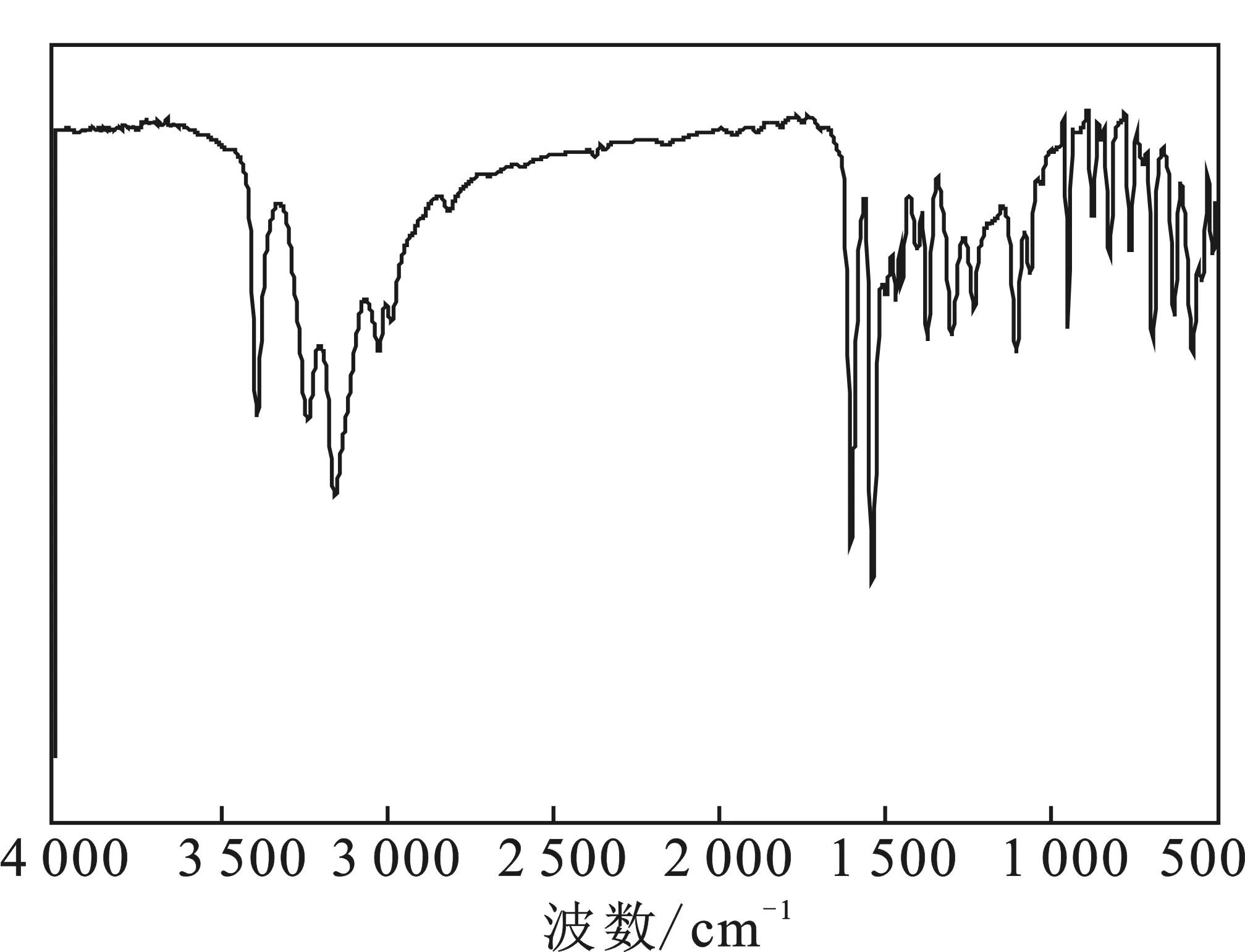
圖1 產物的紅外光譜圖
2.3 失重法結果分析
2.3.1 緩蝕劑加量對腐蝕速率的影響 不同的緩蝕劑加量下,鋼片的腐蝕速率和緩蝕率見圖2。
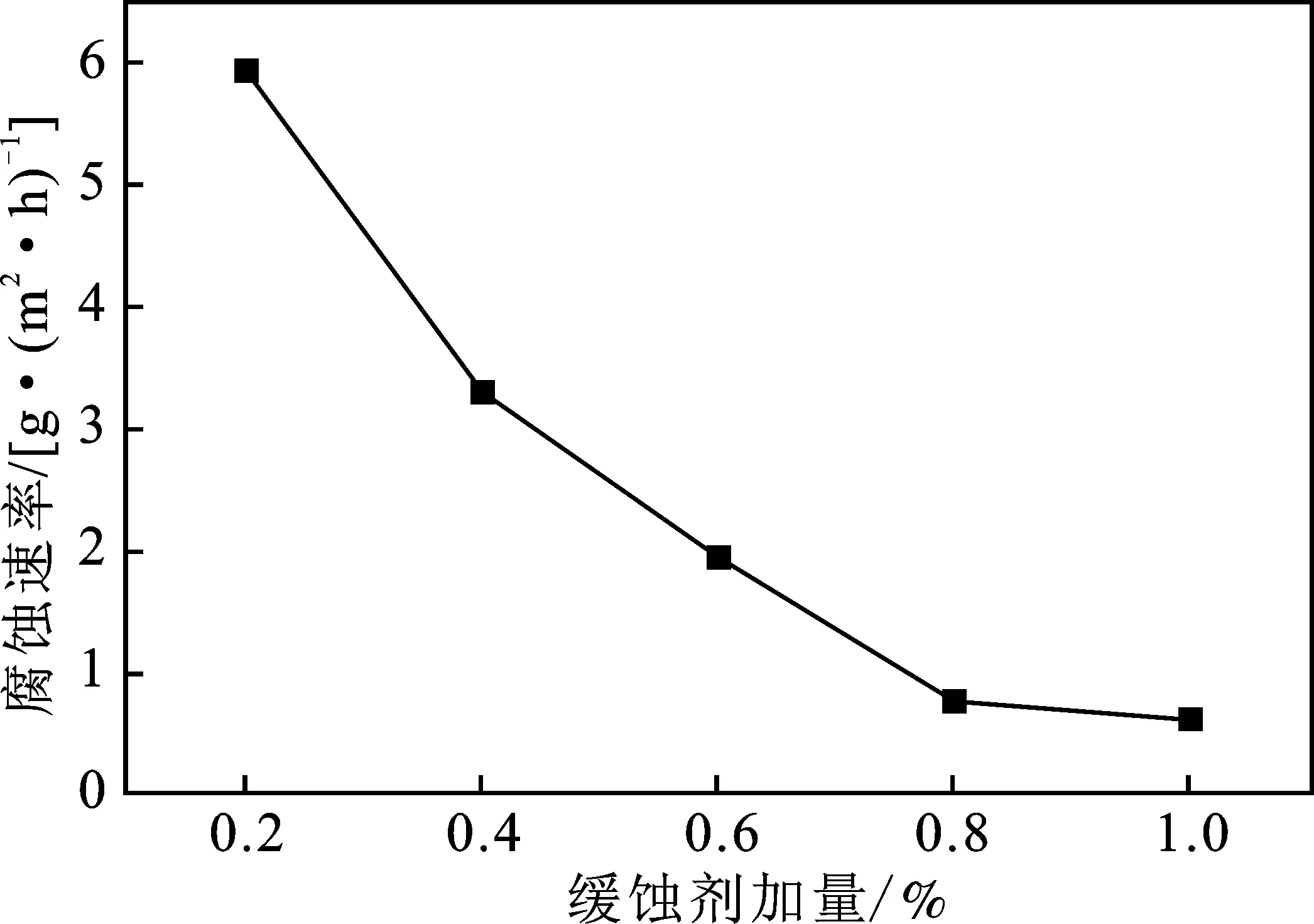
圖2 緩蝕劑加量對N80鋼的腐蝕速率和緩蝕率的影響
由圖2可知,隨緩蝕劑加量的增加,鋼片的腐蝕速率減小,表明緩蝕劑抑制了N80鋼在鹽酸溶液中的腐蝕,尤其當緩蝕劑加量為1%時,腐蝕速率達到最低,為0.627 4 g/(m2·h),緩蝕率達到98%以上。
2.3.2 鹽酸濃度對腐蝕速率的影響 在溫度為333 K,濃度分別為1,2,3,4 mol/L的鹽酸中,分別加入質量分數為1%的緩蝕劑,鋼片浸入4 h后拿出,其腐蝕速率見圖3。
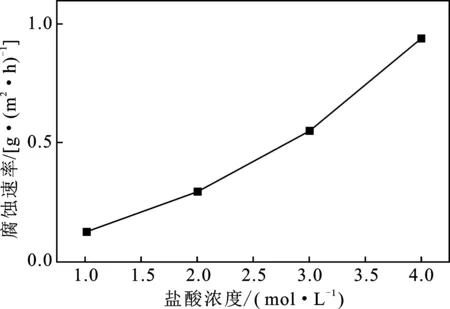
圖3 鹽酸濃度對腐蝕速率的影響
由圖3可知,隨著鹽酸濃度的增加,N80鋼的腐蝕速率變大,但都低于1 g/(m2·h),表明該緩蝕劑的抗酸性能良好,具有很好的緩蝕效果。
2.3.3 溫度對腐蝕速率的影響 在鹽酸濃度10%和緩蝕劑質量分數1%的情況下,改變失重法的溫度,腐蝕速率見圖4。
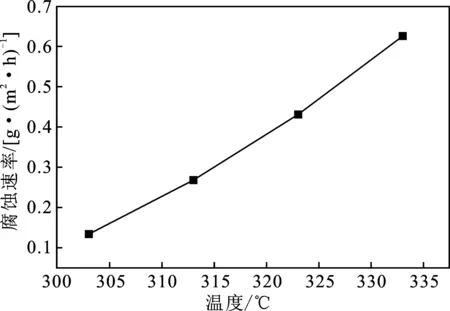
圖4 溫度對腐蝕速率的影響
由圖4可知,N80鋼的腐蝕速率隨著溫度的升高而上升,原因是升高溫度會影響緩蝕劑在N80鋼表面的吸附。
2.4 吸附行為研究
一般情況下,很難直接算出緩蝕劑分子在鋼片表面的覆蓋度,當緩蝕劑作用為幾何覆蓋效應時[9],可用緩蝕率η替代覆蓋度θ。將η=θ代入Langmuir吸附等溫式,發現緩蝕劑分子在N80鋼表面的吸附符合Langmuir吸附等溫式。
Langmuir吸附等溫式見式(3):
(3)
式中c——緩蝕劑濃度,mol/L;
θ——緩蝕劑在N80鋼表面的覆蓋度;
K——Langmuir吸附平衡常數。
以c/θ對c作圖見圖5。
由圖5可知,計算Kads,則吸附吉布斯自由能ΔGads根據式(4)也可計算出來,結果見表3。
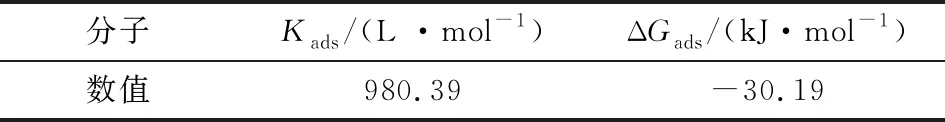
表3 緩蝕劑在N80鋼表面的吸附熱力學參數
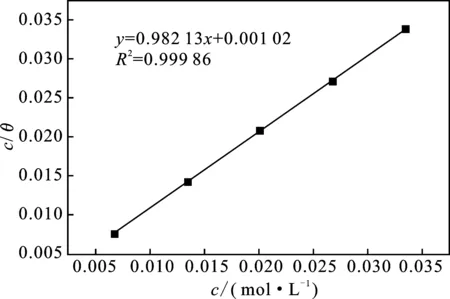
圖5 緩蝕劑在N80鋼上的吸附等溫線
(4)
式中C溶劑——溶劑水的摩爾濃度,取值 55.5 mol/L;
R——理想氣體常數,8.314 J/(mol·K);
T——溫度,K。
文獻表明,當∣ΔGads∣≤20 kJ/mol時,為物理吸附,當20 kJ/mol<∣ΔGads∣<40 kJ/mol為混合吸附,而當∣ΔGads∣≥40 kJ/mol時,為化學吸附[10]。由表3可知,ΔGads< 0且絕對值在20~40 kJ/mol 之間,說明吸附過程是自發的且吸附類型為混合吸附。
2.5 電化學測試法結果分析
2.5.1 極化曲線 實驗在常溫常壓下進行,腐蝕介質為10%鹽酸溶液,測得的極化曲線結果見圖6。極化曲線擬合后的電化學參數見表4。
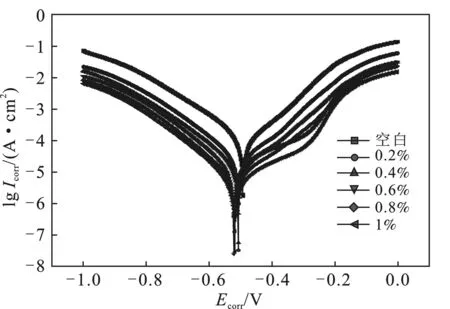
圖6 不同含量緩蝕劑下N80鋼的極化曲線
由圖6和表4可知,加入緩蝕劑后,N80鋼片的腐蝕電流密度明顯降低,說明該緩蝕劑降低了腐蝕過程的電極反應速率。陰極和陽極的Tafel斜率基本保持不變,表明緩蝕劑的加入未改變腐蝕過程中陰極反應和陽極反應機理[11]。腐蝕電流密度的值是通過實驗所測得的Tafel曲線外推測出,以腐蝕電流密度表示的緩蝕率計算公式如下:

表4 極化曲線擬合參數
(5)
由表4可知,隨著緩蝕劑的加入,緩蝕率不斷增加,這與失重法的結果一致。
2.5.2 交流阻抗 電化學阻抗譜測試所用工作電極的材質、電極系統的組成和測試條件與極化曲線均相同,采用Zview軟件對其測試結果按照圖8的等效電路進行擬合,擬合的數據見表5。其中,RS為溶液電阻,CPE為常相位角元件,Rct為電荷轉移電阻,n為彌散系數[12]。

圖8 交流阻抗譜擬合等效電路
由圖7和表5可知,CPE-T值逐漸減小,表明緩蝕劑分子吸附在電極表面,導致電極界面的雙電層電容減小。加入緩蝕劑后,彌散指數n基本不變,表明電極反應過程仍屬于電化學控制過程[13]。容抗弧直徑增大,Rct值逐漸升高,說明反應的阻力在增大,腐蝕反應過程更加艱難,起到了很好的緩蝕效果。
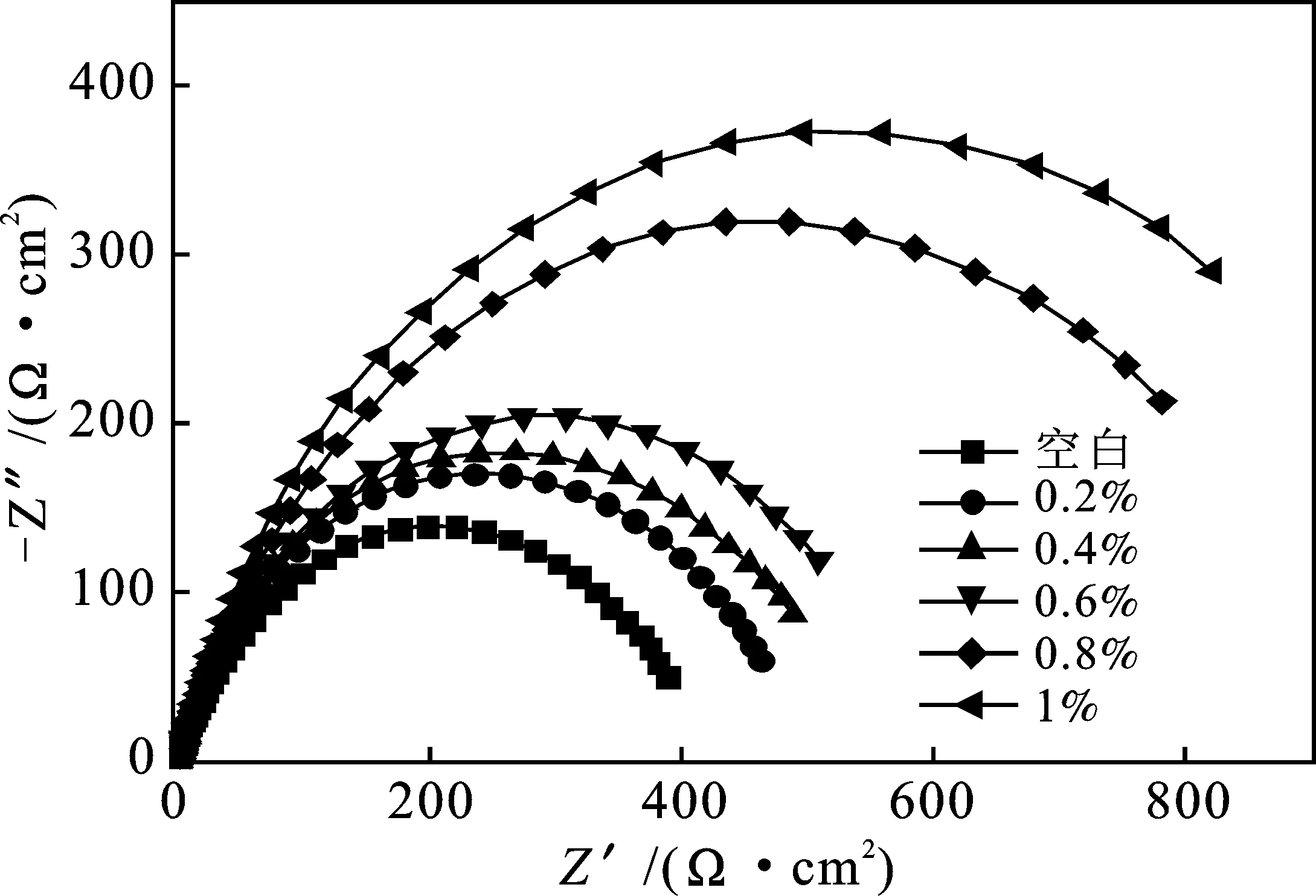
圖7 不同含量緩蝕劑下N80鋼的Nyquist圖
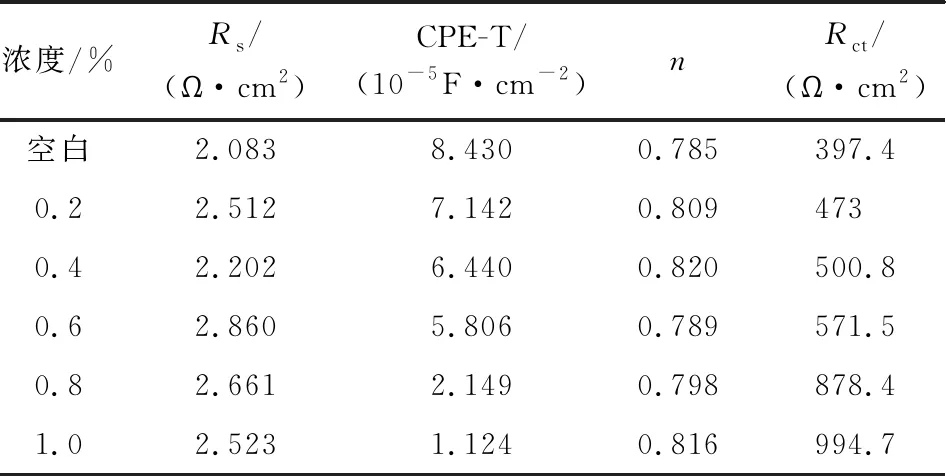
表5 交流阻抗譜擬合參數
3 結論
(1)以苯甲醛、苯乙酮和氨基硫脲為基本原料,在一定條件下合成一種新型含硫緩蝕劑,評價結果表明:該緩蝕劑具有優異的緩蝕性能,在10%鹽酸溶液中,加量為1%時,對N80鋼片(60 ℃)的腐蝕速率為0.627 4 g/(m2·h),緩蝕率達到98%以上。
(2)該緩蝕劑在N80鋼表面的吉布斯自由能<0,說明合成緩蝕劑在N80鋼表面的吸附是自發進行的且為混合吸附。
(3)電化學結果表明,加入該緩蝕劑后,腐蝕電流密度明顯降低,電荷轉移電阻不斷增大,緩蝕效果良好。

