MEX3A在非小細胞肺癌中的表達與功能研究*
朱貝 郭小朋 董天祺 肖春杰
在過去30年間,中國肺癌相關死亡上升了4倍以上[1],其中非小細胞肺癌(non-small cell lung cancer,NSCLC)占肺癌相關死亡約80%[2]。NSCLC的發生和發展通常與腫瘤相關基因的表達有關。因此,尋找NSCLC 新的分子生物學標志物并將其作為NSCLC診斷及治療靶點至關重要。
MEX3A蛋白是一種RNA結合蛋白,其N端具有高度保守的KH結構域[3-4],MEX3A通過KH結構域與mRNA,介導mRNA的翻譯、監控和降解過程[5],進而調節細胞的一系列功能。已有研究表明,MEX3A在膀胱癌、胃癌[6]、腎母細胞瘤[7]、膀胱尿路上皮癌[8]以及肝癌[9]中異常表達,但MEX3A 在NSCLC中的作用及功能卻鮮有研究。據此,本文探究了MEX3A 在NSCLC 中的表達效果以及沉默MEX3A基因后對NSCLC發生和發展的影響。
1 材料與方法
1.1 材料
1.1.1 轉錄組芯片分析及TCGA數據庫數據分析 利用轉錄組芯片分析技術,對云南省腫瘤醫院收集的15例宣威地區的肺癌樣本(癌和癌旁組織)進行mRNA轉錄組芯片分析,通過芯片制備、雜交反應、信號檢測、數據分析,篩選出差異基因。對來自癌癥基因圖譜(The Cancer Genome Atlas,TCGA)數據庫中共226例肺腺癌樣本與20例正常組織樣本進行RNA序列分析。
1.1.2 細胞系與細胞培養 人NSCLC 細胞系A549、NCI-H292 及人正常的肺上皮細胞系BEAS-2B 均購自昆明動物研究所細胞中心,XWLC和GLC均受贈于云南省腫瘤醫院。A549、NCI-H292和BEAS-2B細胞均在RPMI-1640 培養基(Hyclone,美國)中培養,XWLC和GLC 在DMEM 高糖培養基(Hyclone,美國)中培養,每種培養基中均添加10%胎牛血清(Hyclone,美國)、100 g/mL青霉素和100 g/mL鏈霉素(Hyclone,美國)。所有細胞均培養在37℃、5%CO2的恒溫培養箱中培養。
1.2 方法
1.2.1 細胞轉染 選取MEX3A 高表達的A549和NCI-H292細胞系進行轉染。細胞以5×104/孔接種于培養皿中,培養24 h 后,更換為不含抗生素的培養基,用脂質體RNAiMAX(Invitrogen,美國)將MEX3A的靶向抑制劑小干擾RNA(siMEX3A:5'-GCAAGAUCCUCGAGUACAATT-3',上海吉瑪公司)和陰性對照siRNA(siNC:5'-UUCUCUCUC CGAACGUGUCUCUCUGACGUTU TT-3',上海吉瑪公司)轉染至細胞,轉染后繼續培養48 h以待分析。
1.2.2 實時熒光定量聚合酶鏈反應(qRT-PCR) 根據試劑盒說明,提取細胞總RNA并將其反轉錄為cDNA(PrimeScriptTMRT 反轉錄試劑盒,Takara,中國)。人GAPDH 用作內參基因,qRT-PCR 監測MEX3A 在BEAS-2B、NCI-H292、A549、XWLC和GLC 細胞中的表達水平。引物序列見表1。
表1 引物序列
1.2.3 細胞增殖試驗 將3 000/孔細胞懸液接種在96孔板(Corning Costar,美國)中,設置3個復孔,分別在轉染24、48和72 h后中加入10 μL CCK8試劑(Dojindo Laboratories,Kumamoto,日本),加入CCK8試劑2.5 h后,3 h內每隔30 min用多功能酶標儀測量細胞OD 450 nm處的吸光度。
1.2.4 Transwell 試驗 在Transwell小室(Corning Costar,美國)中鋪好10 μL的基質膠(25 mg/50 mL,BD Biosciences,美國),在無血清培養基培養細胞12 h,然后以30 000/孔將細胞接種到Transwell小室的上室中,下室用含20%胎牛血清的培養基作為誘導物,37℃培養48 h,去除培養基并用4%多聚甲醛(生工生物工程有限公司,上海)固定細胞,0.1%吉姆薩染液(北京索萊寶科技有限公司,北京)染色細胞。細胞遷移測定在相同條件下進行,上室不覆蓋基質膠。最后所有細胞均于10×10倍顯微鏡下觀察拍照。
1.2.5 細胞周期與凋亡試驗 細胞周期試驗:收集并純化細胞,70%預冷的乙醇(生工生物工程有限公司,上海)固定細胞12 h,PBS 洗去乙醇,與核糖核酸酶A(10 mg/mL,BD Biosciences,美國)37℃反應30 min,碘化丙啶(10 μg/mL,BD Biosciences,美國)避光染色30 min。流式細胞儀(BD Biosciences,美國)分析細胞周期,采用FlowJo 7.61軟件評估G0-G1、S和G2-M期細胞的百分比。
細胞凋亡試驗:用不含EDTA的胰酶消化細胞,無雙抗的培養基終止消化,收集并重懸細胞,分別加5 μL碘化丙啶和5 μL Annexin V-FITC染液(細胞凋亡試劑盒,BD Biosciences,美國)避光染色20 min。流式細胞儀分析細胞凋亡。
1.3 統計學分析
采用SPSS 16.0和GraphPad Prism 5.0軟件進行統計學分析。t檢驗用于比較組間差異。以P<0.05為差異具有統計學意義。
2 結果
2.1 MEX3A在NSCLC中高表達
本研究對在云南省腫瘤醫院收集的15例宣威地區肺癌樣本(癌和癌旁組織)進行mRNA 轉錄組芯片分析(表2),共篩選出2 724個差異表達的基因,606個基因的mRNA表達水平顯著上調,2 118個基因的mRNA表達水平顯著下調。表達上調的基因中,MEX3A、ARHGAP40、GPR110、FLJ13744、PSAT1、B3GNT6、FUT2、MND1、CXCL13、MUC21 上調倍數均高于6倍(P<0.05,表3)。通過篩查基因背景后,選擇表達效果明顯的MEX3A基因(P<0.01,表3)作為研究對象。對TCGA數據庫數據進行統計分析顯示,與正常組織(n=20)相比,MEX3A mRNA 在肺腺癌組織(n=226)中顯著高表達(P<0.001,圖1A)。
qRT-PCR結果顯示,與癌旁細胞系BEAS-2B 相比,A549、NCI-H292 細胞系中MEX3A mRNA表達水平顯著高于BEAS-2B(P<0.001,圖1B)。此外,qRTPCR結果顯示沉默MEX3A(siMEX3A)后,A549和NCI-H292的MEX3A的mRNA表達水平顯著降低(P<0.001,圖1C)。
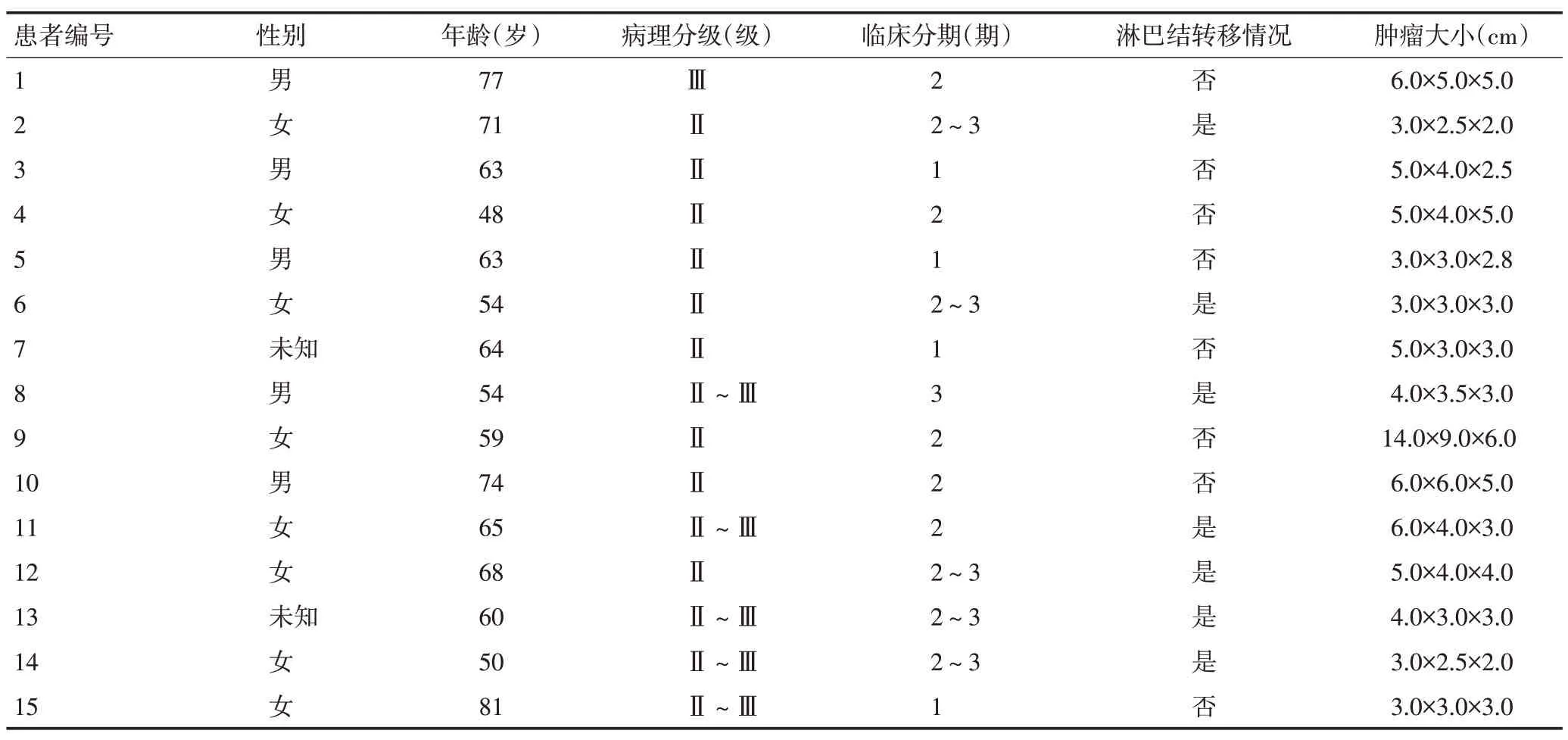
表2 新鮮組織樣本臨床病理資料
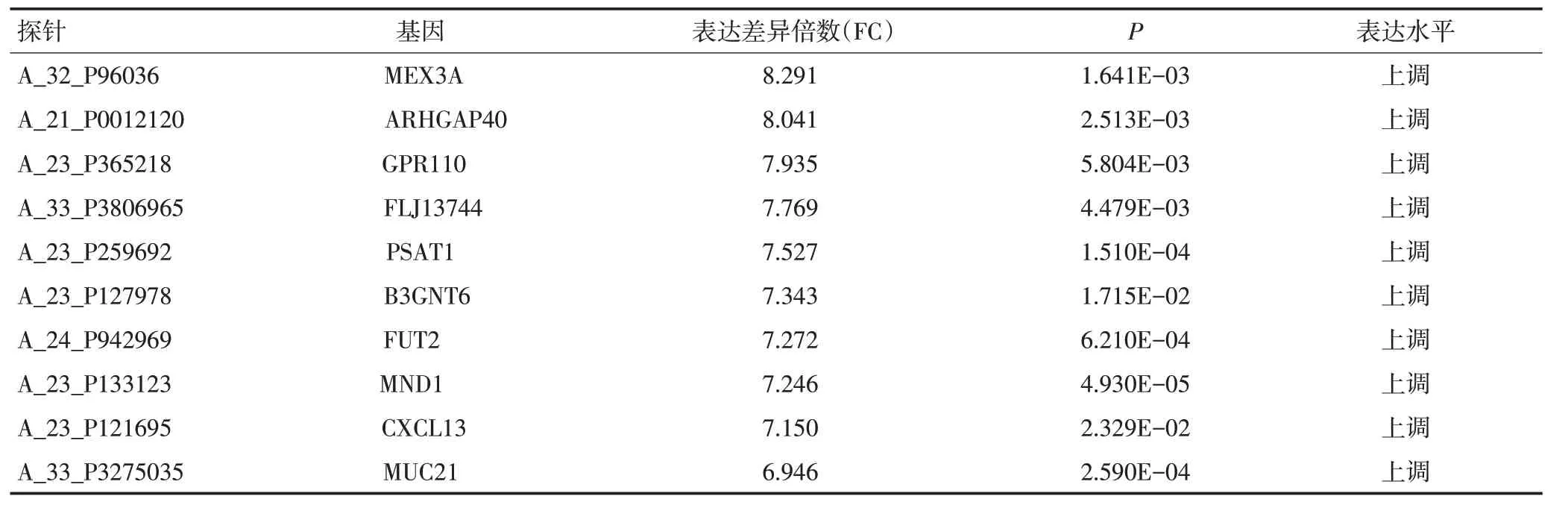
表3 mRNA轉錄組芯片篩選出在NSCLC中上調的mRNAs
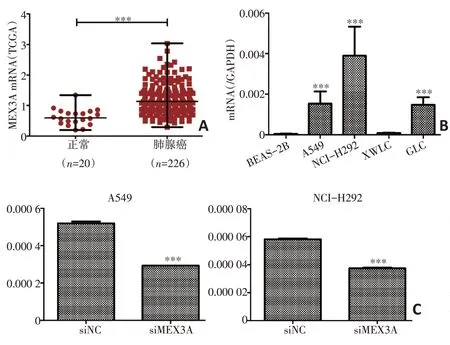
圖1 MEX3A在NSCLC中高表達
2.2 沉默MEX3A對NSCLC增殖的影響
CCK8試驗結果顯示,與陰性對照組(siNC)相比,沉默MEX3A后,A549和NCI-H292的增殖能力均被顯著抑制(P<0.05,圖2)。
2.3 沉默MEX3A對NSCLC侵襲及遷移的影響
Transwell試驗結果顯示,與陰性對照組相比,沉默MEX3A后A549和NCI-H292細胞的侵襲(P<0.001)及遷移(P<0.001)能力均明顯減弱(圖3)。
2.4 沉默MEX3A對NSCLC凋亡的影響
流式細胞試驗結果顯示,MEX3A被沉默后促進A549(P<0.05)和NCI-H292(P<0.001)的凋亡(圖4)。
2.5 沉默MEX3A對NSCLC周期的影響
流式細胞試驗結果顯示,沉默MEX3A后A549及NCI-H292中G2/M期細胞明顯增多,細胞周期均被阻滯于G2/M期(P<0.001,圖5)。
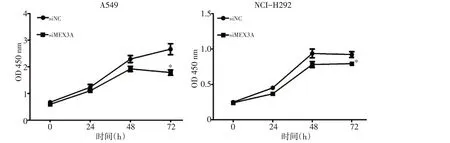
圖2 沉默MEX3A基因后抑制NSCLC的增殖
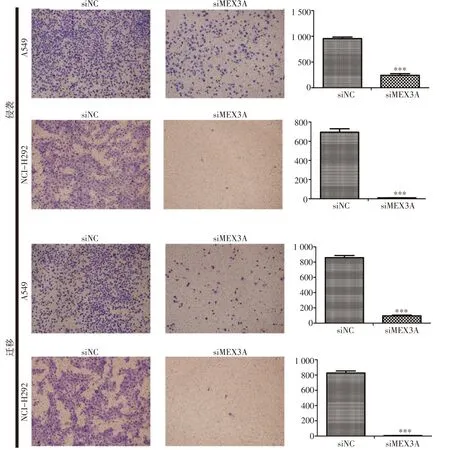
圖3 沉默MEX3A基因后抑制NSCLC的侵襲及遷移
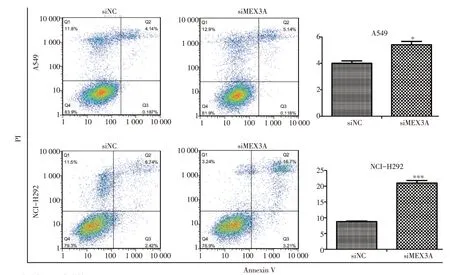
圖4 沉默MEX3A基因后誘導NSCLC細胞凋亡
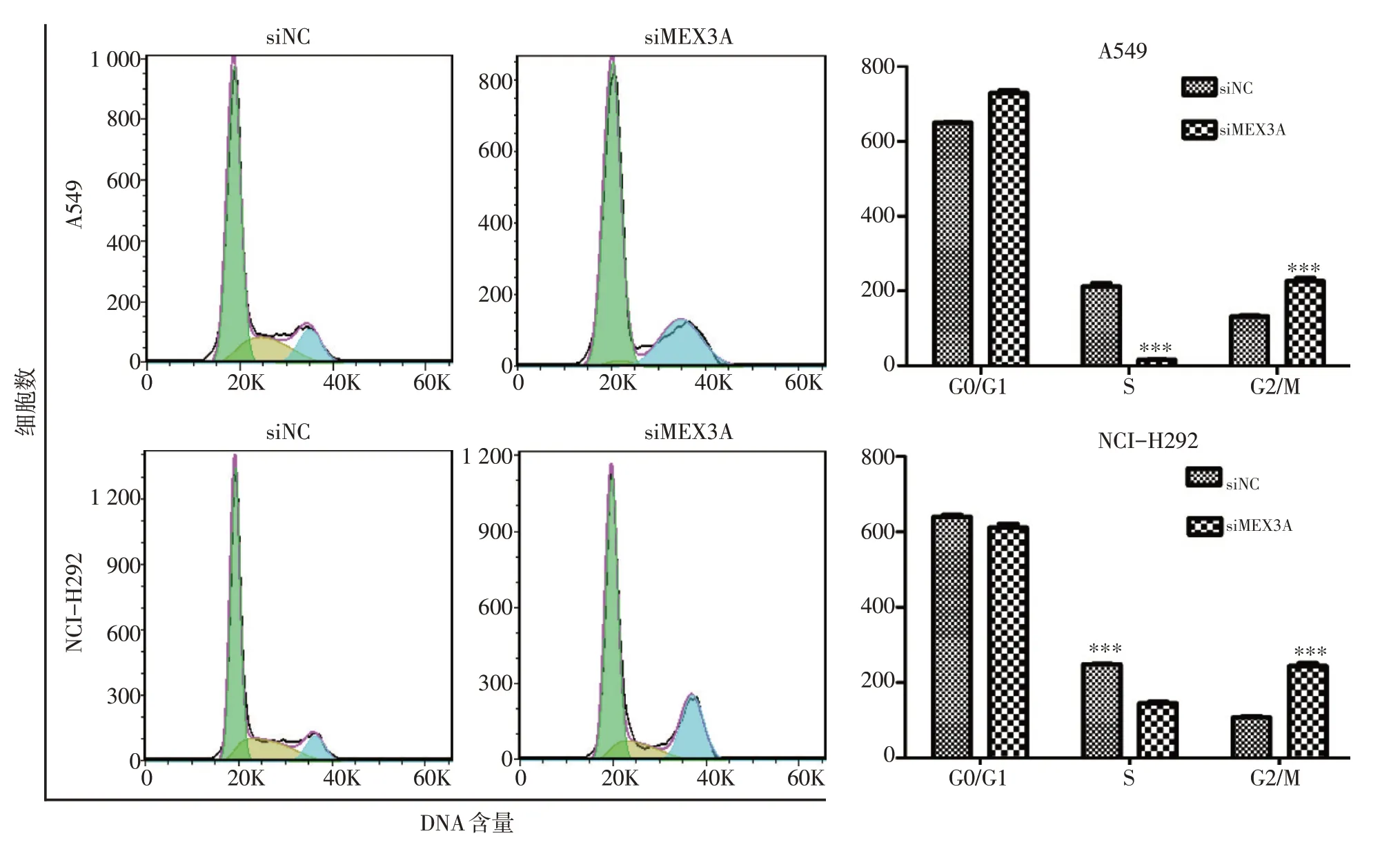
圖5 沉默MEX3A基因后阻滯NSCLC細胞周期
3 討論
NSCLC的靶向治療已取得突破性進展[10],但由于診斷和治療方法有限,導致NSCLC患者的生存和預后仍不理想。遺傳因素是引起NSCLC的主要原因,研究表明,超過40%NSCLC是由未知基因異常表達引起的[11]。因此,找到NSCLC的相關生物標志物,并了解其致癌機制,對NSCLC的早期診斷和尋找治療靶點極為重要。
MEX3是在秀麗隱桿線蟲中發現的一類翻譯調節蛋白,該蛋白能抑制蛋白翻譯過程[12]。MEX3 包含MEX3A、MEX3B、MEX3C、MEX3D基因[3],已有研究表明,MEX3蛋白的相關基因異常表達會引起胚胎死亡[12]。其中MEX3A與MEX3B是P小體的組成部分,P小體可濃縮細胞質中的酶,進而參與mRNA的調控過程[13-14]。現已有證據表明MEX3A可通過介導mRNA的代謝過程,參與細胞的生命進程。MEX3A基因的異常表達會引起癌癥等多種疾病,有研究發現,MEX3A是腎母細胞瘤潛在的致癌基因[7],但MEX3A在NSCLC中的表達效果及其相關功能卻鮮見研究。因此,本文對MEX3A在NSCLC中的表達與功能進行探索。首先,通過轉錄組芯片分析篩選出在NSCLC中表達上調最顯著的MEX3A基因。為探索MEX3A基因在NSCLC中的表達水平,對TCGA數據庫中226例肺腺癌樣本和20例正常樣本進行分析,發現MEX3A mRNA在肺腺癌組織(n=226)中顯著高表達(P<0.001),與此同時qRT-PCR的結果也顯示MEX3A mRNA在NSCLC細胞系A549和NCI-H292中表達顯著升高(P<0.001)。以上結果均表明MEX3A在NSCLC中顯著高表達。
已有研究發現,RNA干擾技術沉默MEX3A基因后膀胱癌細胞的增殖能力受到明顯抑制,且凋亡效率明顯增加[15-16],Shi等[8]也發現MEX3A能促進乳頭狀膀胱尿路上皮癌細胞的增殖和遷移,但卻鮮有MEX3A 對NSCLC影響的相關研究。因此,為進一步探索MEX3A在NSCLC中的功能,本研究通過RNA干擾技術沉默A549和NCI-H292的MEX3A基因,結果提示沉默MEX3A后NSCLC的增殖(P<0.05)、侵襲(P<0.001)及遷移(P<0.001)能力均明顯減弱,提示MEX3A可能作為NSCLC的異常基因導致NSCLC 異常增殖并失去接觸抑制,而沉默MEX3A基因能降低上述異常功能。
細胞的增殖和凋亡與細胞周期調控有關,細胞周期調控異常會導致細胞增殖及凋亡異常,進而引發腫瘤。G2/M期是DNA損傷修復的重要時期,G2/M期被阻滯使DNA 損傷無法被修復而走向凋亡。研究發現,MEX3A基因在胃癌細胞中高表達,主要在胃癌細胞的G2/M期發揮作用從而促進胃癌細胞的增殖與侵襲,而沉默MEX3A能有效抑制該過程[6],亦有研究表明MEX3A可以影響腸細胞的分化和細胞周期進程[17]。但目前尚缺乏關于MEX3A對NSCLC細胞凋亡和周期的影響的相關報道,本研究發現沉默MEX3A基因后A549和NCIH292細胞被明顯阻滯于G2/M期(P<0.001),A549和NCIH292 細胞凋亡顯著上升(P<0.05)。結果提示沉默MEX3A基因可導致NSCLC被阻滯于G2/M期,并最終誘導NSCLC凋亡。
綜上所述,MEX3A可能作為促癌基因參與了NSCLC細胞的生長和增殖過程,而沉默MEX3A能降低該過程。該研究為繼續探究MEX3A的相關作用機制奠定了基礎,提示MEX3A或許可作為NSCLC診斷和治療的標志物,為攻克NSCLC提供新的靶點。

