空間微生物發酵反應器設計及工藝優化研究
葉健文,逯耀鋒,黃悟哲,吳赴清,陳國強*
(1.清華大學生命科學院,北京100084;2.中國載人航天工程辦公室,北京100034)
1 引言
開展長周期、遠距離、多乘員的載人深空探測和地外星球駐留是未來載人航天發展的必然方向。但由于空間飛行中以及星球表面均缺乏人類生存必需的物質資源供給,因此需要探索如何利用生物技術改造生物體,使其可在空間環境下實現廢棄物轉化[1-2]、星球資源原位利用、必需物質生產、星球環境地球化[3]等任務。
近年來,隨著合成生物學等技術的迅速發展,研究人員可將微生物作為細胞工廠,通過工程化手段對其進行改造[4-5],改造后的微生物可高效轉化利用多種物質或可生產出具有不同性質的生物材料[6-7]。因此,研究在空間環境下利用改造后的微生物進行無滅菌開放的高密度培養,如工程改造的嗜鹽單胞菌TD在三段式補料開放發酵中干重超80 g/L[8],從而轉化載人航天任務中不斷產生的生活廢棄物[9-10],或利用地外星球的特有資源,實現材料等物質資源的生物合成,例如在太空合成生物基可降解材料、生物質能源等,已經成為具有戰略意義的研究方向之一。但是,由于載人航天飛行任務的特殊性,受限于上行資源條件約束,開展此類研究的實驗裝置必須實現輕量化;考慮到飛行乘組操作要求,此類實驗設計還必須簡便、易操作;鑒于空間環境中可利用資源的匱乏,在工藝流程中必須考慮資源更加高效地循環利用。現階段,由于存在設備組裝裝載復雜、發酵生產工藝可操作難度大、資源循環利用困難等問題,限制了利用高速生長的微生物轉化月球上廢棄物為生物塑料的可行性嘗試。
綜上,本文設計一種輕量化、便捷組裝的發酵罐,并基于下一代工業生物技術平臺[11-12]提出利用該發酵罐實現無滅菌、可循環發酵的工藝設計。通過利用嗜鹽單胞菌在輕量化發酵罐內進行無滅菌、可循環的發酵實驗,旨在解決現有發酵設施質量大、操作復雜、資源利用率低的問題,從而生產可生物降解的聚羥基脂肪酸酯材料,為解決載人航天任務中可利用物質資源匱乏問題提供新的研究思路。
2 發酵罐的優化設計
嗜鹽單胞菌Halon onas bluephagenesis TD01[13](以下簡稱TD)由于對生長環境具有較好的生長魯棒性以及對不同極端環境具有較強的抗逆性和耐受性,已被用于開發下一代工業生物技術底盤菌[14]。以TD為研究對象,可采用無滅菌的連續開放發酵工藝,從而降低對能源和水資源的消耗,實現多種聚羥基脂肪酸酯(Polyhydroxyalkanoate,PHA)、蛋白質和5-氨基酮戊酸(5-Aminolevulinic Acid,ALA)等化學品的低成本生產[15-16]。
傳統的實驗室小試規模發酵罐主要由4部分組成:主控制器、發酵罐體、空氣壓縮機和冷水機(圖1),其中主控制器和發酵罐體是核心組成部分。主控制器負責發酵過程的溫度、pH、溶氧、攪拌槳轉速、補料等條件的反饋控制;空氣壓縮機和冷水機根據實際發酵需求進行配套使用;發酵罐體主要給微生物生長提供穩定均一的傳質和傳熱條件。小試規模的發酵罐體一般由不銹鋼支架和玻璃罐體組成,易碎且質量較大。傳統的發酵工藝需要保證微生物無雜菌的生長環境,通常需要經高溫高壓蒸汽滅菌后使用,操作過程較為復雜,且需要額外配備蒸汽滅菌鍋。受玻璃罐體易碎、不銹鋼罐體質量大等不利因素制約,載人航天飛行任務中無法利用傳統發酵罐和發酵工藝進行材料生產。
可以選擇塑料材料作為發酵罐體的制作材料,用于開展后續在軌實驗的地面驗證工作。在眾多塑料選材中,亞克力塑料以其耐腐蝕、高透明度、高強度和易加工等特性被應用在很多領域,如水族館、觀光幕墻等。本文采用亞克力塑料制作發酵罐體、上下封頭攪拌系統以及各封頭接口和導管等配件。發酵罐的上封頭和罐體之間用定位銷加螺紋接口進行固定,其他接口固定方式均采用螺紋結構,以方便快速拆裝。初步設計的小試規模發酵罐體總體積為10 L,制造雛形如圖2所示。發酵罐控制器可以維持原有設計,包括補料、溫控、pH控制、進氣系統等[17-18],該設計相對傳統不銹鋼發酵罐或玻璃發酵罐減重60%以上,拆卸或組裝更簡易,且在后續優化過程中可以針對工藝進行功能模塊的調整,以減少主控制器的體積,降低組裝復雜性。
由于嗜鹽菌TD可以允許無滅菌開放發酵,因此發酵準備前培養基一級發酵罐體不需要經過復雜的高溫蒸汽滅菌操作。此外,發酵過程中沒有對接種時的無菌操作和空壓機供氣的過濾除菌有嚴格要求。

圖2 10 L塑料發酵罐Fig.2 10 L plastic bioreactor
3 發酵工藝優化
下一代工業生物技術是基于嗜鹽單胞菌開發的,以海水作為發酵用水的無滅菌開放工業發酵技術,集合了高效的基因改造技術和嗜鹽微生物的底盤優勢。該工藝以在空間環境下利用微生物發酵合成生物基可降解材料,并以高效循環利用發酵用水為目的,擬通過開發并優化工藝設計,以提高微生物發酵的可行性、操作便捷性以及微生物合成目標產物的發酵產率。
基于嗜鹽菌TD及其衍生的基因工程改造菌株,目前已開發了較穩定小試規模發酵工藝以及中試規模放大發酵的工藝,并利用葡萄糖或γ-丁內酯作為碳源生產聚-3-羥基丁酸酯(P3HB)和聚-3-羥基丁酸-4-羥基丁酸酯(P3HB4HB)共聚物,其發酵總生物量均能達到80 g/L,且PHA質量百分比基本實現60%~70%[8],如表1所示。雖然目前該工藝已經實現了產業化的中試放大驗證,如經濟性(成本計算)、穩定性(批次穩定性)和可放大規模(千噸或萬噸級)等相關驗證,但是發酵最終生物量和PHA產量仍有可突破空間。因此,在進行塑料發酵罐設計的同時,對該發酵工藝進行了進一步優化。
在細菌的高密度培養過程中,主要分為3個時間期,依次為適應期、對數生長期和平臺期。一般而言,對數生長期是細菌進入指數分裂的快速生長期,需要供應相應的溶氧及營養物,以適應該時期細菌生長所需的物質來源。在前期開發的三段式補料發酵工藝中(表2)[8],補料I作為對數生長期主要的氮供應來源,補料II和補料III開始限制氮源供應,同時提供穩定的碳源用以合成PHA,從而實現細菌生長和PHA積累的解偶聯。

表1 用于塑料發酵罐高密度發酵的菌種[8]Table 1 Strains for high cell density cultivation in p lastic bioreactor[8]

表2 嗜鹽菌三段式補料發酵培養組份[8]Table 2 Formula of three-phase feeding solution for Halomonas cultivation[8]
然而細菌的對數生長隨著菌體密度的增大是一個動態變化過程,尤其是在菌體密度相對較低的對數前期,其生長速度較快,接近指數生長趨勢,對氮源的消耗量較大;而在對數期中后期,因菌體密度增大,溶氧供應受限及群體效應影響,其生長速度開始逐漸減緩,其對氮源的利用逐漸減弱。因此,本文將補料I拆分成補料I和補料I'來分配不同的碳源和氮源比例,以適應2種不同的生長需求,其中補料I中的氮源比重較多,補料I'中的氮源比重較小。同時,在這2段補料中引入玉米漿粉來部分替代尿素作為氮源,因為玉米漿粉中除了含有大量有機氮源利于生長外,還有較豐富的生長因子可以促進細菌的生長。補料配方更改如表3所示。
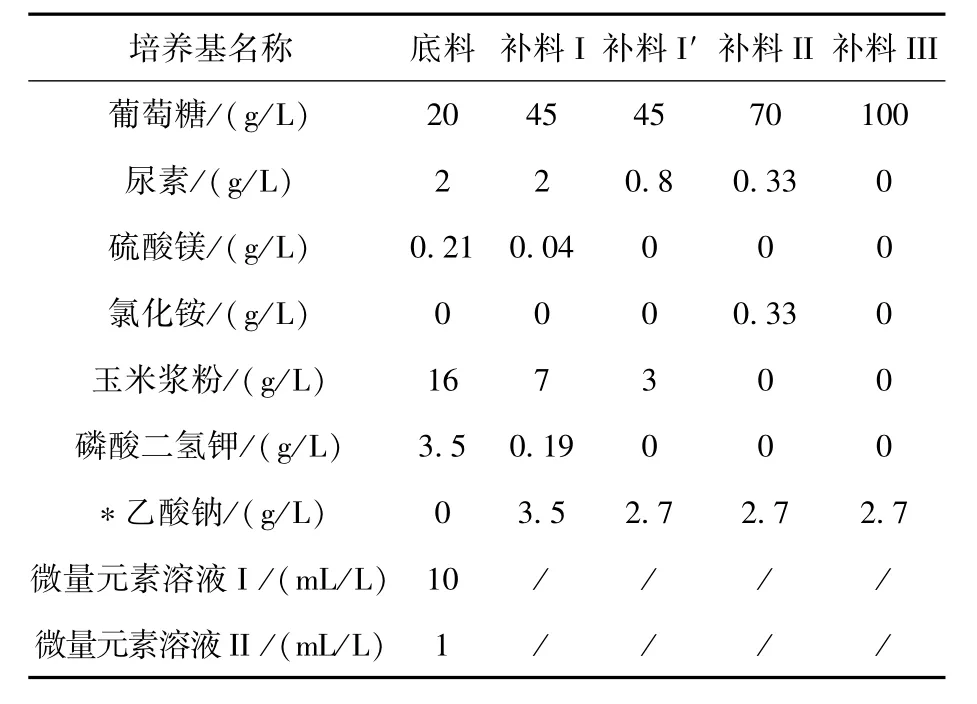
表3 嗜鹽菌四段式補料發酵培養組份Table 3 Formula of four-phase feeding solution for Halomonas cultivation in this study
基于以上發酵補料的優化設計,本文首先用TD40菌株在常規小試規模發酵罐中對以上四段式發酵補料策略進行驗證分析。結果表明:四段補料發酵的干重對比三段式補料發酵工藝[19]在總生物量上提高了12%,達到91 g/L,而PHA含量超75%,聚合物中4HB的摩爾比例均超10%,各項參數及性能達到該材料的下游加工需求,具體如圖3所示。因此,本文的發酵工藝優化策略得以驗證,并值得在塑料罐中進行復制實驗驗證。
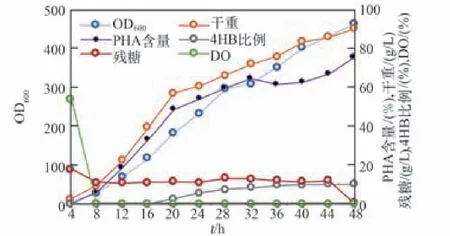
圖3 基于TD40菌株的四段補料發酵工藝在常規發酵罐的優化結果Fig.3 Fermentation study of TD40 strain based on four-phase feeding solution in traditional bioreactor
在完成發酵工藝優化后,將四段補料的發酵工藝復制到新設計制造的塑料發酵罐中進行實驗。塑料發酵罐中仍保持開放無滅菌的發酵方式,經過48 h的發酵,總生物量達到86 g/L,PHA含量達到71%,4HB比例也能達到10%的摩爾比標準,如圖4所示。新設計的塑料發酵罐不僅可以實現同等效果的嗜鹽菌TD發酵,而且經過批次的發酵實驗發現該發酵罐并未出現變形、開裂等力學性能退變。所以,以塑料作為發酵罐的制造材料可以達到預期的輕量化、組裝簡易等設計要求。

圖4 基于TD40菌株的四段補料發酵工藝在塑料發酵罐中的發酵結果Fig.4 Ferm entation study of TD40 strain based on four-phase feeding solution in p lastic bioreactor
基于TD40菌株驗證了四段補料發酵工藝以及塑料發酵罐的設計后,針對不同的嗜鹽菌工程改造菌株進行橫向驗證實驗。分別針對P3HB的高產菌TDU[20]和P3HB4HB的高產菌TDH4[21]在塑料發酵罐中進行發酵實驗,結果如圖5所示。在52 h的發酵實驗中,TDH4菌株的發酵總生物量高達100 g/L,PHA含量達到86%,4HB摩爾比例達到8.5%。而TDU菌株的發酵總生物量也高達83.5 g/L,PHA含量達到79.3%。實驗證明四段式發酵工藝和塑料發酵罐對不同的工程改造菌均有較好的適用性。
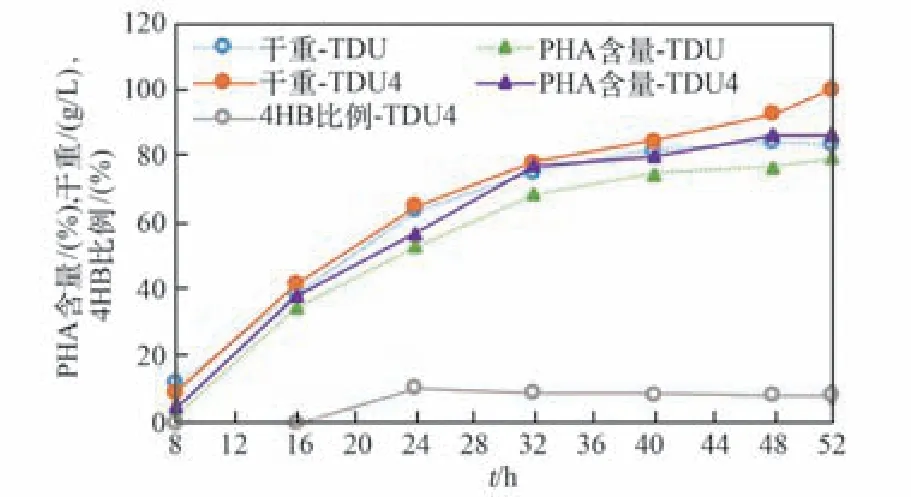
圖5 其他工程菌對于四段發酵工藝的發酵結果Fig.5 Fermentation study of other engineered Halomonas based on four-phase feeding solution
根據Ling等[22]的研究,乙酸的添加有利于PHA在嗜鹽菌TD中的積累,本文在此基礎上在補料中添加乙酸鈉對發酵工藝進行進一步的優化。基于乙酸鈉添加(添加6 g/L乙酸鈉)優化策略及配方見表3。優化后的工藝在塑料發酵罐測試中,經過52 h的發酵,TDH4菌株的發酵總生物量高達107.8 g/L,PHA含量達到74.4%,4HB摩爾比例達到8.3%;而TDU菌株的發酵總生物量也高達102.6 g/L,PHA含量達到69.3%。這是目前嗜鹽菌TD在小試規模發酵罐中能達到的最高發酵水平[8]。因此,乙酸鈉對于細菌的發酵生長起到正向的作用。

圖6 乙酸鈉添加對于四段發酵工藝的優化結果Fig.6 Sodium acetate addition for fermentation optim ization based on four-phase feeding solution
4 廢水發酵優化循環測試
開展了發酵廢水循環利用的測試,擬將一次發酵后的發酵液進行離心分離,將分離后的發酵液上清經簡單熱處理后重新返回到發酵罐中進行二次循環發酵,以實現發酵液最大限度的重復利用,具體流程如圖7所示。在發酵廢水循環測試中,仍選用已經實現工業化中試生產的TD40菌株進行驗證分析,發酵工藝是基于優化后的四段補料發酵工藝。

圖7 基于塑料發酵罐的發酵液循環利用流程Fig.7 Fermented supernatant recycling design based on plastic bioreactor system
首先將首次發酵后的發酵液上清進行收集,經熱處理后返回到塑料發酵罐中,補充固定的發酵底料和菌種種子液后進行一次循環發酵,發酵結果如圖8所示。經48 h發酵后,發酵總生物量達到83 g/L,PHA含量達到68%,4HB摩爾比例達到9.7%。
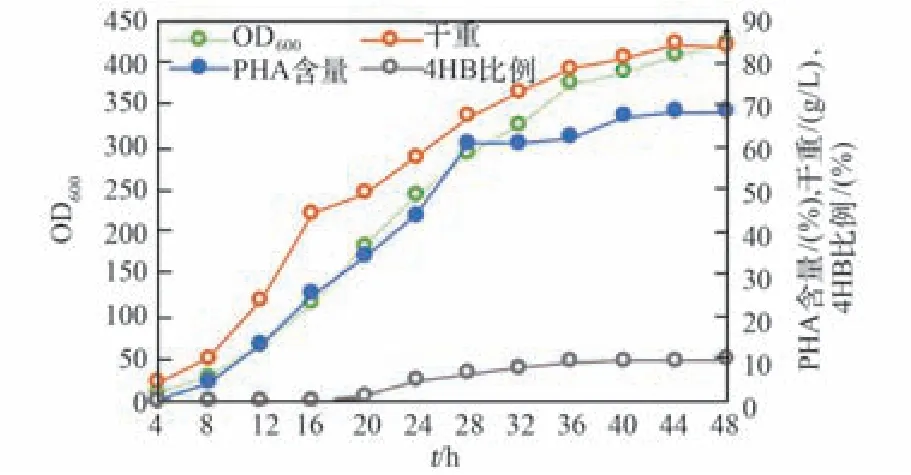
圖8 以TD40菌種為基礎基于塑料罐優化工藝的一次發酵Fig.8 First round fermentation study of TD 40 strain by using optim ized plastic bioreactor technique
經同樣的發酵液分離回收流程,針對發酵液上清繼續進行二次循環發酵,發酵結果如圖9所示。經48 h發酵后,其發酵總生物量降低至76 g/L,PHA含量降低到48%,4HB摩爾比例3.6%,雖然發酵結果整體出現較明顯的降低,但仍能維持相對較高的PHA產量。另外,發酵前期的4HB摩爾比例波動的原因可能在于發酵液上清重復使用,積累了較多前批次未消耗完的γ-丁內酯,導致前期4HB摩爾比波動較大,同時也可能對細菌生長帶來一定的抑制作用。因此,未來可僅利用葡萄糖生產P3HB或者P34HB的工程菌株,細菌的發酵液上清中就消除了γ-丁內酯殘留的影響,減少循環中對菌株生長的抑制,從而增加廢液循環次數。
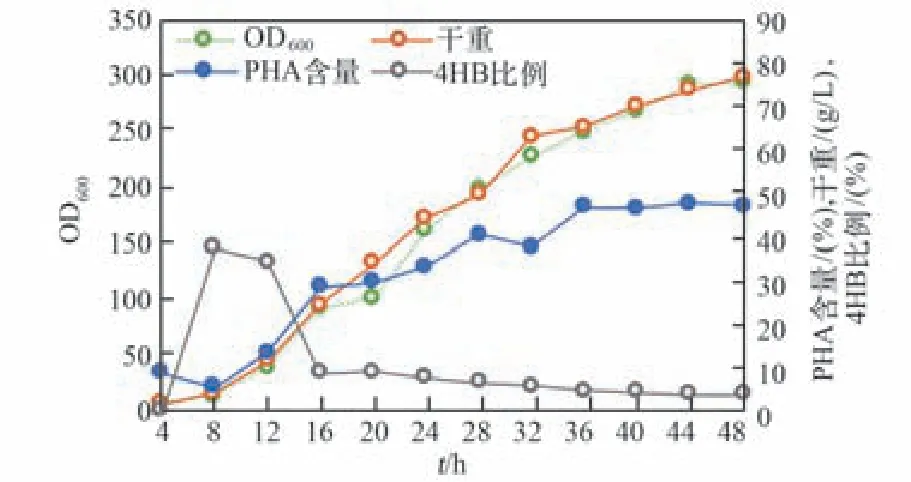
圖9 以TD40菌種為基礎基于圖7發酵廢水循環利用的二次發酵Fig.9 Second round fermentation study of TD 40 strain by using fermented supernatant recycling
5 結論
1)輕型發酵罐相較于傳統發酵罐減重60%以上,拆卸或組裝更簡易,試驗證明其在嗜鹽菌開放無滅菌發酵工藝的適用性,在批次重復的耐久性測試和穩定性上均無退化現象;
2)四段式補料的發酵工藝對嗜鹽菌發酵生產PHA具有促進作用,添加乙酸鈉能提高嗜鹽菌發酵的總生物量,從而獲得更高的PHA產量;
3)發酵廢水經2次循環利用后仍能夠維持較高的PHA產量,證明優化后的工藝可實現發酵用水的循環利用。
綜上,基于下一代工業生物技術平臺的輕型發酵罐設備已完成部分地面驗證,獲取的數據滿足實驗設計要求,為后續進一步開展空間飛行驗證奠定了基礎,其實驗結果可為未來載人深空探測、建立月球基地乃至實現地外星球長期駐留的物資循環利用提供新的思路。
致謝:本研究得到了迪必爾生物工程(上海)有限公司的支持,謹致謝意。

