基于能量分析的天然氣新型利用方式研究
盧添天 閆秋會 侯彥萬
西安建筑科技大學建筑設備科學與工程學院
0 引言
天然氣在世界能源結構中占據重要地位[1]。本文研究了天然氣超臨界水氧化這一新型技術。利用超臨界水體系中,氧氣、空氣、過氧化氫、水及絕大多數有機物可以任意比例互溶,氣液相界面消失這一特性[2-3],消除了傳質傳熱阻力,加快了反應速度,可在幾秒至幾分鐘內將有機物徹底氧化降解為CO2,H2O,N2及其他化合物[4]。因而與傳統直接氧化技術相比,超臨界水氧化技術具有節能、高效、環境友好等特點。
本文對比了天然氣的直接氧化和超臨界水間接氧化這兩個反應過程,基于能量品位理論,利用圖像火用分析法研究了甲烷的間接氧化能量梯級釋放過程,并與實際應用進行熱效率、火用效率進行對比,以期為甲烷在超臨界水氧化這種新技術的進一步發展提供理論依據。
1 天然氣的直接氧化和間接氧化過程
1.1 天然氣的直接氧化
天然氣的直接氧化指天然氣在空氣中燃燒,一般用于燃汽輪機。天然氣分子按自線軌跡不斷運動,運動速度和溫度成正比,溫度越高分子量碰撞越頻繁劇烈。溫度上升到650 ℃左右時,分子獲得足夠的速度與能量,破壞氧的雙鍵結合,并使天然氣分子的氫與中心碳的連接斷開,此時處于一種很不穩定的狀態,由于碳、氫對氧都有很高的親和力,從而開始燃燒[5]。反應式如下

甲烷作為天然氣的主要成分,雖是一種優質潔凈燃料,但在燃汽輪機發電過程中,燃燒的絕熱溫升由初始的空氣/燃料決定。在甲烷常規燃燒的可燃范圍內(5%~15%),火焰絕熱溫度超過2000 ℃,將促使空氣中的N2與O2發生反應,導致大量熱力NOx的生成。同時由于空/燃較低,甲烷不能完全燃燒,還將產生大量的CO。另外,燃氣輪機也難以長時間承受如此高的溫度[6]。同時天然氣中的其他成分H2S 和N2也會在直接燃燒時生成SO2和NO2污染大氣。
1.2 天然氣的間接氧化
Brock[7]等構建了C、H 化合物在超臨界水氧化中的動力學模型,其中就涉及了甲烷的氧化動力學模型。超臨界水間接氧化裝置通過外部熱源提供能量使反應溫度達到超臨界狀態,天然氣在此環境下與氧化劑發生氧化反應。Brock 等認為反應過程中,天然氣的C 先轉化成CO,再轉化成完全的CO2。天然氣中的N2則與超臨界水相融,不會產生NOx和N2O。
超臨界水間接氧化裝置示意圖如圖1:

圖1 超臨界水間接氧化裝置原理圖
天然氣超臨界水間接氧化過程相比傳統直接燃燒天然氣過程具備以下幾個優點:
1)反應溫度低,并且速度快。
2)可回收過程中的CO2再次利用,從而不造成大氣污染。
3)不會產生傳統燃燒中NO2或者H2S 等污染物。
4)產生的高溫高壓產物可用于發電。
Brock 等建立了甲烷超臨界水氧化的模型,詳細的分析了反應生成的自由基。具體主要自由基反應為以下:
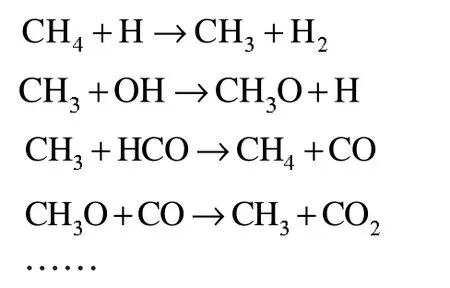
為了計算方便,本文將其簡化為:
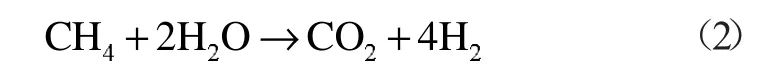
產生的H2與氧氣發生簡單的氧化反應:

2 直接氧化與間接氧化過程能量梯級利用原理
為了明確天然氣在不同氧化氛圍的能量釋放規律,采用能量梯級利用原理進行分析[8]。
2.1 能量梯級釋放理論
Ishida 等[9]于1982 年提出圖像火用分析法(EUD 分析法),以揭示內部火用損失現象。EUD 分析法中橫坐標表示能量轉換過程中的能的“量”,而縱坐標A 表示由能量轉換過程中能的“質”,即能的品位。通過圖像分別描述能量釋放側與能量接收側能的品位隨能量轉化過程的變化趨勢,將能量利用過程中各個子過程清晰地展現出來[10]。
本文假設化學反應均在定溫條件下發生,對于氧化反應過程,可視為反應溫度為T 的定溫放熱反應過程和反應釋放出的熱與工質之間的傳熱過程,其中環境溫度T0為25 ℃。可以得到定溫放熱反應的Gibbs自由能變化ΔG 和火用變化ΔE[11]。

聯立式(4)和(5),并引入卡諾循環效率定義式,可得ηc=1-T0/T
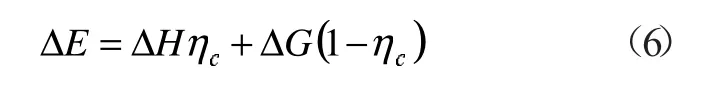
式中:ΔHηc表示熱的最大做功能力;ΔG(1-ηc)代表燃燒火用損失,其意義為相對環境溫度T0的反應的最大做功能力,即氧化反應火用損失[11]。
式(6)兩邊同除以ΔH 得到:

式中:A=ΔE/ΔH,表示燃料化學能品位[11-12]。
2.2 直接、間接氧化過程火用分析比較
假設甲烷在直接氧化過程中,將化學能釋放給溫度為1200 ℃的恒溫熱源(即煙氣),則恒溫熱源熱火用品位ηc1=0.798,甲烷的超臨界水間接氧化將化學能釋放給600 ℃的超臨界水,則外熱源熱火用品位ηc2=0.659。
甲烷在直接氧化氛圍中反應方程式:

該化學反應熱ΔH1(T0)=-890.34 kJ/mol。
按式(4)、(5) 和(7) 計算反應火用變ΔE1=ΔH-T0ΔS=-817.97 kJ/mol;化學能品位A1=1;ΔG1=ΔH-TΔS=-532.63 kJ/mol。
甲烷在間接氧化氛圍中的反應方程式:
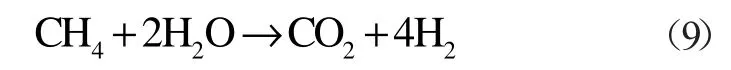
該化學反應熱ΔH2(T0)=253.02 kJ/mol。
同理可得反應火用變ΔE2=ΔH-T0ΔS=130.89 kJ/mol;化學能品位A2≈0.51 ;Gibbs 自由能變化ΔG2=ΔH-TΔS=-104.75 kJ/mol。

該化學反應熱ΔH3=-967.32 kJ/mol。
同理可得反應火用變ΔE3=ΔH-T0ΔS=-772.83 kJ/mol;化學能品位A3≈0.80;Gibbs 自由能變化ΔG3=ΔH-TΔS=-397.54 kJ/mol。
圖2 為甲烷在直接和間接氧化氛圍中的能量品位和火用損失比較。甲烷的直接氧化中化學能與熱火用品位之差A1-ηc1=1-0.798=0.202,而甲烷的間接氧化化學能與熱火用品位之差A3-ηc2=0.80-0.659=0.141,兩種氧化氛圍的化學能與熱火用品位之差:A3-ηc2<A1-ηc1,表明甲烷的間接氧化相比于直接氧化減少了化學能與熱火用品位的差值,可以將更多的化學能轉化為物理能,化學能得到梯級釋放。比較火用損失,甲烷超臨界水間接氧化的火用損失171.51 kJ/mol(即面積ding+面積hglm),甲烷直接氧化火用損失為179.86 kJ/mol(即面積abke)。與甲烷直接氧化過程相比,甲烷間接氧化反應火用損失減少了約4.6%。

圖2 甲烷在直接和間接氧化氛圍中的能量品位和火用損失比較
3 天然氣的間接氧化與實際應用的對比
為證明此間接氧化確實可以減少燃燒過程中的火用損失,本文對超臨界水間接氧化裝置進行火用分析,并與實際燃氣鍋爐進行比較。
3.1 天然氣超臨界水間接氧化裝置及熱效率、火用分析
本文擬采用陜北長慶天然氣,具體參數見表1[13]:
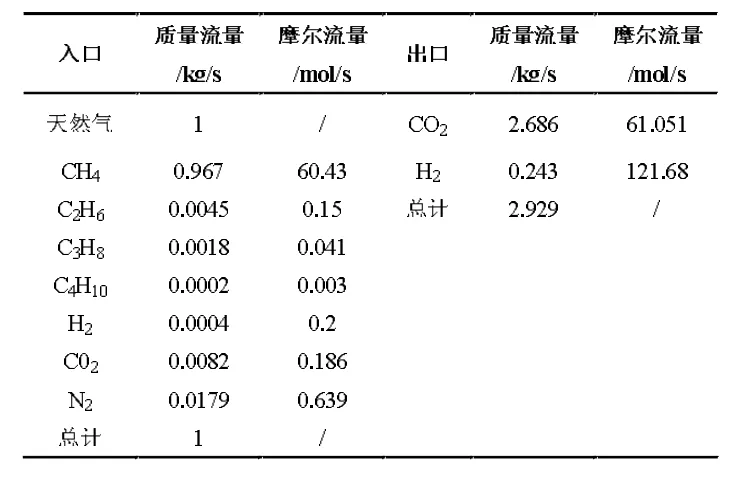
表1 氧化反應器中天然氣和空氣的質量平衡
本文采取水碳比為5[14]的天然氣與水進行反應,即1 kg 天然氣與5 kg 水進入氧化反應器。
3.1.1 氧化器能量分析
圖3 為氧化反應器能量分析模型。
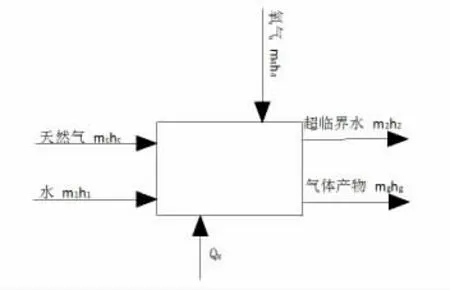
圖3 氧化反應器能量分析模型
氧化反應器能量平衡式:

式中:mc為氧化反應器入口天然氣的質量,kg;hc為氧化反應器入口天然氣的焓值,kJ/kg;m1為輸入氧化反應器的水的質量,kg;h1為氧化反應器入口水的焓值,kJ/kg;m4為輸入氧化反應器的氧氣的質量,kg;h4為氧化反應器入口水的焓值,kJ/kg;Qx為氧化反應器入口處的高壓水轉變為超臨界水時吸收的熱量,kJ;mg為反應產氣的質量,kg;hg為反應產氣的焓值,kJ/kg;m2為輸出氧化反應器的超臨界水的質量,kg;h2為氧化反應器出口超臨界水的焓值,kJ/kg。
熱效率η=mghg/Qx,計算得η=95.9%。
3.1.2 氧化器火用分析
圖4 為氧化反應器火用分析模型。
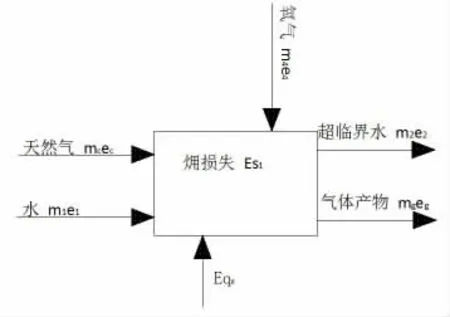
圖4 氧化反應器火用分析模型
氧化反應器火用平衡式:

式中:ec為氧化反應器入口天然氣的化學火用,kJ/kg;e1為氧化反應器入口水的物理火用,kJ/kg;Eqx為氧化反應器內高壓水吸收的熱量火用,kJ;eg為反應產氣的火用,kJ/kg;e2為氧化反應器出口水的火用,kJ/kg。
火用效率η=mghg/eQx,計算得η=54.5%
3.2 實際燃氣鍋爐效率以及與超臨界水氧化效率的對比
本文采用國內某油田注汽鍋爐蒸汽參數[15]分析,利用“黑箱”模型分析方法,建立鍋爐火用分析模型,得出某油田注汽鍋爐的熱效率和火用效率如圖5:

圖5 蒸汽壓力與鍋爐火用效率、熱效率的關系
從圖5 中可得出,若壓力高于20 MPa 后,鍋爐熱效率可達到82%,而火用效率僅為35%。而本文中所采用的超臨界水氧化裝置,熱效率可達到95%,火用效率為54.5%,可見熱效率和火用效率都能大幅提升。實際燃氣鍋爐效率低的原因是:在燃燒過程中需要考慮排煙火用損失、散熱火用損失和傳熱火用損失,以至于整個過程中火用效率大幅降低。而本文所采取的超臨界水氧化裝置,通過天然氣水相氧化減少了化學能品味和熱源品位之差,改變了普通能量釋放方式,從而可以釋放更多的化學火用。
4 結論
1)分析了天然氣在超臨界中水氧化的反應機理,這種間接氧化過程改變了傳統的氧化能量釋放途徑,減少了天然氣化學能品位與熱能品位之差,使更多的化學能轉化成熱能,實現了能量的高效利用。
2)根據EUD 分析法,對天然氣的氣相氧化和水相氧化進行了能量計算,得到天然氣的氣相氧化火用損失為179.86 kJ/mol,而水相氧化火用損失為171.51 kJ/mol。可見天然氣水相氧化火用損失相比氣相氧化減少了約4.6%。
3)分析計算超臨界氧化裝置的熱效率與火用效率,并與普通燃氣鍋爐的參數比較。前者熱效率為95.9%,火用效率為54.5%,而后者熱效率大致為82%,火用效率僅為35%。結果表明了天然氣的超臨界水氧化這一過程雖熱效率提高的程度不大,但大幅度減少了火用損失,從而有效地提高了火用效率。

