當歸揮發油對自發性高血壓大鼠NO、vWF、EMPs表達水平影響*
毛玉娟,何亞麗,江 華,謝 青,王 莉,楊 銳,申進增,伊 琳
(甘肅中醫藥大學中西醫結合學院 蘭州 30000)
高血壓是我國逐年遞增的慢性疾病之一,隨著人口老齡化增加,高血壓患病率在逐年提高。隨著社會經濟的不均衡發展,人們對高血壓病認識逐漸提高,但是高血壓控制率仍然較低,因此積極有效控制血壓,才能夠有效預防并發癥的發生,提高人們的生活質量,是目前刻不容緩的重要公共衛生問題。而中藥在治療高血壓方面效果顯著,我國中藥材種類多、品種齊全、質量好,研究中藥的降壓機理顯得尤為重要。因為我國人口主要以農村居多,長期西藥降壓治療,會造成家庭以及社會的經濟負擔,以及西藥帶來的副作用,所以我們應該發揮中醫藥優勢。隨著人們對中醫藥認識的不斷提高,以及我國大力扶持中醫藥事業發展,中藥被越來越多的病人所接受。目前,高血壓的有關治療主要以西藥為主中藥為輔,從而能夠更好的控制血壓,這樣既能夠緩解西藥的副作用,同時可以改善患者的癥狀。趙君等[1]運用中藥治療原發性高血壓患者,通過隨機對照試驗的Meta 分析發現,中藥聯合西藥組能提高降壓療效、中醫證候療效,說明中藥治療原發性高血壓有一定的優勢,能夠起到補充治療的作用。
當歸是祖國醫學的傳統中藥,始載于《神龍本草經》,是歷代醫家常用之藥。當歸也是甘肅的道地藥材,以岷縣產量多、質量好,是傘形科當歸屬的一種多年生草本植物[2]。當歸的藥理作用非常廣泛,具有增強免疫力、抑制血小板聚集、抗溶血、抑制心率、改善心肌缺血、保護肝臟、改善缺氧等作用[3],及當歸的一般化學成分對心血管有積極調控作用。當歸藥性,屬甘、辛,溫。歸肝、心、脾經。功效為補血調經,活血止痛,潤腸通便。其中有機酸類、當歸揮發油等是當歸的化學成分,也是有效成分之一。當歸揮發油主要分類為3 種油性物質,分別為酚性油、中性油和酸性油,油性比例最高為中性油,占當歸揮發油的總比例88%以上,其中藁本內酯、當歸酮、丁烯基酞內酯、亞丁基苯酞、洋川芎內酯等為其主要化學成分[4]。有研究證實,當歸揮發油可以降壓,主要降壓作用當歸揮發油各組分(5-羥甲基糠醛、鞣酸、腺苷和牛磺酸)共同作用的結果,降壓機制通過多種因素綜合作用結果,其中包括Ca2+通道被抑制、中樞M、β 受體和外周M 膽堿受體被激活、血管擴張、血流加速、血液黏稠度以及腎素-血管緊張素活性降低[5]。劉倍吟等[6]通過實驗研究發現,當歸揮發油能夠降低SHR 的血壓,降低SHR血清中內皮素-1(Endothelin-1,ET-1)、C反應蛋白(Creactive protein,CRP)、血管細胞黏附分子-1(Vascular cell adhesion molecule-1,VCAM-1)的表達,進一步證實當歸揮發油的降壓機制可能與血管的炎性反應有關。
本課題組前期的實驗研究表明,當歸揮發油具有降壓作用,對胸主動脈內皮、心肌組織具有保護作用,其降壓作用可能與抑制血清中內皮素-1(Endothelin-1,ET-1)、血 管 內 皮 生 長 因 子(Vascular endothelial growth factor,VEGF)、前列環素I2(Prostaglandin I2,PGI2)、腎素和血管緊張素Ⅱ受體拮抗劑(AngiotensinⅡ,Ang Ⅱ)水平有關,其降壓機制可能與保護血管內皮、改善動脈血管內皮結構、影響血清中血管活性物質水平有關。為進一步探討其可能的降壓機制,本實驗以自發性高血壓大鼠作為研究對象,觀察當歸揮發油對其血壓及血管假血友病因子(vWF)、一氧化氮(NO)、內皮細胞膜微粒(EMPs)水平等血管活性物質的影響,來探討其可能的降壓機制。
1 材料與方法
1.1 動物選擇與分組
6 只8 周齡雄性Wistar 大鼠(體重180-220 g)為正常組,購于甘肅中醫藥大學動物實驗中心,無特定病原體動物(Specific Pathogen Free,SPF)級,動物許可證號[SCXK(甘)2015-0002]。30只同周齡同體重(180-220 g)雄性SHR,購于北京維通利華實驗動物有限公司,SPF級,動物許可證號[SCXK(京)2016-0006]。
1.2 實驗藥物與試劑
當歸揮發油購西安四季生物科技有限公司(批號:SJDY180207),纈沙坦(北京諾華制藥有限公司,國藥準字:H20040217),NO、vWF 的ELISA 試劑盒(江蘇菲亞生物科技有限公司生產,批號:180614050R),EMPs的ELISA試劑盒(江蘇菲亞生物科技有限公司生產,批號:1812R),多功能酶標儀(Tecan Infinite,瑞士),MS60無創尾動脈血壓測定分析系統(MS60,上海玉研科學儀器有限公司)。
1.3 方法
1.3.1 大鼠分組及給藥
將30 只SHR 隨機分為模型組、纈沙坦組及當歸低、中、高劑量組,取同周齡Wistar 大鼠作為正常組(6只)。其中,纈沙坦組為8 mg·(kg·d)-1,當歸揮發油低、中、高劑量組分別予以當歸揮發油0.1 mL、0.2 mL、0.4 mL,相 當 于 含1%、3%、9% 當 歸 揮 發 油 乳 劑2.0 mL·(kg·d)-1。其中正常組和模型組大鼠給予等量蒸餾水,給藥方式為灌胃,1 次/d,7 天/w,給藥4 周。實驗室環境溫度(23.0± 2.0)℃,相對濕度(35± 5)%,換氣量10~20 次/h,日光燈采光,明暗交替,常規充足飼料喂養,自由飲水,環境安靜。
1.3.2 血壓檢測
在大鼠清醒狀態下采用套尾法測量尾動脈收縮壓,測量前用恒溫水(40℃)使大鼠尾部松軟,皮溫升高,從而擴張大鼠尾動脈,于大鼠尾部尾動脈部位安裝尾套。使得血壓測定系統的脈搏傳感器與大鼠尾動脈精密接觸,在大鼠安靜狀態下,待血壓界面出現穩定的脈搏開始測量血壓。正式實驗前測量血壓1次,待實驗開始后每周測量血壓1次,連續測量4周。
1.3.3 標本的采集
連續給藥4 周后,給予大鼠10% 水合氯醛(0.03 mL·kg-1)麻醉大鼠,于腹主動脈取血8 mL,精置30 min,以4℃,3 × 103 r·min-1離心10 min,分離出血清,置放于-20℃冰箱備用。
1.3.4 ELISA檢測血清中vWF、EMPs、NO水平
本研究嚴格采用大鼠vWF、EMPs、NO 的ELISA 試劑盒說明書操作。分別設置空白孔、標準孔和待測樣品孔,其中每組均設置1個復孔,然后分別進行標準品稀釋,以及加樣、溫育、配液、洗滌、加酶、重復溫育、重復洗滌、顯色、終止反應。以空白孔調零,450 nm 波長測定各孔吸光度,加終止液后15 min 內測定開始進行。然后根據標準品制作標準曲線,計算各組血清中vWF、EMPs、NO的相應濃度。
表1 當歸揮發油對SHR大鼠尾動脈收縮壓的影響(±s,n = 6)
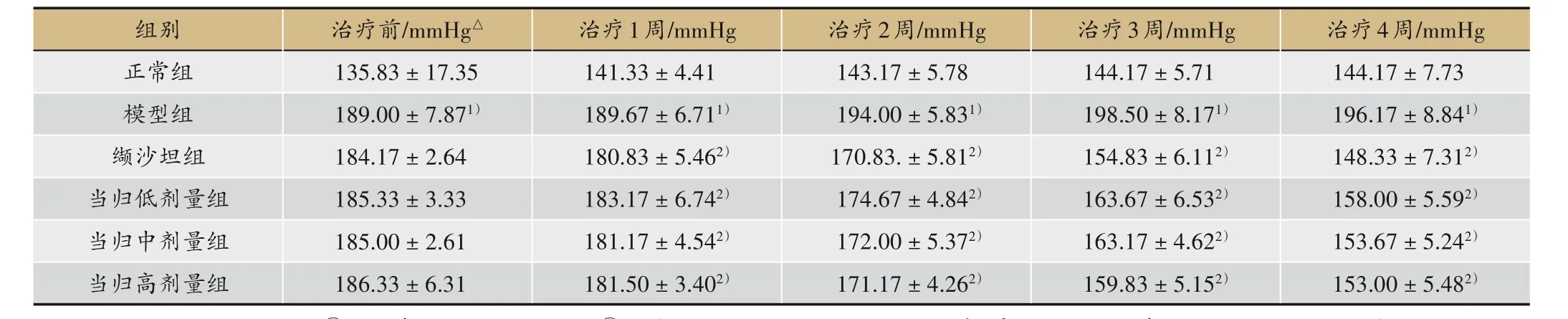
表1 當歸揮發油對SHR大鼠尾動脈收縮壓的影響(±s,n = 6)
注:△1 mmHg =0.133 kPa。①與正常組比較,P<0.01;②治療1、2、3 周纈沙坦組、當歸低、中、高劑量組與正常組比較,P<0.01;治療4 周纈沙坦組與正常組比較,P>0.05;治療4周當歸低劑量組與正常組比較,P<0.01;治療4周當歸中、高劑量組與正常組比較,P<0.05;治療4周纈沙坦組、當歸低、中、高劑量組與模型組比較,P<0.01
治療4周/mmHg 144.17±7.73196.17±8.841)148.33±7.312)158.00±5.592)153.67±5.242)153.00±5.482)組別正常組模型組纈沙坦組當歸低劑量組當歸中劑量組當歸高劑量組治療前/mmHg△135.83±17.35189.00±7.871)184.17±2.64185.33±3.33185.00±2.61186.33±6.31治療1周/mmHg 141.33±4.41189.67±6.711)180.83±5.462)183.17±6.742)181.17±4.542)181.50±3.402)治療2周/mmHg 143.17±5.78194.00±5.831)170.83.±5.812)174.67±4.842)172.00±5.372)171.17±4.262)治療3周/mmHg 144.17±5.71198.50±8.171)154.83±6.112)163.67±6.532)163.17±4.622)159.83±5.152)
表2 各組自發性高血壓大鼠血清EMPs、vWF、NO含量的比較(±s,n = 6)

表2 各組自發性高血壓大鼠血清EMPs、vWF、NO含量的比較(±s,n = 6)
注:與正常組比較,*P<0.05,**P<0.01;與模型組比較△P<0.05,△△P<0.01
NO/(μmol·L-1)24.08±0.428.63±0.24**21.15±0.16△△19.92±0.17△△18.70±0.23△△21.28±4.70△△組別正常組模型組纈沙坦組當歸低劑量組當歸中劑量組當歸高劑量組只數66 6 6 6 6 EMPs/(pg·L-1)129.93±2.23263.62±13.14**157.24±15.89△△173.31±04.31△△175.72±2.27△△194.06±03.49△△vWF/(ng·L-1)412.90±3.65634.53±1.26**456.72±3.65△△492.12±3.86△△509.39±2.19△△528.35±5.50△△
1.4 統計學處理
采用spss 23.0 軟件進行數據分析,數據用均數±標準差(±s)表示,多組間采用重復測量的多因素方差分析;2 組間比較采用獨立樣本t檢驗,以P<0.05、P<0.01為差異有統計學意義。
2 結果
2.1 當歸揮發油對SHR血壓的影響
治療前纈沙坦組、當歸低、中、高劑量組和正常組比較血壓明顯偏高,差異均有統計學意義(P<0.01),見表1。
治療1 周纈沙坦組、當歸低、中、高劑量組和正常組比較,均有顯著差異,差異具有統計學意義(P<0.01)。治療2 周纈沙坦組、當歸低、中、高劑量組和正常組比較,均有顯著差異,差異具有統計學意義(P<0.01)。治療3 周纈沙坦組、當歸低、中、高劑量組和正常組比較,均有顯著差異,差異具有統計學意義(P<0.01)。治療4 周纈沙坦組和正常組比較無顯著差異(P>0.05),當歸低劑量組和正常組比較均有顯著差異,差異具有統計學意義(P<0.01),當歸中、高劑量組和正常組比較有顯著差異,差異有統計學意義(P<0.05),見表1。
治療4周,纈沙坦組、當歸低、中、高劑量組和模型組比較,均有顯著差異,差異具有統計學意義(P<0.01),見表1。
2.2 當歸揮發油對SHR血清中NO、EMPs、vWF的影響
與正常組比較,模型組血清中EMPs 和vWF 含量顯著升高(P<0.01),NO 含量顯著降低(P<0.01);與模型組比較各給藥組可不同程度地降低血清中EMPs、vWF 水平(P<0.01);與模型組比較各給藥組NO含量升高(P<0.01),差異具有統計學意義,見表2。
3 討論
高血壓是最常見的慢性疾病之一,2018年8月,歐洲高血壓學會和歐洲心臟病學會聯合宣布2018年高血壓管理指南,指出在全球范圍內患有高血壓的人數已經超過10億,這是一個龐大的患者群體。隨著人們生活壓力的增加、各種不良的生活方式(高鹽飲食、久坐不動、嗜酒、吸煙)以及全球人口的老齡化,預計在2025年全球高血壓患病人數將達到15 億[7]。高血壓是中風和心血管等疾病的主要危險因素,是世界范圍內死亡的主要原因,因此有效降低血壓,以預防中風及心血管疾病等并發癥的發生,降低患者死亡率[8]。在研究高血壓發病機制時,人們將從血管活性物質以及結構和功能的改變三個方面著手。血管活性物質又稱為血管舒縮劑,是由機體臟器、組織產生的一些對血管具有舒張或者收縮作用的生物介質。這些生物介質對許多臟器系統有顯著作用,但最明顯是對循環系統作用,直接作用于血管平滑肌,使血管產生收縮和舒張作用[9]。高血壓的發生主要是因為動脈血管的變化導致的。血壓升高導致血管內皮結構和功能受損,進一步使得血液中血管活性物質失去動態平衡,從而加重高血壓[10]。
EMPs 是激活或凋亡的血管內皮細胞產生的有生物學活性的微粒,對于其檢測能直接反映血管內皮的損傷狀態。EMPs 是1999年被法國學者Combes 等[11]在研究體外產生內皮微粒和狼瘡抗凝劑患者可能的促血栓形成活性的實驗時首次發現并報道的,微粒的體積一般在0.1-1 μm 大小。EMPs 攜帶源自母細胞表面的不同抗原微粒具有不同的特性,其中可以導致血管內皮細胞損傷的抗原微粒有CD144、CD51/61、CD105、CD31,能夠促進血管內皮修復的抗原微粒有CD62E、CD54、CD106[12]。在多項實驗研究中發現,EMPs 在血管的炎性反應、血栓的形成、血管內皮細胞的損傷及修復、血管內皮的粥樣硬化、缺血性腦卒中等多種血管疾病的發生發展的過程中起到非常重要的作用[13-14]。Jain 等[15]發現,在嚴重高血壓患者血漿中EMPs 水平顯著增高,并在高血壓引起的靶器官損傷中起重要作用,認為血漿EMPs 是內皮損傷最直接的產物。EMPs 可抑制一氧化氮合酶磷酸化,使NO 的生成減少。EMPs 可激活p38 絲裂原活化蛋白激酶(P38 mitogen-activated protein kinase,P38MAPK)通路,刺激腫瘤壞死因子-α(Tumor necrosis factor-α,TNF-α)和白介素-6(Interleukin-6,IL-6)的增加,誘導炎癥反應造成血管內皮損傷[16]。研究表明,EMPs 促使內皮細胞表達炎性因子、損害內皮功能障礙均通過轉錄因子核因子-kB(Nuclear-factor κappa B,NF-kB)介導的轉導通絡進行,從而破壞血管舒張功能,進一步抑制NO合成[17]。
NO 作為舒血管物質,在調節血壓方面起著重要作用,NO 實現生物學作用主要是通過啟動可溶性鳥苷酸環化酶,進一步生成環鳥苷酸,使得增加環鳥氨酸在細胞內水平[18]。NO 能夠調節血壓是因為擴張了血管平滑肌,持續性NO 是生成減少或者功能異常,均會損傷血管內皮細胞,從而降低NO 的生物活性[19]。使得血壓升高,最終損害血管內皮細胞,抑制NO 的合成,使血壓狀態持續處于高水平[20]。孫彩紅等[21]研究發現在高血壓患者中,血清NO 與收縮壓升高,可能與交感神經的激活以及副交感神經抑制有關。內皮功能的紊亂源于自主神經功能紊亂造成的,也是其致病因素,同時有可能存在第3 因素。吳國泰等[22]通過高血壓大鼠模型研究當歸揮發油的降壓機制,采用L-硝基-精氨酸(N-nitro-L-arginine,L-NNA)誘導小鼠制造高血壓模型,其中L-NNA為非選擇性一氧化氮合酶(Nitric oxide synthase,NOS)抑制劑,使小鼠體內NO 合成不足,實驗研究發現當歸揮發油中、高劑量能夠降低SHR的收縮壓(Systolic blood pressure,SBP)、舒張壓(Diastolic blood pressure,DBP)、平均血壓(Mean blood pressure,MBP)水平,通過實驗推測當歸揮發油可能與拮抗L-NNA 有關,促使體內NO 的合成,從而進一步降低血壓,可能的降壓機制與受體操作性Ca2+通道(Receptor-operated Ca2+channel,ROCC)和電壓操作性Ca2+通道(Voltage-operable Ca2+channel,VOCC)介導的主動脈平滑肌收縮均有抑制作用有關,從而呈現非特異性鈣通道阻滯作用。
vWF是一種糖蛋白,這種糖蛋白是由第12號染色體所編碼,vWF 可以結合膠原纖維以及血小板,使得血管破裂大量血小板可以貼附在膠原纖維而形成血栓,最終才能夠止血。vWF 在正常生理情況下大部分是由內皮細胞合成,小部分是由巨噬細胞合成,合成后分別儲存于棒桿狀小體(Weibel-palade body,W-P小體)內和血小板顆粒中,其中W-P 小體與動脈粥樣硬化關系密切[23]。vWF 是一種特異性標志物,當血管內皮細胞受損,vWF 迅速釋放入血使血小板凝聚,進一步形成血栓[24]。在一項實驗研究中,以高血壓頸動脈硬化患者實驗對象,在研究發現,在實驗組血清vWF 水平明顯高于對照組,并且血清中vWF 水平與頸動脈的硬化程度呈正相關[25]。
本研究結果顯示,纈沙坦、當歸低、中、高劑量組均能夠有效降低SHR 的血壓,并能降低血清vWF、EMPs 的表達,升高NO 的表達,說明其降壓作用與血清中vWF、EMPs 水平有關。根據表1,可以看出,治療前后血壓比較,治療1、2、3 周后各治療組的血壓下降程度明顯,尤以纈沙坦組血壓下降程度突出,治療4周后纈沙坦組血壓下降程度減弱,當歸低、中、高劑量組降壓趨于穩定。因此,可以推測出,纈沙坦組的降壓速率快,但是治療效果不穩定。當歸低、中、高劑量組降壓速率慢,但是治療效果恒定。因此,中藥的降壓效果仍然存在一定的優勢。
綜上所述,本研究推測當歸降低血清vWF 的水平,可以降低血小板的粘附聚集,從而抑制血栓的形成,防止動脈硬化的發生,對內皮細胞起到保護的作用。通過降低EMPs 的水平,防止炎癥損傷,從而更進一步提高NO的水平,舒張血管,維持血壓穩定。

