外源ATP對鹽脅迫下油菜種子萌發及幼苗生長的影響
梁娟紅,李巧麗,賴 晶,張小花,張騰國
(西北師范大學生命科學學院,甘肅 蘭州 730070)
5’-三磷酸腺苷(adenosine-5’-triphosphate, ATP)作為一種高能化合物,是生物體內進行正常物質代謝和能量代謝的直接能量來源。已有研究發現,細胞外基質中也存在ATP,即胞外ATP(extracellular ATP,eATP),它可以作為一種重要的信使分子,通過特定的細胞信號轉導機制參與植物對生物、非生物脅迫的響應過程[1]。Luattge等[2]研究發現施加ATP能夠促進燕麥葉片維管束鞘細胞對K+的吸收。此外施加ATP還增強了核酸內切酶的活性[3]。也有研究表明:增加細胞外ATP濃度會抑制擬南芥根的向重力性,跨膜ATP濃度會破壞生長素極性運輸[4],導致花粉不萌發以及抑制花粉管生長[5]。另外,外源ATP還參與次生代謝物的積累[6]、細胞凋亡[7]、脅迫抗性[8]等生理過程。但關于外源ATP對種子萌發及抗鹽性的影響鮮見報道。

植物液泡為儲存Na+提供了一個比較大的空間,液泡膜中的鈉-氫交換蛋白(NHX)可以將細胞質中的Na+螯合到液泡中,降低細胞質中Na+濃度,減少過量Na+對植物的毒害[12]。第一個NHX轉運體基因是在擬南芥中克隆并命名為AtNHX1[13]。研究發現,NHX也會影響植物體內K+的區室化。過表達AtNHX1基因的番茄在鹽脅迫條件下促進了K+從地下向地上運輸,液泡中K+濃度上升,細胞間Na+/K+降低,從而有效降低鹽脅迫對過表達番茄的鹽害作用[14]。Zhao等[15]在兩種耐鹽性不同的楊樹中研究發現,外源ATP的施用顯著降低了兩種楊樹中鹽誘導的K+外流,觸發鹽敏感植株中的SOS(鹽超敏感信號轉導途徑)信號級聯反應,并有助于鹽度下Na+穩態的控制。除此之外,在植物響應鹽脅迫過程中SOS信號途徑也發揮著重要的作用,其中SOS1是參與Na+從細胞質向質外體轉運的關鍵基因[16],在細胞膜上編碼Na+/H+逆向轉運蛋白,在種子萌發過程中起重要作用,處于鹽脅迫條件下也能幫助植物更好地生長發育[17]。Jeter等[18]研究發現,在擬南芥中,ATP的外源處理可以激活MAP激酶途徑以及參與乙烯生物合成和信號轉導蛋白的轉錄物水平。同時,MAP激酶級聯途徑也參與抗鹽調控過程。有研究表明,MEKK1-MKK2-MPK4/MPK6級聯途徑可以參與鹽脅迫下擬南芥的信號響應過程[19],而MKK9-MPK3/MPK6級聯途徑參與調節乙烯的合成并在擬南芥對鹽脅迫的響應中發揮作用[20]。
隨著冬油菜北移技術的成功示范,白菜型冬油菜(Brassicacampestris)已成為北方寒旱區主要的油料作物和生態作物[21]。但北方土壤廣泛存在不同程度的鹽漬化,嚴重影響了冬油菜的生長發育和高產潛力的發揮[22]。因此,本文以白菜型冬油菜‘隴油8號’為材料,研究外源ATP浸種對NaCl脅迫處理下油菜種子萌發、幼苗生理及相關基因表達(MAPK3和MAPK6、SOS1和NHX1)的影響,為提高油菜抗鹽性提供理論依據。
1 材料與方法
1.1 試驗材料處理及培養
挑選籽粒飽滿、大小均一的‘隴油8號’種子(由甘肅農業大學農學院提供)用自來水反復沖洗,室溫下浸泡2 h,再進行以下處理。(1)不同濃度的外源ATP溶液浸種處理:將種子分別置于濃度為0、1、10、25、50、100 μmol·L-1的外源ATP溶液中,于(25±1)℃培養箱黑暗浸種12 h;浸種后的種子用0.5%的次氯酸鈉消毒5 min,無菌水沖洗5~6次后接種到1/2 MS固體培養基中,每個培養皿中放置30粒種子,置于(25±1)℃、光照強度為250 μmol·(m2·s)-1、光照周期16 h/8 h(光照/黑暗)的培養箱(RDN型人工氣候箱)中培養。每個處理5個重復。(2)CK:將油菜種子置于1/2 MS固體培養基中,培養條件與(1)處理相同。(3) NaCl單獨處理:將油菜種子置于含200 mmol·L-1NaCl的1/2 MS固體培養基中,培養條件與(1)處理相同。(4)ATP+NaCl復合處理:用25 μmol·L-1外源ATP溶液,按照(1)處理的方法浸種。用上述方法接種于含200 mmol·L-1NaCl的1/2 MS固體培養基中,培養條件與(1)處理相同。
1.2 種子萌發相關指標的測定
培養3 d后觀察種子萌發情況,以胚根凸出種皮長度大于等于種子長度作為發芽標志,計算發芽勢。處理7 d后觀察種子發芽情況,再以上述方法觀察種子的萌發情況,計算發芽率。
1.3 生理指標的測定
取培養7 d的油菜幼苗地上部分進行后續試驗。幼苗根長與株高測定參照田夢雨[23]的方法;過氧化氫(H2O2)含量測定參照Yin等[24]的方法;羥自由基(·OH)含量測定參照Halliwell[25]的方法;丙二醛(MDA)含量測定參照硫代巴比妥酸法[26];相對電導率測定參照電導率儀法[27];游離脯氨酸含量測定參照磺基水楊酸法[28];可溶性糖含量測定參照蒽酮顯色法[29]。
1.4 活性膠電泳及染色
活性膠制備參照Lammli[30]的方法。采用5%的濃縮膠和12%的分離膠。CAT上樣量為6 μL,POD上樣量為9 μL。濃縮膠電壓為80 V,分離膠電壓為120 V,冰浴中穩壓電泳約5~6 h。
CAT活性染色參照 Woodbury等[31]的方法;POD同工酶活性膠染色參照黃永芬等[32]的醋酸聯苯胺方法。
1.5 實時熒光定量PCR
油菜幼苗總RNA的提取采用TaKaRa MiniBEST Plant RNA Extraction Kit試劑盒,參照試劑盒實驗步驟操作。以提取的總RNA為模板,參照反轉錄試劑盒合成cDNA。以Actin-F、Actin-R為管家基因引物,MAPK3-F和MAPK3-R為MAPK3引物,MAPK6-F和MAPK6-R為MAPK6引物,SOS1-F和SOS1-R為SOS1引物,NHX1-F和NHX1-R為NHX1引物(表1),按照熒光定量PCR試劑盒SYBR Premix Ex TaqTM(購自TaKaRa公司)的操作步驟用25 μL體系進行擴增檢測。采用2-ΔΔCt方法分析數據,計算基因的相對表達量。
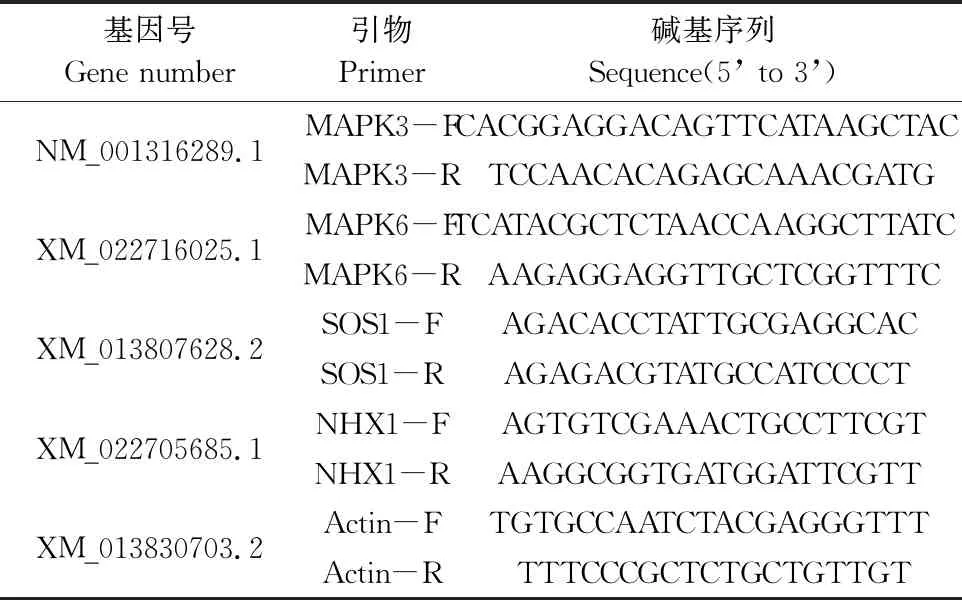
表1 PCR引物序列
1.6 數據處理
試驗數據使用SPSS 20.0軟件進行統計分析,用Excel 2010軟件作圖。
2 結果與分析
2.1 不同濃度外源ATP浸種對油菜種子發芽率和發芽勢的影響
由表2可知,與CK相比較,發芽勢和發芽率均隨外源ATP濃度增大呈先升后降的趨勢。當外源ATP濃度為25 μmol·L-1時,發芽勢和發芽率達到最大值,分別比CK提高26.9%和17.2%。結果表明,外源ATP濃度在一定范圍內對種子萌發具有促進作用,而25 μmol·L-1的外源ATP處理效果最明顯。

表2 不同濃度外源ATP對油菜種子發芽率和發芽勢的影響
2.2 外源ATP浸種對NaCl脅迫處理下油菜種子發芽率和發芽勢的影響
如表3所示,與CK相比,200 mmol·L-1NaCl脅迫處理顯著抑制了油菜種子萌發,發芽率、發芽勢分別下降了13.5%、4.7%;ATP+NaCl復合處理下的種子萌發情況顯著優于NaCl單獨處理,其發芽率、發芽勢分別提高了13.7%和15.0%。結果表明,NaCl脅迫處理顯著抑制了油菜種子萌發,而ATP浸種能顯著緩解NaCl脅迫對油菜種子萌發的抑制作用。
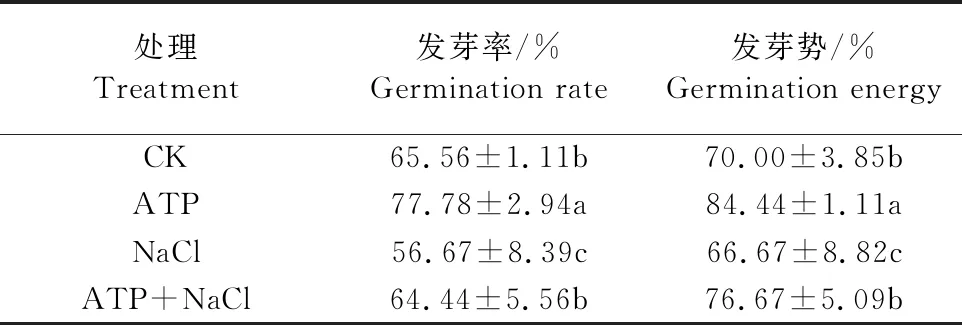
表3 外源ATP 浸種對NaCl脅迫處理下 油菜種子萌發的影響
2.3 外源ATP浸種對NaCl脅迫處理下油菜幼苗生物量的影響
如表4所示,200 mmol·L-1NaCl脅迫處理下的油菜幼苗根長、株高及鮮重均低于CK且鮮重顯著下降;ATP+NaCl復合處理下的油菜幼苗根長、株高及鮮重相較于NaCl單獨處理分別升高了23.6%、27.3%、28.6%。結果表明,NaCl脅迫處理能抑制油菜幼苗生長和生物量積累,外源ATP浸種能夠緩解NaCl脅迫處理對油菜幼苗的抑制作用。
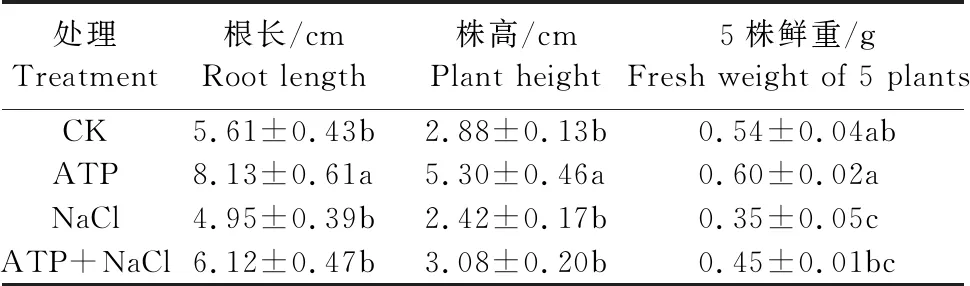
表4 外源ATP浸種對NaCl脅迫處理下 油菜幼苗生物量的影響
2.4 外源ATP浸種對NaCl脅迫處理下油菜幼苗生理特性的影響
2.4.1 外源ATP浸種對NaCl脅迫處理下油菜幼苗H2O2和·OH含量的影響 如圖1顯示,與CK相比,外源ATP浸種、NaCl脅迫處理均顯著誘導油菜幼苗中H2O2(圖1A)和·OH(圖1B)的產生;ATP+NaCl復合處理與NaCl單獨脅迫處理相比,H2O2和·OH的含量分別降低了13.6%和6.3%。結果表明,NaCl脅迫處理顯著促進了油菜幼苗中ROS的積累,而外源ATP浸種能夠降低NaCl脅迫處理下油菜中活性氧(ROS)含量,緩解鹽脅迫對油菜幼苗的損傷。
2.4.2 外源ATP浸種對NaCl脅迫處理下油菜幼苗CAT和POD活性的影響 由圖2A可知,不同處理下CAT同工酶條帶數相同,有且僅有一條帶,在外源ATP浸種、NaCl單獨脅迫處理下,油菜幼苗CAT酶帶相對灰度比CK分別高3.0%和16.0%;ATP+NaCl處理下的CAT酶帶相對灰度比NaCl單獨脅迫處理高10.3%。如圖2B所示,4個處理下的POD有5條同工酶帶,但同一酶帶在不同處理下有差異。NaCl脅迫處理下油菜幼苗POD酶帶相對灰度比CK高89.0%;ATP+NaCl處理下POD同工酶條帶相對灰度比NaCl單獨處理高27.0%。結果表明,外源ATP浸種、NaCl脅迫處理都會提高CAT、POD酶活性水平;外源ATP浸種進一步提高了NaCl脅迫下油菜幼苗中的CAT、POD酶活性,增強了油菜幼苗對體內過量ROS的清除能力。
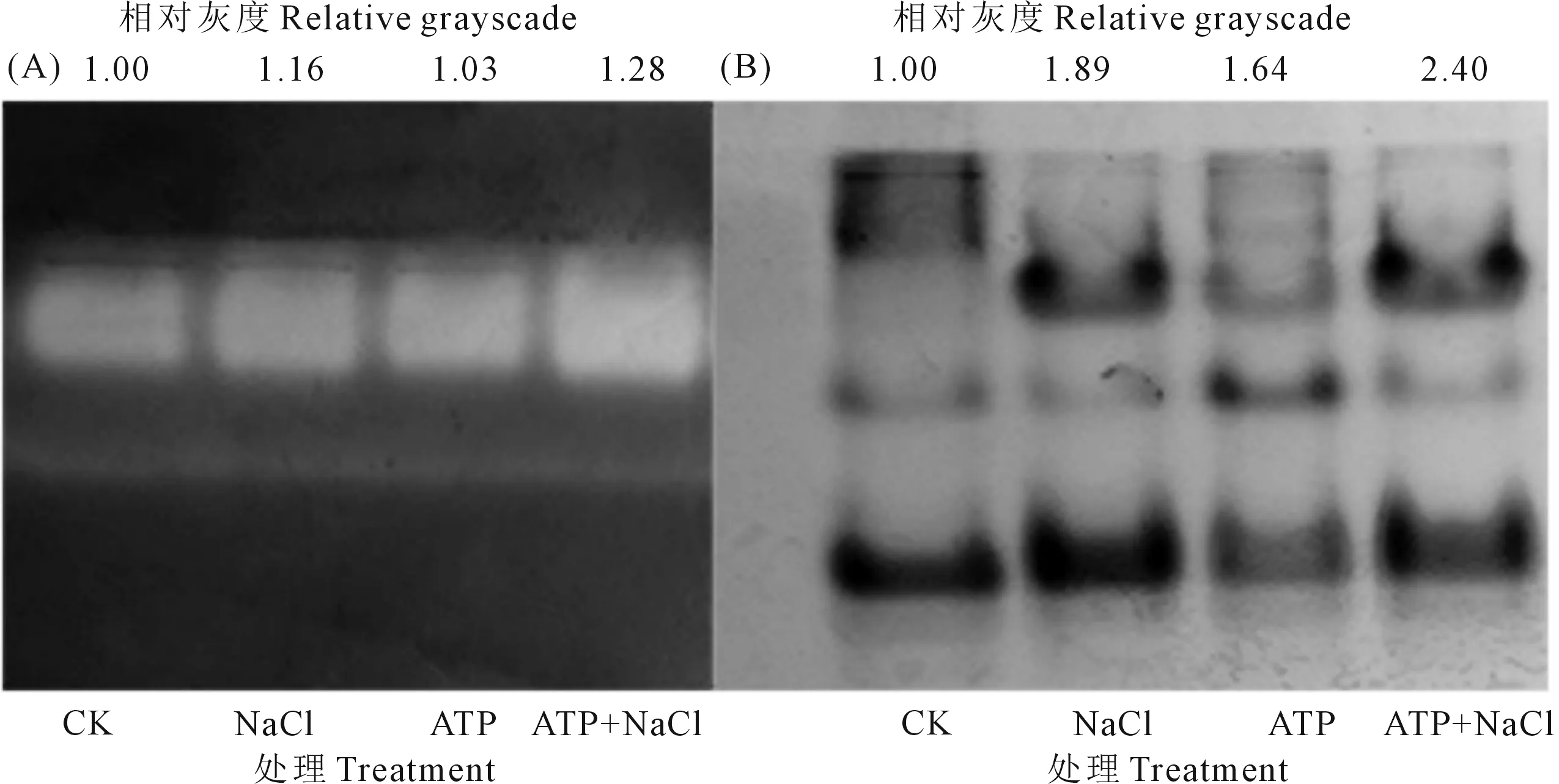
圖2 鹽脅迫處理下外源ATP浸種的油菜幼苗CAT(A)和POD(B)電泳圖及相對灰度分析Fig. 2 Electrophoresis and relative grayscale analysis of antioxidant enzymes in Brassica campestris seedling under NaCl stress by exogenous ATP seed soaking
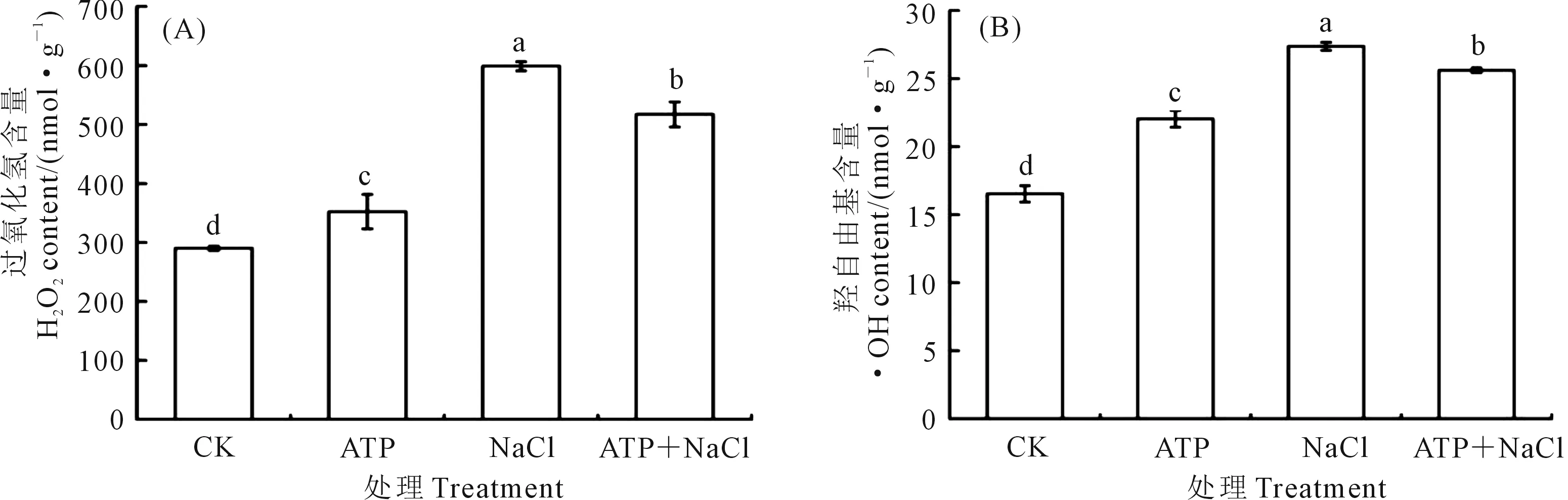
注:不同小寫字母表示處理間差異顯著(P<0.05)。下同。Note: Different lowercase letters in theFigure indicate significant differences among treatments (P<0.05). The same below.圖1 NaCl脅迫處理下外源ATP浸種的油菜幼苗中H2O2 (A)和·OH (B)含量Fig.1 H2O2 (A) and ·OH (B) accumulation of Brassica campestris seedling exposed under NaCl stress by exogenous ATP seed soaking
2.4.3 外源ATP浸種對NaCl脅迫處理下油菜幼苗膜損傷程度的影響 逆境條件下,MDA和相對電導率能夠作為細胞損傷程度的指標。從圖3可以看出,與CK相比,NaCl脅迫顯著增加了油菜中的MDA含量(圖3A)和相對電導率(圖3B),表明NaCl脅迫可以加劇油菜幼苗的膜脂過氧化程度。外源ATP浸種顯著降低了NaCl脅迫處理下的MDA含量和相對電導率,MDA含量降低了27.6%,相對電導率降低了20.5%。結果表明,外源ATP浸種可以降低NaCl脅迫處理下油菜中的MDA含量和相對電導率,減少膜脂過氧化程度和電解質的滲漏,保護細胞膜的完整性,減輕鹽脅迫對油菜的損傷。
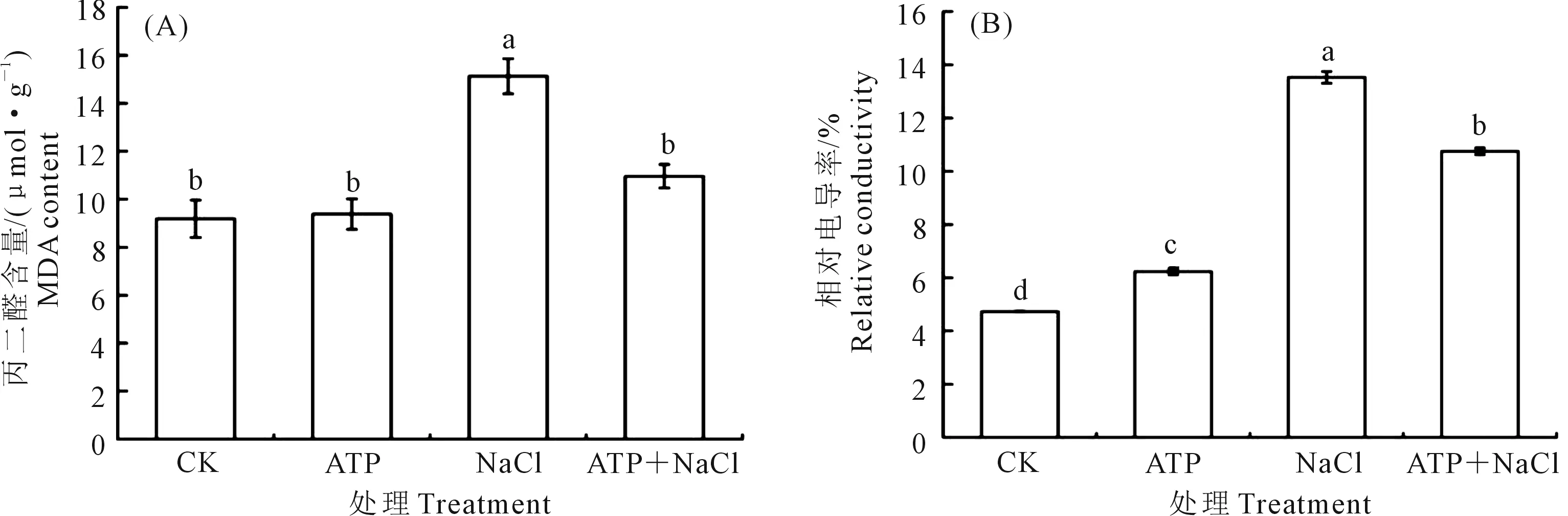
圖3 外源ATP浸種對NaCl脅迫處理下油菜幼苗中丙二醛(A)和相對電導率(B)的影響Fig.3 Effects of seed soaking with exogenous ATP on malondialdehyde (A) and relative conductivity (B) of Brassica campestris seedling under NaCl stress
2.4.4 外源ATP浸種對NaCl脅迫處理下油菜滲透調節物質的影響 可溶性糖和脯氨酸是細胞內重要的滲透調節物質,可保護細胞內蛋白分子,穩定生物大分子結構。如圖4可見,NaCl脅迫處理、ATP+NaCl復合處理都顯著增加了油菜幼苗中可溶性糖(圖4A)和脯氨酸(圖4B)含量,NaCl脅迫處理下可溶性糖、脯氨酸含量分別達到CK的187.8%和459.5%;ATP+NaCl復合處理下油菜幼苗中可溶性糖和脯氨酸含量分別達到NaCl脅迫處理的15.9%和41.0%。結果表明,NaCl脅迫處理下外源ATP浸種能顯著增加油菜幼苗中滲透調節物質積累,增強細胞的持水能力,維持細胞的正常生理代謝,從而增強油菜幼苗的耐鹽性。
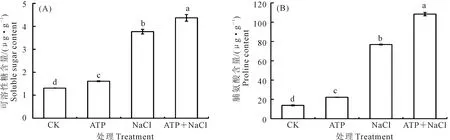
圖4 外源ATP浸種對NaCl脅迫處理下油菜幼苗中可溶性糖(A)和脯氨酸(B)的影響Fig.4 Effects of seed soaking with exogenous ATP on soluble sugar (A) and proline (B) content of Brassica campestris seedling under NaCl stress
2.5 外源ATP浸種對NaCl脅迫處理下油菜幼苗相關基因表達的影響
2.5.1 外源ATP浸種對NaCl脅迫處理下油菜幼苗MAPK3/MAPK6基因表達的影響 如圖5所示,外源ATP處理下的油菜幼苗中MAPK3(圖5A)和MAPK6(圖5B)基因表達量分別較CK增加16.0%、7.0%。在NaCl單獨脅迫處理下的MAPK3和MAPK6基因表達量分別較CK增加86.0%和69.0%。ATP+NaCl處理下的MAPK3和MAPK6基因表達量分別較NaCl單獨脅迫處理增加75.3%、146.2%。結果表明,油菜幼苗中MAPK3和MAPK6基因的表達水平受到NaCl脅迫處理的誘導,外源ATP浸種增強了NaCl脅迫處理下油菜幼苗中MAPK3和MAPK6基因的表達。
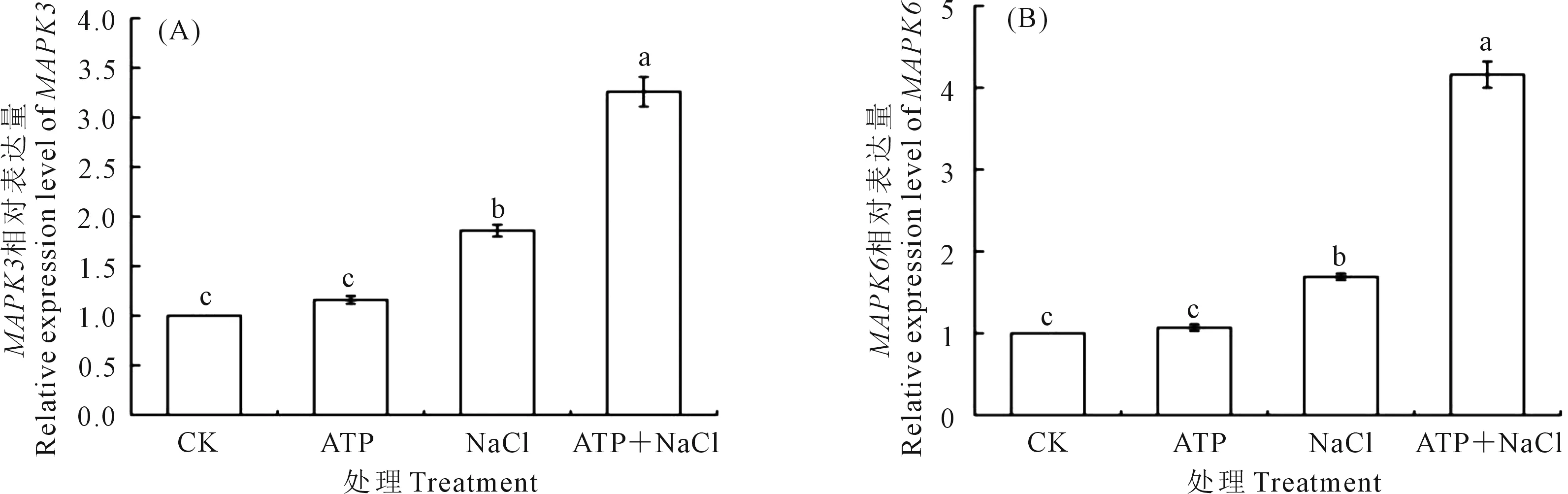
圖5 外源ATP浸種對NaCl脅迫處理下油菜幼苗中MAPK3(A)和MAPK6(B)基因表達的影響Fig.5 Effects of seed soaking with exogenous ATP on the expression of MAPK3 (A) and MAPK6 (B) genes in Brassica campestris seedling under NaCl stress
2.5.2 外源ATP浸種對NaCl脅迫處理下油菜幼苗SOS1/NHX1基因表達的影響 如圖6所示,NaCl脅迫處理下的油菜幼苗中NHX1(圖6A)和SOS1(圖6B)基因表達量上調,分別是CK的1.41倍和1.34倍。與NaCl單獨脅迫處理相比,ATP+NaCl處理下的油菜幼苗中NHX1和SOS1基因表達量分別上升了17.0%和66.4%。結果表明:油菜幼苗中NHX1和SOS1基因的表達受到NaCl脅迫處理的誘導,外源ATP浸種進一步提高了NaCl脅迫處理下油菜幼苗中NHX1和SOS1基因的表達。
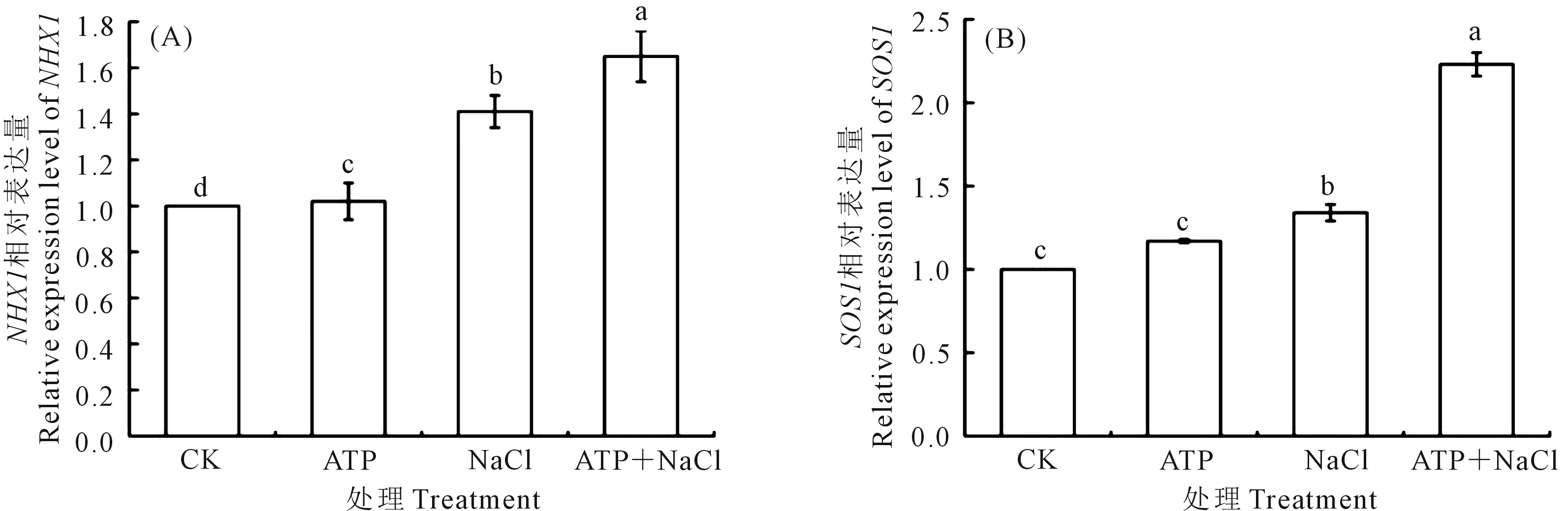
圖6 外源ATP浸種對NaCl脅迫處理下油菜幼苗NHX1(A)和SOS1(B)基因表達的影響Fig.6 Effects of seed soaking with exogenous ATP on the expression of NHX1 (A) and SOS1 (B) genes in Brassica campestris seedling under NaCl stress
3 討論與結論
鹽脅迫對植物的危害包含離子脅迫和滲透脅迫。斯琴巴特爾等[33]研究玉米(Zeamays)種子萌發時發現鹽脅迫抑制了玉米種子的發芽。孫君艷等[34]研究鹽脅迫對小麥種子萌發及幼苗生長的影響,發現高濃度鹽處理對小麥種子萌發和幼苗生長起抑制作用。Chivasa等[35]研究結果表明:細胞外ATP可能通過直接或間接的方式與細胞膜外的某種蛋白質結合,從而在脅迫條件下提高細胞生存率。本試驗結果發現,200 mmol·L-1NaCl處理對油菜種子萌發有抑制作用,而25 μmol·L-1的外源ATP對油菜種子萌發有顯著的促進作用,并能夠提高油菜幼苗的生物量積累,外源ATP浸種能緩解NaCl處理對油菜種子萌發的抑制作用。
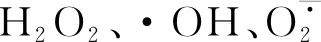
植物在遭受鹽脅迫時會觸發一系列抗鹽相關基因的表達,如NHX和SOS基因的表達。液泡型Na+/H+逆向轉運蛋白(NHX1)可以將細胞質中的Na+逆Na+濃度梯度轉運到液泡中進行區室化,質膜型Na+/H+逆向轉運蛋白(SOS1)也可以將Na+排到胞外,防止細胞質中的細胞器受到Na+的危害。過表達OsNHX1轉基因水稻細胞在鹽條件下存活較好,生長速度和總Na+含量顯著高于野生型[38]。本研究發現,油菜幼苗中NHX1、SOS1基因的表達受到鹽脅迫的誘導,而外源ATP浸種提高了鹽脅迫處理下油菜幼苗中NHX1、SOS1基因的表達,NHX1和SOS1轉錄水平的提高,預示著外源ATP處理觸發了NHX基因家族和SOS途徑介導的Na+外排。MAPK信號級聯途徑在植物應對鹽、干旱、寒冷、炎熱和受傷等信號過程中發揮著十分重要的作用,主要是MAPK3、MAPK4和MAPK6被快速激活[39]。Teige等[20]研究發現,冷和鹽脅迫激活擬南芥的MKK2,控制冷應答基因(COR)的表達,調控植物耐冷和耐鹽能力。而且,MKK2上游的MEKK1和下游的MPK4和MPK6都能被各種脅迫所激活。在本研究結果中,油菜幼苗中MAPK3、MAPK6基因的表達受到鹽脅迫的誘導,而外源ATP浸種提高了鹽脅迫處理下油菜幼苗中MAPK3、MAPK6基因的表達。以上這些研究結果表明,外源ATP在調節植物響應鹽脅迫的過程中,鹽超敏感 (SOS)通路以及MAPK激酶途徑等多種信號傳導途徑之間可能存在交叉對話。
綜上所述,外源ATP浸種通過激活ROS清除系統來有效地清除過量的ROS,降低NaCl脅迫處理下油菜幼苗膜脂過氧化程度,促進滲透調節物質的積累及抗鹽脅迫相關基因的表達,有效保證油菜幼苗代謝活動的正常進行,從而提高油菜幼苗的抗鹽性。

