伴CHD7 基因突變的男性性腺功能減退1 例報告并文獻復習
劉貴中 吳寶軍 白文俊 牛遠杰
1.天津醫科大學第二醫院 泌尿外科,天津300211; 2.天津市津南醫院 泌尿外科,天津300350;3.北京大學人民醫院 泌尿外科,北京,100044
男性低促性腺功能減退癥(HH)病變部位在下丘腦或垂體,多由基因突變引起,就診者首先檢查垂體MR 除外垂體結構性病變,擔心后代遺傳問題行基因測序明確病因。男性HH 患者LH 和FSH 減低,睪酮缺乏,青春期發育不明顯或不完全,常常伴有小陰莖、小睪丸、陰毛稀疏、隱睪或尿道下裂等,早期積極臨床干預,預后良好。
病歷資料
一、病史
患者男性,23 歲,因發育不良于2019年3月11日就診,有包皮環切史。身高171cm,體重75Kg,嗅覺正常,胡須稀疏;Tanner 分期:陰毛P3 生殖器G3;雙側睪丸體積1~2ml,質地軟,陰莖牽拉長度(SPL)7cm。
二、輔助檢查
1、左手骨齡片:骨齡17 歲;
2、陰囊超聲:雙側睪丸小,左側睪丸15mm*12mm*8mm,右側睪丸16mm*10mm*9mm,雙側附睪小,彩色血流信號未見異常。
3、垂體MR:垂體稍小。
4、性激素水平(見表1)。
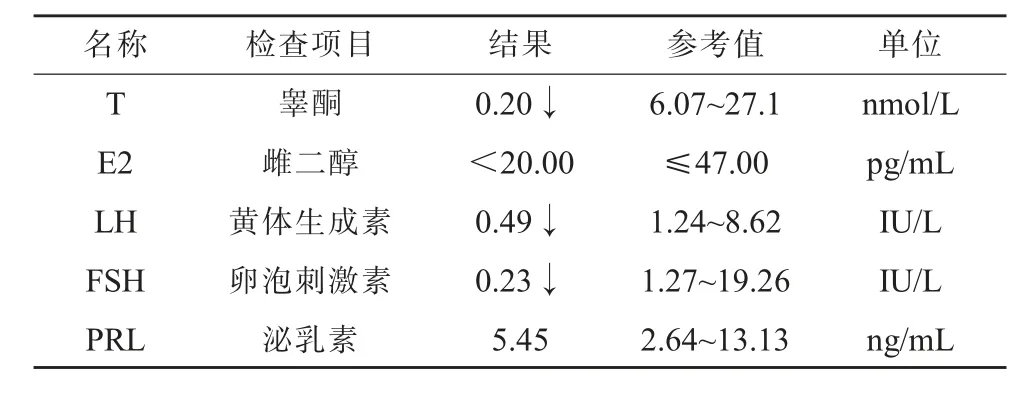
表1 性激素五項水平
5、全基因外顯子測序
(1)先證者測序結果

圖1 全基因外顯子測序
CHD7 基因雜合突變,8 號染色體第33 個外顯子編碼區6955位的胞嘧啶替換為胸腺嘧啶,導致第2319 位的精氨酸(CCG)轉變為半胱氨酸(CTG)
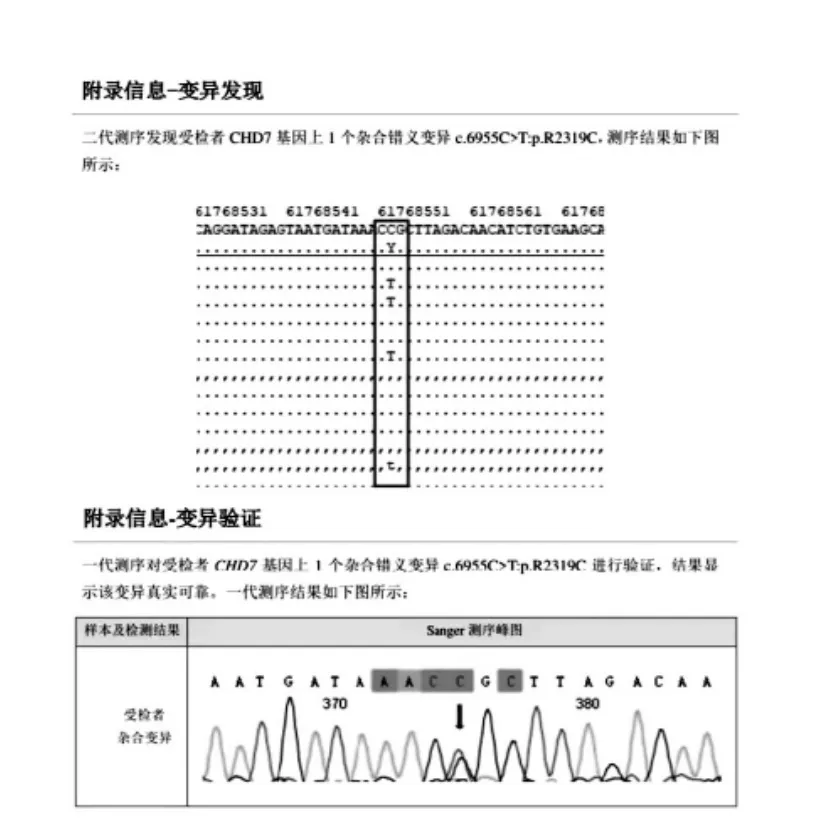
圖2 二代測序變異發現和一代測序變異驗證
(2)先證者母親Sanger 測序結果:
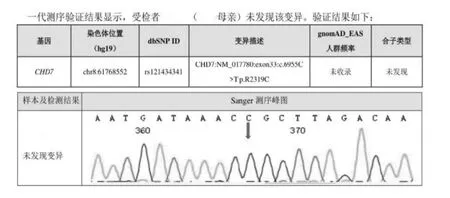
圖3 先證者母親Sanger 測序
(3)先證者父親Sanger 測序結果:
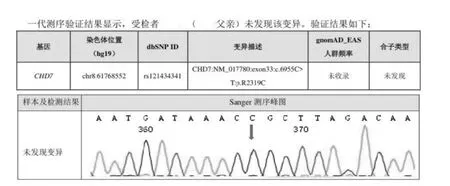
圖4 先證者父親Sanger 測序
三、治療
注射用絨促性素 (hCG)(麗珠制藥) 2000 單位Q72h 肌注;注射用尿促性素(hMG)(麗珠制藥)75 單位Q72h 肌注;十一酸睪酮軟膠丸(安特爾)80mg Bid,早晚餐中口服。
2020年2月復查骨齡片示骨骺閉合,遂停用十一酸睪酮膠丸口服治療,繼續肌注hCG 聯合hMG,鼓勵患者盡早結婚生育。
四、隨訪
上述藥物連續應用治療9 個月后出現精液。隨訪13 個月,胡須增多,陰毛P5,生殖器G4,SPL 10cm,陰莖晨勃及夜間勃起明顯,性欲強,左側睪丸約11ml,右側睪丸約12ml。2020年4月精液常規:量1.5ml,PH7.3,精子濃度10.2×106/mL,活力32%。
討 論
CHD7 基因位于染色體8q12.1,包含38 個外顯子,大小約188kb,編碼2997 個氨基酸,CHD7 包含多個結構域,屬于ATP 依賴的染色質解旋酶DNA 結合蛋白家族,與其他分子協同發揮染色質重塑作用[1]。CHD7是染色質結構域解螺旋酶DNA 結合蛋白7 基因,具有水解ATP 的能力,改變核小體結構,CHD7 基因編碼的蛋白質通過修飾染色質促進轉錄調控和胚胎發育,在染色質重塑、轉錄調控、細胞周期調控、細胞凋亡和胚胎干細胞調控等方面具多種功能[2]。致病性CHD7 等位基因錯義突變破壞ATP 酶和核小體重塑活性,可能是導致HH 發生的分子機制[3]。
CHD7 在胚胎組織細胞廣泛表達,不僅影響神經系統和生殖系統發育,而且對下丘腦、嗅球、耳、心臟、骨骼等器官的生長發育有重要的意義,胚胎時期CHD7在下丘腦、嗅球嗅束、垂體前葉、中葉細胞呈高表達,該基因突變導致GnRH 神經元不能正確的遷移及嗅球發育不良,發生Kallmann 綜合征(KS)[4];CHD7 基因突變致下丘腦GnRH 神經元分泌和作用缺陷,發生低促性性腺功能減退癥(HH)[5,6]。Kim[5]對101 例HH/KS 患者進行CHD7 的38 個外顯子進行篩選,發現3 例散發性KS 和4 例散發性IHH 存在不同程度的CHD7 雜合突變,2 例為點突變,5 例為錯義突變,影響高度保守的染色體結構域,CHD7 基因突變導致單倍劑量不足是發生HH/KS 的主要分子機制。
CHD7 突變引起CHARGE 綜合征[7],為常染色體顯性遺傳疾病,伴有聽力受損、耳畸形、唇腭裂、心臟缺陷、后鼻道閉鎖、生殖器發育不良(如隱睪、小陰莖、尿道下裂、子宮缺如等)和生長發育遲緩等[8,9]。Siavriene[10]報道CHD7 基因突變導致氨基酸移碼突變發生CHARGE 綜合征;Wu[8]對177 例HH 患者進行測序,發現10.2%攜帶CHD7 基因突變。HH 是由于促性腺激素分泌不足導致青春期不發育或發育不全,表現為睪丸發育不良、小陰莖、生精功能障礙等[11],與CHARGE 綜合征有重疊的臨床表型特征,但不伴有心臟、耳、鼻等異常表型,僅僅是影響了GnRH 神經元向下丘腦的遷移或合成與釋放[12]。
CHD7 突變來源分為家族遺傳性和新發突變兩種,家族遺傳性是父母親雙方或一方攜帶相同的致病突變基因,而新發突變是父母親均不攜帶相同的致病突變基因。新發基因突變可能發生在胚胎受精卵卵裂時期,與一些物理因素(射線、紫外線等)、化學因素(亞硝酸鹽、金屬離子、生物堿、抗生素、農藥等)或生物因素(細菌、病毒感染)等影響有關。本例HH 患者因發育不良就診,發現小陰莖、小睪丸、胡須和陰毛稀疏,通過全基因外顯子測序發現CHD7 雜合突變,未發現其他可疑致病基因突變,考慮CHD7 雜合突變為HH 致病原因。對先證者父母進行Sanger 測序未見CHD7 雜合突變,可除外家族遺傳性,遂考慮為新發致病基因突變。CHD7 基因發生錯義突變,精氨酸轉變為半胱氨酸,致使蛋白結構域或功能發生改變,影響大腦和神經系統發育,GnRH 神經元遷移障礙或合成作用缺陷,促性腺激素分泌不足,睪酮降低,導致男性第二性征發育不良。患者就診時骨齡17 歲,幾乎接近閉合,骨骺閉合后陰莖將停止繼續生長發育[13],因而治療時間迫切,遂應用雙促聯合外源性睪酮補充治療,雙管齊下(促性腺激素+睪酮),盡快改變患者一窮(小陰莖)二白(胡須、陰毛稀疏)的面貌,促進睪丸發育及精子成熟,促進男性第二性征發育。
男性HH 的治療以補充睪酮為主,骨骺閉合前早期用藥促進男性第二性征發育,改善男性第二性征不足[15]。有生育需求者,建議應用hCG 聯合hMG 治療,促進精子發生,提高自然妊娠率[16];外源性補充睪酮維持男性身體機能及性功能,適合于無生育需求HH 患者。CHD7 基因突變報道為常染色體顯性遺傳[14],單基因病遺傳概率符合孟德爾定律,自然妊娠后代約50%概率發生HH,如擔心后代遺傳問題,建議選擇胚胎植入前遺傳學篩查,做到優生優育。

