日本落葉松LoERF017基因的克隆及生物信息學分析
馬苗苗 李成浩 劉 曉 張 馨 楊靜莉
(東北林業大學林木遺傳育種國家重點實驗室,哈爾濱 150040)
日本落葉松(Larixkaempferi)為松科(Pinaceae)落葉松屬(Larix)的落葉喬木,為我國東北林區的主要森林樹種,分布于大、小興安嶺海拔300~1 200 m地帶。喜光性強,對水分要求較高,在各種不同環境下均能生長,而以生于土層深厚、肥潤、排水良好的北向緩坡及丘陵地帶生長旺盛[1]。日本落葉松作為北方林區的主要造林樹種,具有生長快、適應性強、經濟價值高的特點,因而常被用于東北地區的荒山造林及紙漿用材林營建[2~3]。然而北方春季易發生干旱,干旱脅迫作為一種最普遍的樹木逆境形式,影響樹木的生長發育,嚴重時可降低林木的產量和品質[4],進而會嚴重影響日本落葉松的成活率。為提高日本落葉松利用效率,我國對落葉松進行的遺傳改良早期主要集中在規模化繁殖配套技術,但是該過程操作復雜周期長,工程量大[5],不適合短時間的育種改良體系。隨著時間的推進以及基因工程的飛速發展,基因工程為縮短育種周期提供了重要選擇,因此研究落葉松遺傳改良的基因工程越來越受到重視。
植物激素中的乙烯對植物的生長發育有著多方面的影響,同時也參與植物生物脅迫和非生物脅迫的調控[6~8]。ERF轉錄因子即乙烯應答因子,又稱為乙烯應答鍵結合蛋白,是乙烯響應元件結合蛋白家族的一個重要的亞族[9],其所包含的AP2區域廣泛參與到植物的各種生理反應中,并且積極地響應各種逆境脅迫和發育信號,在植物的生長發育過程中起著十分重要的作用。ERF類轉錄因子的分類,根據氨基酸序列的不同分為三類,第一和第三類起到激活轉錄的作用,第二類可以抑制轉錄[10]。依據進化關系分類,ERF家族又可以分為B1、B2、B3、B4、B5和B6等6個組[11~12]。ERF轉錄因子的結構,主要由DNA結合域、核定位信號域(NLS)以及轉錄調控域構成其蛋白結構[13]。而ERF轉錄因子的功能,也是植物所特有的[9]。ERF不僅自身表達處在復雜的調控途徑中,并且在植物的生物與非生物脅迫誘導不同信號之間起調控作用,并參與逆境脅迫的應答反應。相關研究表明,ERF轉錄因子在提高農作物抗旱性和耐鹽性中起到了至關重要的作用[14~15]。例如:在水稻中過量表達TERF1后增強了轉基因水稻對干旱和高鹽脅迫的耐受力[16];在番茄中ERF5的過量表達可以增加番茄對干旱和鹽脅迫的適應性[17];在擬南芥的研究中表明ERF4的過量表達可以提高其抗旱和抗鹽的能力[18];在楊樹中ERF5.1可能是參與干旱脅迫的重要轉錄因子[19];而在煙草中ERF3的過量表達可以提高煙草對干旱和鹽脅迫的抗性[20]。隨著研究的發展與深入,在大豆[21]、葡萄[22]、棉花[23]、大薯[24]等多種植物中發現了該類轉錄因子。
近年來ERF轉錄因子成為分子生物學的熱點之一,而落葉松作為一種重要的林業樹種還未涉及,因此本文以落葉松為研究對象,通過生物信息學技術分析預測了ERF基因的功能及結構,同時分析了該基因在落葉松干旱脅迫下的表達模式。
1 材料與方法
1.1 植物材料
利用本實驗室播種培養的日本落葉松土培苗,溫室生長環境為25℃,光周期為16 h/8 h。培養基質是蛭石和土(1∶1),培養120 d左右,選取株高10~15 cm的落葉松幼苗為實驗材料。
1.2 實驗方法
1.2.1 日本落葉松RNA的提取及cDNA的合成
取日本落葉松幼苗頂芽向下5 cm左右放入液氮中研磨,利用無錫百泰克生物技術有限公司生產的通用植物總RNA提取試劑盒,提取落葉松總RNA,使用南京諾唯贊生物公司生產的Hi Script?Ⅱ QRT SuperMix for qPCR(+gDNAwiper)進行反轉錄為cDNA。反轉錄的總cDNA置于-20℃冰箱內儲存備用。
1.2.2 日本落葉松LoERF017基因的克隆
通過本實驗室前期的轉錄組數據,得到該基因的序列,根據序列設計ERF5-2的基因引物,經聚合酶鏈式反應(PCR)擴增技術得到LoERF017基因。
在該基因序列兩端分別設計引物,由擎科生物公司合成正向引物F:5′-ATGGAGATATTCCCCCAGCAGG-3′以及反向引物R:3′-TCAAACGTCCTGGAAGTTCC-5′。以東洋紡生物公司生產的KOD酶進行擴增PCR,克隆出LoERF017基因的全長片段。PCR總反應體系為200 μL,共10管,每管20 μL,其中cDNA模版1 μL、正反向引物各1 μL、dNTP 4 μL、10*KOD Buffer10 μL、KOD酶0.4 μL、去離子水2.6 μL。
PCR反應條件為:95℃預變性3 min,98℃變性10 s,60℃退火30 s,68℃延伸1 min,共35個循環,68℃延伸7 min。
PCR產物經過1.2%瓊脂糖凝膠電泳驗證,使用DL2000 DNA Marker做目的片段長度的比對,在電泳檢測目的條帶長度正確后,使用AXYGEN回收試劑盒對PCR擴增產物進行膠回收,具體步驟見試劑盒說明書。膠回收產物使用AXYGEN純化試劑盒做產物純化,純化后的產物連接T載體,利用熱激法將其轉化于大腸桿菌中,搖菌2 h,菌液離心抽取上清于150 μL重懸涂板,次日挑取平板內生長的大腸桿菌單個菌體12個37℃搖菌,菌液渾濁后PCR,產物用1.2%瓊脂糖凝膠電泳進行初步檢測,挑選條帶長度正確的菌液送擎科生物公司測該基因序列。
1.2.3 植物表達載體pCAMBIA1300-LoERF017-GFP的構建
1.2.3.1 設計載體的雙酶切引物
通過分析LoERF017基因全長序列及pCAMBIA1300-GFP載體圖譜,設計帶有酶切位點的基因引物。在載體圖譜的多個插入位點中找出載體可用的全部酶切位點,以篩選可使用的限制性內切酶,然后將該基因全長序列輸入到BioEdit軟件中,通過軟件分析得到不能切斷該基因的限制性內切酶,以此選取出既可以切斷載體又不會切斷基因的限制性內切酶作為最終所用酶。本實驗選取BamHⅠ和SalⅠ兩個限制性內切酶,并根據所使用的內切酶確定酶切位點序列,由此設計正向酶切引物F:5′-CGCTAGGATGGAGATATTCCCCCAGCAGG-3′反向酶切引物R:3′-CGTCGAGTCAAACGTCCTGGAAGTTCC-5′。
1.2.3.2 目的基因PCR擴增及膠回收
酶切引物合成后,以測序比對序列成功的菌液提取的質粒為模板進行目的基因的擴增,PCR產物在120 V電壓下,以電泳檢測目的條帶長度是否正確,若條帶正確則利用購自南京諾唯贊生物公司的2×Easy Taq Master Mix以膠回收體系進行PCR擴增,然后使用AXYGEN膠回收試劑盒對其進行膠回收,并按AXYGEN產物純化試劑盒說明書的操作步驟進行純化。
1.2.3.3 pCAMBIA1300-GFP質粒的提取
在20 mL含濃度為50 mg·L-1的卡那霉素(Kana)的LB液體培養基加入20 μL轉入pCAMBIA1300-GFP質粒的大腸桿菌菌液,置于37℃搖床上160 r·min-1震蕩培養15 h,使用AXYGEN質粒小提試劑盒提取pCAMBIA1300-GFP質粒,具體操作方法見試劑盒說明書。
1.2.3.4 目的基因與載體的雙酶切反應及純化
將膠回收產物和pCAMBIA1300-GFP質粒同時進行BamHⅠ/SalⅠ雙酶切,酶切體系如下(100 μL),反應條件為37℃,時間為2~3 h。最后使用AXYGEN純化試劑盒對酶切產物分別進行純化。雙酶切總反應體系均為100 μL,其中pCAMBIA1300-GFP質粒50 μL、0×T Buffer 10 μL、BamHⅠ 5 μL、SalⅠ 5 μL、去離子水30 μL。膠回收產物50 μL、0×T Buffer 10 μL、BamHⅠ 5 μL、SalⅠ 5 μL、去離子水30 μL。
1.2.3.5 雙酶切產物的連接
將酶切后的基因與載體使用全式金T4連接酶進行連接,連接體系如下。基因:載體3∶1;T4酶1 μL;5×Buffer 2 μL;去離子水2 μL;總體積10 μL。反應條件:20℃,2 h。
1.2.3.6 大腸桿菌的轉化及PCR檢測
將連接所得產物通過熱激法轉化到大腸桿菌中,搖菌2 h后離心,抽離剩下100 μL菌液打到無菌的含50 mg·L-1Kana的LB固體培養基平板中,用酒精燈燒過的無菌涂棒涂至均勻。在37℃搖床中倒置過夜培養后,次日挑取單克隆菌落搖菌,然后進行菌液PCR及電泳檢測,并將陽性的菌液抽取500 μL送去測序,剩余菌液和50%甘油按1∶1比例混勻加入無菌的1.5 mL離心管中,充分混勻放入液氮快速冷凝,-80℃冷凍保存。測序比對正確后的菌液使用高純度質粒小提試劑盒提取質粒pCAMBIA1300-LoERF017-GFP。
1.2.4 日本落葉松LoERF017基因生物信息學及進化樹分析
利用NCBI(https://www.ncbi.nlm.nih.gov/orffinder/)在線軟件分析該基因的開放閱讀框;通過http://www.bio-soft.net/sms/index.html查詢該基因的同源核苷酸及氨基酸序列;利用Ex PASy服務器中的Protparam(https://web.expasy.org/protparam/)工具分析蛋白的理化性質;根據ExPASy(https://web.expasy.org/protscale/)服務器中的ProtScale程序分析該基因蛋白的疏水性;通過SOPMA程序(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)預測蛋白的二級結構。利用Swiss-Model程序對該基因進行三級結構同源建模;通過TMHMM Server v.2.0(https://www.cbs.dtu.dk/)對蛋白進行跨膜區分析;使用Signal P 3.0 server(http://www.cbs.dtu.dk/services/SignalP-3.0/)對蛋白進行信號肽預測,并預測該蛋白質N端信號肽的有無及其酶切位點;使用COILS Server(https://embnet.vital-it.ch/software/COILS_form.html)對該蛋白卷曲螺旋預測分析;https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi在線預測蛋白結構域;通過http://multalin.toulouse.inra.fr/multalin/multalin.html進行氨基酸多序列比對;通過http://multalin.toulouse.inra.fr/multalin/cgi-bin/multalin.pl網址進行氨基酸結構比對;利用MEGA5.05軟件采用鄰接法構建系統進化樹。
1.2.5 亞細胞定位
構建pCAMBIA1300-LoERF017-GFP基因融合綠色熒光蛋白(GFP)瞬時表達載體,利用AXYGEN質粒試劑盒提取質粒。將pCAMBIA1300-LoERF017-GFP質粒和pCAMBIA1300-GFP質粒分別與金粉包裹,用基因槍(PDS-1000/He Particle Delivery System)轟擊放置在1/2MS培養基的2 cm×2 cm的洋蔥內表皮細胞,暗培養24 h,之后用激光共聚焦顯微鏡(OlympusFV1000MPE)觀察亞細胞定位情況。
1.2.6 日本落葉松LoERF017基因的表達模式分析
采用實驗室播種培養的日本落葉松幼苗,生長環境為25℃組培室,光周期為16 h/8 h,3~5 d澆一次水,生長120 d左右停止澆水,以停止澆水的第3天為0 d取材生長狀態良好且一致的土培苗,2棵為1組取3組,分別提取根莖葉的RNA,反轉錄成cDNA,進行qRT-PCR以分析該基因在日本落葉松不同組織中的特異性表達。
以0 d的落葉松為對照組,干旱脅迫1、3、5、7 d的材料為實驗組,分別提取各個脅迫時間實驗材料根的RNA,反轉錄成cDNA,進行qRT-PCR以分析干旱脅迫下該基因在日本落葉松根中的表達情況。干旱脅迫第7天取材后,對落葉松幼苗澆水,在恢復正常間隔3 d澆水期間,對落葉松根進行間隔1 d的連續4次取材,即復水的第1、3、5、7天,分別提取根的RNA,反轉錄成cDNA,進行qRT-PCR以研究復水后,該基因在根中的表達情況。
使用落葉松基因作為內參基因,設計內參引物由庫美公司合成正向引物tubulin-F:ATTATGAAGAGGTCGGAGCAG-3′以及反向引物tubulin-R:CCCCACCAGTACTACCTATCAA-3′,長度為199 bp。同時合成基因正向引物qPCR-F:5′-GAGATATTCCCCCAGCAGGAAC-3′,反向引物qPCR-R:3′-TCGGATTCCCTTATATTGGCGG-5′,長度為84 bp。
以RNA反轉錄的cDNA為模版,使用南京諾唯贊生物生產的Cham QTMUniversal SYBR? qPCR Master Mix進行qRT-PCR,通過熒光定量PCR儀(Applied Bio systems,Foster City,CA,USA)進行PCR,用2-ΔΔCT計算法計算其相對表達量。
PCR總反應體系為20 μL,其中cDNA模版1 μL、正反向引物各1 μL、2×Easy Taq PCR Super Mix酶10 μL、去離子水7 μL。反應條件:94℃ 30 s;94℃ 5 s、60℃ 30 s,40個循環;60℃ 6 s;70個循環。
2 結果與分析
2.1 日本落葉松LoERF017基因的克隆
以日本落葉松為材料提取頂芽向下5 cm左右的總RNA(如圖1所示)。利用落葉松總RNA反轉錄成cDNA,以Marker2000為片段長度對照,擴增ERF基因的CDS序列,擴增產物長度為624 bp(如圖2所示)。
圖1 落葉松RNA的提取 M. DNA Marker DL2000;1~5.RNA產物Fig.1 The RNA production of L.kaempferi M.DNA Marker DL2000;1-5.RNA production

圖2 落葉松LoERF017基因的克隆 M.DNA Marker DL2000;1~5.LoERF017克隆產物Fig.2 PCR production of LoERF017 M.DNA Marker DL2000;1-5.PCR production of LoERF017
2.2 日本落葉松LoERF017基因編碼的氨基酸序列及其理化特性
2.2.1 日本落葉松LoERF017基因編碼的氨基酸序列
通過在線查詢LoERF017基因共編碼206氨基酸(如圖3所示)。利用ExPASy服務器中的Protparam工具分析蛋白的理化性質,分析結果氨基酸的數量為206,分子質量為23 458.370理論等電子點為5.43,總共包括3 278個原子,分子式為C1042H1624N284O323S5,在組成蛋白的20種氨基酸中,絲氨酸(Ser)所占比例最高,占10.6%,半胱氨酸(Cys)所占比例最低,占0.5%,不包括含硒半胱氨酸(Sec)和吡咯賴氨酸(Pyl)。蛋白的不穩定指數為61.41,脂肪指數為76.86,總平均親水性為-0.632。
2.2.2 日本落葉松LoERF017基因的理化特性
2.2.2.1 日本落葉松LoERF017基因編碼的蛋白疏水性
根據ExPASy服務器中的ProtScale程序分析落葉松ERF蛋白的疏水性,計算基于K-D法的蛋白質疏水性。分析結果發現,第196位的氨基酸為亮氨酸(Iie),疏水性最大,分值為4.500;第26位的氨基酸為精氨酸(Arg),親水性最大,分值為-4.500。根據圖4中數據,分值為負值的氨基酸數量大于分值為正值的氨基酸數量,表示親水性大于疏水性,因而推測該蛋白為親水性蛋白。
2.2.2.2 落葉松LoERF017基因編碼的蛋白的二級結構及功能結構域預測
通過在線預測蛋白的二級結構,如圖5所示該蛋白的二級結構主要是由α-螺旋(30.43%),無規卷曲(54.11%),延伸鏈(12.56%),β-折疊(2.9%)組成。
2.2.2.3 蛋白三級結構預測
通過把氨基酸序列輸入到Swiss-Model程序中,對LoERF017基因所編碼蛋白的三級結構進行預測(如圖6所示)。
2.2.2.4 對蛋白跨膜區進行分析
通過把氨基酸序列輸入到TMHMM Server v.2.0中,對LoERF017該基因所編碼的蛋白進行跨膜區分析,該蛋白長度為206;預測TMHs的數量為0;TMHs中AAs的Exp號是0;Exp編號,前60個AAs為0;其在N端的可能性為0.03768,如圖7所示,在細胞膜表面,該基因并沒有典型的跨膜螺旋區,細胞膜內也沒有氨基酸,同時通過對該蛋白的疏水性區域分析結果,可以得出該蛋白與細胞信號傳導無關。
2.2.2.5 蛋白信號肽及蛋白卷曲螺旋預測分析
通過SignalP3.0 server對該基因所編碼的蛋白進行蛋白信號肽預測,結果預測蛋白質Non-secretory蛋白質信號肽概率:0.000;信號錨定概率:0.000;最大劈理位點概率:pos.-1和0之間的0.000,結果如圖8所示。利用COILS Server對該蛋白卷曲螺旋結構預測分析,結果如圖9所示,該蛋白不具有肝蛋白卷曲螺旋結構。
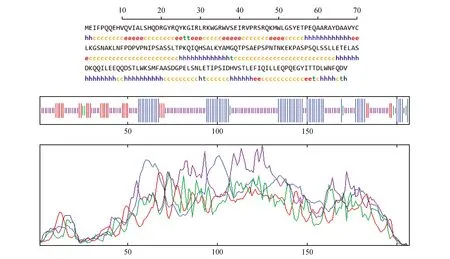
圖5 LoERF017蛋白的二級結構預測Fig.5 Predicted secondary structure prediction of LoERF017 protein

圖6 LoERF017蛋白的三級結構預測Fig.6 Predicted tertiary structure prediction of LoERF017 protein

圖7 LoERF017蛋白的跨膜區分析Fig.7 Transmembrane region prediction of LoERF017 protein

圖8 LoERF017蛋白的信號肽預測Fig.8 Signal peptide prediction of the LoERF017 protein

圖9 LoERF017蛋白的卷曲螺旋預測Fig.9 Coiled Coils prediction of LoERF017 protein
2.2.2.6 蛋白結構域預測
通過https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi在線分析蛋白的功能結構域,如圖10所示,通過分析得出該基因所編碼的蛋白,包括AP2和KRBA1兩個結構域。LA2是1994年由Jofuku等從擬南芥鑒定出來的,在LA蛋白中發現兩個重復的DNA結構域,稱這類DNA結構域為AP2結構域[3]。AP2結構域由第27到90的64個氨基酸構成AP2結構域,AP2結構域廣泛存在于植物蛋白中。該結構域可以利用乙烯、脫落酸、茉莉酸和水楊酸等信號來調控下游基因的表達,從而提高植物的抗逆性。

圖10 LoERF017蛋白的結構域預測Fig.10 Conserverd domain prediction of LoERF017 coded protein
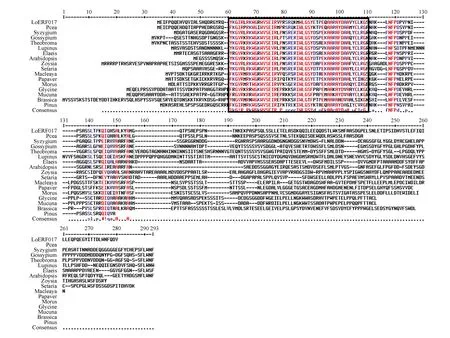
圖11 日本落葉松LoERF017氨基酸與其他植物氨基酸序列比對框選為保守區域Fig.11 L.kaempferi alignment analysis of LoERF017 conservative structure domain in different plants Boxes selected as conservative areas

圖12 不同植物LoERF017基因的系統進化樹(鄰接法)及保守區域Fig.12 Molecular phylogenetic tree analysis of LoERF017 in plant species

圖13 LoERF017基因的亞細胞定位分析Fig.13 Subcellular localization analysis of the LoERF017 gene
2.2.2.7 氨基酸序列比對及系統進化樹的構建
通過在線比對氨基酸序列,將日本落葉松LoERF017基因所翻譯的氨基酸序列與相同基因的其他物種的氨基酸序列進行同源性比對,結果所示:日本落葉松(Larixkaempferi)LoERF017基因與火炬松(Pinustaeda)、北美云杉(Piceastichensis)等物種的同源蛋白序列有較高保守性(如圖11所示)。利用MEGA5.05軟件對該同源蛋白序列進行系統進化樹的構建,如圖12所示,日本落葉松(Larixkaempferi)與火炬松(Pinustaeda)、北美云杉(Piceastichensis)親緣關系最近,同時與蒲桃(Syzygiumoleosum)、陸地棉(Gossypiumhirsutum)、油棕(Elaeisguineensis)、可可(Theobromacacao)、鼠耳芥(Arabidopsisthaliana)、博落回(Macleayacordata)、結縷草(Zoysiajaponica)、罌粟(Papaversomniferum)、狹葉羽扇豆(Lupinusangustifolius)、川桑(Morusnotabilis)、狗尾草(Setariaviridis)有較遠的遺傳距離,所以預測他們有較遠的親緣關系。同時與大豆(Glycinemax)、歐洲油菜(Brassicanapus)、刺毛黧豆(Mucunapruriens)遺傳距離最遠,因此預測他們親緣關系更遠。
2.3 日本落葉松LoERF017基因的亞細胞定位實驗結果
利用基因槍將pCAMBIA1300-LoERF017-GFP質粒和pCAMBIA1300-GFP質粒分別與金粉包裹,轟擊放置在1/2MS培養基的2 cm×2 cm的洋蔥內表皮細胞,暗培養24 h后,通過激光共聚焦顯微鏡觀察,結果如圖13所示。對照組pCAMBIA1300-GFP空載體的綠色熒光充斥整個洋蔥細胞,為組成型表達。pCAMBIA1300-LoERF017-GFP的融合表達載體的綠色熒光只在細胞核中,表明該基因定位在細胞核中,并且具有轉錄因子的一般特征。
2.4 落葉松LoERF017基因的表達模式分析
分別提取0 d的落葉松根、莖、葉RNA,以檢測LoERF017基因在日本落葉松中的組織特異性表達,如圖14所示,該基因在莖中的表達量是根的0.29倍,在葉中的表達是根的0.55倍,因此可以預測,該基因在日本落葉松的根中表達量最高,在莖中最低,在葉中的表達量居中。
以0 d根的表達量為對照組,分別以干旱脅迫后1、3、5、7 d根的表達量為實驗組,分析干旱脅迫下該基因在根中的表達情況,同時在恢復對落葉松的正常澆水間隔之后,分析該基因在落葉松根中的表達情況,結果如圖15所示,干旱脅迫下根中的表達量呈上升趨勢,干旱脅迫復水后,該基因在根中的表達量有下降趨勢,表明復水后該基因的調控作用趨緩,由此可以推測該基因主要在日本落葉松的根中表達并行使功能,并且該基因可能與抗旱性相關。

圖14 LoERF017基因在日本落葉松不同組織中的特異性表達情況Fig.14 Specific expression of LoERF017 gene in different tissues of L.kaempferi

圖15 LoERF017基因在干旱處理及復水后在根中的表達情況Fig.15 Quantitative real-time PCR analysis of the expression pattern of LoERF017 gene in roots after drought treatment and rehydration
3 討論
日本落葉松樹體高大、樹干通直、材質堅韌,是一種重要的造林用材樹種,在造紙業和園林綠化中也被廣泛應用,具有重要的生態和經濟價值。因此提高日本落葉松的抗逆性對我國林業具有多方面的意義。而且利用基因工程的育種手段無疑加快了整個育種進程,縮減了育種工程量,為育種工程提供了極大的便利。
本文從基因工程角度出發,在日本落葉松中克隆獲得的LoERF017基因,共含624 bp的CDS序列,共編碼206個氨基酸。預測該基因所編碼的蛋白只包括AP2一個結構域,不含有指導蛋白的信號肽和跨膜運輸結構,且為親水蛋白。該基因所編碼蛋白的二級結構由α-螺旋(30.43%),無規卷曲(54.11%),延伸鏈(12.56%),β-折疊(2.9%)組成。通過亞細胞定位,得到LoERF017基因定位在細胞核中。QRT-PCR結果表明,在日本落葉松的組織特異性表達中,LoERF017基因在根中的表達量最高,在莖中的表達量最低,在葉中的表達量居中。并且干旱脅迫下,該基因在根中的表達量有明顯的上升趨勢,對其復水后該基因在根中的表達量呈現下降趨勢。這一結果與研究干旱脅迫條件下長春花Str和Pme基因表達變化中Str基因在干旱及復水后的表達結果相一致[25]。由此預測LoERF017與日本落葉松的抗旱調控相關。
通過對實驗結果的分析,可以判斷出本文所克隆的LoERF017基因屬于ERF轉錄因子中的激活轉錄類,該基因可以在日本落葉松受到逆境脅迫時提高自身表達量,進而提高落葉松的抗逆性。這個研究結果與在其他一些物種中的ERF轉錄因子與干旱誘導反應密切相關所一致。并且相關研究表明,在擬南芥中轉入LoERF017基因所得到的轉基因株系在干旱脅迫下,轉基因株系的根長、鮮重及長勢都明顯優于野生型株系,證明了LoERF017基因可以提高擬南芥的抗旱性[26]。除擬南芥中對LoERF017在植物中抗旱性的探討,還并未在其他物種中對該基因的抗旱性做深入研究,由此該結論可直接證明本文對LoERF017在日本落葉松中的研究結果。
通過以上研究,可以初步證明落葉松LoERF017基因與日本落葉松的抗旱能力相關,但是關于該轉錄因子對植物抗逆性的調控機制和信號傳導等具體的功能還有待進一步的研究證明。該基因的發現,為日本落葉松物種的基因組測序工作的完成提供了更多的數據參考,也為日本落葉松的抗旱研究提供了更多的理論基礎。

