早期控制冠狀動脈粥樣硬化患者的心外膜脂肪體積及炎癥因子水平對纖維斑塊穩定性的影響*
王 磊 李大主 艾 文 方葉青 謝培益 華中科技大學協和深圳醫院心血管內科,廣東省深圳市 58000; 華中科技大學同濟醫學院附屬協和醫院心血管內科
冠狀動脈粥樣硬化會造成動脈血管狹窄或梗阻,臨床上大多數會引發高血壓、高血脂、糖尿病等心腦血管疾病。心外膜脂肪聚集與心臟及冠狀動脈四周,其中單核—巨噬細胞通過擴散而作用于鄰近細胞的激素傳遞方式產生炎癥因子,聚集于上皮細胞,對纖維斑塊的形成十分重要[1]。炎癥因子是很多疾病產生和發展十分重要的中間物質,可促進冠狀動脈發生粥樣硬化,其中PLA2、MMP-2是人體中十分多見的炎癥因子[2]。本文通過對EATV、PLA2、MMP-2水平進行檢測,探討了這些因素對纖維斑塊穩定性的影響。
1 資料與方法
1.1 一般資料 收集2017年2月—2019年3月在我院胸外科進行外科手術的患者96例,其中冠心病患者53例(冠心病組),心臟瓣膜病患者43例(瓣膜病組)。排除標準:(1)無手術耐受力;(2)伴有其他各系統重大疾病;(3)會發生系統性炎癥反應。所有患者均已知情本次研究。
1.2 方法
1.2.1 EATV檢測及纖維斑塊的測量:所有患者均進行CT掃描,使用Volumer軟件對EATV進行測量。在測量前5~10min,給患者靜脈注射CT碘對比劑,并口服硝酸甘油以使冠狀動脈平滑肌松弛達到擴張動脈血管的目的,服用倍他樂克將心率控制在正常范圍的最低值。CT測量值為-250~30HU定義為脂肪組織,選取心外膜邊界,使用Volumer軟件生成所選區域的脂肪體積(em)。測量最狹窄血管的斑塊,各斑塊選擇3個不同的區域進行逐一測量,按最小CT測量值進行斑塊的分類,其中軟斑塊為42~47HU;纖維斑塊為61~112HU;鈣化斑塊為126~736HU。血管代償性擴張通過相關指數阻抗指數(RI)進行測量,倘若RI≥1則為血管代償性擴張。
1.2.2 定量即時聚合酶鏈反應(RT-qPCR)提取和純化脂肪組織總核糖核酸(RNA):選取術中提取的100mg脂肪組織,對其采用差速離心法,使用新型總RNA抽提試劑(TRIZOL)提取和純化總RNA,采用紫外光譜儀對總RNA的濃度和純度進行檢測。使用反轉錄試劑將總RNA反轉錄合成互補脫氧核糖核酸(cDNA),將cDNA作為模板,將MMP-2和β-肌動蛋白(β-actin)作為DNA片段的擴增引物。按下述配比制作PCR緩沖液,20μl PCR反應體系中包含了熒光染料(SYBR) 10μl、上游引物(Forward primer) 0.4μl、下游引物(Reverse primer)0.4μl、RT-qPCR擴增儀染料0.4μl、cDNA 2μl和蒸餾水(dH2O)6.8μl,通過擴增儀使用SYBR Green染料法檢測cDNA相應基因的相對表達水平。反應條件為95℃預變性30s,95C°變性5s、60C°退火30s,循環40次。采用公式2-△△Ct,其中公式中△△Ct=(Ct目的基因-Ct管家基因)研究組-(Ct目的基因-Ct管家基因)對照組,計算出目的基因的表達水平,分析MMP-2的相對表達水平,實驗重復操作3次。
1.2.3 免疫印跡法(Westernblot):用總蛋白提取試劑提取脂肪組織中的蛋白,用BCA蛋白質檢測劑對其濃度進行檢測。選取50μg的蛋白進行電泳分離,之后將蛋白轉至甲醛浸泡過的聚偏二氟乙烯膜(PVDF膜)上。使用三羥甲基氨基甲烷(TRIS)+氯化鈉(NaCl)+非離子型表面活性劑(tween20),即TBST緩沖液室溫下密封2h,一抗(與特異性抗原進行特異性結合的蛋白)為獲得滴度為1∶1 000的兔抗人MMP-2多克隆抗體,內參獲得滴度為1∶2 000的兔抗人β-actin多克隆抗體,二抗(抗體的抗體)為辣根過氧化物酶(HRP)標記的獲得滴度為1∶2 000羊抗兔(IgG)抗體;采用凝膠成像儀對蛋白凝膠成像及分析,用圖像處理軟件測定其灰度值,比較分析MMP-2的水平。
1.2.4 PLA2活性檢測:將手術中提取的1g脂肪組織加入2ml 0.9%氯化鈉溶液進行搗碎,以1 000r/min離心10min,提取清液層等待檢測。使用脂肪組織PLA2熒光定量檢測試劑采用ELISA法進行檢測。
1.3 統計學方法 采用SPSS22.0軟件對數據進行統計分析。計量資料以均數±標準差表示,組間進行t檢驗;計數資料以百分率(%)表示,進行χ2檢驗,血管代償性擴張獨立影響因素進行多因素Logistic回歸分析,以P<0.05為差異有統計學意義。
2 結果
2.1 兩組脂肪組織中MMP-2 mRNA表達水平、MMP-2蛋白及PLA2水平水平比較 冠心病組心外膜脂肪中MMP-2 mRNA表達水平、MMP-2蛋白及PLA2水平顯著高于瓣膜病組(P<0.05),而胸腔脂肪中MMP-2 mRNA表達水平、MMP-2蛋白及PLA2水平比較,差異無統計學意義(P>0.05)。見表1。
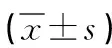
表1 兩組患者中不同部位脂肪組織中不同蛋白的表達比較
注:與冠心病組比較,*P<0.05。
2.2 EATV、脂肪中炎癥因子與纖維斑塊穩定性相關性分析 先行血管代償性擴張的多因素分析,血管代償性擴張與非血管代償性擴張患者的BMI、LDL-C、高血壓數、EATV、纖維及鈣化斑塊體積比較,差異有統計學意義(P<0.05),提示上述因素為發生血管代償性擴張的相關因素,見表2;對血管代償性擴張的多因素進行Logistic回歸分析,EATV、MMP-2、高血壓、PLA2是發生血管代償性擴張的獨立影響因素,見表3。
3 討論
心外膜下脂肪十分靠近心臟,可經多種途徑對心臟及其組織造成不同程度的影響。國內外有研究發現EATV與冠狀動脈粥樣硬化及冠狀動脈狹窄和阻塞程度存在一定的相關性,并且提升了心血管事件的發生率[3]。EATV可通過炎癥因子產生作用,促進冠狀動脈內膜厚度增加,促進冠狀動脈粥樣硬化的產生和發展。在冠狀動脈粥樣硬化患者中,纖維斑塊的不穩定會引起斑塊破裂、出血,最終導致心血管事件的發生[4-6]。目前有關EATV和炎癥因子與纖維斑塊穩定性的相關性研究甚少。本文結果顯示,冠心病組的EATV、MMP-2、PLA2的水平均顯著高于瓣膜病組,且通過多因素Logistic回歸分析,發現EATV、MMP-2、PLA2是血管代償性擴張的獨立影響因素。血管代償性擴張可影響血管內壓力、血管上皮細胞生長因子及其他血管活性物質的釋放,可加速上皮細胞增生、炎癥細胞沉積以及胞外基質降解,是引起冠狀動脈粥樣硬化患者血管狹窄的重要原因[7-8]。巨噬細胞可產生MMP,當血管發生代償性擴張時可使上皮細胞增生及胞外基質降解,大量的巨噬細胞聚集在一起,MMPs水平上升,繼而使血管上皮細胞生長因子增多,其中MMP-2可促進胞外基質降解,形成斑塊,使血管平滑肌增生,上皮細胞下新形成的血管極易進入血管內膜,破壞纖維斑塊的穩定性[9-10]。另外,PLA2在血液中與LDL-C結合,使上皮細胞下氧化修飾低密度脂蛋白(OX-LDL)發生水解,產生游離的水解磷脂和脂肪酸,繼而損傷血管上皮細胞,引誘血液中單核細胞持續聚集于血管內膜,生成大量的巨噬細胞。巨噬細胞又可吞噬OX-LDL形成泡沫細胞,泡沫細胞也能破壞纖維斑塊的穩定性[11-12]。此外,PLA2還可促進LDL-C與MMPs的結合,加速胞外基質的降解,最終引發冠狀動脈粥樣硬化[13]。本文結果顯示,高血壓是血管代償性擴張的獨立影響因素。高血壓對血管內膜產生較大的壓力,加上機體內各種神體液因子的作用,增加了纖維斑塊的不穩定性,進而出現斑塊破裂和出血以及血栓的形成,最終導致心肌缺血或心梗。雖然本文結果顯示MMP-2是血管代償性擴張的獨立影響因素,然而并未進行相關病理檢查,因此,未獲得相關結果,有待深入研究。
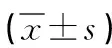
表2 血管代償性擴張的單因素分析

表3 血管代償性擴張的多因素 Logistic回歸分析
綜上所述,本文發現冠心病組心外膜脂肪中炎癥因子高于瓣膜病組,通過血管代償性擴張的多因素Logistic回歸分析,發現EATV、MMP-2、高血壓、PLA2是纖維斑塊穩定性的獨立影響因素。對這些因素進行有效控制,可減少心血管事件的發生。

