腹腔下腹壁切口疝加強修補術與腹壁切口疝橋接修補術療效對比研究
胡雄輝 楊 勇 李 鑫 蒲國士 陳 渝 喻 培
四川省達州市中西醫結合醫院普通外科 635000
腹壁切口疝是因腹部手術后,腹壁起支持作用的肌腱膜層愈合不良,在腹腔壓力下所形成的疝,調查數據顯示腹壁切口疝發生率為2.0%~11.0%, 在腹部大型手術中發生率更高[1-3]。腹壁切口疝與其他類型疝一樣無法自行愈合,且隨著年齡的增長及病程的延長疝囊將逐漸變大,若切口疝出現嵌頓或絞窄可引發腸管壞死等嚴重的并發癥,甚至危及患者生命[4]。目前對于腹壁切口疝唯一有效的治療方法是手術修補,近20年來國內腹壁切口疝外科治療發展迅速[5]。過去臨床上主要通過腹腔鏡鞘卡置入腹腔,并將其固定于疝環缺損周圍以覆蓋該缺損,雖然此術式可有效降低感染率及住院天數,但術后復發率仍較高[6]。近年來在多項研究指出腹壁切口疝修補術中關閉腹壁缺損可有效降低復發率,目前該術式已在國內推廣多年,雖有研究對兩種術式的安全性、有效性進行對比,但均以臨床觀察為主,本研究旨在通過分析兩種術式對患者腹腔壓力、應激反應及呼吸功能的影響,以期為臨床上兩種術式的選擇提供參考依據。
1 資料與方法
1.1 一般資料 選擇2018年5月—2019年8月在我院接受治療的腹壁切口疝患者87例進行研究。納入標準:(1)符合《腹壁切口疝診斷和治療指南(2018年版)》[7]的相關診斷;(2)年齡在18歲及以上;(3)神志清醒,智力正常,可配合進行相關檢查與治療;(4)患者已獲知情同意。排除標準:(1)腹腔內惡性疾病復發、轉移或無法控制者;(2)妊娠期、哺乳期婦女;(3)伴有全身性基礎疾病尚未得到有效控制;(4)重要臟器功能障礙者;(5)復發性腹壁切口疝患者。采用隨機數字表法將患者分為兩組,其中對照組43例,觀察組44例。兩組患者性別、年齡、BMI指數、腹壁缺損大小、切口疝位置比較差異均無統計學意義(P>0.05),具有可比性。
1.2 方法 觀察組行腹腔鏡下腹壁切口疝加強修補術:患者采用靜吸復合麻醉,視切口疝位置取平臥位或健側臥位,建立人工氣腹,壓力控制在10~12mmHg(1mmHg=0.133kPa),氣腹針置入點盡量遠離原實收數切口。氣腹建立后以3個套管針進行腹腔探查,先在遠離疝囊點置入10mm Trocar,對腹腔內臟器損傷、腹內粘連、疝環大小等情況進行探查以判斷腹腔鏡手術的可行性。在同側腹壁分別置入10mm及5mm套管各1個。以超聲刀對腹腔粘連進行分離,回納疝內容物,顯露疝環缺損。分離腹壁膜性粘連與腸管,在腹壁及腸管致密瘢痕粘連處采用超聲刀分離,必要時切除腹壁組織以保全腸管。在疝囊內面進行電凝與增強疝囊粘連,消滅死腔。以腹腔鏡直視下確定疝環缺損位置、邊緣及大小,并通過體表投影在皮膚做3~5個小切口,以10號絲線進行間斷縫合,關閉疝環缺損,將氣腹壓力降至6~8mmHg后于皮下打結。根據疝環缺損大小選擇較其邊緣大5cm以上的雙面復合補片進行覆蓋,于補片四角體表投影處分別做2~3mm小切口,在補片四邊縫合線逐個引出體表,皮下固定,再以疝釘合器對缺損邊緣及補片邊緣釘合以固定,術畢,檢查無異常后解除氣腹,縫合傷口。對照組則采用腹壁切口疝橋接修補術,除處理疝環時不進行關閉疝環組織的相關操作外,其余操作同觀察組。
1.3 評價指標 (1)臨床療效評價標準:顯效:癥狀消失,圍手術期未出現腹壁血清腫、粘連性腸梗阻等并發癥;有效:癥狀明顯改善,圍手術期未見腹壁血清腫、粘連性腸梗阻等并發癥;無效:癥狀未見改善,甚至加重,圍手術期出現并發癥。(2)腹腔壓力:術前6h及術后6h以Foley尿管膀胱測壓法對腹腔壓力進行檢測:參照2006年世界腹腔間隔綜合征協會推薦的膀胱內測壓法進行檢測。(3)應激反應指標:在術前6h及術后6h抽取患者空腹外周靜脈血5ml,以ELISA法對腎上腺素、去甲腎上腺素、兒茶酚胺進行檢測。(4)呼吸功能:在術前6h及術后6h對患者動脈血氧分壓、動脈血氧飽和度及呼吸頻率進行檢測。

2 結果
2.1 兩組患者療效對比 觀察組患者總有效率為90.91%,明顯高于對照組的72.09%(χ2=5.130,P=0.023<0.05)。見表1。

表1 兩組患者療效對比[n(%)]
2.2 兩組患者腹腔壓力對比 術后兩組患者腹腔壓力均明顯升高,但觀察組升高幅度更小(P<0.05)。見表2。

表2 兩組患者腹腔壓力對比
2.3 兩組患者應激反應指標對比 術后兩組患者腎上腺素、去甲腎上腺素及兒茶酚胺水平均明顯升高,但觀察組升高幅度更小(P<0.05)。見表3。
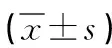
表3 兩組患者應激反應指標對比
注:*表示與術前對比,P<0.05。
2.4 兩組患者呼吸功能指標對比 術后兩組患者動脈血氧分壓及動脈血氧飽和度均明顯下降,但觀察組下降幅度更小,術后兩組患者呼吸率均明顯升高,但觀察組升高幅度更小(P<0.05)。見表4。
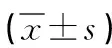
表4 兩組患者呼吸功能指標對比
注:*表示與術前對比,P<0.05。
3 討論
腹壁切口疝是臨床上常見的腹部手術后并發癥,目前腹腔下腹壁切口疝加強修補術較腹壁切口疝橋接修補術均為臨床上常用的術式,普遍認為腹腔下腹壁切口疝加強修補術可有效降低復發率。雖有關于兩種術式療效對比方面的研究,但主要集中于療效觀察為主,對于兩種術式對患者腹腔壓力、應激反應及呼吸功能的影響方面的研究較少[8]。腹壁切口疝治療強調2個最基本的目的,一是通過手術消除疝體征,恢復腹壁的完整性,二是恢復腹壁原有的伸展、收縮、協同調節呼吸、循環等生理功能。因此有必要就兩種術式對患者腹腔壓力、應激反應及呼吸功能的影響進行對比。
本研究中兩種術式療效對比結果顯示:觀察組患者總有效率為90.91%,明顯高于對照組的72.09%(P<0.05),可能是對照組治療過程中僅進行補片的覆蓋,未對囊環缺損進行處理,患者術后出現血清腫、腹壁突出等并發癥的發生率較高,對其療效造成較大的影響。而觀察組在術中先以電凝的方式對疝囊內面進行處理以增強疝囊粘連而消滅死腔,同時采用10號絲線對疝囊缺損進行縫合可有效封閉疝環缺損,減少各種并發癥的發生率,提高療效。有學者認為腹壁切口縫合術疝手術治療后因腹腔內容物突入疝囊而引起腹腔容量明顯下降,疝內容物還納腹腔后,可引起患者腹壓明顯升高,嚴重者可引起腹部間隙綜合征而致呼吸困難[9]。本研究中:術后兩組患者腹腔壓力均明顯升高,但觀察組升高幅度更小(P<0.05),可能與兩種術式均不同程度對腹腔的生理結構造成改變而引起腸道黏膜屏障被破壞,而術后患者多需要進行大量補液及腸外營養支持,容易引起腸黏膜水腫及腸源性感染而使腹壓上升,觀察組相對而言對患者腹壁的修復能力更強,有助于患者腹壁功能的恢復,減少腸源性感染的風險而降低腹壓上升的風險。 腹壓升高可引起雙側膈肌上升,胸腔容量及順應性下降,胸膜腔內壓力上升,肺通氣量下降,加上胸膜腔內壓力上升可引起心排量下降,增加肺血管阻力,導致肺換氣—灌注異常而出現低氧血癥,表現為呼吸率上升,動脈血氧分壓及動脈血氧飽和度下降,觀察組患者因對腹腔壓力的影響更小,因而呼吸功能指標改變較小,本研究術后兩組患者動脈血氧分壓及動脈血氧飽和度均明顯下降,但觀察組下降幅度更大,術后兩組患者呼吸率均明顯升高,但觀察組升高更明顯(P<0.05),印證了上述觀點。另外負壓升高還可引起周圍血管阻力上升、靜脈回流量下降而出現嚴重的應激反應,引起腎上腺激素、去甲腎上腺素及兒茶酚胺等應激激素的升高,觀察組負壓控制效果更好,因而對應激激素的影響也更輕[10]。

