GPER激動劑G-1在大鼠肝臟缺血再灌注損傷中的作用研究*
秦 勇 王超君 徐勝前 葉冠雄 潘德標 葉海林
溫州醫科大學附屬第六醫院(麗水市人民醫院) 1 肝膽外科 2 超聲科,浙江省麗水市 323000
肝臟缺血再灌注損傷在臨床上常見于失血性休克、肝腫瘤切除和肝移植等情況,也是目前肝臟保護研究的熱點,近年來雌激素對大鼠肝臟缺血再灌注損傷的研究發現雌激素預處理能刺激雌激素受體表達,進而降低TNF-α水平,抑制NF-κB表達來減輕肝臟缺血再灌注損傷[1],而雌激素受體GPER作為雌激素的獨立受體,在傳統雌激素受體ERα和ERβ缺乏的細胞中介導了雌激素對靶細胞的快速效應,目前未見有關GPER激動劑G-1在肝臟缺血再灌注損傷中的相關作用的報道。本研究建立肝臟缺血再灌注損傷模型觀察GPER激動劑G-1在大鼠肝臟缺血再灌注損傷中的作用及意義。
1 材料與方法
1.1 實驗材料 成年健康雄性SD大鼠54只,體重(250±20)g,由上海斯萊克實驗動物有限公司提供。TUNEL細胞凋亡檢測試劑盒是由瑞士Roche公司(貨號11684817910)提供,DAB濃縮型試劑盒是由上海長島生物技術有限公司(貨號FL-6001)提供,G-1是由美國Med Chem Express公司提供(貨號HY-107216),谷丙轉氨酶(ALT/GPT)測試盒是由南京建成生物有限公司提供(貨號C009-1),大鼠白細胞介素 1β(IL-1β)酶聯免疫分析(ELISA)試劑盒由武漢華美生物有限公司提供(貨號GSB-E08055r)。
1.2 動物分組 54只大鼠隨機分成三組,每組18只。G-1預處理+肝缺血再灌注組(GIR組)于造模前1h經腹腔給予G-1 120μg/(kg·d),假手術組(PO組)和肝缺血再灌注組(IR組)則于術前1h經腹腔給予同等容積的生理鹽水。缺血再灌注6h、12h和24h共3個時間點進行標本檢測,每個時間點6只大鼠。
1.3 動物模型建立 8周齡SD大鼠術前12h 禁食,腹腔內注射1%戊巴比妥鈉溶液30mg/kg 麻醉,上腹部正中切口開腹,斷離肝周韌帶后分離肝門部脈管,以無創傷小血管夾夾閉左外及中葉的肝動脈、門靜脈造成70%肝臟缺血,45min后重新開放血供并切除未阻斷血供的30%肝葉,造成肝切除肝缺血再灌注模型,分別在各時間點沿著大鼠劍突剪開胸腔,暴露心臟,右心室取4~6ml血液,分裝于Eppendoef導管中,室溫下1 000g離心10min分離出血清,-20℃保存待測。同時取肝左中葉組織,用冰生理鹽水沖洗后用10%甲醛溶液浸泡固定,制作石蠟切片。
1.4 全自動生化檢測儀檢測血清ALT水平 根據谷丙轉氨酶(ALT/GPT)測試盒操作步驟完成大鼠缺血再灌注后6h、12h和24h的血清谷丙轉氨酶檢測。
1.5 ELISA法測定血清白細胞介素1β(IL-1β) 取大鼠肝臟缺血再灌注后6h、12h和24h的血清,室溫血液自然凝固10~20min,離心20min左右(2 000~3 000r/min),仔細收集上清,保存過程中如出現沉淀,應再次離心,經過標準品的稀釋與加樣(稀釋后各孔加樣量都為50μl,濃度分別為30ng/L、20ng/L、10ng/L、5ng/L、2.5ng/L),分別設空白孔(空白對照孔不加樣品及酶標試劑,其余各步操作相同)、待測樣品孔,溫育、配液洗滌、加酶、再次溫育、再次洗滌、顯色(每孔先加入顯色劑A 50μl,再加入顯色劑B 50μl,輕輕震蕩混勻,37℃避光顯色15min)、終止(每孔加終止液50μl,終止反應,此時藍色立轉黃色)等步驟;最終測定:以空白孔調零,450nm波長依序測量各孔的吸光度(OD值),測定應在加終止液后15min以內進行。
1.6 TUNEL法觀察肝細胞的凋亡 取肝組織包埋與固定,脫蠟、水化、消化、制備TUNEL反應混合液,加50μl TUNEL反應混合液于標本上,加蓋玻片或封口膜在暗濕盒中37℃反應1h;PBS洗3min×3次,加50μl POD于標本上,加蓋玻片或封口膜在暗濕盒中反應37℃×30min,PBS洗3min×3次,DAB染色3~10min,自來水沖洗,蘇木素復染,1%鹽酸酒精分化,顯微鏡下觀察,控制染色程度,脫水:75%酒精、85%酒精、95%酒精、100%酒精,逐級脫水,各3min,透明:二甲苯透明3min×2次,中性樹膠封片,通過顯微鏡采集分析樣本相關部位,計算凋亡率。

2 結果
2.1 血清轉氨酶水平變化 大鼠肝臟缺血再灌注后6h、12h及24h,PO組、IR組及GIR組血清ALT值在組間各時點分別兩兩對比,差異顯著(P<0.01),GIR組血清ALT值隨著再灌注時間的延長而逐漸下降,于再灌注6h達到峰值,到再灌注24h時漸漸接近PO組,見表1。

表1 大鼠肝缺血再灌注后各時點血漿ALT的活性比較
注:★P<0.01 VS PO組;▲P<0.01 VS IR組。
2.2 大鼠肝缺血再灌注后各時點凋亡率的變化 大鼠肝臟缺血再灌注后6h,PO組、IR組及GIR組的凋亡率兩兩對比,有統計學意義(P=0.000、0.015、0.000),大鼠肝臟缺血再灌注后12h,三組的凋亡率兩兩對比,差異顯著(P=0.000、0.005、0.000),大鼠肝臟缺血再灌注后24h,三組肝細胞凋亡率兩兩對比,其中PO組及GIR組與IR組兩兩對比差異明顯(P=0.000),PO組與GIR組對比無統計學意義(P=0.265),GIR組隨著再灌注時間的延長,凋亡率逐漸下降,到再灌注24h時已顯著下降,接近PO組,見表2。

表2 大鼠肝缺血再灌注后各時點凋亡率比較研究
注:★P<0.01 VS PO組;▲P<0.01 VS IR組。
2.3 大鼠肝缺血再灌注后各時點大鼠血清白細胞介素 1β(IL-1β)的變化 大鼠肝臟缺血再灌注后6h PO組、IR組及GIR組IL-1β值兩兩對比,差異顯著(P=0.000),大鼠肝臟缺血再灌注后12h,三組IL-1β值兩兩對比有統計學意義(P=0.000),大鼠肝臟缺血再灌注后24h,三組IL-1β值兩兩對比有差別(P=0.000),隨著再灌注時間的延長,GIR組白細胞介素 1β(IL-1β)水平逐漸下降,到再灌注24h時下降明顯,見表3。
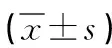
表3 大鼠肝缺血再灌注后各時點白細胞介素 1β(IL-1β)的變化情況
注:★P<0.01 VS PO組;▲P<0.01 VS IR組。
3 討論
肝缺血再灌注(Ischemia reperfusion,I/R)損傷常由炎癥反應和氧化應激介導,引起肝細胞的凋亡和壞死,進而導致肝功能不全[2],隨著研究進展,近年發現了與雌激素相關聯的第3種受體,即G蛋白偶聯雌激素受體(G protein-coupled estrogen receptor,GPER),雌激素可通過GPER介導的快速信號反應來調控細胞的增殖、凋亡、炎癥反應等[3],G-1和G-15分別是CPER高選擇性的激動劑和抑制劑,它們的發現促進了GPER在細胞、組織和動物中的功能研究[4-5]。
本研究成果通過建立大鼠肝切除肝缺血再灌注模型,于造模前1h經腹腔給予120μg/(kg·d)G-1預處理,于造模后6h、12h及24h取大鼠血清及肝組織標本,分別檢測血清谷丙轉氨酶(ALT)濃度、肝細胞的凋亡情況發現,肝臟缺血再灌注后,血清ALT活性明顯升高。在IR組和GIR組,大鼠肝臟缺血再灌注后各個時間點ALT活性明顯升高,且隨著再灌注時間的延長而逐漸下降,組間同時點比較,GIR明顯低于IR組(P<0.05),且隨著再灌注時間的延長GIR組血清ALT值漸漸接近PO組;通過TUNEL法檢測肝細胞的凋亡情況發現,GIR組隨著再灌注時間的延長,G-1預處理組凋亡率逐漸下降,于再灌注6h達到峰值,到再灌注24h時已顯著下降,說明GPER激動劑G-1具有保護肝功能作用。
近期國內相關學者[6]對GPER激動劑(G-1)對C57BL/6小鼠腹腔巨噬細胞的研究發現GPER激動劑G-1可特異性降低IL-1β表達,IL-1β的激活依賴NLRP3炎性小體的活化,GPER激動劑G-1可能抑制NLRP3炎性小體的活化,本研究通過ELISA法在大鼠肝缺血再灌注后各時點測定血清白細胞介素1β(IL-1β)的變化,發現GPER激動劑G1預處理后,假手術組的IL-1β明顯低于GIR組及IR組(P<0.01),且隨著再灌注時間的延長,GIR組白細胞介素 1β(IL-1β)水平逐漸下降,到再灌注24h時下降明顯,表明GPER激動劑G-1預處理能降低大鼠肝缺血再灌注損傷后的IL-1β水平,抑制炎性細胞聚集,減輕肝組織炎性浸潤和細胞凋亡,從而減輕大鼠肝臟缺血再灌注損傷,這說明GPER激動劑G-1在大鼠肝缺血再灌注損傷的作用可能與NLRP3炎性小體相關。
綜上所述,GPER激動劑G-1預處理大鼠肝缺血再灌注損傷后,隨著再灌注時間的延長,能降低肝轉氨酶(ALT),減少肝細胞凋亡率,從而起到肝保護作用,其可能作用是通過降低IL-1β水平,來抑制IL-1β產生減輕肝臟缺血再灌注損傷,其進一步作用機制為GPER激動劑G-1可能是抑制NLRP3炎性小體的活化而發揮抗炎作用,從而影響細胞周期進程及細胞增殖,在肝臟缺血再灌注損傷中發揮保護肝臟組織的功能有待我們進一步研究。

