TGF-β1在放射性頜骨骨髓炎發病過程中對骨髓間充質干細胞的影響及其分子機制的體外研究
賈駿麒 趙路 陳媛麗 張哲儒 宗春琳 田磊
放射性頜骨骨髓炎(osteoradionecrosis of jaws, ORNJ)是頜面部惡性腫瘤放射治療的最嚴重并發癥之一,發病率高達5%~40%[1-2],并在放療后拔牙的患者中發病率顯著升高[3]。ORNJ可導致創口不愈、死骨形成、骨面外露、皮膚黏膜瘺道形成等后果;且病變不具有自限性,一旦發生遷延不愈進而造成病理性骨折,影響頜面部功能和容貌,嚴重者甚至造成死亡[4]。ORNJ的發病機制至今尚未完全闡明,近年來較為廣泛接受的放射性纖維萎縮學說[5]認為其是一種放射所導致的以局部組織肌成纖維細胞(myofibroblasts,MFB)分化、膠原基質分泌等為主要特征的放射性纖維化疾病[6]。
在前期研究中我們發現下頜骨局部骨髓間充質干細胞(bone marrow mesenchymal stem cells,BMSCs),BMSCs是ORNJ中MFB的來源之一,轉化生長因子β1(transforming growth factor-β1,TGF-β1)可能在這一過程中起到一定作用[7-8],TGF-β1表達的升高與組織纖維化具有重要關系[9]。還原型煙酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶NOX家族亞型NOX4在肝纖維化疾病過程中可介導成纖維細胞向MFB發生分化[10]。本實驗圍繞放射線對BMSCs的作用,以TGF-β1為研究靶點,對TGF-β1在ORNJ發病過程中的作用及其與NOX4表達合成之間的關系進行研究,為ORNJ的防治提供理論參考。
1 資料與方法
1.1 細胞來源、鑒定及分組
原代BMSCs取自2 周齡雄性SD大鼠,麻醉處死后分離股骨,剪斷兩端骨骺后用加壓沖洗骨髓腔,細胞待傳至P3代后備用。顯微鏡下觀察細胞形態,并用流式細胞技術檢測細胞表面標志物CD34、CD44、CD45進行鑒定。
接種細胞至6 孔板中,待生長穩定后設置細胞分組為:空白對照組:P3代BMSCs不做任何干預; 實驗組1:BMSCs+輻照; 實驗組2:BMSCS+TGF-β1中和抗體(sigma,美國)+輻照; 實驗組3:BMSCS+外源性TGF-β1(BioVision,美國); 實驗組4:BMSCs+siNOX4+輻照;實驗組5:BMSCs+siNOX4+外源性TGF-β1。
1.2 射線來源及參數設置
放射線來源于陜核工業咸陽第二一五醫院放療科CX5762型放射治療機(VARIAN,美國),射線性質屬高能X射線,設置射線能量為6 MeV,劑量率為4 Gy/min,單次照射劑量為4 Gy。
1.3 siNOX4轉染及效率鑒定
構建對NOX4的轉錄具有沉默作用的小分子RNA(small interfering RNA, siRNA)siNOX4: 5′-GCUUCUACCUAUGCAAUAA-3′(正義鏈)、 3′-CGAAGAUGGAUACGUUAUU -5′(反義鏈)(廣州銳博生物)。對P3代BMSCs細胞按試劑盒說明書,進行轉染24 h后進行qPCR檢測NOX4基因表達水平,并加入外源性TGF-β1, 7 d后免疫熒光法檢測NOX4合成水平鑒定轉染效率。
1.4 細胞生長活性以及ORNJ相關蛋白表達測定
倒置顯微鏡對各組細胞形態進行觀察,在第 1、 2、 3、 4、 5、 6、 7 天進行CCK8(Thermo Fisher Scientific,美國)染色,酶標儀讀取A值并繪制生長曲線。Western-blot法檢測各組中TGF-β1以及MFB特異性標志蛋白α-SMA 合成情況。
1.5 統計學分析
采用SPSS 19.0軟件進行ANOVA分析,P<0.05時認為差異具有統計學意義。
2 結 果
2.1 細胞形態觀察
空白對照組細胞呈短梭形,形態較完整。射線和外源性TGF-β1可造成細胞形態不規則、密度減小,并可觀察到大量破碎的細胞結構。TGF-β1中和抗體和siNOX可以明顯減輕細胞形態的破壞(圖 1)。
2.2 細胞生長能力
繪制細胞生長曲線(圖 2)觀察細胞生長能力變化。可見空白對照組細胞在接種初期短暫適應后于第3 天開始明顯增殖,于第5 天左右生長明顯放緩,達到平衡狀態。射線和外源性TGF-β1在干預后第3 天開始造成細胞生長的明顯抑制,在第7 天細胞生長幾乎停滯。TGF-β1中和抗體、siNOX4的應用可以在一定程度上保護細胞的增殖能力。
2.3 TGF-β1合成水平的檢測
射線可引起細胞TGF-β1合成的升高,并無法通過抑制NOX4表達降低TGF-β1的合成。中和抗體對TGF-β1具有較好的中和效果(圖 3)。
2.4 NOX4合成的檢測
射線和外源性TGF-β1可造成細胞NOX4合成的明顯升高,應用TGF-β1中和抗體可部分降低NOX4的合成水平(圖 4)。
2.5 α-SMA合成的檢測
射線和外源性TGF-β1均可以造成α-SMA合成量的增加,TGFβ1中和抗體和siNOX4的應用可以顯著降低α-SMA的合成,但后者的抑制合成作用低于前者(圖 5)。
3 討 論
對BMSCs施加4Gy劑量的X線照射后出現了MFB特異性蛋白α-SMA合成分泌的增多,以及細胞增殖能力下降等現象,與ORNJ的疾病行為及病理表現相契合,驗證了本實驗所用細胞輻照模型較強的科學性與適用性。TGF-β1是一種廣泛存在于多種病理生理過程中的細胞因子,免疫細胞化學研究表明TGF-β1是放射性纖維化中最主要的細胞因子[11]。NOX家族則是通過過表達產生大量活性氧從而引起氧化壓力增加,與機體多種疾病的發生緊密相關,誘導了多種疾病的發生、發展,其中NOX4 被廣泛認為是多種纖維化疾病發生過程中的重要環節[12-13]。本實驗通過對體外培養的 BMSCs 施加適合劑量的放射線,觀察到TGF-β1和NOX4的合成水平較對照組顯著升高,進一步證實了TGF-β1是BMSCs 對放射線電離輻射作用的產物;同時,NOX4表達的升高也提示了氧化應激損傷可能是導致ORNJ纖維化發生的重要因素。
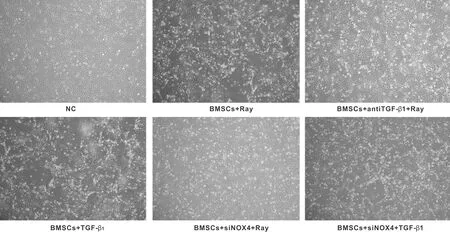
圖1 射線、 TGF-β1、TGF-β1中和抗體、 siNOX4對細胞形態的影響 (倒置顯微鏡,×40)
Fig 1 The effects of radiation, TGF-β1, TGF-β1neutralizing antibody and siNOX4 on cell morphology (Inverted microscopy, ×40)

圖2 射線、TGF-β1、TGF-β1中和抗 圖 3 射線、中和抗體及siNOX4對TGF-β1合成水平的影響體、siNOX4對細胞增殖的影響
Fig 2 The effects of radiation, TGF - β1, Fig 3 The effects of radiation, neutralizing antibody and siNOX4 on TGF - β1neutralizing antibody TGF-β1synthesis level and siNOX4 on cell proliferation

圖 4 射線、 TGF-β1對NOX4合成水平的影響 (×100)
Fig 4 The effects of X-ray and TGF-β1on the synthesis level of NOX4 (×100)
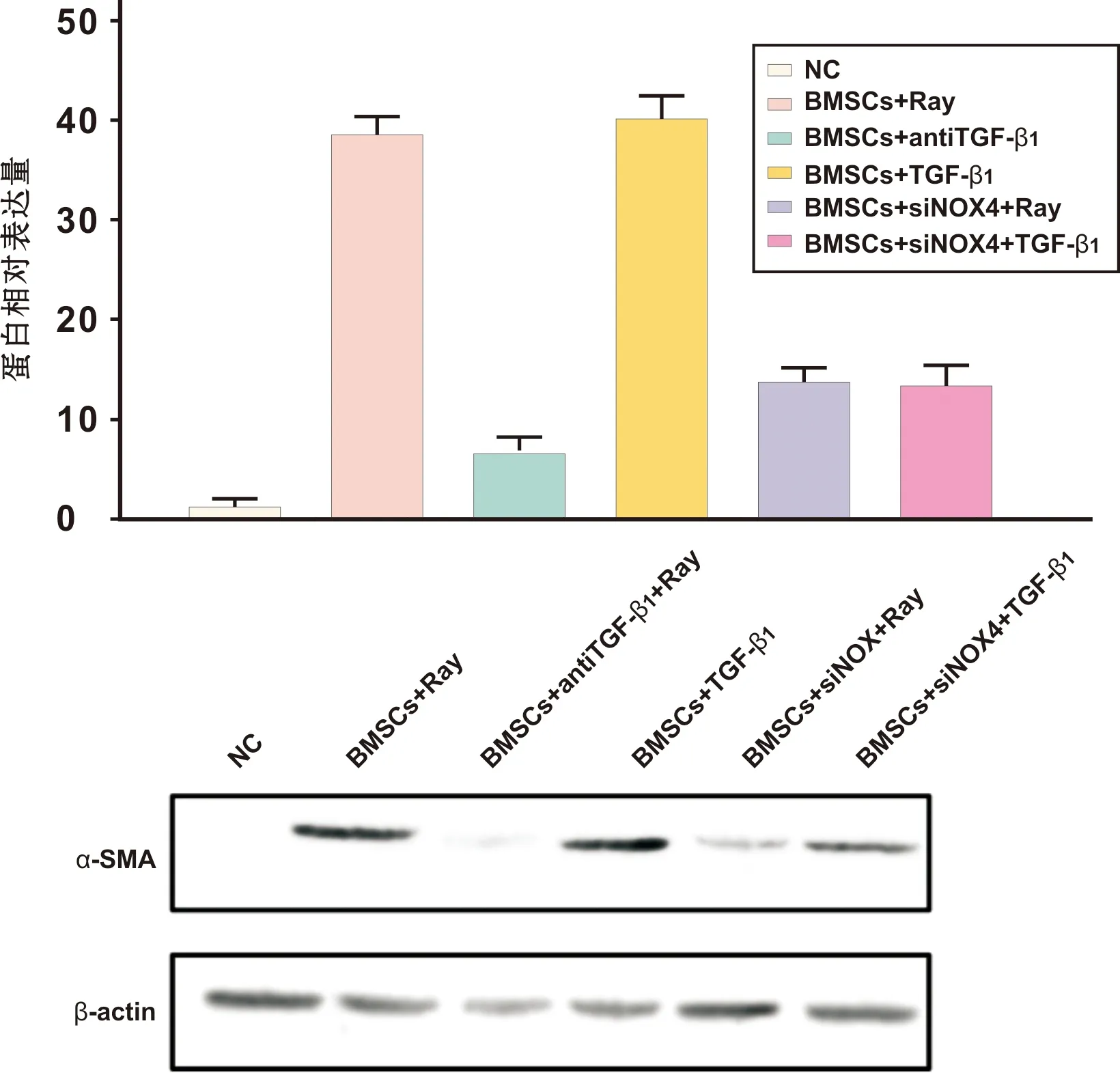
圖 5 射線、TGF-β1及siNOX4對α-SMA合成量的影響
Fig 5 The effects of radiation, TGF-β1and siNOX4 on α-SMA synthesis
為揭示TGF-β1在ORNJ疾病發展中的作用,本研究對BMSCs進行外源性TGF-β1的干預,觀察到與射線對BMSCs的作用效果相似的NOX4、α-SMA合成的增多、細胞增殖能力下降等一系列現象,證實TGF-β1導致BMSCs中α-SMA合成的增多作用與放射線的電離輻射損傷高度類似,且TGF-β1極有可能是導致NOX4表達升高的重要因素。同時,用抗體中和TGF-β1的作用,觀察到放射線的促BMSCs中NOX4與α-SMA合成作用以及抑制細胞增殖的作用減弱。上述實驗結果表明TGF-β1合成的增多可能是放射線對BMSCs的作用中NOX4與α-SMA合成增多、細胞增殖能力下降的關鍵環節。用siRNA抑制NOX4表達后對細胞進行的照射實驗中,觀察到α-SMA水平較單純照射組有一定下降。說明NOX4在一定程度上參與了射線對BMSCs向MFB分化的過程。此外,抑制NOX4的表達還可以緩解射線對細胞增殖的抑制作用,提示NOX4也參與了是射線電離輻射對BMSCs的細胞損傷作用。
對siNOX4轉染后的BMSCs進行輻照,其TGF-β1合成水平較單純照射組無明顯改變,說明NOX4未參與射線對BMSCs的促TGF-β1合成作用。有研究表明NOX 4可以介導TGF-β1對內皮細胞的凋亡和表型變化[14],那么對于ORNJ中的BMSCs是否也有類似的作用?為進一步明確TGF-β1與NOX4這兩種重要細胞損傷產物之間可能存在的關系,將外源性TGF-β1作用于siNOX4轉染的BMSCs。觀察到抑制NOX4表達合成后,除α-SMA的表達合成部分下降外,細胞形態損傷、生長抑制等現象均得到一定緩解。上述現象說明NOX4可能是TGF-β1誘導BMSCs中細胞損傷和增殖抑制的重要分子機制之一,并部分參與了TGF-β1的促MFB分化作用。
綜合上述系列實驗結果可以得出結論:放射線作用于BMSCs后首先誘導了TGF-β1合成水平的升高,進而誘導了BMSCs向MFB發生分化,并導致細胞結構破壞、細胞增殖抑制等現象的發生。在這一過程中,NOX4 作為重要中間環節,參與了TGF-β1對BMSCs的細胞破壞和增殖抑制作用,并部分參與了TGF-β1的促MFB分化作用。本實驗結果提示抑制TGF-β1的表達和/或合成可能是防治ORNJ的有效途徑。但由于TGF-β1是體內的一種關鍵細胞因子,其作用廣泛而復雜,牽涉眾多細胞和器官的功能。為避免抑制TGF-β1所帶來的全身其他負面影響,將NOX4作為防治靶點也可有效緩解射線帶來的組織細胞壞死、纖維化形成等后果,具有較高的臨床指導意義。

