培養基加氟后滲透壓變化對成釉細胞超微結構影響的觀察
張樂 王垚 王軍強 曹偉靖 張學武
成釉細胞(ameloblast)是牙釉質形成的關鍵細胞[1],來源于牙胚內釉上皮。成釉細胞對氟十分敏感,目前認為過量的氟作用于成釉細胞,可造成細胞的形態結構改變,基質分泌異常,功能障礙,繼而引起牙齒的發育和礦化障礙,導致氟牙癥的形成。
現階段獲得成釉細胞主要方法來源于體外培養,培養體外細胞的過程中,培養基的滲透壓需保持在一定的平衡范圍內。如果滲透壓發生變化,平衡被打破會造成細胞生物學特性異常。前期,本課題組已成功制備染氟的成釉細胞[2],由此發現體外染氟成釉細胞的一系列生物學特性發生變化。為明確這種變化的真正原因,我們在前期實驗中初步發現加入氟化鈉、氯化鈉等滲透壓調節劑后可使培養基的滲透壓發生變化,這種變化對成釉細胞的形態方面未見明顯影響[3]。本研究將繼續通過觀察成釉細胞于不同環境中的超微結構,明晰滲透壓對成釉細胞生物學特性的是否有影響。
1 材料與方法
1.1 主要實驗材料與儀器
健康的出生4 d的SD大鼠(西安交通大學實驗動物中心);透射電子顯微鏡(H-7650*,日本);全自動冰點滲透壓儀(ONE-TEN OSMOMETER,德國);50 mOsm/kg 和850 mOsm/kg 氯化鈉標準定標液、NaCl、KCl、Na2HPO4·12H2O、KH2PO4、NaOH、Na2EDTA·2H2O、溴酚蘭、二甲苯(西安化學試劑廠);醋酸(天津市河東區紅巖試劑廠);膠原酶、胰酶、明膠(Sigma公司,美國);DMEM(Hyclone公司,美國);胎牛血清(浙江天杭生物科技有限公司);甘油(西安交通大學法醫實驗室惠贈)。
1.2 實驗方法
1.2.1 實驗組設置 通過本課題組前期預實驗和查閱文獻資料[2-3],實驗選取0 mg/L氟化鈉,42 mg/L氟化鈉,84 mg/L 氟化鈉3 組。為觀察對比成釉細胞超微結構變化情況,通過查閱文獻資料[4]和預實驗的結果:分別選取58.5 mg/L(1 mmol/L,324 Pa)氯化鈉、117 mg/L(2 mmol/L,329.2 Pa)氯化鈉、0.05 mg/L甘油(324.3 Pa)、0.09 mg/L甘油為42 mg/L(1 mmol/L,330.1 Pa)和84 mg/L(2 mmol/L,330.8 Pa)氟化鈉組的對照組[4]。
1.2.2 成釉細胞的體外培養 沿用本課題組已建立的體外培養成釉細胞方法[5-6]:取斷頸處死四天齡的SD大鼠,用75%的酒精浸泡頭部15 min后分離下頜骨,仔細剝離雙側下頜內磨牙牙胚將其置于培養皿內,PBS清洗兩遍,加入0.25%的 Ⅰ型膠原酶,輕柔剪碎牙胚,使其成d≤1 mm的組織塊,然后置于37 ℃恒溫孵育箱內消化2 h。取出培養皿,放入超凈臺,靜置2 min,吸出上層消化液,棄之,PBS清洗,再加入新配置的0.25%胰酶,消化8 min,終止消化,靜置1 min,收集上清,放置于離心管,1 200 r/min離心3 min,棄去上清,將已配置好的含10%胎牛血清的DMEM培養液加入,吹打混懸并均分,分別將其接種于已用明膠包被完成的培養瓶中。
1.2.3 分別于2、4 d時差別消化。5 d后,觀察待成釉細胞進入生長期、且純度達到可以電鏡下檢查的要求后,7 組實驗組分別加入含氟化鈉 0 mg/L(空白對照組)、42 mg/L、84 mg/L、氯化鈉 58.5mg/L、117 mg/L、甘油0.05 mg/L、0.09 mg/L的培養基。
1.2.4 48 h后 ①新鮮配制的0.25%的胰酶消化細胞,1 200 r/min,3 min離心收集細胞,戊二醛固定細胞;②細胞團塊移入容器中,4 ℃ PBS漂洗3 次×10 min。4 ℃ 1% 四氧化鋨固定15 min,PBS漂洗3 次;③室溫下于系列丙酮脫水(每次10 min):50%丙酮1 次,70%丙酮1 次,90%丙酮2 次,純丙酮3 次;④浸透:吸棄脫水劑,加包埋劑,靜置30 min,除去包埋劑,加純包埋劑1 ml,隔夜保存;⑤包埋:用混合包埋劑將成釉細胞團塊注滿,于烤箱烘烤,固化成硬塊;⑥修塊:包埋塊裝在夾具上,顯微鏡下,修塊;⑦切片:先將包埋塊切成厚約1 μm的半薄切片,染色后鏡下觀察成釉細胞圖像,確定部位位置,作好標記,切厚約60 nm的超薄切片,挑片,貼在銅網上;⑧電子染色:行檸檬酸鉛的染色和清洗。涼干觀察。
2 結 果
本研究使用透射電子顯微鏡觀察各組成釉細胞超微結構,結果顯示:對照組(圖1)成釉細胞胞體呈橢圓狀,胞體表面有微絨毛,細胞核亦呈現不規則長圓形,大都居于中央,可見1~2 個清晰核仁,核仁大而明顯,核周圍胞漿內有可見充足的內質網,高爾基體,也可見線粒體和游離的核糖體,含蛋白質分泌物,空泡和脂滴,還有清晰的屬上皮細胞的張力原纖維,其中內質網大都無明顯變化,僅個別內質網輕度擴張;42 mg/L (1 mmol/L)氟化鈉組(圖1中F1)成釉細胞大多體積變小,細胞連接較松散,個別細胞水腫,并有死細胞出現,細胞核皺縮,部分粗面內質網擴張,高爾基體水腫,其余細胞器無明顯變化,張力原纖維稀疏;84 mg/L(2 mmol/L) 氟化鈉組(圖1中F2)成釉細胞膜溶解破壞,細胞核溶解,胞漿,細胞器溢出,大部分明顯腫脹,可見空泡性變。117 mg/L(2 mmol/L)氯化鈉組(圖2),0.09 mg/L甘油組(圖3)成釉細胞超微結構與對照組大致相同。張力原纖維溶解模糊(圖4),界不清,染色體出現凝集,邊集現象(圖4),細胞核碎裂后向包膜邊緣擴散,或可形成凋亡小體(圖4),被溶酶體吞噬,外排。線粒體極度水腫(圖4),嵴崩解消散,結構模糊。
3 討 論
近年來,國內外學者從多方面對氟牙癥進行研究,普遍認為氟化物可以引起成釉細胞增殖、凋亡及蛋白分泌的一系列變化,但具體機制尚不清楚[7-8]。為直觀發現氟對體外培養成釉細胞的影響情況,本課題組前期在培養成釉細胞的培養基中加入不同濃度的氟化鈉后發現氟離子的添加,成釉細胞的形態結構,增殖凋亡均發生了變化的同時考慮到氟離子的添加會導致培養基滲透壓的變化,從而懷疑滲透壓的這種改變是否間接干擾了氟對成釉細胞的影響,即體外培養成釉細胞細胞形態功能的變化是由于氟離子的直接毒性作用,還是由于氟離子導致滲透壓的變化,間接影響細胞,有必要進一步研究。

圖1 3 組成釉細胞超微結構觀察Fig 1 Observation of ameloblast ultrastructure of the 3 groups

圖2 117 mg/L氯化鈉組(N2)成釉細胞超微結構觀察Fig 2 Observation of the ultrastructure of ameloblasts of 117 mg/L sodium chloride group(N2)
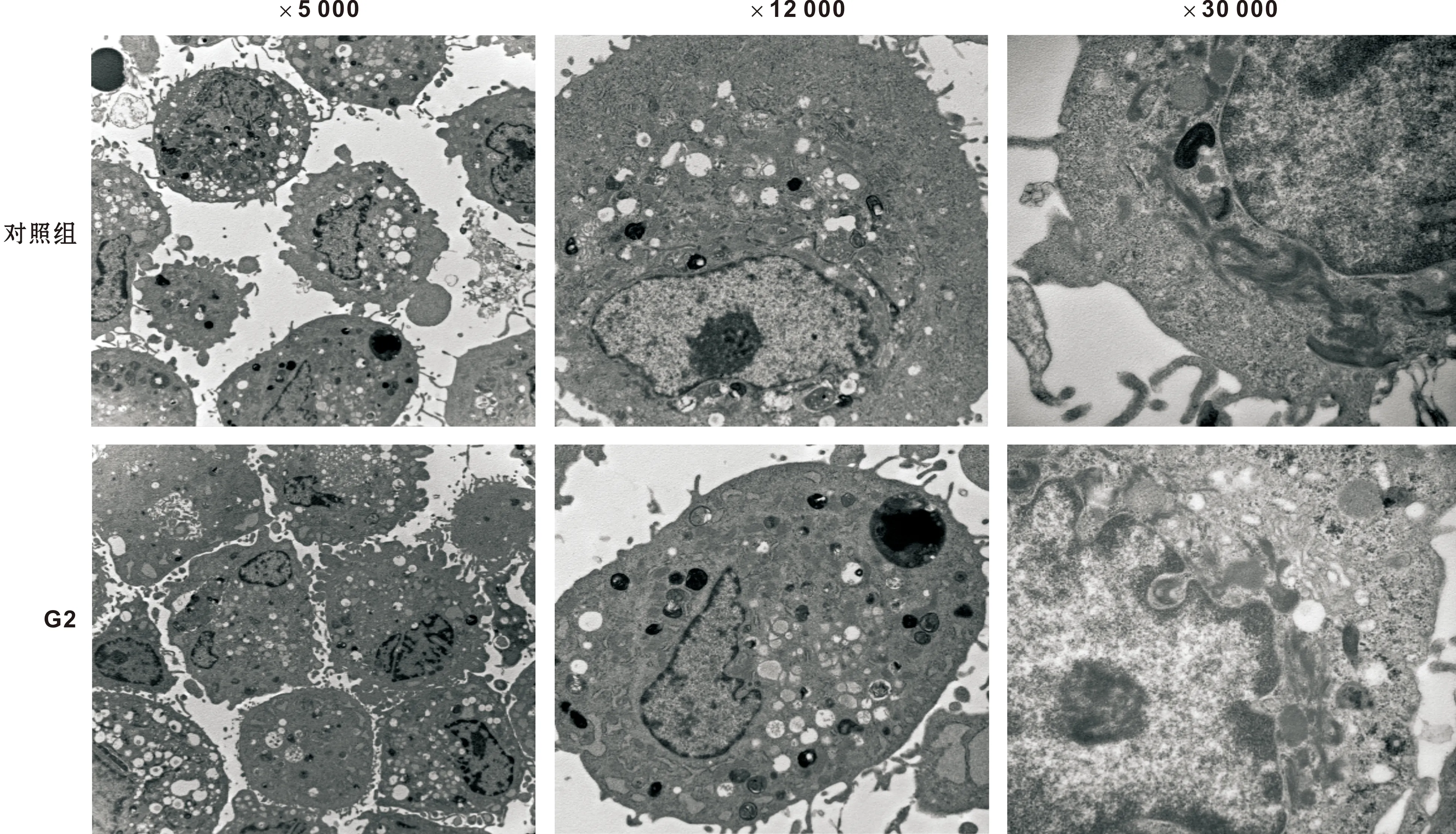
圖3 0.09 mg/L甘油組(G2)成釉細胞超微結構觀察Fig 3 Observation of the ultrastructure of ameloblasts of 0.09 mg/L glycerol group(G2)

圖4 84 mg/L氟化鈉組成釉細胞超微結構觀察Fig 4 Ultrastructure observation of ameloblasts of 84 mg/L sodium fluoride group
細胞的生長和存活受到滲透壓十分顯著的影響,尤其對于體外培養細胞,滲透壓是關鍵的影響因素[9]。本研究在實驗中將氟化物加入培養基,改變了培養基中溶質的總離子濃度,繼而可能會影響培養基的滲透壓。本課題組前期實驗[4]通過冰點滲透壓儀檢測各實驗組滲透壓值,各實驗組顯微鏡下及HE染色結果發現滲透壓變化對成釉細胞形態無明顯影響,染氟成釉細胞形態變化與滲透壓的變化無關,而是由氟離子濃度改變所致。本實驗通過透射電子顯微鏡分別繼續觀察了對照組,42 mg/L和84 mg/L的氟化鈉組,117 mg/L 氯化鈉組,0.09 mg/L甘油組細胞的超微結構,發現滲透壓的改變對成釉細胞的超微結構無明顯影響。
細胞膜是細胞的機械性和化學性屏障,同時參與細胞的內外物質交換、運動以及生長調控等;線粒體則是細胞內產生能量的主要場所;粗面內質網參與了細胞蛋白質的合成[10];高爾基體與細胞的分泌活動和溶酶體的形成有關;而來源于上皮細胞的張力原纖維[11],是上皮角蛋白中間絲,它們呈連于橋粒的致密束狀。在細胞連接處能加固細胞間的連接,在細胞內起支持,保持細胞韌性和彈性的作用。近年來研究發現[12]:氟化鈉會引起原代成釉細胞超微結構的變化。過量的氟化物作用于原代成釉細胞,首先會引起內質網應激,進而導致非折疊蛋白反應[13]。
本研究于電鏡下發現:與對照組相比,42 mg/L 氟化鈉組細胞大多體積變小,細胞連接較松散,部分粗面內質網擴張,高爾基體水腫,張力原纖維稀疏;84 mg/L 氟化鈉組細胞膜溶解破壞,細胞核溶解,胞漿,細胞器溢出,內質網疏松形成空泡,線粒體腫脹嵴消失,張力原纖維溶解模糊,與其他文獻研究[14-15]結果相同。而與之滲透壓相同的117 mg/L 氯化鈉 0.09 mg/L甘油各組細胞超微結構均與對照組相似,并未出現明顯變化。根據上述變化可以推測:體外培養成釉細胞,培養基中隨著氟濃度的增加,成釉細胞的超微結構變化更明顯。成釉細胞超微結構的變化主要是由于氟的毒性作用。本課題組將對染氟成釉細胞生物學特性繼續進一步的研究。

