口腔鱗癌中NF-κBp65、IL-6表達與巨噬細胞極化的關系
錢嫻嫻 馮紅超 宋宇峰
超過80%的口腔頜面部惡性腫瘤為口腔鱗狀細胞癌(oral squamous cell carcinoma,OSCC),盡管目前有一系列綜合治療方法,如放化療、手術治療、基因治療等,但OSCC的長期療效仍不能令人滿意[1]。因此,OSCC的早期診斷及分子靶向治療是必要的。研究表明,腫瘤自身分泌的炎癥因子可能刺激核因子-κB(nuclear factor kappa B,NF-κB)通路的持續激活,促進OSCC的轉移[2]。自1999 年以來,Duffey等[3]研究發現頭頸部鱗癌的癌細胞能夠自分泌白介素-6(Interleukin-6,IL-6),并且IL-6基因中包含NF-κB家族核轉錄因子的結合位點。學者們還發現,腫瘤相關巨噬細胞(Tumor associated macrophages,TAMs)與腫瘤的侵襲、轉移密切相關。為探討在OSCC中NF-κB、IL-6的表達及其二者與巨噬細胞表型極化的關系,本研究應用免疫組化SP法對15 例正常組織及42 例OSCC組織中NF-κBp65、IL-6的表達及CD68+、CD163+巨噬細胞的浸潤進行了檢測。
1 資料與方法
1.1 基本資料
收集貴陽市口腔醫院及貴州醫科大學附屬醫院2015~2016 年臨床資料完整的正常組織15 例、OSCC標本42 例。納入、排除標準:OSCC患者均經病理確診,術前未接受放、化療等治療,正常組織取自癌旁2.0 cm外的黏膜組織。OSCC患者女性11 例、男性31 例,年齡25~78 歲,平均60.38 歲,無淋巴結轉移17 例,有淋巴結轉移25 例,中分化及低分化共16 例,高分化26 例。本研究由倫理委員會審查批準,所有患者簽署了知情同意書。
1.2 方法
1.2.1 檢測方法 4%中性甲醛固定標本,常規石蠟包埋,4 μm連續切片,脫蠟,水化,EDTA高壓抗原修復,添加一抗在4 ℃孵育過夜,染色。NF-κB p65小鼠抗人單克隆抗體(稀釋度1∶300)、IL-6小鼠抗人單克隆抗體(稀釋度1∶200)(北京博奧森生物技術有限公司);CD68小鼠抗人單克隆抗體(稀釋度1∶75)、CD163小鼠抗人單克隆抗體(稀釋度1∶80)、SP免疫組織化學試劑盒、二氨基聯苯胺(DAB)顯色、蘇木精復染液(北京中杉金橋生物技術有限公司);嚴格按照試劑盒說明書方法并在相同條件下進行染色,磷酸鹽緩沖液(PBS)代替一抗作陰性對照。
1.2.2 結果判定 2 名病理醫師協助觀察染色結果,綜合染色強度及陽性細胞數百分比進行判定,NF-κBp65陽性染色為細胞核或細胞質呈現棕黃色細小顆粒,IL-6陽性染色顯示為細胞質呈現棕黃色細小顆粒,高倍鏡(×400)下每張切片觀察10 個視野(每個視野約100 個腫瘤細胞),分別觀察計分,陽性細胞數<10%計1 分,2 分(11%~50%),3 分(50%~75%),>75%計4 分;染色強度評分:無色0 分,淺色1 分,棕黃色2 分,棕褐色3 分,然后根據乘積分數分4 個等級:0~2 分(-),3~4 分(+),6~8 分(++),9~12 分(+++),分數≥3為陽性、<3為陰性。CD68+巨噬細胞陽性染色顯示細胞質有棕黃色細小顆粒,CD163+巨噬細胞陽性染色顯示細胞膜呈現棕黃色細小顆粒,在高倍鏡下觀察5 個非重疊的間質及癌巢,并計數陽性細胞。
1.3 統計方法

2 結 果
2.1 在OSCC及正常組織中NF-κBp65、IL-6的表達及CD68+、CD163+巨噬細胞的浸潤情況
在OSCC組織中,NF-κBp65、IL-6的表達及CD68+、CD163+巨噬細胞的浸潤數量高于正常組織,且差異具有統計學意義(P<0.05),NF-κB p65陽性染色主要分布在為細胞核或細胞質內,呈棕褐色小顆粒,IL-6陽性染色為細胞質呈現棕黃色小顆粒,NF-κB p65、IL-6在正常組織中極少量表達,CD68+、CD163+巨噬細胞的浸潤主要集中在腫瘤間質內,CD68+巨噬細胞陽性染色顯示細胞質有棕黃色細顆粒,CD163+巨噬細胞陽性染色顯示細胞膜有棕黃色小顆粒,CD68+、CD163+巨噬細胞在正常組織中少量表達(圖1、表1)。
2.2 OSCC中NF-κBp65、IL-6的表達及CD68+、CD163+巨噬細胞的浸潤與臨床病理資料的關系
在OSCC中,NF-κBp65、IL-6的表達及CD68+、CD163+巨噬細胞的浸潤數量均與患者年齡、性別無關(P>0.05);在有淋巴結轉移組中NF-κBp65的表達、CD68+及CD163+巨噬細胞的浸潤高于無淋巴結轉移組(P<0.05);CD68+巨噬細胞在中低分化組的浸潤數量高于高分化組(P<0.05);在不同分化組中,NF-κBp65及IL-6的表達、CD163+巨噬細胞的浸潤數量差異無統計學意義(P>0.05)(表2~3)。
2.3 OSCC中NF-κBp65、IL-6的表達及CD68+、CD163+巨噬細胞浸潤數量的相關性
NF-κBp65與IL-6的表達呈正相關(r=0.316,P=0.041),CD68+巨噬細胞與CD163+巨噬細胞的浸潤數量呈正相關(r=0.590,P=0.000);NF-κBp65的表達與CD68+、CD163+巨噬細胞的浸潤數量均呈正相關(r=0.746,P=0.000;r=0.491,P=0.001);IL-6的表達與CD68+巨噬細胞的浸潤數量呈正相關(r=0.336,P=0.029)。

圖1 OSCC及正常組織中NF-κBp65、IL-6的表達及CD68+、CD163+巨噬細胞的浸潤 (×400)Fig 1 Expression of NF-κBp65,IL-6 and infiltration of CD68+,CD163+ macrophages in OSCC and normal tissues (×400)
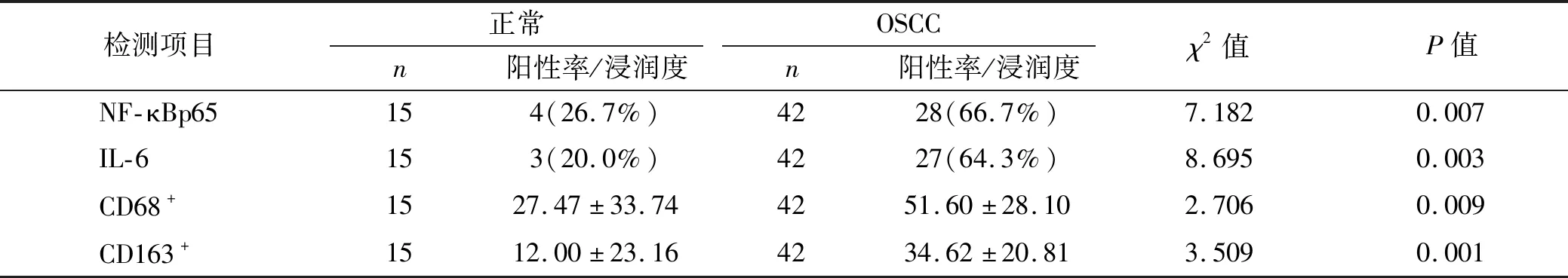
表1 OSCC及正常組織中NF-κBp65、IL-6的表達及CD68+、CD163+巨噬細胞的浸潤Tab 1 Expression of NF-κBp65,IL-6 and infiltration of CD68+,CD163+ macrophages in OSCC and normal tissues

表2 OSCC中NF-κBp65、IL-6的表達與臨床病理資料的關系 [n(%)]Fig 2 Relationship between the expression of NF-κBp65,IL-6 in OSCC and the clinicopathologic parameters [n(%)]

表3 OSCC中CD68+及CD163+巨噬細胞的浸潤數量與臨床病理資料的關系Tab 3 Relationship between the CD68+,CD163+ macrophages infiltration in OSCC and the clinicopathologic parameters
3 討 論
目前通過研究腫瘤標志物在OSCC中的表達來了解OSCC發生發展已成為研究熱點。已有研究發現靶向腫瘤細胞表達的NF-κB可以誘導抗腫瘤免疫應答[4],顯示NF-κB可能是OSCC治療的有效靶標;還有研究表明對巨噬細胞特異性治療具有明顯效果[5],所以以TAMs極化調節為靶點的抗腫瘤免疫治療具有可行性;IL-6的高表達與患者的不良預后也具有相關性,所以IL-6被提議作為一種檢測惡性腫瘤的診斷標志物也具有可行性。
NF-κB是真核轉錄因子結構相關的蛋白家族,包括5個成員,即RelA(p65)、RelB、c-Rel、p50(NF-κB1)、p52(NF-κB2)。其中p65(RelA)能發揮轉錄激活功能,是NF-κB主要的功能蛋白。異常激活NF-κB通路會導致多種疾病發生,例如慢性炎癥、自身免疫性疾病、腫瘤等[6]。通常,NF-κBp65結合IκB抑制蛋白存在于細胞質中,在通路被外界刺激(射線、機械刺激等)或內部信號(炎癥因子、化學因子等)激活下,發生磷酸化并降解,NF-κBp65進入細胞核并結合相應的靶序列,在腫瘤抗凋亡機制中起重要作用[7]。因此,IκB的磷酸化和p65核轉位是NF-κB激活的標志。本研究中,NF-κBp65在OSCC組織的細胞質及細胞核中均有表達,在細胞核中有明顯的陽性表達,特別是在有淋巴結轉移的OSCC中,呈現深褐色表達。在NF-κB的經典激活途徑中,上游信號磷酸化IKK復合物并激活IKKα/β,且磷酸化IκBα,并發生泛素化,隨后NF-κB核轉位,還與核內靶基因啟動子區域的κB序列結合,從而發揮調節作用。在旁路激活途徑中,p100在誘導激酶(NIK)和IκBα的作用下,被降解為其活性衍生物p52,并且與RelB結合以調控基因的轉錄。早期有學者已經提出癌癥中IKK-NF-kB途徑的上游組分突然變化或腫瘤微環境中的促炎刺激可能活化NF-κB信號傳導途徑[8]。
IL-6是一種多功能細胞因子,可調節癌癥的多種信號通路(例如細胞增值和凋亡、血管生成、侵襲和轉移),促進腫瘤發生[9]。在前列腺癌中,IL-6可通過磷脂酰肌醇激酶-蛋白激酶途徑來促NF-κB激活[10]。
巨噬細胞可分化為兩種類型:M1型(抗炎)和M2型(促腫瘤浸潤、轉移、血管生成)[11]。TAMs即浸潤在腫瘤組織及其周圍的巨噬細胞,目前認為TAMs的功能更偏向于M2型巨噬細胞[12]。CD68是巨噬細胞的標志,而M2型巨噬細胞則高表達CD163、CD206等,在本研究中,CD163用于標記M2型巨噬細胞、CD68用于標記巨噬細胞。本課題組前期研究顯示:OSCC中存在大量巨噬細胞浸潤,且TAMs可通過分泌VEGF、VEGF-C來促進腫瘤的生長和轉移[13]。
本研究結果顯示:NF-κBp65、IL-6、CD68+及CD163+巨噬細胞在OSCC中有明顯的高表達或高浸潤,與多數研究結果相似,提示四者的異常表達或浸潤可能與OSCC的發生發展有關。同時在對照組中未見NF-κBp65的表達增高,提示NF-κBp65在OSCC中有較強的活性。在OSCC淋巴結轉移組中,NF-κBp65的表達、CD68+及CD163+巨噬細胞的浸潤均高于無淋巴結轉移組,由此推測,三者表達升高可能與OSCC的淋巴結轉移、侵襲能力成正相關。CD68+巨噬細胞的浸潤數量和OSCC分化程度有關,顯示出在中、低分化的OSCC中,腫瘤微環境中的巨噬細胞會更多的聚集,炎性細胞高水平浸潤對腫瘤的發展起到很大作用。NF-κBp65、IL-6的表達、CD163+巨噬細胞的浸潤和分化程度無關,可能因樣本量較少或癌組織的組織學分級比例不同導致;有研究表明,多種細胞或病毒的癌蛋白可激活NF-κB,其作為聯系炎癥與癌癥的橋梁,可通過炎癥反應來參與細胞的癌變[14],IL-6也可調節癌細胞增殖來促腫瘤發生,由此本研究推測NF-κB和IL-6可能與癌變有關而與癌變后的腫瘤分化無關,不過這還需增大樣本量后進一步驗證。CD163+巨噬細胞與CD68+巨噬細胞浸潤的差異較小,說明在OSCC中,TAM多表達為M2型巨噬細胞,與多數研究結果一致。
本研究中NF-κBp65與IL-6的表達呈正相關,表明NF-κB表達增加可能導致IL-6的高表達,反過來,IL-6高表達亦可能會促進NF-κB通路的激活。已發現IL-6的5'端啟動子序列含有NF-κB家族轉錄因子結合位點,IL-6是重要的NF-κB依賴性細胞因子之一,也就是說,IL-6是受NF-KB調控的靶分子[15]。NF-κBp65的表達和CD68+、CD163+巨噬細胞的浸潤呈正相關,提示NF-κB信號通路可能參與了巨噬細胞表型極化的過程,這與以往研究結果相似[16]。IL-6的表達與CD68+巨噬細胞的浸潤數量呈正相關,IL-6R是傳遞IL-6 信號的唯一受體,而TAMs表面存在IL-6受體,IL-6與巨噬細胞表型極化相關[15]。
綜上所述,本研究推測OSCC中NF-κB、IL-6的高表達和M2型巨噬細胞的高浸潤可能促進腫瘤的侵襲與轉移,三者在腫瘤的發生發展中可能起相互促進作用,NF-κB和IL-6可能參與了巨噬細胞的表型極化過程;猜測可以通過改變IL-6的分泌量來影響NF-κB信號途徑的激活從而調節巨噬細胞極化表型來對抗腫瘤免疫治療,至于IL-6激活NF-κB信號通路、激活的NF-κB產生IL-6以及調節巨噬細胞表型極化的作用機制仍需擴大樣本量后進行深入研究。

