墨蘭‘吳字翠’× 墨蘭‘紅花’雜交后代根狀莖增殖及芽分化研究
謝娟 李龍 邢玥 翁青史 樊晚林 彭東輝

摘? 要:墨蘭(Cymbiduim sinense)又稱報歲蘭,是蘭科蘭屬植物,以其株型健壯、花期在春節深受國人喜愛。鑒于墨蘭組培根狀莖增殖率低、分化成芽困難,本研究以雜交墨蘭根狀莖為材料,通過不同濃度的生長素、分裂素以及有機添加物的組合,以期找到適宜墨蘭根狀莖增殖和分化的培養基配方。結果表明,最適宜雜交墨蘭根狀莖增殖的培養基配方為MS+ 2 mg/L 6-BA+0.1 mg/L NAA+0.2 mg/L TDZ+1.5 g/L AC+35.0 g/L Su+6.0 g/L Ag,增殖系數達5.35,生長速度為3.44。在添加不同激素的情況下,最適宜葉芽分化的培養基為MS+10.0 mg/L 6-BA+0.7 mg/L NAA+0.2 mg/L TDZ+1.5 g/L AC+35.0 g/L Su+6.0 g/L Ag,葉芽分化率為52.5%。在添加其他添加物的情況下,墨蘭葉芽分化最適宜的培養基為MS+8.0 mg/L 6-BA+0.1 mg/L NAA+7.0 g/L蛋白胨+100.0 mg/L CW+1.0 g/L AC,葉芽分化率為173.30%。本研究探討了激素和添加物對根狀莖增殖分化的影響,可實現雜交品種組培苗大量繁殖。
關鍵詞:墨蘭;根狀莖;增殖;分化;誘導
中圖分類號:S682.31? ? ? 文獻標識碼:A
Rhizome Proliferation and Bud differentiation of Cymbiduim sinense ‘Wuzicui × C. sinense ‘Honghua Hybrid
XIE Juan, LI Long, XING Yue, WENG Qingshi, FAN Wanlin, PENG Donghui*
College of Landscape Architecture, Fujian Agriculture and Forestry University / Key Laboratory of Orchidaceous Plant Conservation and Utilization, State Forestry and Grassland Administration, Fuzhou, Fujian 350002, China
Abstract: Cymbiduim sinense is also called Bao Sui Lan (Heralding New Year Orchid), which belongs to Cymbiduim (Orchidaceae). It is loved by Chinese people for its robust plant type and flowering period during the Spring Festival. In view of the low proliferation rate and the difficulty of bud differentiation of the rhizome of C. sinense. In this study, the hybrid rhizomes of C. sinense were used as materials, through the combination of auxin, mitogen and organic additives in different concentrations, in order to find a suitable medium formula for the proliferation and differentiation of the rhizomes of hybrid C. sinense. The results showed that the most suitable medium for rhizomes proliferation was MS+ 8 mg/L 6-BA+0.1 mg/L NAA+0.8 mg/L TDZ+1.5 g/L AC+35.0 g/L Su+6.0 g/L Ag, with a proliferation coefficient 5.35 and the growth rate 3.44. The most suitable medium for leaf bud differentiation was MS+10.0 mg/L 6-BA+ 0.7 mg/L NAA+0.2 mg/L TDZ+1.5 g/L AC+ 35.0 g/L Su+6.0 g/L Ag, with a leaf bud differentiation rate 52.5%. The most suitable medium for leaf bud differentiation was MS+8.0 mg/L 6-BA+0.1 mg/L NAA+7.0 g/L peptone+100.0 mg/L CW+1.0 g/L AC, with a leaf bud differentiation rate 173.30%. This study explored the effects of hormones and additives on the proliferation and differentiation of the rhizomes, which could achieve large-scale reproduction of the tissue culture seedlings.
Keywords: Cymbiduim sinense; rhizome; proliferation; differentiation; induction
DOI: 10.3969/j.issn.1000-2561.2020.05.019
墨蘭(Cymbidium sinense)又稱報歲蘭,蘭科(Orchidaceae)蘭屬(Cymbidium)植物,原產于我國、越南和緬甸,因其花期在春節,深受國人喜愛,具有較高的經濟價值、觀賞價值和藥用價值。
墨蘭的繁殖方式很多,常見的有分株繁殖和組織培養方式。傳統的繁殖方式主要是分株繁殖,但面臨繁殖率較低、周期長等問題,無法實現大量生產和滿足市場的需求。隨著組培技術的發展,國內外學者開展了墨蘭組培繁殖研究,其中在墨蘭根狀莖的增殖研究中,較適合的基本培養基有1/4MS、1/2MS、MS、Hyponex1-2和KC,常用的激素有6-BA、NAA、KT、IBA、TDZ等,但其適宜的濃度并不一致[1]。施福軍等[2]研究表明2.0 mg/L 6-BA和1.0 mg/L NAA有利于金嘴墨蘭根狀莖增殖,增殖系數達8.1。左利娟等[3]研究發現2.0 mg/L 6-BA+0.5 mg/L KT+0.05 mg/L NAA有利于墨蘭雜交后代增殖分化,增殖系數達3.96;丁雪珍等[4]發現2.0 mg/L BA和0.1 mg/L NAA有利于金錦鳳墨蘭根狀莖增殖,增殖系數達6.6。
在墨蘭芽分化相關研究中發現添加6-BA和NAA、TDZ可促進根狀莖的芽誘導[5-6],傅雪琳等[7]研究表明5.0 mg/L 6-BA+0.5 mg/L NAA能夠使芽的分化率達180%;朱根發等[8]發現在MS培養基中加入10 mg/L 6-BA和適量無機鹽有利于墨蘭根狀莖芽的分化。許申平等[9]提到5 mg/L 6-BA與0.5 mg/L NAA的組合,墨蘭根狀莖綠芽數達到6.43;Yan等[10]研究表明4.0 mg/L 6-BA與1.0 g/L NAA組合時,芽數達2.9;Chen等[11]發現大花惠蘭(Cymbidium hybrida)×墨蘭(C. sinense)和惠蘭(C. faberi)根狀莖在含有1.0 mg/L BA和0.5 mg/L NAA的培養基中,根狀莖頂端80%以上發育成芽;Gao等[12]研究在培養基中添加4 mg/L 6-BA和0.2 mg/L NAA可促進根莖的芽誘導。以上研究結果中發現6-BA的濃度高低對芽分化促進的結果存在較大出入。除了NAA和6-BA對葉芽分化有促進作用,TDZ也有利于芽分化。Chang等[13]提到添加TDZ有利于芽分化。
綜上所述,雖然墨蘭根狀莖的組培增殖及芽分化的相關研究已經取得了較大的進展,但研究結果存在差異,且并不統一。在墨蘭組織培養研究中,仍存在繁殖系數偏低、芽分化系數低和繁殖周期長等問題,并且制約了種苗規模化生產。除此之外,不同品種之間存在較大差異,導致其研究結果存在較大差異。本試驗以雜交墨蘭為材料通過調節培養基和添加外源激素進行根狀莖誘導,以期篩選出最佳的培養基配方,提高其根狀莖的繁殖系數和芽分化率,從而達到降低成本、提高效率的目的,有利于選育優良品種,促進墨蘭種苗生產產業化。
1? 材料與方法
1.1? 材料
由福建連城蘭花股份有限公司提供的墨蘭‘吳字翠× 墨蘭‘紅花雜交種子無菌播種誘導出的根狀莖為試驗材料。
1.2? 方法
1.2.1? 6-BA、NAA和TDZ對墨蘭根狀莖增殖的影響? 采用L9(34)正交試驗研究不同濃度(2、5、8 mg/L)6-BA、(0.1、0.3、0.5 mg/L)NAA和(0.2、0.5、0.8 mg/L)TDZ對墨蘭根狀莖增殖的影響。所有處理附加1.5 g/L AC+35.0 g/L Su+ 6.0 g/L Ag(pH 5.6~5.8)。一共9組處理,每組接種20個材料為一個重復,每個材料長度為1.5~ 2.0 cm,3次重復。培養條件:光照時間12 h/d,光照強度1000~1500 lx,培養溫度(25±1)℃。180 d后根據統計生長速度、增殖系數。
生長速度=(增殖后根狀莖質量?接種時根狀莖質量)/接種時根狀莖質量
增殖系數=接種根狀莖上新增的側枝數/接種根狀莖數(新增根狀莖長度>0.5 cm)
1.2.2? 高濃度6-BA和低濃度NAA、TDZ對根狀莖葉芽分化的影響? 采用L9(34)正交試驗研究不同6-BA(8、10、12 mg/L)、NAA(0.3、0.5、0.7 mg/L)和TDZ(0.2、0.5、0.8 mg/L)對根狀莖葉芽分化的影響。所有處理附加MS+1.5 g/L AC+35.0 g/L Su+6.0 g/L Ag(pH 5.6~5.8)。一共9組處理,每組接種20個材料為一個重復,每個材料長度為1.5~2.0 cm,2次重復。每組20個材料,2重復進行計算平均值,并對9組,每組2次重復的正交試驗數據進行方差分析和多重比較分析。培養條件:光照時間12 h/d,光照強度1000~ 1500 lux,培養溫度(25±1)℃。240 d后基于生長情況統計平均每個根狀莖的葉芽分化率和株高。
葉芽分化率=根狀莖上誘導出的芽個數/接種根狀莖數×100%(芽>0.5 cm)
1.2.3? 蛋白胨、椰子汁(CW)、活性炭(AC)對根狀莖葉芽分化的影響? 將材料采用L9(34)正交試驗研究不同濃度蛋白胨(1、2、3 g/L)、活性炭(1.0、1.5、2.0 g/L)、椰子汁(50、100、150 mg/L)對根狀莖的影響。基礎培養基為MS+ 0.1 mg/L NAA+8 mg/L 6-BA+1.5 g/L AC+35.0 g/L Su+6.0 g/L Ag(pH 5.6~5.8)。一共9組,每組接種20個材料為一個重復,每個材料長度為1.5~ 2.0 cm,3次重復。培養條件:光照時間12 h/d,光照強度1000~1500 lx,培養溫度(25±1)℃。240 d后記錄生長情況并統計每個根狀莖的葉芽分化率和株高。
葉芽分化率=根狀莖上誘導出的芽個數/接種根狀莖數×100%(芽>0.5 cm)
1.3? 數據處理
使用Excel 2010軟件計算平均值和標準差,SPSS 19.0統計分析軟件對數據進行方差分析和Least- Significant Difference(LSD)多重比較,分析各因素對增殖和芽分化的影響。
2? 結果與分析
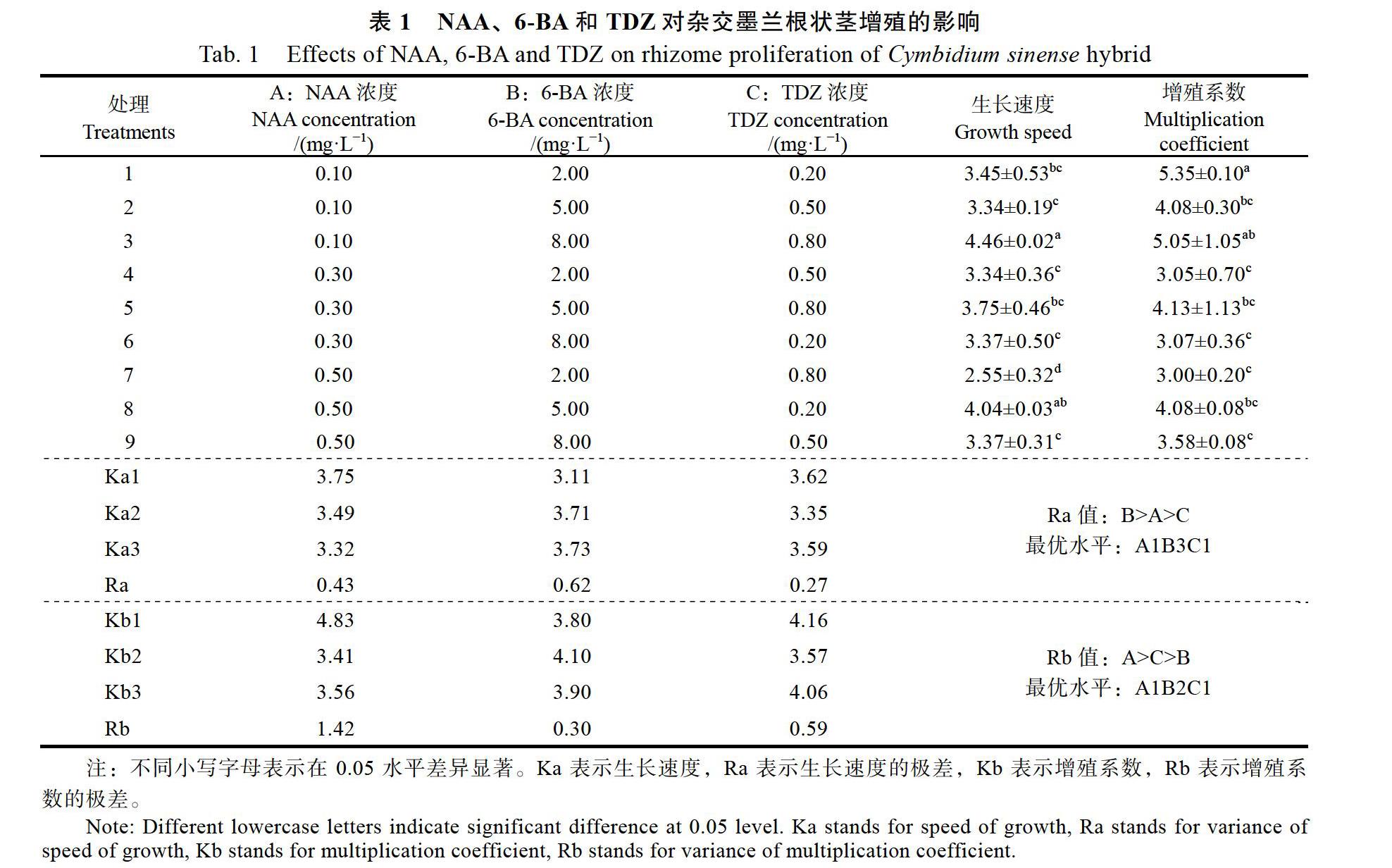
2.1? 6-BA、NAA和TDZ對根狀莖增殖的影響
由表1可知,激素組合為8 mg/L 6-BA+ 0.1 mg/L NAA+0.8 mg/L TDZ(處理3)對根狀莖生長速度的影響高于其他組合;當6-BA為2 mg/L,添加0.1 mg/L NAA+0.2 mg/L TDZ(處理1)時根狀莖增殖系數最高,但添加0.5 mg/L NAA+0.8 mg/L TDZ(處理7)時增殖系數明顯降低至3.00。
通過極差分析得出:在根狀莖生長速度指標中,3種影響因素的主次關系為:6-BA>NAA> TDZ,6-BA濃度之間的關系5 mg/L 6-BA>8 mg/L 6-BA>2 mg/L 6-BA。在增殖系數的指標中,3種因素的主次關系為NAA>TDZ>6-BA,NAA濃度之間的關系是0.1 mg/L NAA>0.3 mg/L NAA> 0.5 mg/L NAA。最有利于根狀莖生長的培養基為:8 mg/L 6-BA+0.1 mg/L NAA+0.2 mg/L TDZ;有利于提高根狀莖增殖系數的培養基為:5 mg/L 6-BA+0.1 mg/L NAA+0.2 mg/L TDZ。
由圖1可知,根狀莖接種在培養基上培養180 d后根狀莖數量明顯增加,并且新生根狀莖有分支出現(圖1)。處理1(圖1A)根狀莖粗壯、增殖數量較多。處理3(圖1B)根狀莖生長速度較高。處理7(圖1C)根狀莖生長速度和增殖的數量較低。
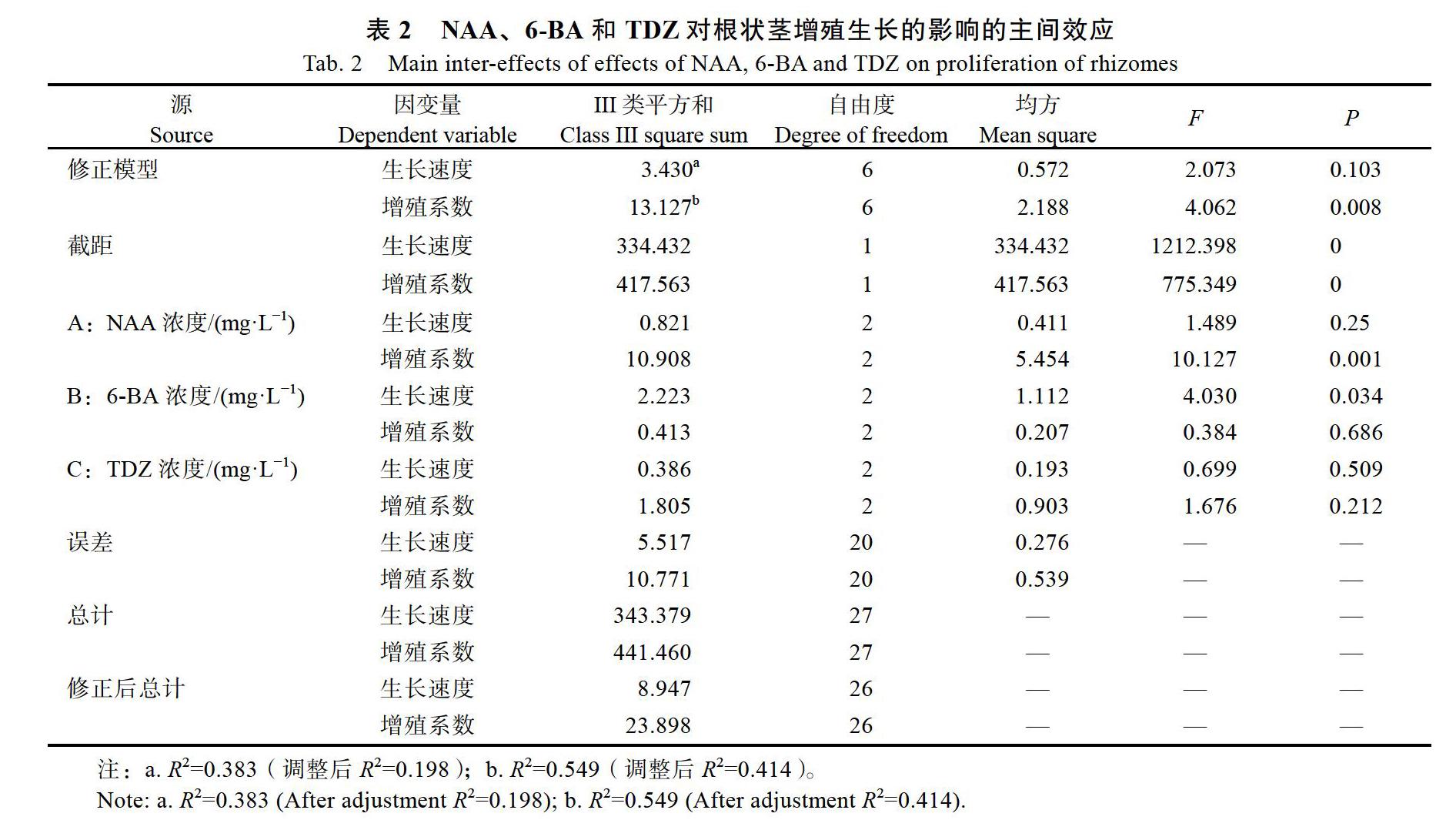
通過方差分析可知(表2),NAA和TDZ對根狀莖生長速度的影響不顯著。6-BA對根狀莖生長速度具有顯著性影響(P<0.05),LSD多重比較分析可知,2 mg/L 6-BA與5 mg/L 6-BA(P=0.026< 0.05)、2 mg/L 6-BA與8 mg/L 6-BA(P=0.021< 0.05)之間具有顯著性影響,5 mg/L 6-BA與8 mg/L 6-BA(P=0.925)不具有顯著性影響。NAA對根狀莖增殖系數的影響具有顯著性(P<0.01),6-BA和TDZ對增殖系數的影響不顯著(P>0.05)。進一步進行LSD多重比較分析可知,0.1 mg/L NAA與0.3 mg/L NAA(P=0.001<0.01)、0.1 mg/L NAA與0.5 mg/L NAA(P=0.001<0.01)具有顯著性差異,0.3 mg/L NAA與0.5 mg/L NAA(P= 0.688)無顯著性差異。
2.2? 6-BA、NAA和TDZ對根狀莖葉芽分化的影響
根狀莖接種在培養基中,暗培養30 d有明顯側枝生長(圖2A),培養120 d后,根狀莖進行轉綠生長并有葉芽分化,并形成植株(圖2B),培養180 d后芽數明顯增加,并生長狀態良好(圖2C、圖2D),到240 d后,植株高明顯,芽誘導數明顯提高(圖2E)。
由表3可知,當6-BA為10 mg/L,添加0.2 mg/L TDZ和0.7 mg/L NAA時葉芽分化率最高,為52.50%,并且高于其他組合,即處理8;但添加0.8 mg/L TDZ和0.5 mg/L NAA時芽分化率僅次最高值,葉芽分化率為40%,即處理5。當6-BA降至8.0 mg/L時,組合為8 mg/L 6-BA+ 0.3 mg/L NAA+0.2 mg/L TDZ略低于處理5,處中間值葉芽分化率達37.50%。
由極差分析得出,適宜誘導根狀莖葉芽分化及株高的組合為10 mg/L 6-BA+0.7 mg/L NAA+ 0.2 mg/L TDZ,葉芽分化影響因素的主次關系為:6-BA>TDZ>NAA,6-BA濃度之間的關系10 mg/L 6-BA>12 mg/L 6-BA>8 mg/L 6-BA。因此,當6-BA含量由小到大逐漸增大時,K值先增大后減小,說明墨蘭6-BA對墨蘭葉芽分化的影響先增大后減小。
通過NAA、6-BA和TDZ對葉芽分化率的主間效應檢驗可知(表4),NAA、TDZ對墨蘭葉芽分化的影響不顯著,6-BA對葉芽分化的影響具有顯著性(P<0.05)。進行LSD多重比較分析可知,8 mg/L 6-BA和10 mg/L 6-BA(P=0.016<0.05)之間差異顯著,8 mg/L 6-BA與12 mg/L 6-BA(P= 0.474)、10 mg/L 6-BA與12 mg/L 6-BA(P=0.059)之間差異不顯著。
2.3? 蛋白胨、椰子汁和活性炭對根狀莖葉芽分化的影響
由表5可知,處理8的添加物組合為7 g/L蛋白胨+100 mL/L CW+1.0 g/L AC,葉芽分化率最高,達173.30%,并顯著高于其他組合。處理2的添加物組合為1 g/L蛋白胨+100 mL/L CW+ 1.5 g/L AC,葉芽分化率最低,為26.70%。通過極差分析可知,適宜誘導芽分化的有機物配比為7 g/L蛋白胨+50 mL/L CW+1.0 g/L AC,3種因素之間的主次關系為AC>蛋白胨>CW,AC濃度之間的關系為1.0 g/L AC>2.0 g/L AC>0.5 g/L AC。因此,當AC含量由小到大逐漸增加時,K值先減小后增大,說明活性炭濃度對墨蘭根狀莖的影響先減小后增大。
雜交墨蘭根狀莖接種在培養基上,暗培養30 d后,根狀莖有明顯萌動,并且向下生長(圖3A);接種培養90 d后,墨蘭根狀莖有明顯芽分化,形成一定高度的植株(圖3B);180 d后有大量植株形成,生長狀況良好(圖3C);并且在不同培養基中,處理8的葉芽分化率最高(圖3F),處理2中的葉芽分化率最低(圖3E),處理1的葉芽分化率處于中間值(圖3D)。
通過蛋白胨、CW和AC對葉芽分化率的主間效應檢驗可知(表6),蛋白胨和活性炭對葉芽分化的影響具有顯著性(P<0.05),CW對葉芽分化的影響不顯著(P>0.05)。進行LSD多重比較分析可知,1 g/L蛋白胨與4 g/L蛋白胨(P=0.01< 0.05)、1 g/L蛋白胨與7 g/L蛋白胨(P=0.000< 0.001)和7 g/L蛋白胨與4 g/L蛋白胨(P=0.04< 0.05)之間存在顯著性差異。1.0 g/L AC與2.0 g/L AC(P=0.000<0.05)、1.0 g/L AC與1.5 g/L AC(P=0.000<0.001)之間具有顯著性差異,1.5 g/L AC與2.0 g/L AC(P=0.326<0.05)之間差異不顯著。
3? 討論
組織培養是進行大量種苗繁殖的重要手段,一般包括誘導、增殖、分化、生根煉苗4個階段。目前,關于墨蘭組織培養的研究已經有許多相關報道,并主要以墨蘭根狀莖為試驗材料。但墨蘭不同品種、不同外植體部位之間差異很大,并且對培養基的組合、培養環境的要求都不盡相同。目前,在部分墨蘭的組培繁殖研究中,以自交品種的根狀莖為試驗材料[2, 4],本研究以‘吳字翠× 墨蘭‘紅花雜交種子無菌播種誘導出的根狀莖為試驗材料,相對自交品種繁殖周期長,生長速度較慢,增殖系數較低,芽誘導率較低,但選用雜交品種的根狀莖為材料有利于選育優良品種,促進墨蘭產業化生產。因此,本研究通過對墨蘭根狀莖增殖分化的研究,探討不同培養基對墨蘭根狀莖增殖分化的影響。
3.1? 激素在墨蘭根狀莖增殖階段的作用
組織培養增殖階段對細胞分裂素的需求低于生長素,同時要保持生長素和細胞分裂素之間的平衡;大多數植物激素在調控植物生長發育過程中的作用比較復雜,同一種激素可調控影響多個發育過程,一個生長發育過程需要多種激素共同作用于植物[14]。相關研究表明,一定濃度范圍6-BA(1~2 mg/L)、NAA(0.1~1.0 mg/L)組合有利于增殖,增殖系數達5.9[15]、7.4[2]、8.3[4]等,并且TDZ對根狀莖增殖也有促進作用。劉昳雯等[16]提到激素配比為2.0 mg/L TDZ+0.3 mg/L NAA最適宜蓮瓣蘭‘滇梅(C. tortisepalum ‘Dian Mei)增殖。
本研究中6-BA、NAA和TDZ的激素配比有利于墨蘭根狀莖增殖,6-BA使用濃度與前人的研究有所不同,適宜濃度范圍為2~8 mg/L,在后期生長起主要主導作用,其最適濃度為5.0 mg/L;NAA對根狀莖增殖起主導作用,其濃度0.1 mg/L與以上結果接近;TDZ的作用不顯著,并未取得較好的進展。與劉昳雯的結果不同,對此還需進一步實驗確定。當2.0 mg/L 6-BA、0.1 mg/L NAA和0.2 mg/L TDZ組合配比時,增殖系數達5.35,這一結果進一步確定一定濃度6-BA、NAA和TDZ有利于根狀莖增殖,雖然激素配比與丁雪珍[4]的結果接近,與其他品種研究結果相比較低,但高于左利娟等[3]的研究結果。這可能與不同品種之間存在差異有關,本研究雜交品種相較其他品種生長周期長、增殖系數低。
3.2? 激素在墨蘭葉芽分化階段的作用
在葉芽分化的相關研究中,墨蘭根狀莖存在芽分化較低的問題,6-BA對葉芽的影響高于NAA,同時TDZ有利于芽分化,但其添加組合濃度各不相同,6-BA使用濃度范圍較廣為(1~ 10 mg/L),NAA為(0.5~1.0 mg/L)[5-12],葉芽分化率達0.8[11]、1.8[7]、2.9[10]、6.43[9]。
本研究中6-BA對墨蘭葉芽分化起主要主導作用,6-BA濃度范圍(8~10 mg/L)、NAA(0.3~ 0.7 mg/L)與以上研究接近,但與前人研究不同,6-BA濃度更廣。當激素組合為10 mg/L 6-BA+ 0.7 mg/L NAA時葉芽分化率達52.50%,當激素組合為8 mg/L 6-BA+0.3 mg/L NAA時葉芽分化率達37.50%,研究結果與朱根發[8]的接近,這一結果表明,高濃度(8~10 mg/L)6-BA有利于葉芽分化,但可能與不同品種之間存在差異有關,并且對培養基的要求也不同,其葉芽分化率較低。
3.3? 其他添加物對墨蘭葉芽分化的作用
在相關研究中表明,100 mL/L CW能改變培養基中的滲透壓提高蔗糖含量[9];于1/4 MS培養基中添加椰奶、馬鈴薯粉、蛋白胨和AC有利于花芽分化[17-18];加入活性炭會降低細胞分裂素的有效活性[19];陳云喜等[20]發現100 mL/L CW對芽分化有促進作用,活性炭對分化有抑制作用;陳蘭芳[5]等表明培養基為MS+0.1 mg/L KT+1.0 mg/L NAA+100 ml/L CM+0.3 g/L活性炭,葉芽分化率達56%;Zeng等[21]提到添加1.0 ml/L NAA,1.0 g/L蛋白胨,10% CW和1.0 g/L AC有利于兜蘭(Pap hiopedilum wardii Sumerh.)的芽培養;羅虹[22]指出活性炭明顯抑制了墨蘭分化,對增殖和生根壯苗階段起促進作用。翁錦周等[23]研究發現MS+ 3.0 mg/L BA+0.5 mg/L NAA+4.0 g/L活性炭適合于不定芽分化。以上研究表明1.0 g/L AC和100 ml/L CW及1.0 g/L蛋白胨的添加有利于葉芽分化。
本研究結果表明1.0 g/L活性炭對葉芽分化起主導作用并具有顯著性影響,蛋白胨對葉芽分化具有顯著性影響,最適宜葉芽誘導的添加物組合7 g/L蛋白胨+100 mg/L CW+1.0 g/L AC,與Zeng等[21]結論接近,但蛋白胨濃度有所不同為7 g/L;本研究中CW對葉芽分化不具有顯著性影響與陳云喜等[20]和陳蘭芬等[5]研究結果不同,葉芽分化率高于陳蘭芳的研究結果。過高含量的活性炭會抑制葉芽分化與羅虹[22]研究結果活性炭明顯抑制葉芽分化類似。因此,一定濃度6-BA、NAA、活性炭和蛋白胨能夠提高葉芽分化率,但過高含量的活性炭會抑制葉芽分化,會導致芽誘導數降低,活性炭的適宜濃度為1.0 g/L。
4? 結論
本研究通過添加外源激素和其他添加物對雜交墨蘭根狀莖進行誘導繁殖,結果表明NAA對根狀莖增殖影響具有顯著性,且較高濃度6-BA(2.0~8.0 mg/L)有利于根狀莖后期生長。最適宜根狀莖增殖的培養基組合為MS+2 mg/L 6- BA+0.1 mg/L NAA+0.2 mg/L TDZ+1.5 g/L AC+ 35.0 g/L Su+6.0 g/L Ag,增殖系數達5.35。在雜交墨蘭根狀莖葉芽分化階段,6-BA起主要影響作用,在一定范圍濃度內6-BA(8.0~10.0 mg/L)有利于葉芽分化,最適宜葉芽分化的培養基為MS+10.0 mg/L 6-BA+0.7 mg/L NAA+0.2 mg/L TDZ+1.5 g/L AC+35.0 g/L Su+6.0 g/L Ag,葉芽分化率為52.5%。其他添加物對葉芽分化有影響作用,1.0 g/L活性炭起主導因素。雜交墨蘭根狀莖葉芽分化最適宜的培養基為MS+8.0 mg/L 6-BA+0.1 mg/L NAA+7.0 g/L蛋白胨+100.0 mg/L CW+1.0 g/L AC,葉芽分化率為173.30%,株高達3.58 cm。
參考文獻
陳? 麗, 潘瑞熾, 陳汝民. 墨蘭原球莖生長的研究[J]. 熱帶亞熱帶植物學報, 1999(1): 59-64.
施福軍, 莫昭展, 韋江萍, 等. 墨蘭的無菌播種及根狀莖的增殖研究[J]. 安徽農業科學, 2008, 36(32): 13968-13969, 13992.
左利娟, 湯久楊, 李志強. 墨蘭雜交及F1代離體培養研究[J]. 北京農業職業學院學報, 2017, 31(3): 22-25.
丁雪珍, 韓? 磊, 張文靜. 墨蘭增殖培養基的篩選研究[J]. 北方園藝, 2009(8): 208-209.
陳蘭芬, 王? 晶, 田亦平, 等. 墨蘭組織培養根狀莖分化技術研究[J]. 河北林果研究, 2011, 26(1): 22-24.
魯雪華, 郭文杰, 林? 勇. 墨蘭的無菌播種和植株再生[J]. 亞熱帶植物科學, 1999(1): 34-37.
傅雪琳, 張志勝, 何? 平, 等. 墨蘭根狀莖綠芽分化的研究[J]. 華南農業大學學報, 2000(3): 53-55.
朱根發, 葉秀斌, 陳明莉, 等. 培養基不同成分對墨蘭根狀莖分化成苗的影響[J]. 中南林學院學報, 2003(5): 42-44, 58.
許申平, 袁秀云, 王默霏, 等. 墨蘭(Cymbiduim sinense)組培快繁技術體系研究[J]. 熱帶作物學報, 2018, 39(5): 926-930.
Yan X, Feng-an Y U, Zhen-hua P. Tissue culture of Cymbidium sinensis[J]. Forest Research, 2003, 16(4): 434-438.
Chen Y Y, Zhang Y, Zhang C, et al. A study on aseptic seed germination of interspecific hybrid between Cymbidium hybrida × C. sinense and C. faberi[J]. Acta Horticulturae Sinica, 2009, 36(3): 441-446.
Gao R, Wu S Q, Piao X C, et al. Micropropagation of Cymbidium sinense using continuous and temporary airlift bioreactor systems[J]. Acta Physiologiae Plantarum, 2014, 36(1): 117-124.
Chang C, Chang W. Effect of thidiazuron on bud development of Cymbidium sinense Willd in vitro[J]. Plant Growth Regulation, 2000, 30(2): 171-175.
徐? 程, 詹忠根, 張? 銘. 中國蘭的組織培養[J]. 植物生理學通訊, 2002(2): 171-174.
鄭艷艷. 墨蘭組培體系的優化及根狀莖在生物反應器培養的研究[D]. 延吉: 延邊大學, 2011.
劉昳雯, 許春梅, 王? 丹, 等. 蓮瓣蘭“滇梅”根狀莖的增殖與分化技術研究[J]. 安徽農業科學, 2014, 42(10): 2890-2892.
Duan J X, Yazawa S. Floral induction and development in Phalaenopsis in vitro[J]. Plant Cell Tissue and Organ Culture, 1995, 43(1): 71-74.
Duan J X, Yazawa S. In vitro floral development in × Doriella Tiny (Doritis pulcherrima × Kingiella philippinensis)[J]. Scientia Horticulturae, 1994, 59(3-4): 253-264.
Duan J X, Yazawa S. In vitro flowering of Doriella, Phalaenopsis and Dendrobium[J]. Proceedings of NIOC, 1994: 87-96.
陳云喜, 何丹丹, 廖浩如, 等. 影響墨蘭×兔耳蘭根狀莖芽分化的因素[J]. 中國農學通報, 2010, 26(9): 65-69.
Zeng S, Wu K, da Silva J A T, et al. Asymbiotic seed germination, seedling development and reintroduction of Paphiopedilum wardii Sumerh., an endangered terrestrial orchid[J]. Scientia Horticulturae, 2012, 138: 198-209.
羅? 虹. 活性炭對墨蘭根狀莖生長的影響[J]. 廣東農業科學, 1998(1): 30-31.
翁錦周, 林加耕, 林江波. 不同濃度活性炭對墨蘭離體培養的影響[J]. 亞熱帶植物科學, 2006(3): 37-38, 36.

