轉移性癌性骨痛的分子機制及臨床治療研究進展
綜述 審校
中、晚期癌癥患者均伴有不同程度的疼痛,其中約44%為難以忍受的持續疼痛[1]。癌痛嚴重影響患者的生存質量并造成沉重的心理負擔。在所有癌性疼痛中,肺癌、乳腺癌、前列腺癌、腎癌及甲狀腺癌等骨轉移引起的骨破壞性骨痛是最為常見的癥狀[2-3]。轉移性癌性骨痛發病機制復雜,包括炎性疼痛及神經病理性疼痛等多種類型,涉及腫瘤細胞、免疫細胞、骨細胞和支配骨骼及骨髓的感覺神經元之間的相互作用。在治療上除了世界衛生組織(WHO)推薦的三階梯鎮痛方案外,雙磷酸鹽及神經調控等也被應用于癌性骨痛治療中。闡明癌性骨痛的分子機制對優化治療方案具有指導意義,本文將對癌性骨痛的發病機制及臨床治療進展進行綜述。
1 癌性骨痛分子機制
1.1 癌細胞和腫瘤基質細胞釋放致痛因子
在腫瘤微環境中,癌細胞及多種基質細胞,如內皮細胞、成纖維細胞及免疫細胞,可分泌多種細胞因子及趨化因子,其中許多為致痛因子,可激活痛覺感受器或誘發痛覺過敏[4]。這些致痛因子包括緩激肽、前列腺素(prostaglandin,PG)E2、大麻素、內皮素、白介素(IL-1β、IL-6、IL-8、IL-15)、集落刺激因子-1(colony-stimulating factor,CSF-1)、趨化因子5(C-C motif chemokine ligand 5,CCL5)、單核細胞趨化蛋白-1(monocyte chemoattractant protein-1,MCP-1)、神經生長因子(nerve grow factor,NGF)、腫瘤壞死因子(tumor necrosis factor,TNF)-α和細胞外ATP等[5]。而在支配骨骼的感覺神經纖維表面有豐富的致痛因子受體和離子通道表達,包括內皮素受體、PG 受體、原肌球蛋白相關激酶A(tropomyosin-related kinase A,TrkA)、緩激肽受體、細胞因子受體、趨化因子受體和嘌呤能受體(P2X3)等[6]。當致痛因子與感覺神經纖維末梢表達的受體及離子通道結合后,可激活痛覺神經元,從而將傷害信號傳遞到脊髓,然后通過上行系統投射到大腦皮層產生痛覺(圖1)。
1.2 腫瘤細胞促進破骨細胞異常活化
生理情況下,骨重塑取決于破骨細胞骨吸收與成骨細胞骨新生之間的平衡。腫瘤骨轉移時,此生理性平衡被打破,存在破骨細胞和/或成骨細胞的異常激活[7]。破骨細胞的增殖和分化主要受核因子κB受體活化因子配體(receptor activator for nuclear factor kappa B ligand,RANKL)/RANK通路調節。腫瘤微環境中,腫瘤細胞和T細胞等免疫細胞也會分泌RANKL,另外腫瘤細胞可分泌甲狀旁腺激素相關蛋白(parathyroid hormone-related protein,PTHrP)、IL-11等促進成骨細胞表面RANKL表達。升高的RANKL與CSF-1結合后激活其受體RANK從而促進骨髓腫瘤免疫微環境中破骨細胞的分化與成熟。成熟的破骨細胞與骨骼表面緊閉連接形成封閉槽,通過釋放大量的H+,進一步激活酒石酸抗酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)及組織蛋白酶K(cathepsin K,CatK),從而溶解吸收骨骼[8]。吸收槽中H+可作用于骨膜表面感覺神經纖維末梢表達的瞬時受體電位通道1(transient receptor potential channel 1,TRPV1)及酸敏感離子通道3(acid-sensing ion channel 3,ASIC3),從而驅動癌性骨痛的發生及發展(圖1)[9]。
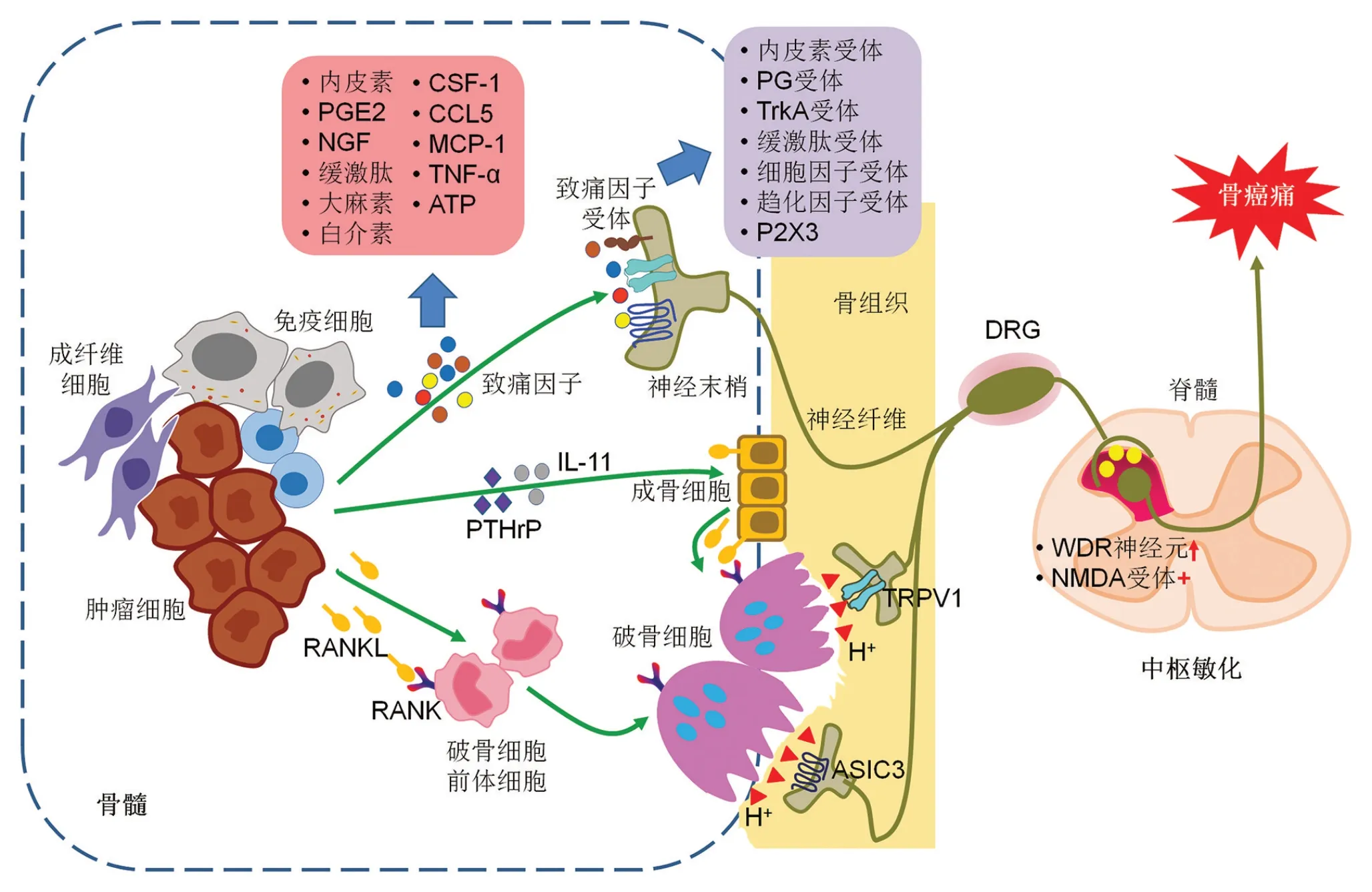
圖1 轉移性癌性骨痛的分子機制
1.3 中樞敏化
在轉移性癌性骨痛中,背根神經節(dorsal root ganglia,DRG)及脊髓背角神經元存在特殊的神經化學性變化[10],提示外周腫瘤與神經纖維末梢相互作用傳遞疼痛信號進入脊髓后引起中樞敏化,促進癌性疼痛的進展和維持[11]。脊髓切片膜片鉗記錄結果顯示,癌性骨痛動物模型脊髓神經元對誘發的刺激表現出增強的反應,表明神經元的總體興奮性增強[12]。相較于正常動物,癌性骨痛動物模型中寬動態范圍(wide dynamic range,WDR)神經元與傷害感受特異性神經元比例增加,表明脊髓背角淺層神經元的感受野增加,從而導致中樞對傳入的低閾值傷害信息作出反應的概率增加,產生中樞敏化[13]。此外,作為中樞性神經遞質谷氨酸的受體,谷氨酸的N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)受體在中樞敏化中也發揮作用。NMDA 受體的持續激活會引發“上發條”(wind-up)現象,即使外周輸入信號不變,NMDA 受體也會呈現出4~5 倍過度激活狀態,這是中樞敏化的另一重要基礎(圖1)。
2 癌性骨痛的評估
對于轉移性癌性骨痛患者,進行充分的疼痛評估是合理、有效鎮痛治療的前提,應當遵循“常規、量化、全面、動態”的癌痛評估原則[14]。骨痛的評估包括疼痛強度、功能影響及對鎮痛藥反應等方面[15]。對于認知功能完好的患者,疼痛強度可采用數字評分量表,范圍從0(無疼痛)到10(可想象的最嚴重的疼痛)。此外還可以使用分類量表或視覺模擬量表(無疼痛、輕度疼痛、中度疼痛或重度疼痛)。對認知功能受損的患者,臨床醫師應注重患者非言語的身體不適表現,如煩躁、表情痛苦、運動功能障礙等,同時觀察鎮痛藥物劑量滴定時患者反應的改善。此外,應重視癌癥患者生存質量(qulity of life,QOL)評分中疼痛程度與睡眠精神狀態的相互聯系,鼓勵患者撰寫疼痛日記,可為醫師判斷患者治療依從性及癥狀轉歸提供重要臨床線索[15]。
3 轉移性癌性骨痛的臨床治療
3.1 藥物治療
3.1.1 非甾體類抗炎藥 非甾體類抗炎藥(nonsteroidal anti-inflammatory drugs,NSAIDs)基本機制為抑制參與前列腺素生成的環加氧酶(cyclooxygenase,COX)活性,從而產生抗炎、鎮痛、解熱等作用。動物研究表明,長期應用COX-2 抑制劑也可減輕腫瘤負擔,從而進一步緩解癌性骨痛[16]。一項臨床薈萃分析表明,盡管NSAIDs 較安慰劑能顯著降低癌癥相關的疼痛,但其在癌性骨痛中的作用仍有待評價。由于NSAIDs 類藥物鎮痛效果弱、作用時間短及易引發胃腸道不良反應,其在臨床中的治療作用較為有限[17]。對于輕度疼痛(數字評分量表中評分<4分)患者,建議使用非阿片類鎮痛藥,如對乙酰氨基酚單獨或聯合其他NSAIDs[14,18]。
3.1.2 阿片類藥物 阿片類藥物是癌性骨痛治療中應用最為廣泛的藥物之一,給藥方式包括口服、經皮、肌肉、靜脈及鞘內給藥。其主要不良反應包括藥物耐受、過度鎮靜、便秘、惡心嘔吐和呼吸抑制[19]。研究表明,長期大量應用嗎啡可能促進腫瘤進展,并且是患者不良預后的危險因素[20-21]。因此,臨床上應采用基于基因測序的藥物基因組學分析,制定個體化治療方案,可通過使用最小劑量的阿片類藥物發揮最佳的止痛效果,同時減少不良反應。
阿片類藥物鞘內給藥時可聯合羅哌卡因或氯胺酮等其他藥物,以產生協同效應。鞘內植入鎮痛泵時應注意穿刺點局部骨組織腫瘤浸潤、鞘內出血及局部感染等禁忌證及風險。由于目前相關臨床報道多為非對照研究,因此需要多中心、隨機對照臨床試驗進一步評估阿片類藥物通過脊髓途徑給藥的療效和安全性[22]。
3.1.3 破骨細胞抑制劑 1)雙膦酸鹽:雙磷酸鹽可直接促進破骨細胞凋亡。雙磷酸鹽與被吸收的骨組織緊密結合并被破骨細胞內吞進入胞內,通過干擾ATP 能量代謝或甲羥戊酸途徑引起破骨細胞功能障礙,最終導致破骨細胞凋亡。在腫瘤骨轉移過程中,雙磷酸鹽可改善局部腫瘤骨骼組織的酸性微環境,減少骨破壞及酸敏感離子通道的活化,從而緩解癌性骨痛并降低骨骼相關事件(skeletal-related events,SRE)的風險。其不良反應主要包括腎功能下降及頜骨壞死,臨床應用中應密切監測。一項隨機臨床試驗顯示,靜脈注射4 mg 伊班膦酸可使前列腺癌患者的總體疼痛減輕,與單劑量放療療效相當[23]。對于乳腺癌骨轉移患者,唑來膦酸每12 周1 次的治療方案與每4 周1 次治療方案對于改善患者SRE 的效果并無差異,提示可通過減少唑來膦酸的用量以控制其不良反應[24]。由于在實體瘤(主要為乳腺癌和前列腺癌)以及多發性骨髓瘤引起的骨轉移中,雙磷酸鹽單獨短期使用可改善癌性骨痛的證據尚不充分,故臨床中雙磷酸鹽應聯合鎮痛藥物使用[14]。2)地諾單抗:地諾單抗是一種合成的人類單克隆抗體,可與RANKL 結合以阻止其與RANK 相互作用[25]。由于RANKL/RANK信號通路激活是生理和腫瘤病理情況下破骨細胞增殖和分化的必要條件,地諾單抗可抑制破骨細胞分化及功能,從而減少癌性骨痛和腫瘤引起的病理性骨折,改善骨轉移患者生存質量。根據歐洲醫學腫瘤學會(ESMO)指南,地諾單抗可作為實體瘤和骨髓瘤骨轉移時雙膦酸鹽的替代用藥。一項針對乳腺癌骨轉移患者的多中心臨床試驗表明,與唑來膦酸相比,地諾單抗可更為有效地預防并延緩骨痛發展,同時減少阿片類藥物的使用量[26]。另一項臨床試驗中,與雙膦酸鹽相比,盡管地諾單抗不能減少多發性骨髓瘤患者骨痛程度及時間,但其可降低SRE 風險并促進功能恢復[27]。對于絕經后乳腺癌患者,地諾單抗還可有效預防并減少內分泌輔助治療所引起的骨質疏松及骨折風險[28]。需指出的是,臨床使用地諾單抗時應密切監測頜骨壞死及顎骨壞死等嚴重并發癥[29]。
3.1.4 NGF 阻斷劑 由于腫瘤細胞及其基質細胞釋放的NGF 可作用于神經纖維末梢TrkA 受體誘發骨痛,并介導神經纖維病理性增生,因此阻斷NGF/TrkA信號通路可能緩解癌性骨痛。一項臨床前動物研究證實,NGF/TrkA 拮抗劑可減少腫瘤引起的神經出芽或神經瘤的形成[30]。tanezumab是一種重組人源化單克隆抗體,可結合循環及局部組織中的NGF,從而阻止其與TrkA 受體和p75受體相互作用[31]。研究者已在肌肉骨骼慢性非癌性疼痛患者中進行了廣泛的tanezumab 相關研究。一項臨床試驗表明,與安慰劑和NSAIDs類藥物相比,tanezumab可有效緩解骨性關節炎痛及下背部疼痛,且無NSAIDs 類藥物不良反應[31]。在癌性骨痛領域,兩項臨床試驗前期數據結果顯示,tanezumab聯合嗎啡,可提供嗎啡鎮痛之外持續的鎮痛作用,同時不增加嗎啡的不良反應[32]。目前,tanezumab在癌性疼痛治療中應用的報道較少,尚需要更多臨床研究進一步觀察及評價。
3.2 非藥物治療
3.2.1 放射療法 放射療法(radiotherapy,RT)在轉移性癌性骨痛和轉移性脊髓壓迫(metastatic spinal cord compression,mSCC)治療中療效顯著[33],被常用于控制癌痛的非藥物治療[15]。多項研究表明,RT 可緩解60%~80%患者的疼痛癥狀,完全緩解者可達30%[34]。根據WHO 建議,RT 可有效減少鎮痛藥使用、預防病理性骨折并改善生存質量。目前常用的RT 方法包括外照射放射治療(external beam radiotherapy,EBRT)、半身照射(half body irradiation,HBI)和放射性藥物[35],其中EBRT應用最為廣泛且疼痛緩解效果確切。美國放射腫瘤學會(ASTRO)匯總多項隨機臨床試驗發現,EBRT應用不同放療劑量緩解疼痛時具有等效性[36]。對于轉移性癌性骨痛患者,最佳的放射方案為8 Gy單劑量照射[14]。放射性同位素治療對多部位骨轉移引起的癌痛同樣具有顯著的緩解作用。有研究系統評估了鍶、釤或錸對轉移性癌性骨痛的治療效果[37],在短期和中期(1~6 個月)時間內,放射性同位素治療可在不改變鎮痛藥物使用方案的情況下,提供更多的疼痛控制,同時不增加白細胞減少和血小板減少等常見不良反應的發生率。在前列腺癌中,一項隨機試驗評估了鐳223對轉移性前列腺癌轉移性骨痛的治療效果,發現鐳233可顯著降低SRE發生率、緩解患者疼痛癥狀并提高患者生存質量以及生存率,目前鐳223為前列腺癌放射性同位素治療的首選[38]。
3.2.2 神經阻滯或神經損毀 神經阻滯或損毀會導致疼痛傳導通路的阻斷和破壞,從而抑制信號通過脊髓傳遞至大腦。阻滯的程度取決于疼痛的嚴重程度,具體方法包括脊髓或丘腦切開術,以及在神經節上注射神經溶解物質進行微創治療。與藥物治療相比,介入治療對耐藥及難治性骨痛患者可有效緩解疼痛,且作用時間持久。一項應用神經溶解性交感神經切除術治療骨盆癌痛的多中心隨機對照臨床研究表明,早期接受介入治療患者較晚期接受治療者的口服鎮痛藥劑量顯著降低,且疼痛控制及生存質量明顯改善,提示盡早行神經阻滯治療可使患者受益增加。同時需要注意,神經破壞及阻滯可引起不可逆性神經損傷,會導致麻木、虛弱、感覺異常、神經認知障礙等并發癥[39]。因此應嚴格選擇適應證,權衡風險與收益,并密切監測及治療可能的并發癥。
3.2.3 脊髓電刺激 電神經調節是腫瘤骨轉移患者疼痛的第三種非藥物治療方式。該方法包括對周圍神經的電刺激以及對脊髓背角和大腦的電刺激。脊髓電刺激最早應用于神經性疼痛的治療,如蛛網膜炎相關性疼痛,但在感覺傷害性疼痛方面并未得以充分應用。脊髓電刺激可使癌性骨痛患者疼痛程度降低60%左右,從而改善其3年或更長時間的生存質量[40],因此脊髓電刺激在癌痛治療尤其是難治性癌痛治療中有廣泛的應用前景。
4 結語
綜上所述,癌性骨痛的機制復雜,并且會隨著癌癥的進展而發展。腫瘤骨轉移及骨痛可誘發病理性骨折等不良事件,對總體功能和生存質量產生負面影響,并使預后惡化。目前仍缺乏以疼痛為首要觀察指標的高質量、多中心、隨機對照的臨床試驗。因此應針對不同的疼痛機制和疾病階段采用個體化及多模式的治療策略,以實現最佳的疼痛緩解、改善生存質量并最終延長患者生存期。

