張弓老酒大曲中耐高溫酵母菌的分離鑒定及發酵條件優化
劉延波,程莉莉,趙志軍,候文靜,潘春梅,*,孫西玉
(1.河南牧業經濟學院食品與生物工程學院(酒業學院),河南鄭州 450046; 2.河南牧業經濟學院河南省白酒風格工程技術研究中心,河南鄭州 450046; 3.河南牧業經濟學院鄭州市白酒釀造微生物技術重點實驗室,河南鄭州 450046; 4.張弓老酒酒業有限公司,河南寧陵 476733)
大曲是釀制傳統白酒的糖化劑、發酵劑和增香劑,含有多種微生物,在釀造過程中起著重要的糖化、發酵和生香的作用,直接或間接影響白酒的產量、質量和風格[1]。濃香型白酒大曲的制作工藝為自然發酵,富集了原材料和環境中的微生物,微生物區系十分復雜[2]。酵母菌是白酒釀造微生物家族中不可或缺的一類微生物,從白酒制曲到釀造過程一直可以檢測出,直接關系到產酒率[3]。
酵母菌種特性的要求是在高溫、高滲、高糖、高pH、高酒精度等極端條件下仍具有較高的發酵能力。傳統釀酒的酵母最適發酵溫度為28~33 ℃[4],一般不超過36 ℃,但夏季生產時,室溫在35~40 ℃之間,此時酵母菌的生長、繁殖、代謝均受到抑制,有些酵母菌甚至因不耐高溫,出現死亡現象,這嚴重影響了夏季白酒生產的產量[5]。許多酒廠選擇壓排度夏,給生產帶來極大的不便,更大大降低了設備和廠房等的利用率[6]。目前,耐高溫酵母研究較多,但大都篩選自土壤[7-8],從大曲中篩選耐高溫酵母的研究少有報道;因此,研究耐高溫酵母菌株對白酒釀造和發酵工業具有重要的理論及實際意義。
本研究從張弓老酒中高溫大曲中篩選出耐高溫的酵母菌,并對該菌進行耐高溫和耐乙醇性以及發酵性能測試和響應面法優化發酵條件,以期得到一株耐高溫耐乙醇且高產酒精的酵母菌,為建立和開發中原濃香型白酒酵母菌菌種資源庫提供理論依據。
1 材料與方法
1.1 材料與儀器
中高溫大曲曲樣 張弓老酒酒業有限公司;葡萄糖 天津市科密歐化學試劑有限公司;酵母粉、蛋白胨 英國Oxoid公司;KH2PO4、(NH)2SO4、MgSO4天津大學科威公司。
SW-CJ-2FD型雙人單面凈化工作臺 浙江孚夏醫療科技有限公司;DNP-9272BS-Ⅲ電熱恒溫培養箱 上海新苗醫療器械制造有限公司;LQZ-211恒溫振蕩培養箱 上海知楚儀器有限公司;LDZX-50KBS立式高壓滅菌鍋 上海申安醫療器械廠;721分光光度計 上海菁華科技儀器有限公司;H1850R高速離心機 湖南湘儀實驗室儀器開發有限公司。
1.2 實驗方法
1.2.1 培養基的配制 富集培養基(豆芽汁培養基):稱取新鮮黃豆芽100 g,置于燒杯中,再加入1000 mL水,小火煮沸30 min,用紗布過濾,補足失水,制成10%豆芽汁,再按每100 mL豆芽汁加入5 g葡萄糖,繼續加熱至葡萄糖溶化,補足失水,pH自然。分裝、包扎,121 ℃滅菌20 min。
分離培養基(YEPD):蛋白胨20 g,酵母浸粉10 g,葡萄糖20 g,蒸餾水定容至1000 mL,pH自然,121 ℃下滅菌20 min。配制YEPD固體培養基時加入20 g/L的瓊脂粉[9]。
發酵培養基:蛋白胨20 g,酵母浸粉10 g,葡萄糖100 g,硫酸鎂1 g,硫酸銨1 g,磷酸二氫鉀1 g,蒸餾水定容至1000 mL,pH自然,121 ℃下滅菌20 min[9]。
1.2.2 張弓老酒大曲中酵母菌的分離純化 取大曲樣品5 g,以無菌操作加入到195 mL富集培養基中加滅菌玻璃珠,于28 ℃,150 r/min,恒溫搖床培養48 h。取富集菌液進行10倍梯度稀釋,依次得到10-1~10-7的7個梯度稀釋液。吸取10-5、10-6、10-7梯度稀釋液各200 μL,均勻涂布于YEPD固體培養基平皿上,于28 ℃恒溫培養箱培養48 h后,選取形態適宜的菌落通過美藍染色法進行鏡檢,根據菌落特征及鏡檢確認為酵母菌后,挑取單菌落在YEPD固體培養基平皿上進行平板劃線,得到單菌落后,與20%滅菌甘油按1∶1體積注入凍存管混勻,在-20 ℃冰箱保存。
1.2.3 耐高溫酵母菌的篩選 將每株保藏的菌種以相同接種量接種至裝有10 mL YEPD液體培養基的試管中,于28 ℃,150 r/min,恒溫搖床培養24 h。在超凈工作臺內,用接種環蘸取富集菌液一環在YEPD固體培養基平皿上進行平板劃線,于45 ℃恒溫培養箱培養,有菌落長出的平板對應菌株為耐高溫酵母菌。
1.2.4 耐高溫酵母菌的鑒定
1.2.4.1 形態學鑒定 將篩出的耐高溫酵母菌在YEPD固體培養基上進行涂布,在28 ℃恒溫培養箱培養48 h,記錄耐高溫酵母菌的基本形態特征,并通過美藍染色法進行制片,然后進行顯微鏡觀察。
1.2.4.2 分子生物學鑒定 26S rDNA序列分析:采用Ezup柱式酵母基因組DNA提取試劑盒提取分離菌株基因組DNA作為PCR反應的模板。基因擴增采用通用引物NL1(5′-GCATATCAATAAGCGGAGG AAAAG-3′)和NL4(5′-GGTCCGTGTTTCAAGACGG-3′),反應體系為50 μL(SanTaqPCRMix預混液25 μL,引物各2 μL,DNA模板2 μL,ddH2O 19 μL)。PCR擴增條件:94 ℃ 5 min;94 ℃ 40 s,53 ℃ 45 s,72 ℃ 45 s,35個循環;最后72 ℃延伸10 min。取3 μL PCR產物經1%瓊脂糖凝膠電泳,將PCR產物送上海生工生物工程有限公司進行測序,將測序所得到的特定序列,在NCBI上通過BLAST程序進行菌株同源性比對[10];最后用MEGA X 10.0.2軟件構建系統發育樹。
1.2.5 耐高溫酵母菌的耐高溫性研究 菌種活化后,吸取200 μL接種于9.8 mL的YEPD液體培養基,分別在溫度為33、35、37、40、42、45、48 ℃的條件下靜置培養24 h,通過OD660 nm值反映生長情況[11]。
1.2.6 耐高溫酵母菌的耐乙醇性研究 菌種活化后,吸取200 μL分別接種于乙醇濃度為0、3%、6%、9%、12%的9.8 mL YEPD液體培養基試管中,在37 ℃靜置培養24 h,通過OD660 nm值反映生長情況。
1.2.7 耐高溫酵母發酵力測定 菌種活化后,吸取2 mL接種于98 mL發酵培養基中,在40 ℃下靜置培養,每隔2 h測一次CO2失重量,記錄發酵終止時間,并使用蒸餾-酒精計法測定發酵結束后發酵液的酒精度[12]。
1.2.8 單因素實驗
1.2.8.1 溫度 菌種活化后,吸取2 mL接種于pH自然、糖濃度為100 g/L的98 mL發酵培養基中,分別在溫度為28、31、34、37、40、43 ℃的條件下靜置培養72 h,通過CO2失重量反映發酵情況[13]。
1.2.8.2 pH 菌種活化后,吸取2 mL分別接種于糖濃度為100 g/L、pH為4.0、4.5、5.0、5.5、6.0、6.5、7.0的98 mL發酵培養基中,在最適發酵溫度下靜置培養72 h,通過CO2失重量反映發酵情況。
1.2.8.3 葡萄糖濃度 菌種活化后,吸取2 mL分別接種于最適pH、葡萄糖濃度為80、100、120、140、160、180 g/L的98 mL發酵培養基中,在最適發酵溫度下靜置培養72 h,通過CO2失重量反映發酵情況。
1.2.8.4 接種量 菌種活化后,分別吸取含有8%、10%、12%、14%、16%的上述菌液2 mL接種于在最適糖濃度和最適pH的發酵培養基中,在最適發酵溫度下靜置培養72 h,通過CO2失重量反映發酵情況。
1.2.9 響應面試驗 根據單因素試驗結果,進行方差分析選出三個顯著性比較明顯的三個因素[14];以發酵溫度(A)、初始pH(B)、葡萄糖濃度(C)3個因素為自變量,將各自最優條件的范圍編碼為-1、0、1,響應面分析法的因素與水平表見表1,利用Design Expert 8.0.6軟件設計Box-Behnken試驗,確定耐高溫酵母菌株的最佳發酵工藝參數組合并進行試驗驗證[15]。
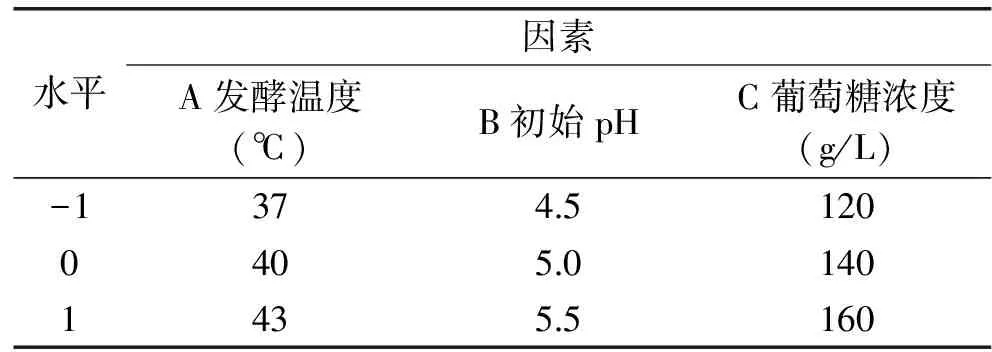
表1 響應面分析法的因素與水平表Table 1 Factors and levels of response surface analysis
1.3 數據處理
單因素試驗結果均用平均值±標準差表示,利用Design Expert 8.0.6軟件方差分析和設計BoxBehnken試驗,建立模型并進行多元回歸分析,所有實驗均重復3次,實驗數據處理以及顯著性分析采用Excel 2010。
2 結果與分析
2.1 大曲中耐高溫酵母菌的分離純化
通過豆芽汁培養基富集培養,YEPD固體培養基劃線分離,從大曲中篩出了100株酵母菌,又經45 ℃耐高溫培養最終篩選出一株菌落形態較好的耐高溫酵母菌,編號為ZG-3,如圖1所示。菌株ZG-3呈白色,菌落為圓形,邊緣整齊,表面光滑。
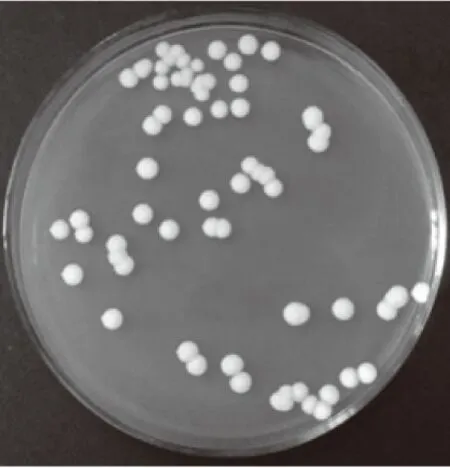
圖1 ZG-3菌落圖Fig.1 ZG-3 colony map
2.2 耐高溫酵母菌的鑒定
2.2.1 形態學鑒定 制作美藍染色涂片在顯微鏡下觀察菌株ZG-3,結果如圖2所示,菌體多呈卵圓形或圓形,并以芽殖的方式進行繁殖,存在單個或多個連接成串的菌體,結合菌落特征,可知ZG-3符合酵母菌形態[16]。
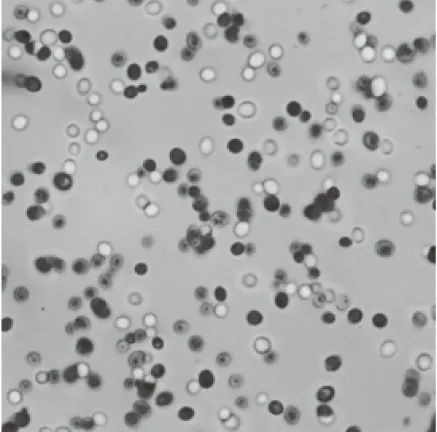
圖2 ZG-3鏡檢圖(100×)Fig.2 ZG-3 Microscopic view(100×)
2.2.2 分子生物學鑒定 將菌株ZG-3進行了PCR擴增,PCR擴增產物電泳圖如圖3所示。
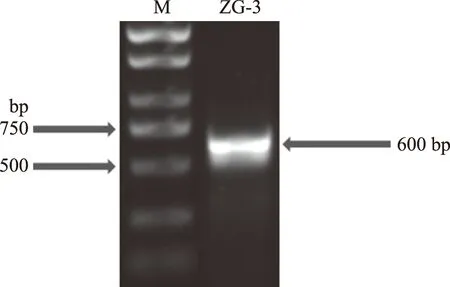
圖3 酵母菌26 S rDNA PCR擴增結果Fig.3 Yeast 26 S rDNA PCR amplification results注:M為DNA Marker,ZG-3為菌株。
經檢測ZG-3長度在600 bp,這與酵母菌的D1/D2區域序列長度相符合,說明擴增正常。將測序所得到的特定序列,在NCBI上通過Blast程序進行同源性比較與分析,采用MEGA X 10.0.2軟件中的鄰接(neighbor joining,NJ)法構建系統進化樹,結果見圖4,確定其與庫德里阿茲威畢赤酵母(Pichiakudriavzevii)相似性達100%,因此確定菌株ZG-3為庫德里阿茲威畢赤酵母。
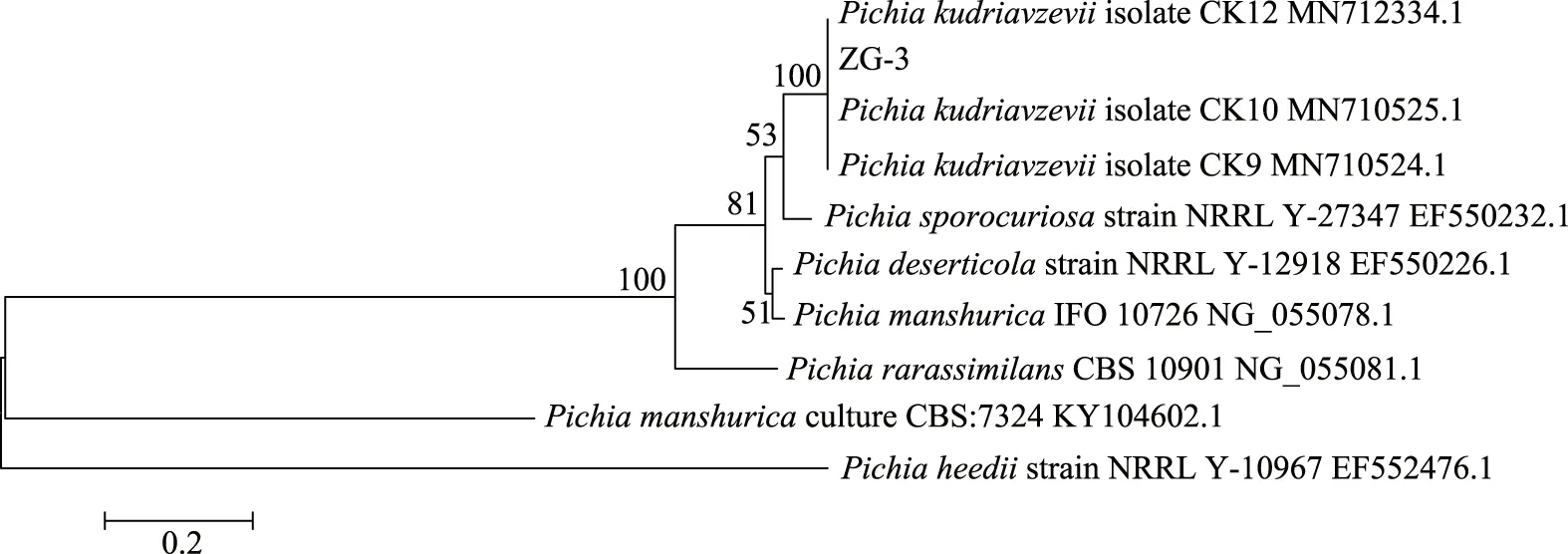
圖4 基于26S rDNA序列菌株ZG-3的系統發育樹Fig.4 Phylogenetic tree of strain ZG-3 based on 26S rDNA sequence
2.3 耐高溫酵母菌的性質研究
溫度在酵母的生長及發酵過程中起至關重要的作用。從圖5可得菌株ZG-3在YEPD液體培養基中33~37 ℃時對應的OD值呈上升趨勢,在37~48 ℃時呈下降趨勢,在37 ℃條件培養下菌體生長量最高,45 ℃時仍有菌體生長,而48 ℃時無菌體生長,因此菌株ZG-3的最適生長溫度為37 ℃,最高生長溫度為45 ℃。卜文靜等篩選出耐高溫釀酒酵母L-9a最高生長溫度40 ℃[17];譚才鄧等[18]篩選出一株耐高溫高鹽生香酵母菌PX-8,最高生長溫度40 ℃;李王強等[19]篩選的馬克思克魯維酵母菌A2-13、庫德畢赤酵母菌A2-1最高耐受溫度42 ℃;本實驗比他們所篩的耐高溫酵母菌耐高溫能力高;與石嬌嬌等[20]從自然發酵的甜面醬中篩選得到6株耐45 ℃高溫的生香酵母相比,耐高溫能力相當。
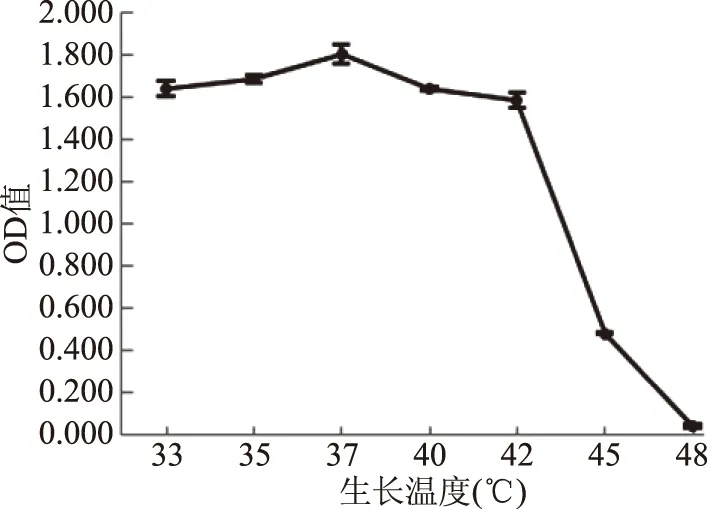
圖5 溫度對酵母菌ZG-3生長的影響Fig.5 Effect of temperature on ZG-3 growth of yeast
2.4 耐高溫酵母菌的耐乙醇性研究
由圖6可知,菌株ZG-3隨著乙醇濃度的增加,OD值不斷降低,當乙醇濃度高于6%時菌體生長明顯受到抑制,乙醇濃度12%時仍有菌體生長,而乙醇濃度達15%時,菌株ZG-3不再生長,因此,菌株ZG-3耐乙醇濃度可達12%;高于姚曉瑞寧[21]等篩選的菌株D4、13耐乙醇濃度的9%,以及劉超帝等[7]篩選的馬克斯克魯維酵母KMBM2-5的6%;與譚才鄧等[18]篩選的庫德畢赤酵母菌A2-1耐乙醇濃度12%能力相當。由此可見ZG-3是一株很有應用開發潛力的耐高溫耐乙醇的酵母菌。
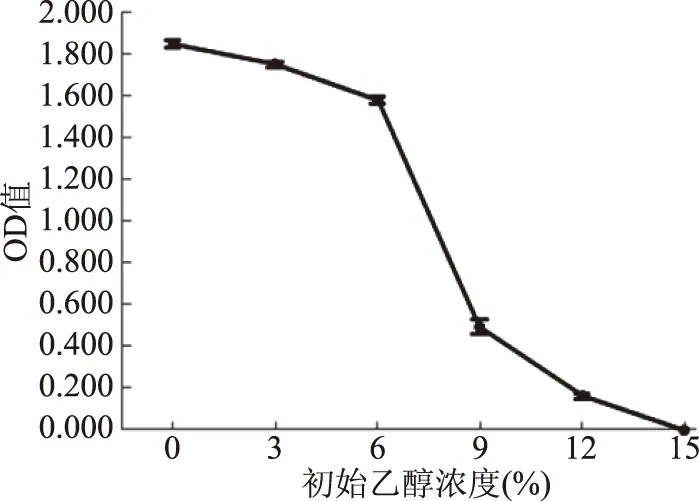
圖6 初始乙醇濃度對酵母菌的影響Fig.6 Effect of initial ethanol concentration on yeast
2.5 酵母菌的發酵力測定
在40 ℃下用含糖10%的發酵培養基培養菌株ZG-3,每隔2 h測定二氧化碳失重量,至CO2失重量不再減少,記錄發酵時間為72 h,測得CO2失重量為7.40 g,酒精度為4.7%vol。
2.6 單因素實驗結果
2.6.1 溫度對酵母菌發酵性的影響 由圖7可知,菌株ZG-3在發酵培養基中28~40 ℃下CO2失重量不斷增加,在40~43 ℃下CO2失重量不斷減少,表明菌株ZG-3的最適發酵溫度為40 ℃。
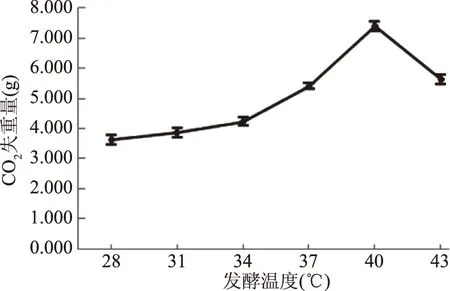
圖7 溫度對酵母菌發酵性的影響Fig.7 Effect of temperature on yeast fermentability
2.6.2 pH對酵母菌發酵性的影響 由圖8可知,當發酵pH為5.0時,CO2失重量達到最高為7.59 g。表明pH=5.0是菌株ZG-3在發酵培養基中最適發酵pH。酵母細胞的生長和胞內酶促反應都需要在一定的pH環境中進行,pH過高或過低都會影響酵母細胞膜所帶電荷狀態,使酵母生長代謝受阻[22]。
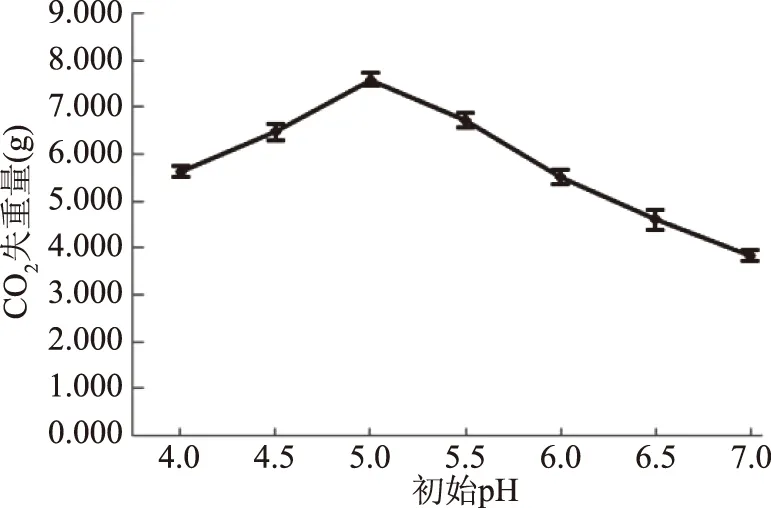
圖8 初始pH對菌株ZG-3的發酵力影響Fig.8 Effect of initial pH on the fermenting power of strain ZG-3
2.6.3 葡萄糖濃度對酵母菌發酵性的影響 初始碳源的濃度對發酵也會產生影響,在工業化生產中,糖濃度一般不超過20%[22]。由圖9可知,當初始葡萄糖濃度為140 g/L時,CO2失重量達到最高為8.11 g。表明在發酵培養基中140 g/L是菌株ZG-3的最適葡萄糖濃度。
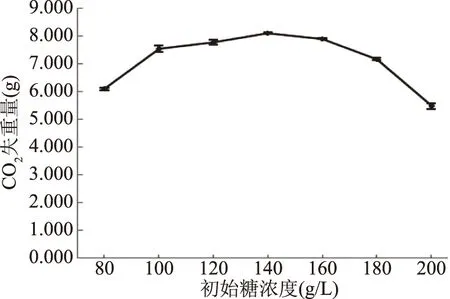
圖9 葡萄糖濃度對菌株ZG-3的發酵力影響Fig.9 Effect of glucose concentration on thefermentation capacity of strain ZG-3
2.6.4 接種量對酵母菌發酵性的影響 向pH為5、初始糖濃度140 g/L的發酵培養基接入不同量的菌液后在40 ℃培養菌株ZG-3,待發酵結束后測定CO2失重量,結果如圖10所示。當接種量為12%時,CO2失重量達到最高為8.17 g。表明菌株ZG-3的最適接種量是12%。
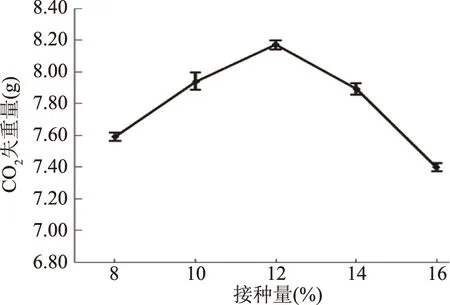
圖10 接種量對酵母菌發酵性的影響Fig.10 Effect of inoculation amount on yeast fermentability
2.7 重要因素篩選
根據表2~表5的方差分析結果可知,接種量的P值相對于發酵溫度、初始pH和葡萄糖濃度大,所以響應面優化實驗中選取發酵溫度、初始pH、葡萄糖濃度三個具有顯著影響的因素作為自變量。
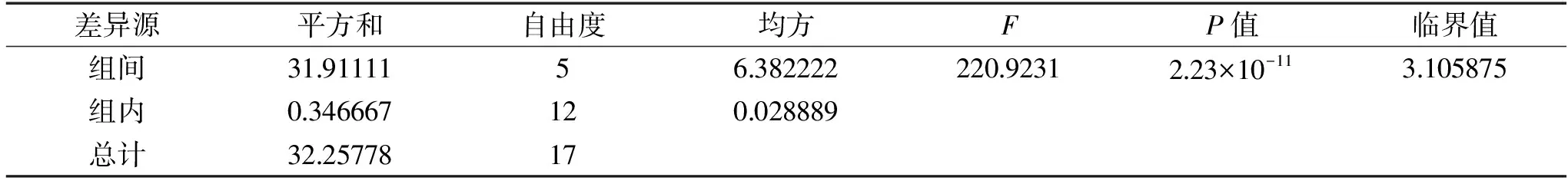
表2 溫度對酵母發酵性的影響方差分析Table 2 Analysis of the effect of temperature on yeast fermentability
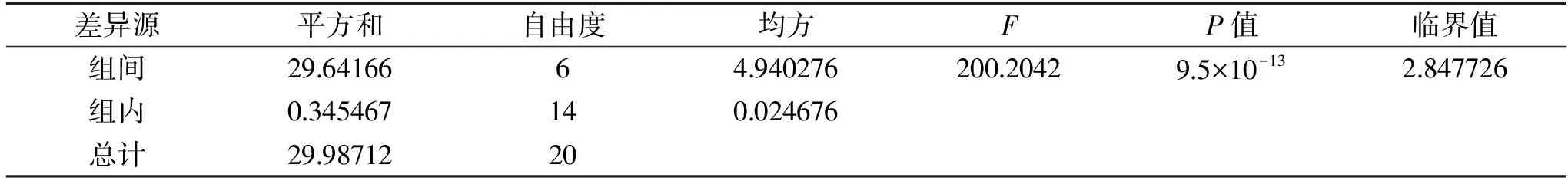
表3 pH對酵母菌發酵性的影響方差分析Table 3 Analysis of the effect of pH on the fermentability of yeast
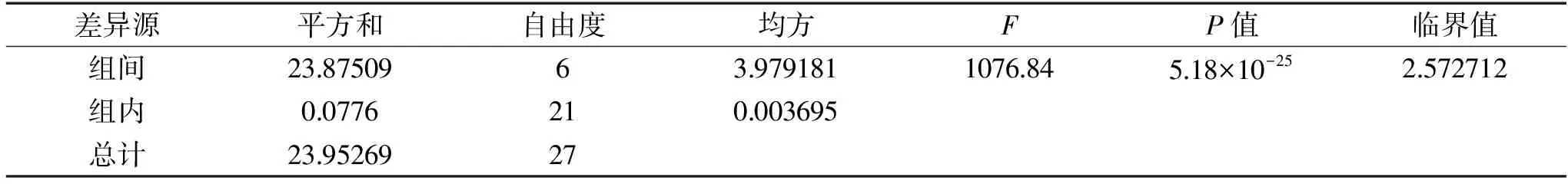
表4 葡萄糖濃度對酵母菌發酵性的影響方差分析Table 4 Analysis of the effect of glucose concentration on yeast fermentability
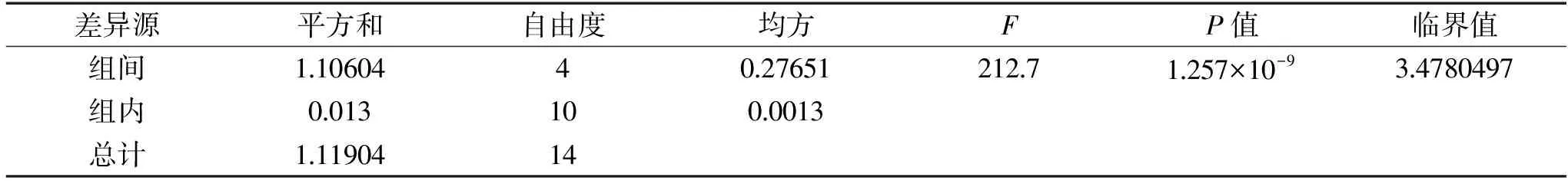
表5 接種量對酵母菌發酵性的影響方差分析Table 5 Analysis of the effect of inoculum size on yeast fermentability
2.8 響應面優化實驗
2.8.1 Box-Behnken設計與結果 根據Box-Behnken試驗設計原理,設計了17個試驗的響應面分析試驗,以菌株的發酵結束后CO2失重量作為響應值,選取發酵溫度、初始pH、葡萄糖濃度三個具有顯著影響的因素作為自變量,試驗設計與結果見表6。
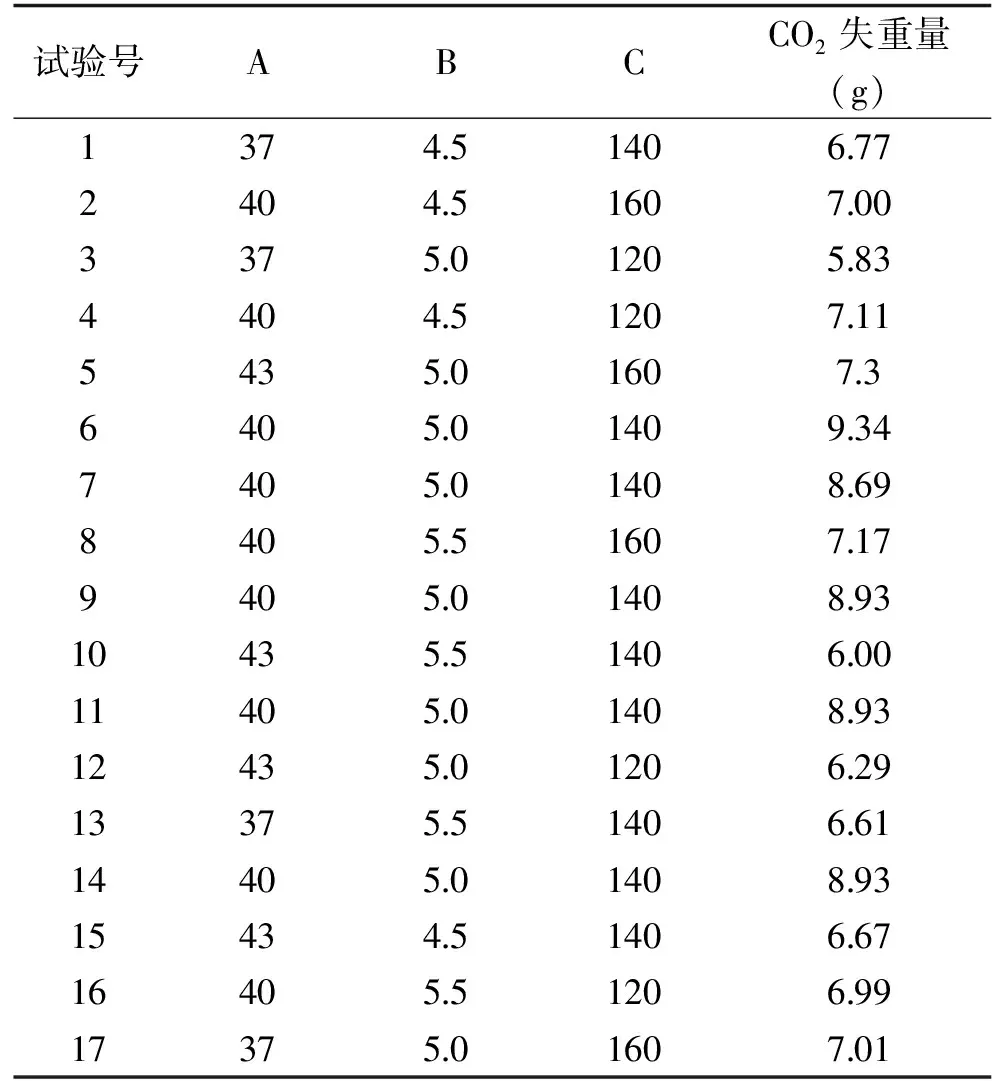
表6 Box-Behnken試驗設計與結果Table 6 Box-Behnken test design and results
采用Design Expert 8.0.6軟件對表6數據進行多元二次回歸擬合,得到CO2失重量對A:發酵溫度(℃)、B:初始pH、C:葡萄糖濃度(g/L)的多元回歸方程為:Y=8.96+5.0×10-3A-0.097B+0.28C-0.13AB-0.043AC+0.072BC-1.46A2-1.00B2-0.90C2。回歸方程決定系數R2=94.36%,表明94.36%的CO2失重量變化量可由此模型解釋,且實際值與預測值之間的擬合度和可信度良好。
回歸方程的方差分析結果見表7,整個模型極顯著,回歸模型F值為13.00,顯著性檢驗為極顯著(P=0.0014<0.01),失擬項不顯著(P=0.0646>0.05),說明該模型余實際情況擬合良好。發酵溫度、pH、葡萄糖濃度三個因素及其之間的交互作用都不顯著,A2、B2、C2影響極顯著(P<0.01)。該方程為ZG-3菌株發酵產酒精提供了一個合適的模型,因此可用上述模型代替實際實驗對ZG-3菌株酒精發酵情況進行分析和預測。
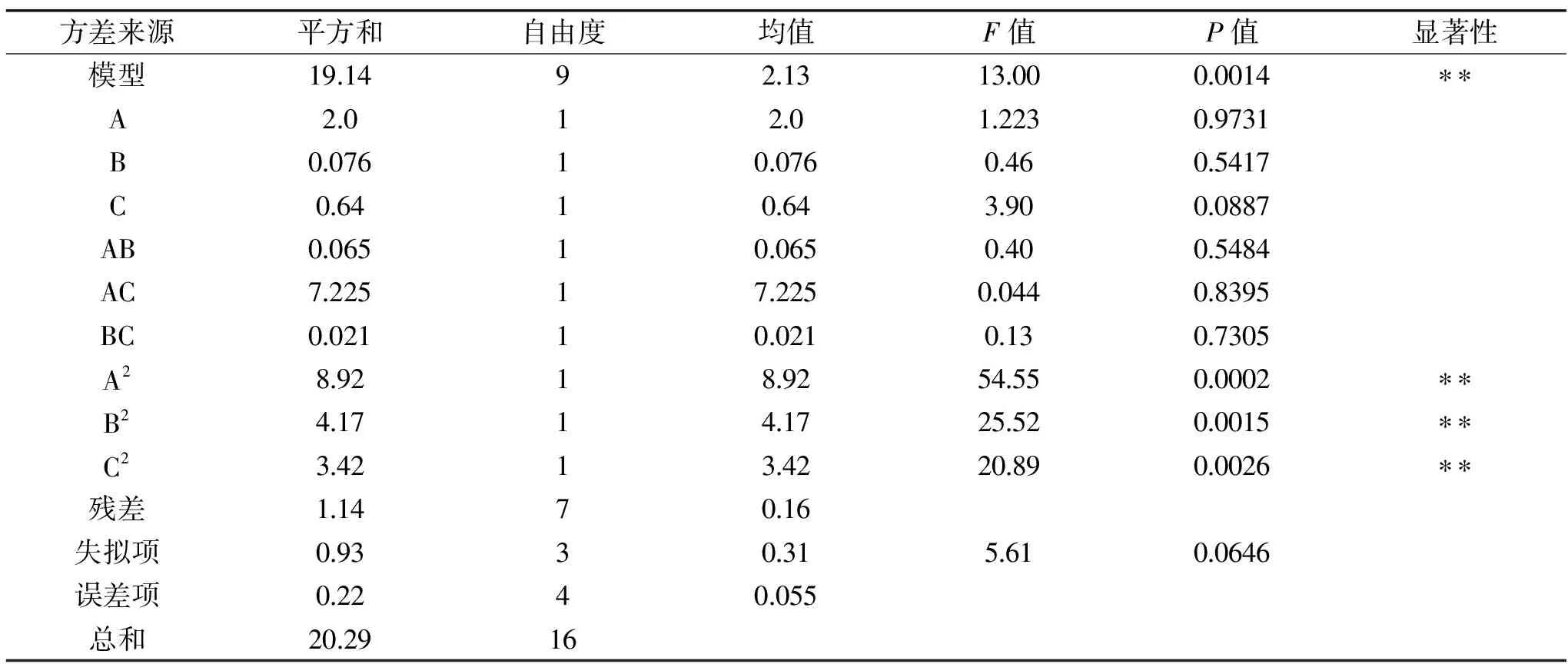
表7 響應面回歸方程的方差分析Table 7 Analysis of variance of response surface regression equation
2.8.2 各因素交互作用的響應面圖 利用Design-Expert 8.0.6軟件對二次響應面回歸模型做出相應的響應曲面,結果如圖11所示。
2.8.3 驗證試驗 由回歸模型繪制的響應面圖所示,回歸模型存在最大點,為A=40.004,B=4.978,C=143.091,在此條件下理論預測CO2失重量為8.988 g,根據實際情況將參數修改為:A=40,B=5,C=140。即得最佳發酵條件為:發酵溫度40 ℃,pH為5,葡萄糖濃度140 g/L,實驗的實際值8.48 g,與預測值基本接近,說明所建模型擬合良好且可靠。采用蒸餾-酒精計法測得優化后的ZG-3的酒精產量為5.2%vol。
3 結論
經富集、純化、耐高溫篩選等操作從大曲中分離得到一株耐高溫酵母菌,編號為ZG-3,經分子生物學鑒定,確定菌株ZG-3為庫德里阿茲威畢赤酵母(Pichiakudriavzevii)。其最高生長溫度為45 ℃,耐乙醇能力可達12%。菌株ZG-3在40 ℃下發酵72 h,酒精產量為4.7%vol;通過響應面法優化,當接種量12%、發酵溫度40 ℃、發酵pH為5和初始葡萄糖濃度140 g/L時,菌株ZG-3的酒精產量可以達到5.2%vol,由此可見ZG-3是一株很有應用開發潛力的耐高溫耐乙醇的酵母菌。

