湖泊水生植物穩定碳同位素分餾機制與應用研究進展
劉金亮,薛 濱, 姚書春, 程龍娟, 李玲玲
1 中國科學院南京地理與湖泊研究所,湖泊與環境國家重點實驗室,南京 210008 2 中國科學院大學,北京 100049
水生植物是湖泊生態系統的重要組成部分,是維持湖泊生態系統多樣性和穩定性的重要基礎與支撐[1]。碳是植物生長不可或缺的重要元素之一,水生植物體內穩定碳同位素組成不僅記錄了植物生長過程中外界環境信息的變化,還可以揭示碳的生物地球化學循環過程[2]。水生植物穩定碳同位素已被廣泛應用于研究水生生態系統演變和營養傳遞規律等方面,逐步成為研究水生植物與環境間相互關系的重要方法[2- 3]。
與陸地植物相比,水生植物由于生活在特定的水體環境中,其碳在合成過程中的分餾機制較復雜,影響因素眾多,系統的了解水生植物穩定碳同位素的分餾模式和影響其組成變化的主要因素,對于研究湖泊食物網結構和生態系統演變具有重要意義。本文詳細的介紹了水生植物穩定碳同位素的分餾過程和影響其碳同位素分餾的主要因素,闡述了水生植物穩定碳同位素在水域生態學和湖泊古環境研究中的應用,探討了研究中存在的問題,并以太湖典型水生植物開展實例研究,對本領域未來的研究趨勢進行了展望。
1 水生植物穩定碳同位素分餾
1.1 水生植物穩定碳同位素的分餾機制
在光合作用過程中,植物通過吸收CO2與H2O合成有機質,Friend等[4]研究發現在這個過程中植物體內的碳同位素發生了不同程度的分餾:首先,大氣中的CO2在向植物氣孔擴散過程中會發生同位素分餾,導致植物體內CO2的δ13C較大氣中CO2的δ13C低;其次,CO2從細胞間隙進入葉肉細胞時會遇到一定的阻力,由于動力學分餾效應的影響,質量較輕的12CO2由于擴散速率快而更易被植物吸收。最后,植物體內的CO2在羧基多肽酶的作用下發生羧化反應,溶解在細胞內的12CO2與核酮糖1,5-二磷酸核酮糖羧化酶/加氧酶(Rubisco)通過酶的作用被優先結合到磷酸甘油酸中(PGA),而剩余的CO2富集重13CO2。水生植物主要包括水生維管束植物和高等藻類(以浮游植物為主),而水生維管束植物又可依據它們的生境進一步劃分為沉水型、挺水型、漂浮型和浮葉型植物[5]。其中水生維管束植物的碳同位素分餾方式與陸地C3、C4植物相似[6],其具體可表示為:
δ13Cp=δ13Catm-a-(b-a)Ci/Ca
(1)
δ13Cp=δ13Catm-a-[b4+φ(b-ai)-a]Ci/Ca
(2)
式中,δ13Cp與δ13Catm分別代表植物和大氣中CO2的δ13C值;a和b分別為大氣中的CO2經擴散作用進入植物體內細胞時所產生的分餾(約為4.4‰)和植物體內的CO2經核酮糖二磷酸羧化酶羧化時產生的分餾系數(約為27‰);Ci/Ca分別為植物光合作用過程中,葉片細胞內外的CO2濃度;b4為磷酸烯醇式丙酮酸羧化酶(PEP)羧化過程中的同位素分餾(約為-5.9‰);φ為C4脫羧釋放CO2時從PCK循環泄露到PCA循環的比例;ai是泄露過程中發生的碳同位素分餾(約為1.8‰)。
而浮游植物的碳同位素分餾可表示為[7]:
(3)

圖1 CO2固定過程中同位素的排斥階段(改自文獻[10])Fig.1 The repellent phase of isotope during the process of absorb carbon dioxide
1.2 不同光合作用類型植物的δ13C
早在20世紀70年代,就有學者發現陸生植物的δ13C可以用來區分不同植物的光合作用類型[11]。根據植物不同光合作用的途徑可以將陸地植物劃分為C3、C4和CAM植物,不同類型的植物具有不同的δ13C。C3植物的δ13C相對偏輕,主要分布在-33‰—-21‰之間,光合作用碳同化的途徑主要通過卡爾文循環,大氣中CO2被細胞吸收后經擴散發生動力分餾,之后被1, 5-二磷酸核酮糖(RuBP)固定再次發生動力分餾(圖2)。C4植物的δ13C值相對偏重,主要分布在-16‰—-9‰之間。C4植物能夠在干旱環境下關閉氣孔防止水分流失,利用細胞間低濃度的CO2進行光合作用維持其生長(圖2)。CAM植物分布較少,其δ13C值介于-20‰—-10‰之間,夜間植物固定CO2比例和環境中水分條件是影響CAM植物δ13C變化的主要因素[12]。
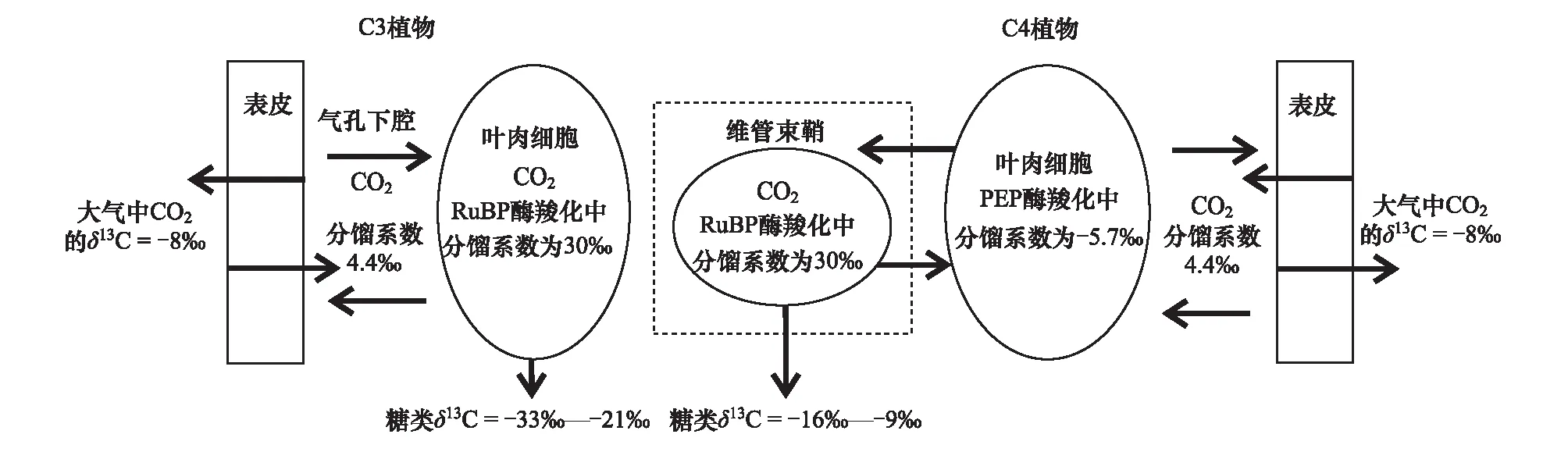
圖2 C3和C4植物光合作用過程中碳同位素的分餾效應(改自文獻[13])Fig.2 The carbon isotope fractionation effect during photosynthesis in C3 and C4
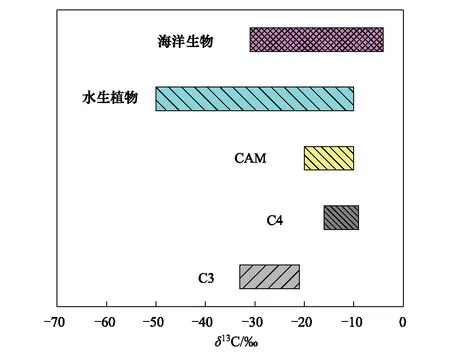
圖3 陸地植物、水生植物和海洋生物的δ13C變異范圍(改自文獻[5])Fig.3 The range of δ13C in land plants, aquatic plants and marine organisms
2 水生植物穩定碳同位素的影響因素
水生植物中的碳主要源于大氣、水體和沉積物的孔隙水中,來源較為廣泛[18]。不同碳源具有不同的碳同位素信號,并且不同類型的水生植物利用無機碳的形式也不一樣,復雜的水體環境使得影響水生植物碳同位素化學分餾的因素眾多。
2.1 碳源
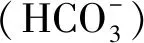
2.2 水體DIC濃度
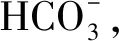
Xp=X+V/Ce(Xt-X) = 103[(δ13Cd+ 1000) / (δ13Cp+ 1000)-1]
(4)
其中,Xt和X為細胞吸收環境中CO2和固碳所產生的同位素效應;V是植物體細胞內外CO2的濃度梯度;Ce為水中溶解的CO2濃度;δ13Cd和δ13Cp分別是溶解的無機碳和沉水植物的碳同位素。由上式可以看出水中溶解無機碳的濃度越低,沉水植物的δ13C越偏重。林清[26]和劉勇麗[27]通過室內控制實驗和野外實驗也證實了沉水植物的δ13C與水中DIC的濃度具有負相關的關系,由此可見水體中DIC的濃度是影響沉水植物δ13C變化的重要因素。
2.3 水體pH
Hinga等[28]研究表明水體的pH不僅可以直接影響水生植物的碳同位素分餾,也可以通過改變碳酸鹽的化學性質間接的影響水生植物碳同位素的平衡分餾。首先,水體的pH升高會導致CO2中富集12C,水生植物受同位素平衡分餾影響而δ13C偏負。其次,水體的pH會影響浮游植物光合作用過程中無機碳的傳輸、轉化(碳濃縮機制)和碳酸酐酶的活性,從而改變浮游植物的δ13C[29- 30]。此外,水體的pH可以控制水生植物細胞內CO2的滲漏。Sharkey等[31]提出碳源與細胞內CO2的外逸是影響植物碳同位素變化的重要因素,pH增加通過碳濃縮機制引起細胞內CO2的滲漏減少,導致碳同位素分餾減少。最后,外界環境中pH也會影響水生植物細胞內的pH,進而可以通過調控細胞內的[CO2(aq)]和CO2的滲漏影響水生植物的碳同位素分餾[32]。
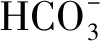
2.4 其他因素
①溫度。溫度不僅可以通過改變水生植物光合作用過程中的反應速率影響碳同位素分餾,也可以通過調節水生植物體內的生物化學過程和生理變化影響碳同位素分餾[36]。如林清[26]通過室內控制實驗,發現溫度升高,龍須眼子菜的碳同位素分餾減少,二者之間具有明顯的相關性。②水體富營養化。水體富營養化會導致水體中DIC消耗增加,進而改變水體的pH值,從而可以間接的影響水生植物的δ13C[37]。張金美等[38]通過探討水華條件下鄱陽湖水生植物碳同位素的變化特性,證實了馬來眼子菜的δ13C受水華條件影響顯著,可以被用于指示水體環境災變。③水位。湖泊不同水深處的水生植物的生境存在差異,不同水深的碳源也分布不同,從而也會影響水生植物的碳同位素組成[39- 40]。
不同生活型的水生植物吸收利用不同形式的碳源,使得不同水生植物的δ13C存在顯著差異,而水體環境要素(pH、DIC濃度、溫度和營養鹽濃度等)可以直接通過影響水生植物的碳同位素分餾過程或者間接的影響其吸收利用碳源的δ13C,從而改變水生植物的δ13C。此外,水生植物穩定碳同位素的分餾過程除受外界環境因素影響之外,還受自身遺傳特性和生理學特征所控制。目前對水生植物自身生理特性的變化與環境因子之間的對應關系研究相對較少,要全面理解水生植物穩定碳同位素對環境變化的響應機理,需要加強植物生理學、生態學和同位素地球化學等多學科之間的交叉研究。
3 水生植物穩定碳同位素的應用
3.1 在生態學中的應用
3.1.1在湖泊食物網中的應用
水生植物可為浮游動物和魚類等水生生物等提供食物來源,是驅動水生食物網能量流動與傳遞的重要基礎,而穩定碳同位素技術可以用來指示食物的來源,區分不同初級生產者對消費者碳源的貢獻[41]。生態系統中不同初級生產者的δ13C存在明顯的差異,而這種差異可用于識別消費者的食物來源和追蹤生態系統中的碳流動。同時,根據不同水生生物δ13C的富集特征可以確定它們在食物網中的營養級[42]。在研究湖泊食物網結構與營養級關系時,利用一種同位素往往存在不足,而且不同水生植物的δ13C存在時空上的差異,植物不同組織的δ13C也不同[43]。因此基于具體的研究目標,選擇合適的多元素同位素分析方法與樣品的處理可能是解決湖泊生態系統中物質傳輸和能量流動等科學問題的關鍵。
3.1.2在碳循環研究中的應用
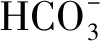
3.1.3在湖泊營養化研究中的應用
不同環境條件下的水生植物具有不同的δ13C,當湖泊的營養水平發生變化時,藻類與高等水生植物產生競爭,導致水生植物的δ13C發生改變。如Wang等[47]研究發現湖泊水生植物的δ13C隨水體營養水平升高而降低,二者之間具有顯著的負相關關系,挺水植物的δ13C可作為湖泊營養水平變化的代用指標。而張金美等[38]探討了水華條件下馬來眼子菜(Potamogetonmalaianus)的δ13C變化特征,結果顯示馬來眼子菜對環境變化的響應較敏感,能夠很好的指示環境災變。水生植物是聯系微觀生態學和宏觀生態學的重要橋梁,而碳同位素具有分布廣泛、測量較為成熟等優點,深入開展水生植物碳同位素在生態學中的研究,對于我們研究湖泊生態系統的演化與保護具有重要的現實意義。
3.2 在古環境研究中的應用
湖泊沉積物是環境氣候變化的敏感指示器,沉積物中的有機質碳同位素變化可以反演古氣候的變化歷史、判斷沉積物中有機質的來源和計算湖泊生產力的變化,是良好的古氣候信息載體之一[48]。水生植物殘體作為沉積物中有機質的重要組成成分,其碳同位素信號包含了豐富的古環境信息。Edwards等[49]首次利用湖泊沉積物中纖維素的δ13C和δ18O重建了加拿大Shield Lake過去一萬年以來溫度和濕度的變化歷史,變化趨勢可分為“冷干-暖干-暖濕-冷濕”四個階段,揭示了湖泊沉積物纖維素同位素在古氣候變化研究中的巨大潛力。此后,我國陳毅風等[50]利用瀘沽湖沉積物中纖維素的δ13C反演了研究區一百年以來的氣候變化。此外,湖泊沉積物中不同來源的有機質具有不同的δ13C,利用水生植物殘體的δ13C同時結合其他生物學指標可以判斷湖泊有機質的來源。如Street-Perrott等[51]測試了愛沙尼亞ntu Sinij?rv Lake水生植物的δ13C和生物標志物等指標,確定了該湖沉積物中的有機質來源主要為內生,全新世以來湖泊有機質的輸入主要可劃分為三類:微藻類(11.4—10.4 ka BP)、輪藻類(10.4—3.5 ka BP)和苔蘚類(3.5—0.23 ka BP)。此外,不同類型水生植物的光合作用途徑不同,其13C富集也不同,進而可以利用沉積物纖維素的δ13C判定歷史時期該地區的植被類型和古水文特征,從而反演古湖泊的生產力狀況[52- 53]。總體來看,目前利用湖泊沉積物纖維素碳同位素在古環境研究中相對較少,其主要原因是由于湖泊沉積物中植物纖維素含量較低,提取過程較為復雜,樣品量難以滿足測量要求。
雖然水生植物的δ13C已被廣泛應用于研究湖泊現代生態系統變化和古環境演化中,取得了顯著的研究成果,但是由于水生植物中包含了許多次級組分,如脂類、果膠、木質素和綜纖維素(纖維素與半纖維素的總稱)等,不同組分由于化學合成途徑不同致其δ13C存在一定的差異,這對于應用水生植物碳同位素研究湖泊環境變化的結果解譯會存在一定的影響,而這往往容易被忽視[54]。由上述可見,學者們在利用水生植物δ13C研究湖泊現代生態環境變化時多選用水生植物的全樣作為研究載體,而在研究湖泊古環境演化時多選用水生植物的纖維素組分作為研究載體,對于研究不同時間尺度上湖泊環境變化的載體存在差異。此外,利用湖泊沉積物中纖維素組分的碳同位素研究環境變化最早是參考樹輪的研究方法,而在樹輪研究中不同組分(全樣、綜纖維素與α纖維素)的碳同位素對環境變化的響應存在差異,而這種現象是否存在于湖泊水生植物中尚未知曉[55]。因此,湖泊水生植物不同組分的碳同位素對環境變化的響應是否存在差異,水生植物的何種組分更適用于作為研究環境變化的載體需要開展進一步相應的研究,這對于利用水生植物碳同位素更加準確的研究湖泊環境變化具有重要的現實意義。
4 研究實例:太湖
目前,國內關于水生植物穩定碳同位素的研究較國外相對較少,而且圍繞水生植物不同組分的碳同位素信號特征的區域調查還未見報道。基于此,以太湖流域水生植物為研究對象,分析水生植物不同組分δ13C的組成特征及其對環境因素的響應差異,旨在研究在湖泊環境中水生植物的何種組分(全樣、綜纖維素與α纖維素)更適用于研究環境變化,為利用水生植物δ13C更準確的研究環境變化提供數據支持和實驗支撐。
太湖(30°55′—32°32′N,119°52′—121°36′E)是中國第三大淡水湖,湖泊總面積約2338 km2,平均水深1.9 m(圖4)。于2018年4月和7月在太湖入湖河流處(R)和湖區(TH)共14個樣品點采集了大型水生植物和水樣,本文主要選擇研究區蓋度較高的挺水植物菰(Zizanialatifolia)、沉水植物狐尾藻(Myriophyllumverticillatum)和馬來眼子菜(PotamogetonwrightiiMorong)以及浮葉植物菱角(Trapabispinosa)為研究對象,共采集到44個植物樣品和28個水樣,樣品低溫保存帶回實驗室以備分析。
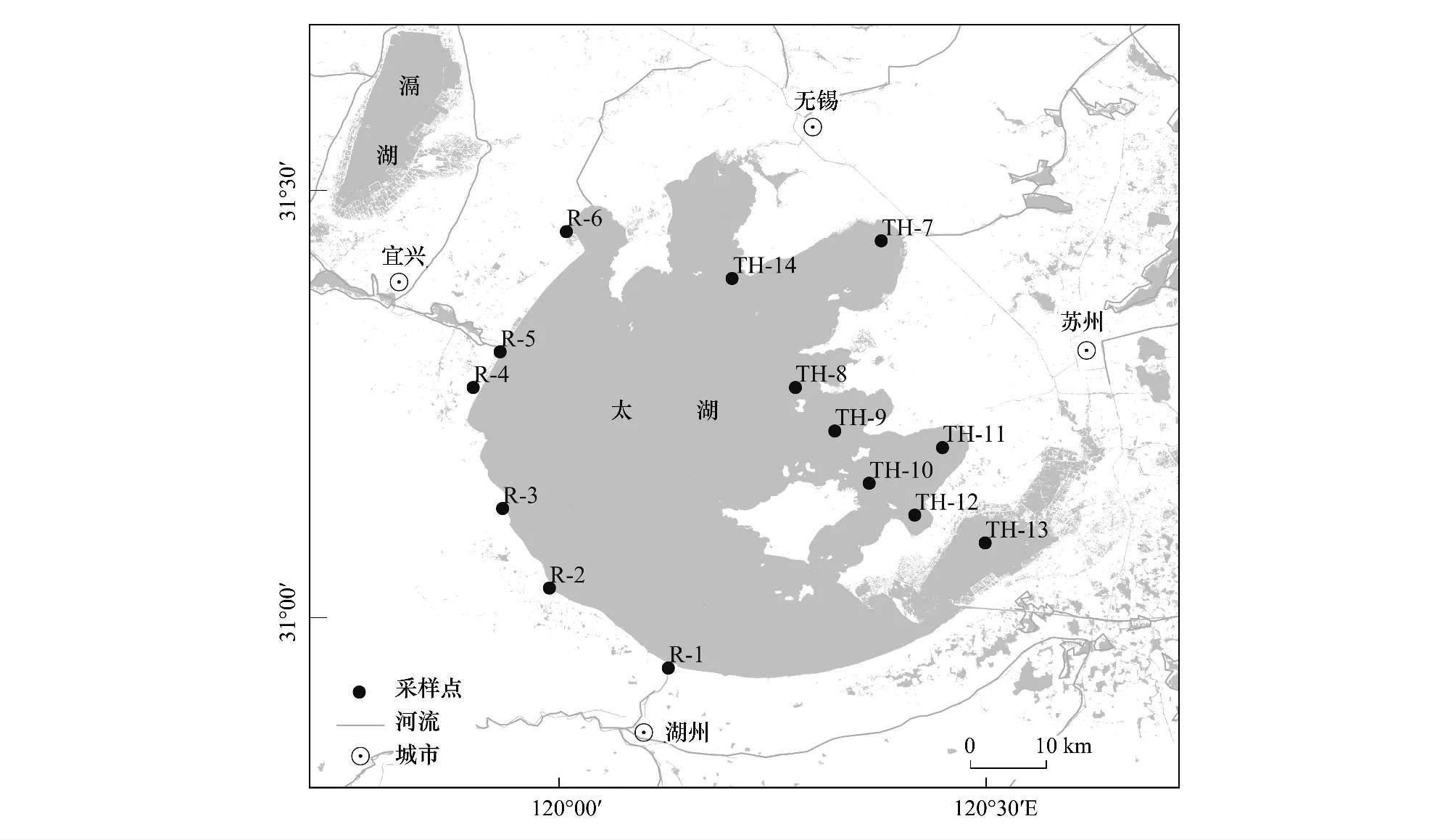
圖4 采樣點位置示意圖Fig.4 Location of the sampling points R代表入湖河流處的采樣點,TH代表太湖湖區的采樣點
在實驗室將采集的植物按照“堿-亞氯酸鈉法”標準程序提取綜纖維素(HC)和α纖維素(AC)[56]。植物樣品的δ13C(共132個樣品)在中國科學院南京地理與湖泊研究所測定,測定儀器為MAT253,測試精度為±0.15‰。在現場采樣過程中利用便攜式YSI儀器測定水體pH、溶解氧(DO)和水溫等理化指標。將采集的水樣冷藏帶回實驗室進行總氮、總磷和溶解無機碳濃度等指標分析,實驗測定方法均參照《湖泊富營養化調查規范》中的方法[57]。
太湖地區菰的δ13C變化范圍在-28.25‰ ± 0.93‰(平均值±標準差)之間,狐尾藻的δ13C變化范圍在-12.64‰ ± 2.14‰之間,馬來眼子菜的δ13C變化范圍在-15.24‰ ± 2.25‰之間,菱角的δ13C變化范圍在-27.15‰ ± 1.34‰之間,其中,沉水植物的δ13C空間變異最大(圖5)。由圖5可見,沉水植物的δ13C較挺水植物和浮葉植物的δ13C偏重,并且這三種類型植物全樣的δ13C(δ13CW)較纖維素組分的δ13C偏輕,綜纖維素的δ13C(δ13CHC)與α纖維素的δ13C(δ13CAC)較為接近。菰和菱角的δ13C分布與陸地C3植物的變化范圍所重疊,而狐尾藻和馬來眼子菜的δ13C分布與陸地C4植物的δ13C變化范圍所重合。
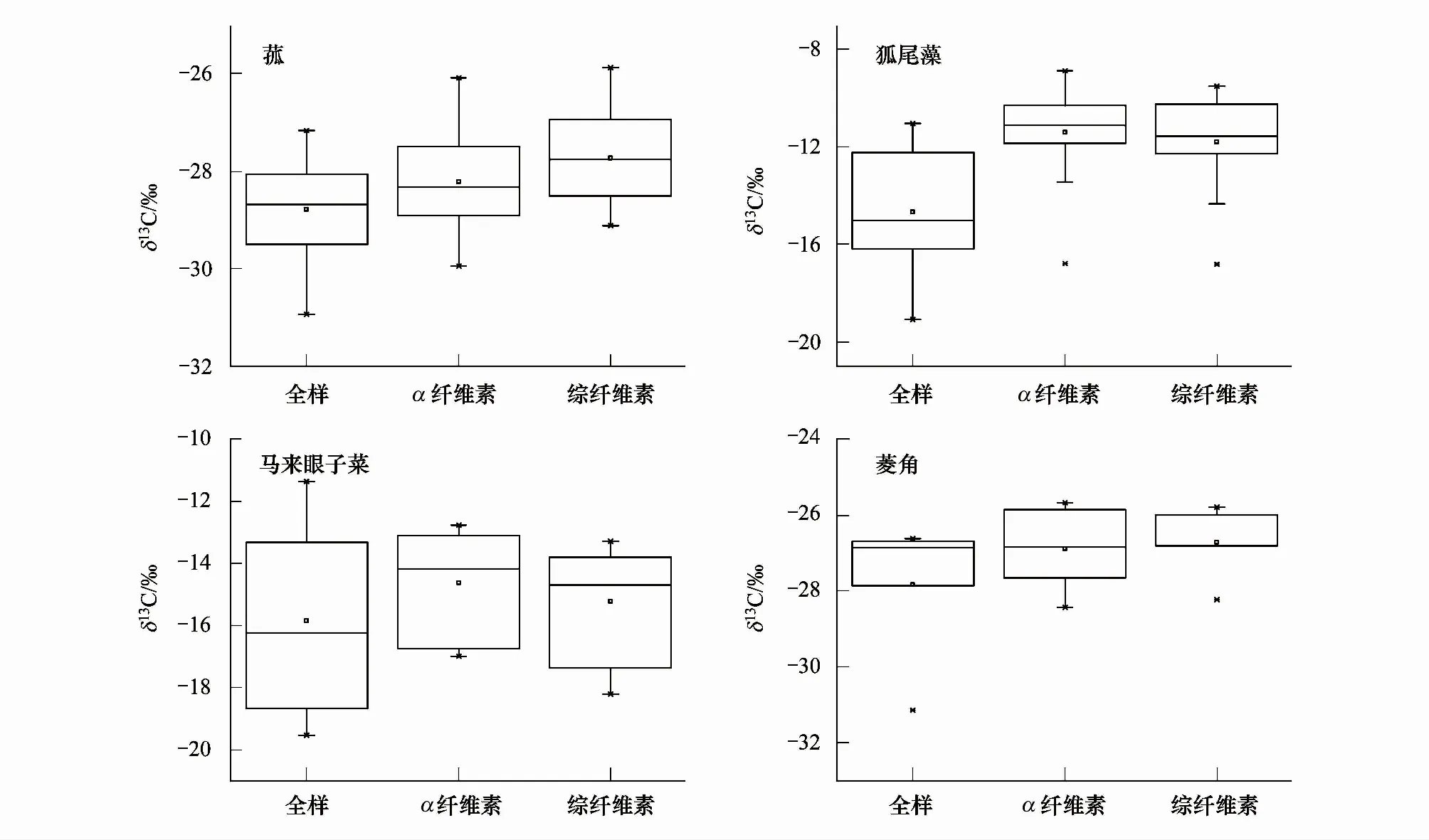
圖5 水生植物各組分的δ13C分布特征Fig.5 The distribution characteristics of δ13C of the different components in macrophytes
由于水生植物不同組分的δ13C對環境變化響應敏感性的研究主要關注的是各組分δ13C的變化趨勢與環境要素變化趨勢的差異,因此各組分δ13C變化趨勢的差異大小是判斷哪種組分更適用于研究環境變化的載體[55]。利用SPSS 23.0 對四種植物不同組分的δ13C進行單因素方差分析(one-way ANOVA),結果顯示菰和狐尾藻三種組分之間的δ13C存在顯著的差異(P<0.01),而馬來眼子菜和菱角各組分之間的δ13C差異并不顯著,我們猜測這可能與這兩種水生植物所采集到的樣品量較少有關。盡管如此,在利用水生植物穩定碳同位素研究環境變化時,應謹慎考慮所選用的研究載體。
為了進一步探討水生植物不同組分的δ13C對環境因子的響應差異,利用統計軟件(Origin 8.0 和SPSS 23.0)分析了水生植物不同組分的δ13C與水體理化特征的關系。結果顯示pH是影響水生植物δ13C變化的主要因素,其中菰、狐尾藻和馬來眼子菜的δ13C與pH具有正相關關系,而菱角的δ13C與pH呈負相關(圖6)。由圖6可見,這四種水生植物α纖維素組分的δ13C對環境的響應較全樣和綜纖維素組分更加顯著,總體來看水生植物α纖維素組分更適用于作為研究水生態環境變化的研究載體。
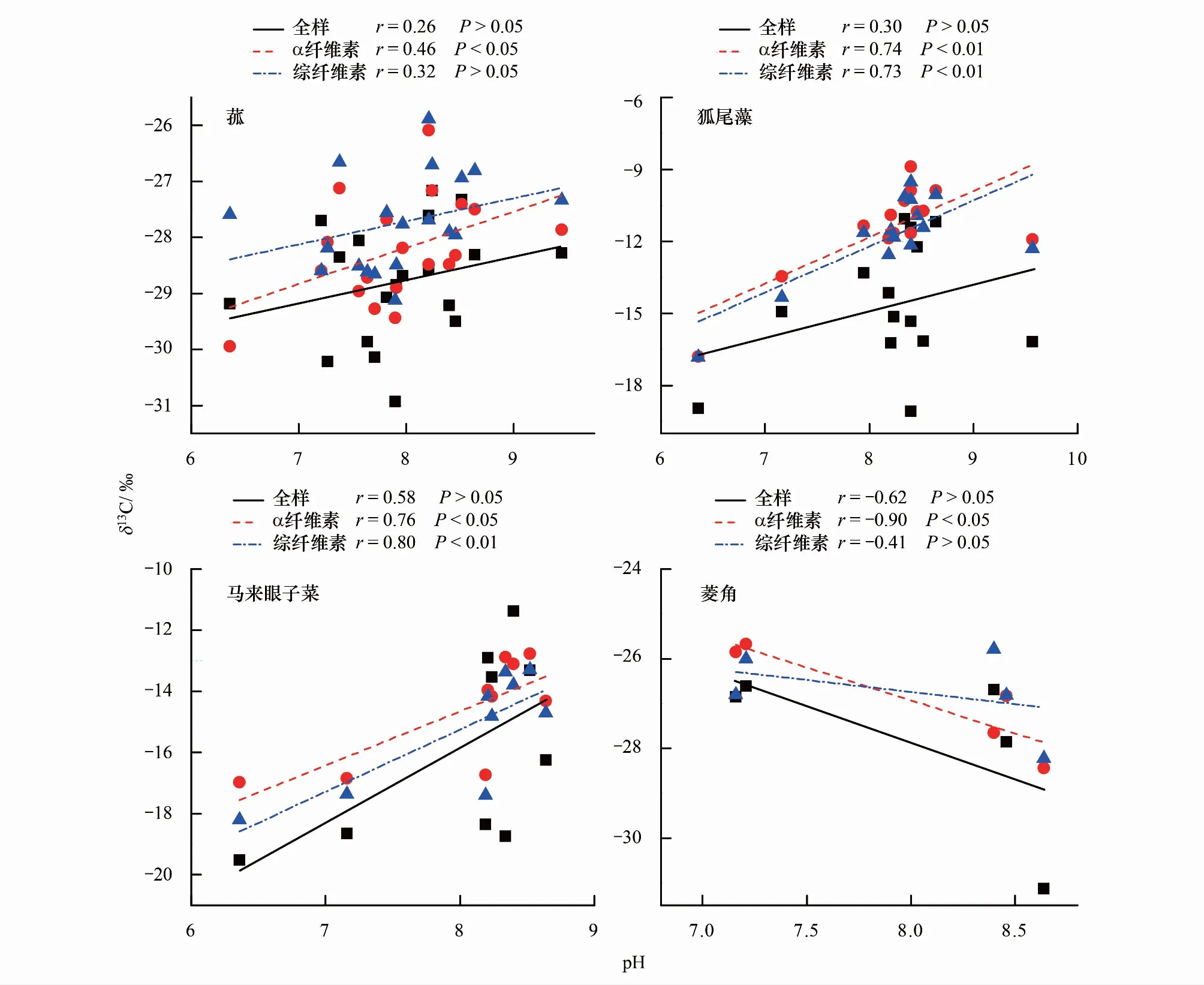
圖6 水生植物各組分的δ13C與pH的相關性Fig.6 Correlation of δ13C of macrophytes with pH
研究結果顯示水生植物α纖維素組分的δ13C對水體環境的響應較全樣與綜纖維素更為明顯(圖6),推測這主要是由于植物中的木質素和抽提物等次級組分對全樣的δ13C信號具有一定的干擾。水生植物組成較復雜,包含了綜纖維素、木質素、脂類和果膠等不同組分,這些不同的組分因化學途徑和合成過程存在差異而具有不同的δ13C[58]。在植物全樣中,木質素所占比重較大,而且木質素與綜纖維素合成的時間也存在差異,木質素可以利用不同時段的光合產物而合成自身,因此記錄了不同時段的δ13C信號,從而會導致全樣的δ13C因木質素干擾對環境響應較綜纖維素組分較差[59]。此外,全樣中還包含了許多抽提物,如淀粉、單糖和油脂等。抽提物在全樣中所占比重的變化和遷移也會導致全樣和綜纖維素的δ13C存在差異,許多關于樹輪和陸地植物的研究也建議去除全樣中的抽提物來研究環境變化[60]。纖維素是由葡萄糖以β- 1,4糖苷鍵組成的鏈狀高分子化合物,根據手型結構不同可分為α、β、γ纖維素,其中α纖維素占據很大部分,β和γ纖維素很少。與綜纖維素相比,α纖維素組成成分單一、理化性質相對穩定,有固定的分子式,對環境變化響應更為敏感[61]。因此,在利用水生植物δ13C研究環境變化時選用水生植物的α纖維素組分作為研究載體可能會更準確的反映環境變化的信息,這為利用水生植物穩定碳同位素更準確的研究環境變化提供了實驗支持和數據支撐,對進一步挖掘水生植物碳同位素的環境信息具有重要意義。
5 小結與展望
水生植物是湖泊生態系統的重要組成部分,影響其穩定碳同位素分餾的因素較復雜,一定程度上限制了其應用,在今后的研究中應首先加強對水生植物自身生理學特性的研究。植物為適應環境變化可能會使葉片厚度和氣孔密度等發生改變,從而會影響植物的氣孔導度和CO2的擴散速率等生理活動,導致δ13C發生變化[62]。因此,促進植物生理學、生態學和同位素地球化學的交叉研究,將有利于更加全面的認識和理解水生植物δ13C變化的機理。其次,拓寬水生植物α纖維素δ13C在湖泊環境中的應用。目前,許多學者為拓寬湖泊沉積物纖維素穩定同位素在古環境中的應用空間,已建立了有效、簡便的纖維素提取方法[63]。隨著纖維素提取方法的日漸成熟,而水生植物α纖維素是記錄環境變化的良好載體,有必要開展深入的研究。同時結合其他多種同位素分析方法,應用統計模型區分不同因子對水生植物δ13C的影響。將水生植物穩定碳同位素分析結合非線性響應函數和遙感技術等,從中提取更多的環境信息,加強與其他環境指標的對比,推動水生植物穩定碳同位素更深層次的發展。

