小膠質細胞清除對小鼠空間型學習與記憶的影響
隗闖 張萌 武瑞 王玉亭 王鑰 周宇

[摘要] 目的 探討細胞集落刺激因子1受體(CSF1R)抑制劑PLX5622對C57BL/6小鼠空間型學習與記憶的影響。方法 16只健康雄性C57BL/6小鼠隨機分為實驗組和對照組,各8只。實驗組小鼠連續2周投食含PLX5622的鼠糧,對照組小鼠投食等量的標準鼠糧。采用Morris水迷宮實驗檢測兩組小鼠的空間型學習力與記憶力;應用熒光免疫組化法測定兩組小鼠海馬區域小膠質細胞的密度。結果 水迷宮結果顯示,與對照組相比,實驗組小鼠在圓臺所在象限探索的時長百分比明顯下降(t=3.556,P<0.01),逃避潛伏期、穿越圓臺次數、游泳速度差異無顯著性(P>0.05)。熒光免疫組化結果顯示,與對照組相比,實驗組小鼠每平方毫米海馬區域小膠質細胞的數量明顯減少(t=11.430,P<0.01),成熟神經元數量兩組比較差異無顯著性(P>0.05)。結論 海馬區域小膠質細胞清除不影響小鼠空間學習與記憶獲取,但削弱小鼠的空間型記憶力。
[關鍵詞] 小神經膠質細胞;迷宮學習;海馬;小鼠
[中圖分類號] R338.2 ?[文獻標志碼] A ?[文章編號] 2096-5532(2020)02-0173-04
doi:10.11712/jms.2096-5532.2020.56.089 [開放科學(資源服務)標識碼(OSID)]
[網絡出版] http://kns.cnki.net/kcms/detail/37.1517.R.20200519.1430.004.html;2020-05-20 08:57
[ABSTRACT] Objective To investigate the effect of the colony-stimulating factor 1 receptor inhibitor PLX5622 on the spatial learning and memory in C57BL/6 mice. ?Methods A total of 16 healthy male C57BL/6 mice were randomly divided into control group and experimental group, with 8 mice in each group. The mice in the experimental group were given PLX5622-based chow diet for 2 consecutive weeks, and those in the control group were given an equivalent amount of normal chow diet. Morris water maze test was conducted to evaluate the spatial learning and memory of the mice. Fluorescent immunohistochemistry was used to determine the density of microglial cells in the hippocampus of the mice. ?Results Morris water maze test showed that the searching time (%) for the platform in the target quadrant was significantly reduced in the experimental group compared with that in the control group (t=3.556,P<0.01), while the escape latency, number of platform crossings, and swimming speed were not significantly different between the two groups (P>0.05). Fluorescent immunohistochemistry showed that the number of microglial cells per square millimeter of the hippocampus was significantly reduced in the experimental group compared with that in the control group (t=11.430,P<0.01), while the number of mature neurons was not significantly different between the two groups (P>0.05). ?Conclusion Microglial cell elimination in the hippocampus has no significant effect on spatial learning and memory acquisition in mice, but it reduces the spatial memory of the mice.
[KEY WORDS] microglia; maze learning; hippocampus; mice
越來越多的實驗結果顯示,神經炎癥和多種神經退變性疾病(如阿爾茲海默癥和帕金森病等)的發生相關度很大[1-4]。小膠質細胞是神經并發炎癥的一個重要的參與者[5-6]。在健康的情況下,小膠質細胞可以維持大腦的微環境平衡,保護其神經元;中樞神經系統受到損傷或感染時,小膠質細胞發生炎癥反應性激活即M1極化,高表達炎性細胞因子,同時細胞形態發生改變,吞噬細胞碎片,利于損傷修復;而過度激活的小膠質細胞則引起促炎性細胞因子大量增加,誘導慢性炎癥并導致神經元死亡[7-12]。集落刺激因子1受體(CSF1R)抑制劑PLX5622,可以阻斷血小板衍生的生長因子家族配體CSF1與單核類細胞和外周巨噬細胞型細胞特異的酪氨酸激酶型受體CSF1R的結合,從而清除腦內的小膠質細胞。PLX5622不影響小鼠日常活動,在停用該藥物1周后,腦內的小膠質細胞基本恢復正常水準[12-15]。為了探究小膠質細胞的消除是否影響小鼠的學習與記憶,本研究采取PLX5622喂食清除小鼠腦內小膠質細胞[16],觀察小膠質細胞的清除對正常的野生型小鼠空間型學習與記憶的影響。
1 材料與方法
1.1 實驗動物及分組
SPF級12周齡的雄性C57BL/6小鼠16只,體質量(30±2)g,由北京維通-利華實驗動物有限公司供應。小鼠于20 ℃、日夜循環光照狀態下喂養,可隨意進食、飲水、活動。隨機將小鼠分為對照鼠糧喂食組(對照組)、PLX5622鼠糧喂食組(實驗組),各8只。PLX5622鼠糧(每千克含PLX5622量為1 200 mg)和對照鼠糧(不含PLX5622,其余成分與實驗組一致)購自Plexxikon公司。
1.2 給藥方法
實驗開始前14 d啟動 PLX5622 喂食或對照喂食,并在實驗期間維持。喂食期間小鼠單籠飼養并每天撫慰2 min以降低其焦慮水平[15]。小鼠每天定點定量喂食(每只4 g/d),同時記錄食用量。
1.3 Morris水迷宮實驗
Morris 水迷宮包括裝有水的圓柱狀水箱、隱匿在水平面下的圓臺以及一系列視頻主動拍攝和處理數據系統,可以用來評價小鼠的空間型學習與記憶能力。每只小鼠每天進行4次空間定位游泳訓練,記下小鼠每天尋找水下圓臺的逃避潛伏期,評價小鼠的空間型學習能力[17]。連續訓練6 d后進行為期60 s的空間型記憶測試,記錄小鼠穿過圓臺次數、象限探索時長的百分比、游泳速度等,以評價小鼠的空間型記憶[18]。
1.4 熒光免疫組化檢測
水迷宮實驗完成后,兩組小鼠以40 g/L多聚合甲醛經心灌注后取腦,固定4 h,放入含有300 g/L蔗糖的混合液中沉糖。用包埋劑OCT包住腦組織,快速冷凍、切片,切片厚度40 μm。將切片移到0.01 mol/L PBS混合液中保存。行常規熒光免疫組化檢測:腦切片以0.01 mol/L PBS混合液洗凈后,加抗體封閉液在常溫搖床上封閉1 h,然后加一抗4 ℃搖床上孵育72 h;以0.01 mol/L PBS混合液清洗3次后,加熒光二抗在常溫搖床上孵育1~2 h(暗光下);再以0.01 mol/L PBS混合液洗清干凈后,將切片轉移到載玻片上鋪片、晾干,封片劑封片。應用Leica DMi8倒置熒光顯微鏡和10倍干物鏡捕獲熒光圖像,Image J圖像閾值測量工具對擇定海馬腦域(ROI)小膠質細胞染色密度進行量化分析。所用一抗NeuN抗體(1∶1 000)和Iba1抗體(1∶500)均購于美國Cell Signaling Technology 公司,熒光二抗Alexa-568 goat anti-mouse IgG(1∶2 000)和Alexa-488 goat anti-rabbit IgG(1∶2 000)購自美國Invitrogen公司。
1.5 統計學處理
應用Graph Pad Prism 6軟件進行統計學分析,計量資料結果以±s表示,兩組比較采取成組t檢驗;多組數據比較采用雙因素方差分析,然后采用Tukeys多重對比法進行兩兩對比。以P<0.05表示差異有統計學意義。
2 結 ?果
2.1 兩組小鼠空間型學習能力比較
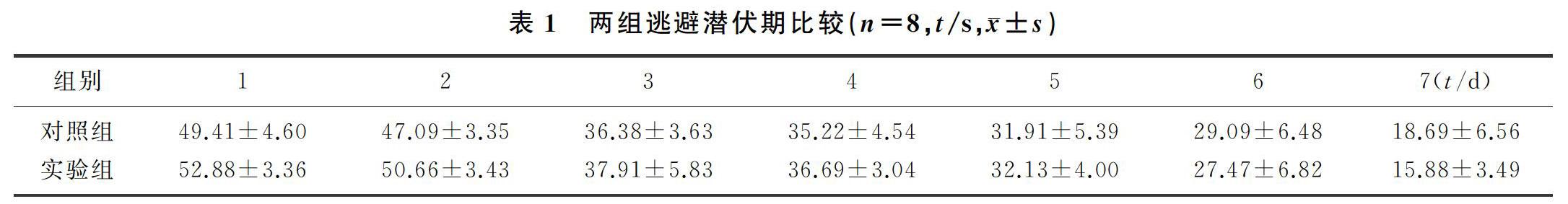
雙因素方差分析顯示,訓練天數和藥物處理兩種因素對小鼠的逃避潛伏期不存在交互作用(F=0.127,P>0.05)。藥物處理對小鼠逃避潛伏期不存在作用,兩組各時間逃避潛伏期比較差異無顯著性(P>0.05)。訓練天數對小鼠空間型學習能力有影響(F=11.940,P<0.01),兩組小鼠第7天逃避潛伏期均較第1天縮短,差異有顯著性(P<0.01)。表明小鼠的空間型學習不受PLX5622投食的影響。見表1。
2.2 兩組小鼠空間型記憶能力對比
雙因素方差分析顯示,藥物處理和迷宮象限兩種因素對小鼠的探索時長百分比有交互作用(F=8.473,P<0.01)。藥物處理對小鼠探索時長百分比不存在作用,兩組各象限探索時長百分比差異無顯著性(P>0.05)。迷宮象限對小鼠探索時長百分比有影響(F=111.400,P<0.01),實驗組和對照組小鼠在圓臺象限的探索時長百分比均顯著高于其他3個象限,差異有統計學意義(P<0.01),說明經過6 d練習兩組小鼠均獲得了空間型記憶。兩組圓臺象限探索時長百分比比較,差異有顯著性(t=3.556,P<0.01);兩組穿越圓臺的次數及游泳速度比較,差異無顯著性(P>0.05)。見表2、3。
2.3 兩組小鼠ROI小膠質細胞比較
小鼠ROI小膠質細胞Iba1免疫染色陽性(綠色熒光),成熟神經元呈NeuN免疫染色陽性(紅色熒光)。熒光定量分析結果顯示,實驗組小鼠ROI每平方毫米小膠質細胞的數目明顯少于對照組(t=11.430,P<0.01);而兩組小鼠ROI成熟神經元數量差異無顯著性(P>0.05)。見表4。
3 討 ?論
小膠質細胞不僅是大腦的免疫型細胞,同時在大腦的發育、神經元的網絡結構和功能穩態,以及中樞類神經受損與修復等生理過程中都起著重要的調節作用[19]。小膠質細胞是腦中存在的巨噬細胞,但是由于其獨特的表型和中樞神經系統中微環境的嚴格調節,小膠質細胞主要負責消除可能危害中樞神經系統的微生物、壞死細胞、多余的突觸、蛋白質的聚集體以及其他顆粒和可溶性的抗原等[20-21]。小膠質細胞是腦內促進炎性細胞因子產生的主要來源,是中樞性神經炎癥的關鍵遞質,可以誘導或調節廣泛的細胞炎癥反應。小膠質細胞的功能變化與老化以及神經變性相關度很高[5,22-23]。
有研究顯示,小膠質細胞的存活離不開CSF1R信號;而PLX5622是最新研制成功的特異度很高的CSF1R抑制劑,其特點是可口服,可透過血-腦脊液屏障,對小膠質細胞的清除率高,連續給小鼠喂食2周PLX5622可以清除腦中90%以上的小膠質細胞[24]。同時,PLX5622還具有不影響小鼠基本生理活動和行為的特點[11,25]。
本研究通過投食PLX5622消除腦內小膠質細胞,采取Morris水迷宮實驗評估小膠質細胞消除對小鼠空間型學習與記憶的影響,結果顯示,與對照組比較,實驗組小鼠腦內小膠質細胞數量顯著減少,與相關研究結果相一致[12,15]。本文研究結果顯示,海馬內小膠質細胞清除對小鼠的空間型記憶力有一定的抑制作用,表現為實驗組在圓臺所在象限的探索時長的百分比顯著低于對照組,說明生理狀況下海馬內小膠質細胞參與空間型記憶的調節。本文結果還顯示,兩組小鼠定位航行的圓臺逃避的潛伏期和運動速度差異無顯著性,兩組小鼠空間探索時在圓臺所在象限逗留的時長均較其他象限明顯延長,表明PLX5622誘導的小膠質細胞清除并不影響小鼠的空間探索、運動協調、空間型學習與記憶獲取。本文結果可為后續開展小膠質細胞對阿爾茨海默癥等神經退變性疾病的影響及機制研究奠定基礎。
綜上所述,生理狀態下海馬區小膠質細胞對小鼠的空間型記憶有重要的調節作用。其分子和細胞機制需要深入的研究。衰老、神經變性和慢性應激都可能導致認知與情感障礙,同時伴隨著小膠質細胞的異常激活和促炎性改變。小膠質細胞異常激活導致記憶受損已有不少報道[20,26-31]。因此,清除異常激活的小膠質細胞可能為認知障礙的治療或干預提供新的思路和靶點。
[參考文獻]
[1] LIU Y, CHU J M T, YAN T, et al. Short-term resistanceexercise inhibits neuroinflammation and attenuates neuropathological changes in 3xTg Alzheimers disease mice[J]. Journal of Neuroinflammation, 2020,17(1):4.
[2] GITLER A D, DHILLON P, SHORTER J. Neurodegenerative disease:models,mechanisms,and a new hope[J]. Disease Models & Mechanisms, 2017,10(5):499-502.
[3] MUSELLA A, FRESEGNA D, RIZZO F R, et al. Prototypi-cal proinflammatory cytokine (IL-1) in multiple sclerosis: role in pathogenesis and therapeutic targeting[J]. Expert Opinion on Therapeutic Targets, 2020,24(1):37-46.
[4] HUANG L K, CHAO S P, HU C J. Clinical trials of new drugs for Alzheimer disease[J]. Journal of Biomedical Science, 2020,27(1):18-30.
[5] SROOR H M, HASSAN A M, ZENZ G, et al. Experimental colitis reduces microglial cell activation in the mouse brain without affecting microglial cell numbers[J]. Scientific Reports, 2019,9(1):20217-20228.
[6] HOCQUEMILLER M, HEMSLEY K M, DOUGLASS M L, ? et al. AAVrh10 vector corrects disease pathology in MPS ⅢA mice and achieves widespread distribution of SGSH in large animal brains[J]. Molecular Therapy Methods &Clinical Deve-lopment, 2020,17:174-187.
[7] HANSEN D V, HANSON J E, SHENG M. Microglia in Alzheimers disease[J]. The Journal of Cell Biology, 2018,217(2):459-472.
[8] COLONNA M, BUTOVSKY O. Microglia function in the central nervous system during health and neurodegeneration[J]. Annual Review of Immunology, 2017,35:441-468.
[9] SHINOHARA M, TASHIRO Y, SHINOHARA M, et al. Increased levels of Aβ42 decrease the lifespan of ob/ob mice with dysregulation of microglia and astrocytes[J]. FASEB Journal, 2019,34(2):2425-2435
[10] PIERS T M, COSKER K, MALLACH A, et al. A locked immunometabolic switch underlies TREM2 R47H loss of function in human iPSC-derived microglia[J]. FASEB J, 2019,34(2):2436-2450.
[11] ROSIN J M, VORA S R, KURRASCH D M. Depletion of embryonic microglia using the CSF1R inhibitor PLX5622 has adverse sex-specific effects on mice, including accelerated weight gain, hyperactivity and anxiolytic-like behaviour[J]. Brain, Behavior, and Immunity 2018,73:682-697.
[12] SPANGENBERG E, SEVERSON P L, HOHSFIELD L A, et al. Sustained microglial depletion with CSF1R inhibitor impairs parenchymal plaque development in an Alzheimers disease model[J]. Nature Communications, 2019,10(1):3758-3778.
[13] HATTON C F, DUNCAN C J A. Microglia are essential to protective antiviral immunity: lessons from mouse models of viral encephalitis[J]. Frontiers in Immunology, 2019,10(1):2656-2664.
[14] HUPP S, ILIEV A I. CSF-1 receptor inhibition as a highly effective tool for depletion of microglia in mixed glial cultures[J]. Journal of Neuroscience Methods, 2019,332(1):108537.
[15] ALLEN B D, APODACA L A, SYAGE A R, et al. Attenuation of neuroinflammation reverses Adriamycin-induced cognitive impairments[J]. Acta Neuropathologica Communications, 2019,7(1):186-200.
[16] TODD L, PALAZZO I, SUAREZ L, et al. Reactive microglia and IL1β/IL-1R1-signaling mediate neuroprotection in excitotoxin-damaged mouse retina[J]. Journal of Neuroinflammation, 2019,16(1):118-136.
[17] ZHOU Cui, LI Mengyu, LIU Zhaoxia, et al. Effects of moxibustion on the structure and function of blood brain barrier in Alzheimers disease model rats[J]. Chinese Journal of Applied Physiology, 2019,35(5):443-446.
[18] MO Jun, CHEN Tingkai, YANG Hongyu, et al. Design, synthesis, in vitro and in vivo evaluation of benzylpiperidine-linked 1,3-dimethylbenzimidazolinones as cholinesterase inhi-bitors against Alzheimers disease[J]. Journal of Enzyme Inhibition and Medicinal Chemistry, 2020,35(1):330-343.
[19] AROUT C A, WATERS A J, MACLEAN R R, et al. Minocycline does not affect experimental pain or addiction-related outcomes in opioid maintained patients[J]. Psychopharmacology, 2019,236(10):2857-2866.
[20] BURETA C, SETOGUCHI T, SAITOH Y, et al. TGF-beta promotes the proliferation of microglia in vitro[J]. Brain Sciences, 2019,10(1):20-28.
[21] YAVARPOUR-BALI H, GHASEMI-KASMAN M, SHOJAEI A. Direct reprogramming of terminally differentiated cells into neurons: a novel and promising strategy for Alzheimers disease treatment[J]. Progress in Neuro-Psychopharmacology & Biological Psychiatry, 2020,98(1):109820-109831.
[22] 余軍,趙維星,杜春彥,等. 膽堿改善脂多糖誘導的小鼠中樞神經系統炎癥反應及認知功能障礙[J]. 南方醫科大學學報, 2017,37(5):600-606.
[23] YIRMIYA R, RIMMERMAN N, RESHEF R. Depression as a microglial disease[J]. Trends in Neurosciences, 2015,38(10):637-658.
[24] JOVANOVIC J, LIU X, KOKONA D, et al. Inhibition of inflammatory cells delays retinal degeneration in experimental retinal vein occlusion in mice[J]. Glia, 2020,68(3):574-588.
[25] CARROLL J A, CHESEBRO B. Neuroinflammation, microglia, and cell-association during prion disease[J]. Viruses, 2019,11(1):65-84
[26] OMERAGIC A, SAIKALI M F, CURRIER S, et al. Selective peroxisome proliferator-activated receptor-gamma modulator, INT131 exhibits anti-inflammatory effects in an EcoHIV mouse model[J]. FASEB Journal, 2019,34(2):1996-2010.
[27] ESTRADA S M, THAGARD A S, DEHART M J, et al. The orphan nuclear receptor Nr4a1 mediates perinatal neuroinflammation in a murine model of preterm labor[J]. Cell Death & Disease, 2020,11(1):11-25.
[28] LIU Y, GIVEN K S, DICKSON E L, et al. Concentration-dependent effects of CSF1R inhibitors on oligodendrocyte progenitor cells ex vivo and in vivo[J]. Experimental Neurology, 2019,318:32-41.
[29] KONDO Y, MATSUSHIMA A, NAGASAKI S, et al. Factors predictive of the presence of a CSF1R mutation in patients with leukoencephalopathy[J]. European Journal of Neurology, 2020,27(2):369-375.
[30] ANDERSON S R, ROBERTS J M, ZHANG J, et al. Deve-lopmental apoptosis promotes a disease-related gene signature and independence from CSF1R signaling in retinal microglia[J]. Cell Reports, 2019,27(7):2002-2013.
[31] DAIDA K, NISHIOKA K, LI Y, et al. CSF1R mutation p.G589R and the distribution pattern of brain calcification[J]. Internal Medicine (Tokyo, Japan), 2017,56(18):2507-2512.
(本文編輯 黃建鄉)

