滅字脊虎天牛CSP基因的鑒定、表達譜及XquaCSP7基因的功能研究
莊翔麟 吉帥帥 趙昱杰 尹寧娜 劉乃勇


摘要 基于已發表的滅字脊虎天牛Xylotrechus quadripes的觸角轉錄組數據,采用BLAST同源搜索的方法從轉錄組中一共鑒定到14個CSP基因,所有CSP均具有全長序列、信號肽序列和4個保守的半胱氨酸。序列比對結果表明,滅字脊虎天牛CSP間氨基酸一致性差異較大(12%~73%),平均值為34%;具有C1-X6-C2-X18-C3-X2-C4的半胱氨酸保守模式。進化分析表明,除XquaCSP8和XquaCSP12外,其余XquaCSPs聚類到不同分支。表達譜分析表明,XquaCSP7基因在觸角特異表達;XquaCSP4、CSP5、CSP12和CSP14基因在觸角高表達;XquaCSP13基因在足特異表達;其余XquaCSPs基因在多個組織中有表達。結合測定結果發現,XquaCSP7與測試的21種寄主氣味結合能力均較弱,熒光取代率在4.5%~13.5%之間,其中與苯乙酮的結合能力最強,熒光取代率為13.5%。研究結果可為后續滅字脊虎天牛CSP基因的功能研究奠定基礎。
關鍵詞 滅字脊虎天牛; 化學感受蛋白; 基因鑒定; 表達譜; 熒光競爭性結合測定
中圖分類號: S 433.5
文獻標識碼: A
DOI: 10.16688/j.zwbh.2019123
Identification and expression pattern of chemosensory protein genes
from Xylotrechus quadripes Chevrolat (Coleoptera: Cerambycidae) and
functional studies of XquaCSP7 gene
ZHUANG Xianglin1, JI Shuaishuai1,2, ZHAO Yujie1, YIN Ningna1, LIU Naiyong1
(1. Key Laboratory of Forest Disaster Warning and Control of Yunnan Province, Southwest Forestry University, Kunming
650224, China; 2. Deyang Administration Branch of Giant Panda National Park, Deyang 618000, China)
Abstract
In this study, we identified 14 chemosensory protein genes from the antennal transcriptome of Xylotrechus quadripes by using a BLAST homology-based approach. All identified XquaCSPs had full-length sequences with signal peptides and four conserved cysteines. Sequence alignment results showed a varied amino acid identities with a range of 12%-73% (mean: 34%) among XquaCSPs. A conserved cysteine pattern of C1-X6-C2-X18-C3-X2-C4 was presented among XquaCSPs. Phylogenetic analysis indicated that XquaCSP8 and XquaCSP12 were grouped into a small clade and others were classified into different clades. Expression pattern analysis revealed that XquaCSP7 showed an antennae-specific expression, while XquaCSP4, CSP5, CSP12 and CSP14 were highly expressed in the antennae; XquaCSP13 expression was limited to legs. The remaining XquaCSP genes had a broad expression in various tissues. Binding assays showed that XquaCSP7 exhibited weak binding affinities to 21 odorants derived from host plants, with a range of fluorescent displacements of 4.5%-13.5%. Among these, acetophenone was the best ligand with a fluorescent displacement of 13.5%. The results laid a foundation for future functional studies of XquaCSP genes in this species.
Key words
Xylotrechus quadripes; chemosensory protein; gene identification; expression pattern; fluorescence competitive binding assay
云南省是我國小粒咖啡Coffea arabica Linn.的主產區,種植面積和產量均居全國之首[1]。長期以來,滅字脊虎天牛Xylotrechus quadripes嚴重威脅和制約云南省小粒咖啡產業的發展,有學者對定植5年的小粒咖啡調查發現滅字脊虎天牛為害率高達80.6%[2]。該蟲隸屬于鞘翅目Coleoptera,天牛科Cerambycidae,天牛亞科Cerambycinae,主要以幼蟲蛀食小粒咖啡樹干,為害較為隱蔽,目前主要采取人工捕殺幼蟲、成蟲和噴灑化學農藥等方法進行防治,成本高昂且防治效果不理想,亟待研發新型的綠色防治技術[3]。
觸角是天牛等昆蟲的重要嗅覺感受器官,其表面著生有不同類型的感器,感器內部的淋巴液中有兩種參與識別和運輸氣味分子的嗅覺蛋白:氣味結合蛋白(odorant binding proteins,OBPs)和化學感受蛋白(chemosensory proteins,CSPs)[46]。昆蟲CSP是一類小分子可溶性蛋白,分子質量約為15~17 kDa,一般多肽鏈全長100~120個氨基酸,具有4個保守的半胱氨酸殘基(cysteine,Cys),能夠形成兩對二硫鍵,起穩定蛋白三級結構的作用[5,78]。1994年,在黑腹果蠅Drosophila melanogaster觸角中分別發現OS-D(olfactory specific-D)和A-10兩個CSP基因,這也是在昆蟲觸角中最早發現的CSP基因[910]。近年來,隨著分子生物學技術的不斷發展以及轉錄組和基因組測序技術的不斷更新,大量昆蟲的CSP基因已被鑒定,如在鞘翅目昆蟲云斑天牛Batocera horsfieldi[11]、紅脂大小蠹Dendroctonus valens[12]、松褐天牛Monochamus alternatus[13]、光肩星天牛Anoplophora glabripennis[14]、星天牛A.chinensis[15]和赤擬谷盜Tribolium castaneum[16]中分別鑒定到3、6、12、12、16和20個CSP基因;在非鞘翅目昆蟲家蠶Bombyx mori[8,17]、棉鈴蟲Helicoverpa armigera[18]、黑腹果蠅和意大利蜜蜂Apis mellifera[8]中分別鑒定到22、29、4和6個CSP基因。另外,研究發現昆蟲的CSP基因在觸角、頭、胸、腹、足、翅、下唇須等多個組織中均有表達,說明其功能具有多樣性[6,1417,19]。目前,一般認為昆蟲的CSP具有嗅覺感受、運輸氣味分子、發育和免疫調節等功能[2021],如日本弓背蟻Camponotus japonicus的CjapCSP能夠特異性識別非同種巢穴螞蟻表皮的烴類物質[22];2007年,Maleszka等人利用RNAi技術證明意大利蜜蜂的AmelCSP5基因參與了胚胎覆蓋膜的形成[23]。
在昆蟲體外,熒光競爭性結合測定技術被廣泛用于研究CSP和氣味分子的結合能力,如華山松大小蠹Dendroctonus armandi的DarmCSP2與月桂烯和3-蒈烯具有較強的結合能力[24]。苜蓿盲蝽Adelphocoris lineolatus的AlinCSP1-3與順-3-己烯-1-醇、2-己烯醛和戊二醛具有較強的結合能力[25]。據此研究CSP與氣味分子(植物揮發物和性信息素)的結合能力,結合電生理測定、室內行為學研究和田間誘捕試驗,在篩選到害蟲防治潛在分子靶標的同時,還可進一步研發基于植物揮發物或性信息素的行為引誘劑或驅避劑。
國內外學者在滅字脊虎天牛的蟲情調查、種群動態和發生規律等方面已做了大量的研究[23,2628],但是在分子生物學尤其是嗅覺方面的研究較少。先前,我們采用轉錄組測序、生物信息學和分子生物學等技術研究了滅字脊虎天牛的5類化感基因家族:OBPs、氣味受體(odorant receptors,ORs)、味覺受體(gustatory receptors,GRs)、離子型受體(ionotropic receptors,IRs)和化學感受神經元膜蛋白(sensory neuron membrane proteins, SNMPs)[2930]。基于已測序的轉錄組數據,本文進一步鑒定了該天牛的CSP基因家族,并采用PCR研究了這些CSP基因的組織表達特征;在此基礎上選取觸角特異表達的XquaCSP7基因進行原核表達和純化,研究了XquaCSP7與不同寄主氣味的結合特性。研究結果不僅豐富了滅字脊虎天牛的化感基因家族,還可為后續該種害蟲基于寄主揮發物的行為調控劑的研發奠定基礎。
1 材料和方法
1.1 試驗材料
1.1.1 試驗昆蟲
滅字脊虎天牛采自云南省德宏熱帶農業科學研究所咖啡種植園,緯度24°1′32″N,經度97°51′18″E,海拔767 m。田間采集受害的咖啡樹干,帶回室內后將其用紗網套住,每天不定時觀察,將羽化當天的滅字脊虎天牛雌雄成蟲分開飼養,并提供咖啡枝葉和蜂蜜水作為食物。然后,分別收集3~5日齡成蟲觸角、頭(去除觸角)、胸、腹、足、翅等組織。將雌雄成蟲同一組織按1∶1的比例混合,以便后續RT-PCR試驗中同一組織雌雄蟲cDNA模板濃度相等。收集好的組織立即用液氮速凍,保存于-80℃冰箱。
1.1.2 試驗試劑
TRIzol試劑購自美國Invitrogen公司;反轉錄試劑盒PrimeScriptTM RT reagent Kit、DNA rTaq酶、dNTP Mixture、10×PCR Buffer (Mg2+)和6×Loading buffer購自TaKaRa寶生物工程有限公司;SuperRed/GelRed核酸染料購自BioSharp公司。
1.2 基因的鑒定
基于已發表的滅字脊虎天牛觸角轉錄組(SRA登錄號:SRP143591),采用BLAST同源搜索的方法鑒定滅字脊虎天牛的CSP基因。首先,從NCBI(National Center for Biotechnology Information)數據庫中下載松褐天牛、星天牛、光肩星天牛、赤擬谷盜、大猿葉蟲Colaphellus bowringi的CSP作為目標序列,在BioEdit中采用本地BLAST鑒定候選的CSP基因。然后,將鑒定的所有CSP基因再次在NCBI nr蛋白序列(NCBI non-redundant protein sequence database)數據庫中進行比對,確定候選的CSP基因。最后,根據鞘翅目昆蟲CSP氨基酸序列中4個保守Cys及其位置(C1-X6-C2-X18-C3-X2-C4),進一步確定候選的CSP基因[8,16,3132]。
1.3 序列分析
利用NCBI上的open reading frame finder(ORF finder)預測開放閱讀框(https:∥www.ncbi.nlm.nih.gov/orffinder/)。利用在線軟件SingalP 4.1 Sever(http:∥www.cbs.dtu.dk/services/SingalP)預測信號肽[33]。CSP氨基酸序列間的一致性采用GeneDoc進行計算;序列比對采用Clustal X 1.83。在進化樹分析中,選取了天牛科昆蟲松褐天牛、云斑天牛、光肩星天牛和星天牛共42條CSP序列,利用MEGA 7.0軟件鄰位相連法(neighbour-joining)構建進化樹,對結果進行1 000次bootstrap驗證[34]。
1.4 基因的表達譜分析
根據TRIzol試劑盒使用說明書,分別提取滅字脊虎天牛各組織總RNA;然后,采用NanoDrop 1000測定其濃度。利用DNase Ⅰ去除各組織中的基因組DNA,之后采用反轉錄試劑盒PrimeScriptTM RT reagent Kit合成cDNA。選取滅字脊虎天牛肌動蛋白actin基因作為內參基因[32],以檢測各組織cDNA模板質量及完整性。采用RT-PCR研究CSP基因在以上各組織的表達情況。PCR引物采用Primer Premier 5軟件設計,引物序列送昆明奧基生物科技有限公司進行合成(表1)。PCR反應條件為:94℃預變性3 min;94℃變性30 s,60℃退火30 s,72℃延伸40 s,35個循環;72℃延伸5 min。PCR擴增產物用1.2%的瓊脂糖膠進行電泳分析,最后根據目的條帶的有無及亮度判斷CSP基因在不同組織中的表達情況。
1.5 重組蛋白XquaCSP7的表達和純化
1.5.1 原核表達載體的構建
根據XquaCSP7基因的開放閱讀框序列(去除信號肽)設計原核表達引物,并在正向和反向引物中分別加入Nde Ⅰ和Xba Ⅰ酶切位點(表1),從而將目的基因更好地連入載體pCzn1中。用相應的限制性內切酶(Nde Ⅰ和Xba Ⅰ)酶切表達載體pCzn1,然后與PCR擴增獲得的XquaCSP7基因進行連接,獲得重組質粒pCzn1-XquaCSP7。重組質粒陽性克隆進一步通過測序進行驗證,以確定序列及插入方向的正確性。
1.5.2 重組蛋白的表達和純化
將測序正確的重組質粒pCzn1-XquaCSP7轉入大腸桿菌感受態細胞Arctic-Express中,離心后全部涂于含50 μg/mL氨芐青霉素(ampicillin,Amp+)的LB平板上,挑取單克隆接種于3 mL LB液體培養基(50 μg/mL Amp+)中,37℃,220 r/min振蕩過夜。次日,按1∶100的比例接種于1 L LB液體培養基(50 μg/mL Amp+)中,37℃,220 r/min培養至菌體OD600值為0.6~0.8時,向培養液中加入終濃度為0.5 mmol/L的異丙基硫代半乳糖苷(isopropyl β-D-thiogalactoside,IPTG);然后,在37℃,220 r/min繼續振蕩培養4 h進行誘導表達。
4℃離心后棄上清;然后用磷酸鹽緩沖液重懸菌體,超聲波破碎后分別取上清和沉淀進行聚丙烯酰胺凝膠電泳(SDS-PAGE)分析,以確定重組蛋白的可溶性。采用鎳離子親和層析柱對目的蛋白進行純化,純化后的目的蛋白液采用超濾管對其進行濃縮。
1.6 熒光競爭性結合測定
在熒光競爭性結合測定中,N-苯基-1-萘胺(N-phenyl-1-naphthylamine,1-NPN)和所有化合物均購自Sigma Aldrich有限公司,純度大于或等于90%(表2)。以色譜級甲醇為溶劑,分別配制濃度為10 mmol/L的熒光探針1-NPN和21種氣味配基的母液,-20℃冰箱保存備用。使用時再用色譜級甲醇將探針和氣味配基母液稀釋為1 mmol/L的工作液。
首先,在96 Micro Well TM微孔板(Nunclon TM)加入2 μmol/L的蛋白和2 μmol/L的1-NPN,判斷XquaCSP7與探針是否能夠結合;然后,在2 μmol/L蛋白液中加入終濃度為2、4、6、8、12、16 μmol/L和20 μmol/L的1-NPN,計算XquaCSP7與1-NPN的結合常數(Kd);最后,在2 μmol/L蛋白和2 μmol/L 1-NPN的混合液中分別加入不同濃度的氣味配基,用多功能酶標儀(VARIOSKAN FLASH)進行結合測定。測定參數為:激發波長為337 nm,發射波長為370~550 nm,激發和發射狹縫均為5 nm。
2 結果與分析
2.1 滅字脊虎天牛CSP基因的鑒定
利用BLAST同源性搜索的方法,從滅字脊虎天牛觸角轉錄組中共鑒定到14個CSP基因。所有CSP基因均具有完整的開放閱讀框,編碼101~148個氨基酸,且在N端均具有信號肽序列(16~26個氨基酸)。NCBI BLAST比對結果表明,所有CSP均比對到鞘翅目其他昆蟲的CSP,其中XquaCSP6與松褐天牛的MaltCSP2具有最高的氨基酸一致性,為87%;而XquaCSP14與中歐山松大小蠹的DponCSP1的氨基酸一致性最低,僅為50%(表3)。
2.2 滅字脊虎天牛CSP的序列及進化分析
利用Clustal X 1.83對滅字脊虎天牛14個CSP的氨基酸序列進行比對,結果表明所有CSP均具有4個保守的Cys,模式為C1-X6-C2-X18-C3-X2-C4(圖1)。
為了明確滅字脊虎天牛14個CSP與鞘翅目其他昆蟲CSP的進化關系,我們構建了星天牛、光肩星天牛、云斑天牛、松褐天牛和滅字脊虎天牛CSP的進化樹。結果表明,除XquaCSP8和XquaCSP12聚類到同一個小分支外,其余XquaCSPs聚類到不同的分支(圖2)。
2.3 滅字脊虎天牛CSP基因的表達譜分析
為了明確CSP基因的可能功能,利用RT-PCR技術研究了14個CSP基因在觸角、頭(去除觸角)、胸、腹、足和翅等組織的表達情況。結果表明,除XquaCSP13基因外,其他XquaCSPs基因在觸角中均有表達。其中XquaCSP7基因在觸角特異表達;XquaCSP4、CSP5、CSP12和CSP14基因在觸角高表達;XquaCSP13基因在足特異表達;其余XquaCSPs基因在除觸角以外的多個組織中有表達(圖3)。
2.4 滅字脊虎天牛XquaCSP7的表達及純化
首先,檢測了重組蛋白pCzn1-XquaCSP7在大腸桿菌的可溶性表達形式,超聲波破碎后分別取上清液和沉淀進行SDS-PAGE分析。結果表明,pCzn1-XquaCSP7主要以包涵體的形式存在,因此采用包涵體變性和復性的方法進行純化。將處理好的蛋白混合液過柱,純化后得到約14 kDa的高純度單一目的蛋白(圖4)。
2.5 滅字脊虎天牛XquaCSP7與不同配基的結合能力測定
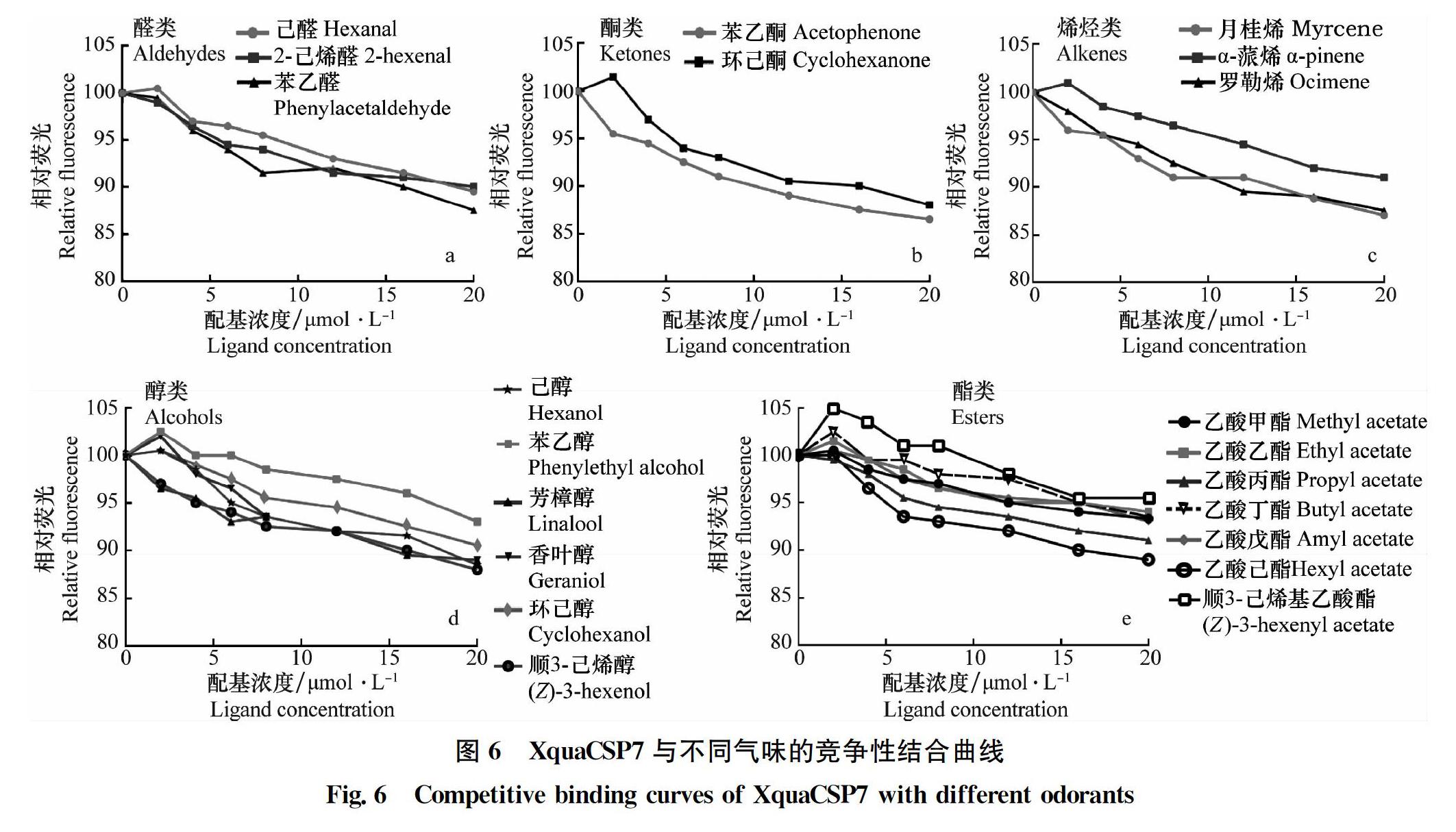
采用熒光競爭性結合測定方法,研究了XquaCSP7與21種寄主氣味的結合能力。首先,測定了XquaCSP7與1-NPN的結合能力。結果表明,該蛋白與1-NPN探針具有好的結合能力,結合常數Kd為6.50 μmol/L(圖5)。結合測定結果表明,XquaCSP7與21種氣味配基的結合能力均較弱,1-NPN的熒光取代率在4.5%~13.5%之間。在測試的所有化合物中,XquaCSP7與苯乙酮的結合能力最強,熒光取代率為13.5%;XquaCSP7與順-3-己烯乙酸酯的結合能力最弱,熒光取代率僅為4.5%(圖6)。
3 討論
滅字脊虎天牛是小粒咖啡上為害較為嚴重的蛀干害蟲之一,嗅覺在其寄主定位中起著重要作用。與其他大部分昆蟲的觸角功能類似,天牛的觸角能夠感受同種性信息素和普通植物氣味,在其種群繁衍和生存中必不可少[3537]。近年,轉錄組測序已成為基因鑒定的主要手段,基于觸角轉錄組可鑒定到嗅覺相關的基因及害蟲防治的潛在分子靶標,然后采用反向化學生態學技術可篩選到用于害蟲防治的行為調控劑。從滅字脊虎天牛的觸角轉錄組中我們已鑒定了該種害蟲的5類化感基因家族:ORs、GRs、IRs、SNMPs和OBPs,并研究了它們各自的進化關系及組織表達特征[2930]。為了進一步完善該天牛的化感基因家族,本文研究了參與嗅覺感受的另一類重要化感蛋白基因:CSPs。研究結果極大地豐富了滅字脊虎天牛的化感基因家族,并為后續化感基因的功能研究奠定基礎。
從滅字脊虎天牛的觸角轉錄組中,一共鑒定到14個CSP基因,其數量多于銅綠異麗金龜Anomala corpulenta(5個)[37]、云杉八齒小蠹Ips typographus(6個)[31]、紅脂大小蠹(6個)[12]、華山松大小蠹(9個)[24]、中歐山松大小蠹Dendroctonus ponderosae(11個)[31]、大猿葉蟲(12個)[38]、松褐天牛(12個)[13]、光肩星天牛(12個)[14]和紅棕象甲Rhynchophorus ferrugineus(12個)[39],考慮到以上鞘翅目昆蟲的CSP基因均來自于成蟲觸角轉錄組,因此推測滅字脊虎天牛有更多的CSP基因參與嗅覺感受;此外,也有可能是由于不同昆蟲觸角轉錄組測序深度和組裝技術的差異導致。但是少于星天牛(16個)[15]和赤擬谷盜(20個)[16],其中與赤擬谷盜CSP基因的數量差異較大,原因很可能是赤擬谷盜的CSP基因來源于基因組,而滅字脊虎天牛的CSP基因僅從觸角轉錄組中獲得,在其他組織特異或高表達的CSP基因并未被鑒定。
在滅字脊虎天牛中,所有CSP均具有4個保守的Cys,其保守模式“C1-X6-C2-X18-C3-X2-C4”與鞘翅目其他昆蟲的CSP類似[8,16,3131],這種保守的Cys模式極大地幫助了鞘翅目昆蟲CSP基因的鑒定。此外,研究發現不同物種同源的CSP間氨基酸一致性較高,如云南切梢小蠹Tomicus yunnanensis的CSP與鞘翅目其他昆蟲的CSP一致性大于45%[32];星天牛[15]和光肩星天牛[14]的CSP與鞘翅目其他昆蟲的CSP一致性均大于50%;類似的結果在滅字脊虎天牛中也有發現。然而,同一物種不同CSP間氨基酸一致性差異較大,如光肩星天牛CSP間的一致性為8.9%~71.8%[14];家蠶CSP間的一致性為20%~60%[17]。與其他昆蟲的CSP類似,滅字脊虎天牛的14個CSP間氨基酸一致性變化較大(12%~73%),其中XquaCSP8和XquaCSP12一致性最高,在進化樹中聚類到同一個小分支,且它們具有相似的組織表達特征,說明它們很可能具有相似的功能。
昆蟲的CSP基因具有多樣性的組織表達特征,說明其在嗅覺和非嗅覺感受中均具有重要功能。在鞘翅目中,光肩星天牛的CSP基因在觸角、足、下顎須、下唇須等組織中均有表達[14],類似的結果在星天牛[15]、銅綠異麗金龜[37]、赤擬谷盜[16]、黃曲條跳甲Phyllotreta striolata[40]、榆紫葉甲Ambrostoma quadriimpressum[41]等昆蟲中也有發現。在滅字脊虎天牛中,除XquaCSP7和XquaCSP13基因外,其余XquaCSPs基因在除觸角以外的多個組織中有表達,說明這些CSP基因具有多種功能。其中,XquaCSP7基因呈現觸角特異表達的特點,很可能參與性信息素或是寄主氣味的感受;XquaCSP13基因在足特異表達,與光肩星天牛[14]和赤擬谷盜[16]的部分CSP基因表達特征類似。在美洲大蠊Periplaneta americana中,PameCSP10(p10)基因在再生足中表達,很可能與足的再生有關[42],滅字脊虎天牛的XquaCSP13基因是否與足的發育有關仍需進一步的功能驗證。在功能研究中,選取觸角特異表達的XquaCSP7基因,主要考慮到觸角是滅字脊虎天牛主要的嗅覺器官,在其寄主定位中具有重要作用。此外,在結合測定中主要選取了寄主植物的氣味。雖然XquaCSP7能夠很好地與熒光探針1-NPN結合(Kd=6.50 μmol/L),但是在測試的21種氣味物質中,XquaCSP7與所有氣味配基的結合能力均較弱,沒有一種配基的相對熒光值下降到50%以下。據此分析認為XquaCSP7可能是一個非廣譜的結合蛋白,即結合譜較窄,僅對一種或幾種氣味具有結合能力;而在結合測定中,由于測試的配基數量有限,因此沒能夠篩選到XquaCSP7親和力較好的配基。
參考文獻
[1] WALLER J M, BIGGER M, HILLOCKS R J. 咖啡病蟲害防治[M]. 劉杰, 申科,李福榮,譯.北京: 中國農業出版社, 2016: 12.
[2] 舒梅, 成文章, 李忠恒,等. 思茅咖啡滅字脊虎天牛發生與危害調查[J]. 熱帶農業科學, 2016, 36(5): 8184.
[3] 周又生, 趙忠喜, 李松林, 等.咖啡滅字虎天牛生物生態學及發生危害規律和治理研究[J].西南大學學報(自然科學版), 2002, 24(1): 14.
[4] LEAL W S.Odorant reception in insects: roles of receptors, binding proteins, and degrading enzymes [J]. Annual Review of Entomology, 2013, 58(1): 373391.
[5] PELOSI P, IOVINELLA I, FELICIOLI A, et al.Soluble proteins of chemical communication: an overview across arthropods [J/OL].Frontiers in Physiology,2014, 5: 320. DOI:10.3389/fphys.2014.00320.eCollectien.2014.
[6] PELOSI P,IOVINELLA I,ZHU Jiao, et al. Beyond chemoreception: diverse tasks of soluble olfactory proteins in insects [J]. Biological Reviews of the Cambridge Philosophical Society, 2018, 93(1): 184200.
[7] PELOSI P, CALVELLO M, BAN Liping. Diversity of odorant-binding proteins and chemosensory proteins in insects [J].Chemical Senses, 2005, 30(S1): i291i292.
[8] VIEIRA F G, ROZAS J. Comparative genomics of the odorant-binding and chemosensory protein gene families across the Arthropoda: origin and evolutionary history of the chemosensory system[J]. Genome Biology and Evolution, 2011, 3: 476490.
[9] MCKENNA M P, HEKMATSCAFE D S, GAINES P, et al. Putative Drosophila pheromone-binding proteins expressed in a subregion of the olfactory system[J].Journal of Biological Chemistry, 1994, 269(23): 1634016347.
[10]PIKIELNY C W, HASAN G, ROUYER F, et al. Members of a family of Drosophila putative odorant-binding proteins are expressed in different subsets of olfactory hairs [J]. Neuron, 1994, 12(1): 3549.
[11]LI Hui, ZHANG Guoan, WANG Manqun. Chemosensory protein genes of Batocera horsfieldi (Hope): identification and expression pattern [J]. Journal of Applied Entomology, 2012, 136(10): 781792.
[12]GU Xiaocui, ZHANG Yanan, KANG Ke,et al. Antennal transcriptome analysis of odorant reception genes in the red turpentine beetle (RTB), Dendroctonus valens [J/OL]. PLoS ONE,2015, 10(5): e0125159.
[13]WANG Juan, LI Dongzhen, MIN Shuifa, et al. Analysis of chemosensory gene families in the beetle Monochamus alternatus and its parasitoid Dastarcus helophoroides [J].Comparative Biochemistry and Physiology Part D-Genomics and Proteomics, 2014, 11(9): 18.
[14]HU Ping, WANG Jingzhen, CUI Mingming, et al. Antennal transcriptome analysis of the Asian longhorned beetle Anoplophora glabripennis [J/OL]. Scientific Reports, 2016, 6: 26652. DOI:10.1038/srep26652.
[15]WANG Jingzhen, HU Ping, GAO Peng, et al. Antennal transcriptome analysis and expression profiles of olfactory genes in Anoplophora chinensis [J/OL].Scientific Reports, 2017, 7(1):15470. DOI:10.1038/s41598017154252.
[16]DIPPEL S,OBERHOFER G,KAHNT J,et al. Tissue-specific transcriptomics, chromosomal localization, and phylogeny of chemosensory and odorant binding proteins from the red flour beetle Tribolium castaneum reveal subgroup specificities for olfaction or more general functions [J/OL]. BMC Genomics, 2014, 15: 1141. DOI:10.1186/14712164151141.
[17]GONG Daping, ZHANG Huijie, ZHAO Ping, et al. Identification and expression pattern of the chemosensory protein gene family in the silkworm,Bombyx mori [J]. Insect Biochemistry and Molecular Biology, 2007, 37(3): 266277.
[18]PEARCE S L, CLARKE D F, EAST P D, et al. Genomic innovations, transcriptional plasticity and gene loss underlying the evolution and divergence of two highly polyphagous and invasive Helicoverpa pest species [J/OL]. BMC Biology, 2017, 15: 69. DOI:10.1186/s1291501704026.
[19]LI Zhaoqun, ZHANG Shuai, LUO Junyu, et al. Expression analysis and binding assays in the chemosensory protein gene family indicate multiple roles in Helicoverpa armigera[J]. Journal of Chemical Ecology, 2015, 41(5): 473485.
[20]LARTIGUE A, CAMPANACCI V, ROUSSEL A, et al. X-ray structure and ligand binding study of a moth chemosensory protein [J]. Journal of Biological Chemistry, 2002, 277(35):3209432098.
[21]PICIMBON J F, DIETRICH K, ANGELI S, et al. Purification and molecular cloning of chemosensory proteins from Bombyx mori [J]. Archives of Insect Biochemistry & Physiology, 2000, 44(3):120129.
[22]OZAKI M, WADA-KATSUMATA A, FUJIKAWA K, et al. Ant nestmate and non-nestmate discrimination by a chemosensory sensillum [J]. Science, 2005, 309(5732):311314.
[23]MALESZKA J, FORT S, SAINT R, et al. RNAi-induced phenotypes suggest a novel role for a chemosensory protein CSP5 in the development of embryonic integument in the honeybee (Apis mellifera) [J]. Development Genes & Evolution, 2007, 217(3):189196.
[24]LI Zhumei, DAI Lulu, CHU Honglong, et al. Identification, expression patterns, and functional characterization of chemosensory proteins in Dendroctonus armandi (Coleoptera: Curculionidae: Scolytinae) [J/OL]. Frontiers in Physiology, 2018, 9: 291. https:∥doi.org/10.3389/fphys.2018.00291.
[25]GU Shaohua, WANG Songying, ZHANG Xueying, et al. Functional characterizations of chemosensory proteins of the alfalfa plant bug Adelphocoris lineolatus indicate their involvement in host recognition[J/OL]. PLoS ONE, 2012, 7(8): e42871. DOI:10.1371/journal/pone.0042871.
[26]VENKATESHA M G AND DINESH A S. The coffee white stemborer Xylotrechus quadripes (Coleoptera: Cerambycidae): bioecology, status and management [J]. International Journal of Tropical Insect Science, 2012, 32(4): 177188.
[27]SHU Mei, CHENG Wenzhang, LI Zhongheng, et al. Survey of occurrence and damage of Xylotrechus quadripes Chevr on Simao coffee in Puer city [J]. Plant Diseases and Pests, 2016, 7(5/6): 57.
[28]THAPA S, LANTINGA E A. Growing coffee in the shade: a strategy to minimize the prevalence of coffee white stem borer, Xylotrechus quadripes [J]. Southwestern Entomologist, 2017, 42(2): 357362.
[29]吉帥帥, 莊翔麟, 劉乃勇. 滅字脊虎天牛觸角轉錄組中氣味結合蛋白基因的鑒定及表達譜分析[J]. 四川農業大學學報, 2018, 36(2): 193202.
[30]PANG Jixin, ZENG Xin, ZHU Jiayin, et al. Chemosensory transmembrane protein families in the coffee white stemborer, Xylotrechus quadripes (Coleoptera: Cerambycidae) [J]. Environmental Entomology, 2018, 47(4): 969981.
[31]ANDERSSON M N, GROSSEWILDE E, KEELING C I, et al. Antennal transcriptome analysis of the chemosensory gene families in the tree killing bark beetles, Ips typographus and Dendroctonus ponderosae (Coleoptera: Curculionidae: Scolytinae) [J/OL]. BMC Genomics, 2013, 14(1): 198. http:∥www.biome-dcentral.com/14712164/14/198.
[32]LIU Naiyong, LI Zongbo, ZHAO Ning, et al. Identification and characterization of chemosensory gene families in the bark beetle, Tomicus yunnanensis [J]. Comparative Biochemistry and Physiology Part D-Genomics and Proteomics, 2018, 25: 7385.
[33]PETERSEN T N, BRUNAK S, VON H G, et al.SignalP 4.0: discriminating signal peptides from transmembrane regions [J]. Nature Methods, 2011, 8(10): 785786.
[34]KUMAR S, STECHER G, TAMURA K. MEGA7: Molecular Evolutionary Genetics Analysis version 7.0 for bigger datasets [J]. Molecular Biology & Evolution,2016, 33(7): 18701874.
[35]ALLISON D J, BORDEN H J, SEYBOLD J S.A review of the chemical ecology of the Cerambycidae (Coleoptera) [J].Chemoecology, 2004, 14: 123150.
[36]GINZEL M D, HANKS L M. Role of host plant volatiles in mate location for three species of longhorned beetles [J]. Journal of Chemical Ecology, 2005, 31: 213217.
[37]LI Xiao, JU Qian, JIE Wencai, et al. Chemosensory gene families in adult antennae of Anomala corpulenta Motschulsky (Coleoptera: Scarabaeidae: Rutelinae)[J/OL]. PLoS ONE, 2015, 10(4): e0121504. https:∥doi.org/10.1371/journal.pone.0121504.
[38]LI Xiaoming, ZHU Xiuyun, WANG Zhiqiang, et al. Candidate chemosensory genes identified in Colaphellus bowringi by antennal transcriptome analysis [J/OL]. BMC Genomics, 2015, 16: 1028. DOI:10.1186/s1286401522363.
[39]ANTONY B, SOFFAN A, JAKE J, et al. Identification of the genes involved in odorant reception and detection in the palm weevil Rhynchophorus ferrugineus, an important quarantine pest, by antennal transcriptome analysis [J/OL]. BMC Genomics, 2016, 17(1): 69. DOI:10.1186/s1286401623626.
[40]WU Zhongzhen, BIN Shuying, HE Hualiang, et al. Differential expression analysis of chemoreception genes in the striped flea beetle Phyllotreta striolata using a transcriptomic approach [J/OL].PLoS ONE, 2016, 11(4): e0153067. DOI:10.1371/journal.pone.0153067.
[41]WANG Yinliang, CHEN Qi, ZHAO Hanbo, et al. Identification and comparison of candidate olfactory genes in the olfactory and non-olfactory organs of elm pest Ambrostoma quadriimpressum (Coleoptera: Chrysomelidae) based on transcriptome analysis [J/OL]. PLoS ONE, 2016, 11(1): e0147144. https:∥doi.org/10.1371/journal.pone.0147144.
[42]KITABAYASHI A N, ARAI T, KUBO T, et al. Molecular cloning of cDNA for p10, a novel protein that increases in the regenerating legs of Periplaneta americana (American cockroach) [J]. Insect Biochemistry and Molecular Biology, 1998, 28(10): 785790.
(責任編輯:田 喆)
收稿日期: 20190313?? 修訂日期: 20190425
基金項目:云南省科技廳青年項目(2017FD101)
致? 謝: 參加本試驗部分工作的還有江代禮、譚翰杰、張能和紀燁斌等同學,特此一并致謝。
通信作者?E-mail:naiyong_2013@163.com
#?為并列第一作者

