類胰島素性腺激素調控對蝦性腺分化的研究進展
任晉東,牛寶龍*,楊衛明,樓寶*
(1.浙江省農業科學院 水生生物研究所,浙江 杭州 310021; 2.海鹽縣水產技術推廣站,浙江 嘉興 314300)
我國是對蝦養殖大國。據統計,世界具有商業價值或潛在商業價值的蝦有300多種,我國近海對蝦種類達100多種[1],主要養殖類別包括凡納濱對蝦、中國對蝦、長毛對蝦、斑節對蝦、日本對蝦、墨古對蝦等,以及由此培育的新品種。隨著蝦苗種質資源退化和病害頻發等問題,我國對蝦養殖業受到巨大影響[2]。由于對蝦雌雄之間的某些生物學或經濟學性狀(生長速度、個體大小等)存在顯著差異,且性成熟后個體大小相差懸殊,如果實現單性化養殖,則可以縮短養殖周期,提高產量。
類胰島素性腺激素(insulin-like androgenic gland hormone,IAG)是甲殼類動物雄性個體性腺分化和維持性別特征的控制因子,其在雄性甲殼類動物性腺中的表達情況決定著雄性個體性腺的分化發育方向。IAG在對蝦性腺分化中調控分子機理的研究對于揭示對蝦性腺發育分化機理、提高對蝦生產效率和開發高產單性對蝦群體或配體套系具有重要的理論指導意義,并為開發更為便捷的對蝦性別逆轉方法提供理論基礎。
本文就對蝦性腺結構與作用、IAG介導對蝦性別控制、IAG與對蝦性腺分化作用、IAG調控對蝦性別控制機制的難點,以及以IAG為關鍵因子進行對蝦單性繁育群體構建的可行性措施進行綜述,旨在為對蝦單性繁育技術研究提供參考。
1 對蝦性腺結構特征
對蝦屬于節肢動物門、甲殼綱、十足目、對蝦科,可分為淡水類和海水類。雌性對蝦生殖系統主要包括卵巢及輸卵管等,輸卵管位于卵巢兩側,呈透明狀[3];雄性對蝦生殖系統主要包括精巢、輸精管和精囊莢,精莢囊末端附著有促雄性腺(圖1)。研究發現,凡納濱對蝦促雄性腺位于精莢囊的壺腹部,呈不規則塊狀結構(圖2)[4]。1962年,Charniaux-Cotton研究發現促雄性腺與甲殼動物雄性分化和發育相關[5];1999年,Khalaila等[6]發現促雄性腺素(insulin-like androgenic gland hormone,IAG)在沼蝦性腺分化中起決定性作用,至此揭開研究人員對IAG和甲殼類動物促雄性腺體主要功能的初步認識和了解。
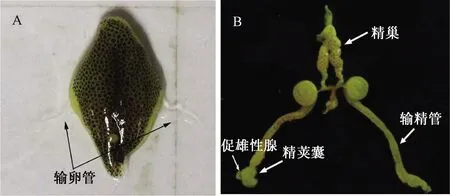
A—雌性對蝦;B—雄性對蝦。圖1 脊尾白蝦性腺的結構解剖
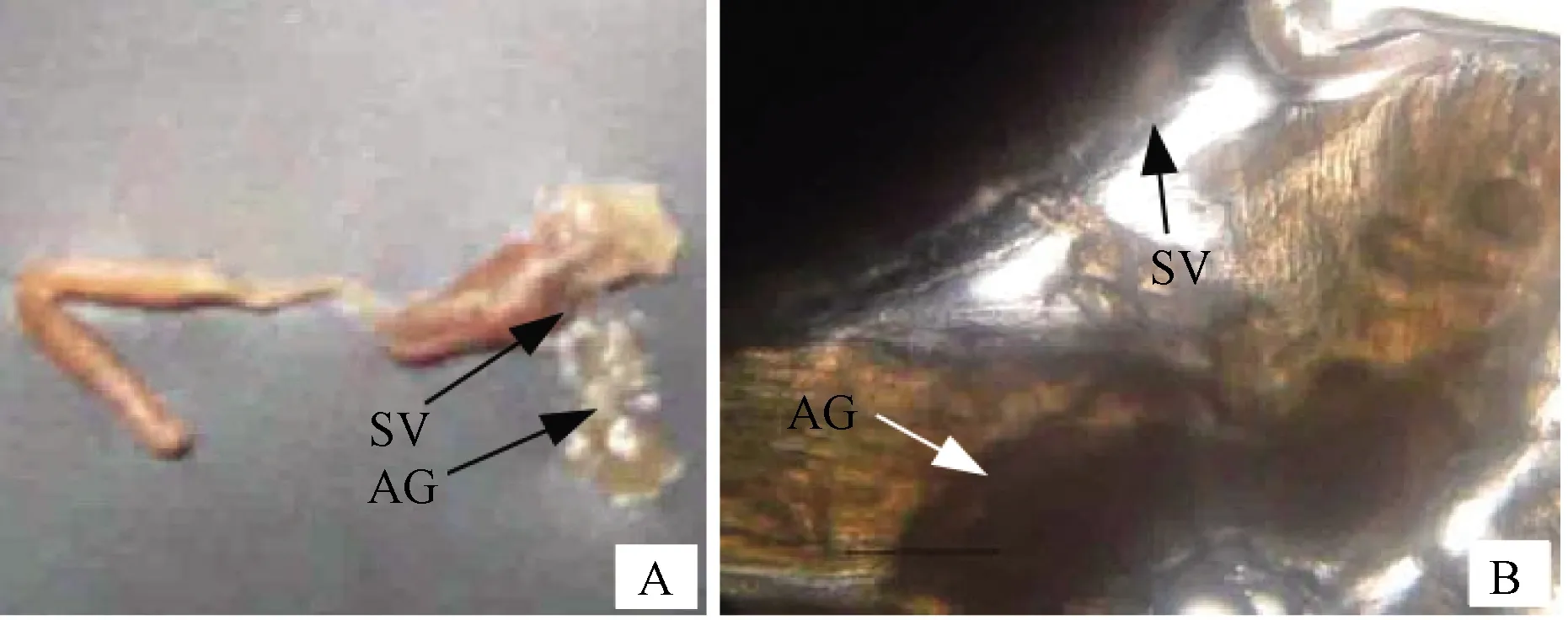
A—促雄性腺的外部形態;B—放大20倍的促雄性腺。SV—精莢囊;AG—促雄性腺。圖2 對蝦促雄性腺體的解剖結構
甲殼動物的促雄性腺常位于第五對步足基部,多數位于輸精管近末端[7]。厚紋蟹(Pachygrapsuscrassipes)促雄性腺呈索狀[8],纏繞在輸精管上,切面直徑30~50 μm,某些部位促雄性腺細胞聚集成團,腺體包被一層很薄的鞘膜,細胞質比較均勻,細胞核呈卵圓形,最大細胞直徑達8~10 μm[9]。中國明對蝦(Fenneropenaeuschinensis)與克氏原螯蝦(Procambarusclarkii)細胞類型相似[10],呈葡萄串狀,由長橢圓形和球形這2種細胞組成。凡納濱對蝦促雄性腺呈不規則的塊狀,通過結締組織與精莢囊相連,在不同的發育時期其結構和細胞類型會發生一定變化。
促雄性腺是雄性甲殼動物特有的內分泌器官,也是分泌IAG的唯一性腺體[11-12]。IAG分子由2條肽鏈組成,中間由2個二硫鍵連接,結構與胰島素家族類似,因此,又被稱為類胰島素性腺激素[13]。研究發現,促雄性腺不僅在雄性性別發育分化中具有一定的作用,而且在鰲蝦生長發育中也具有一定的功能[14]。Tekitek等[15]發現,甲殼類動物促雄性腺在性腺發育成熟的過程中存在高水平的甲基化酶表達,而DNA甲基化對于細胞分化過程中多個基因座大規模改變產生作用[16],表明雌雄個體IAG差異表達與上游的甲基化調控存在一定關聯。然而,IAG在促雄性腺體發育分化中是否受到DNA甲基化酶的調控尚不明確,尤其是在IAG不表達的情況下,其誘導的性腺逆轉分化調控分子機制還有待于進一步研究。
2 IAG結構特征與特性
IAG是甲殼類動物雄性個體性腺分化和維持性別特征的控制因子,由雄性個體的性腺體分泌,并且決定了雄性個體的性特征[17-18]。在缺乏IAG的情況下,雄性個體會出現性逆轉,表現出雌性繼發性特征和卵黃發生;將能夠分泌IAG的AG細胞懸液植入未成熟雌性個體中,導致雌性個體性逆轉和卵黃發生停止[19]。由于IAG在雄性甲殼類動物性腺中的表達情況決定著雄性個體性腺的分化發育方向(圖3),常用其作用于甲殼類動物,以構建單性繁殖群體,培育高產的甲殼類動物優勢種群或新品種。
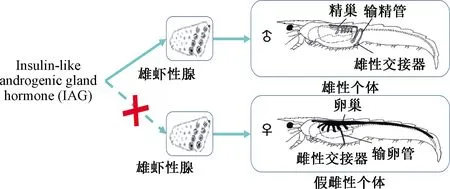
圖3 IAG對甲殼類動物雄性個體性別的控制機理
已有甲殼類動物性別控制方法較多,Levy等[20]利用性腺細胞移植進行羅氏沼蝦雄性個體性別翻轉,Sellars等[21]利用三倍體誘導進行對蝦性別控制,Lezer等[19]利用RNA干擾表達技術進行IAG基因表達控制,從而調控甲殼類動物性腺分化。水產動物性腺分化較復雜[22],而IAG對于甲殼類動物性腺分化控制的高效性,決定了IAG在調控甲殼類動物性腺分化機制中的關鍵性作用。IAG主要通過性腺激素調控軸和神經遞質傳遞調控軸2種途徑進行性別控制。性腺激素調控途徑中,性腺刺激激素、IAG和性腺抑制激素發揮關鍵作用;在神經遞質調控途徑中,僅有性腺抑制基因存在關鍵調控作用。IAG的表達對性腺抑制激素基因的表達有影響,但IAG調控的下游轉錄因子有哪些,這些調控因子如何控制性腺分化,以及IAG基因自身表達調控的分子機制尚處于探索階段。
3 IAG介導的對蝦性別控制
IAG是維持甲殼動物雄性個體性腺分化發生的唯一確定的關鍵因子,其自身表達也具有顯著的時空特征[23-24],IAG具有調控雄性分化、維持雄性第二性征的功能,可抑制甲殼動物的卵巢發育[25]。IAG不表達的情況下,雄性個體保持雌性個體特征,分化形成雌性生殖腺,產生成熟的卵子[19]。
Ventura等[26]通過RNAi對羅氏沼蝦雄性個體IAG基因進行沉默表達研究,發現其在甲殼類動物性腺逆轉分化過程中產生作用。在羅氏沼蝦幼蟲階段后期注射雙鏈的IAG干擾表達序列,羅氏沼蝦逆轉成全雌性表征個體,并具有完整的雌性羅氏沼蝦繁殖生殖系統[27]。利用IAG干擾表達和兩階段式的生產繁育方式,可以大范圍培育全雄性個體的繁育生產群體,是甲殼類動物單性繁殖的研究熱點[20,28]。兩階段式生產方式指通過注射雙鏈的IAG干擾表達RNA序列獲得假雌性個體,然后利用假雌性個體與真雄性個體繁殖生產,孵化獲得全雄性個體的生產群體。同時基于IAG的RNAi干擾技術,研究獲得了甲殼類動物早期性別鑒定的高效生物標記[29]。已有研究發現IAG在甲殼類動物性別控制中的關鍵作用,但對于IAG調控甲殼類水產動物性腺逆轉分化和生殖系統表觀遺傳特征的生物信號通路仍未知,其分子機制有待進一步研究。
4 IAG與對蝦性腺分化
甲殼類動物中雄性個體的性腺分化受到雄激素腺體控制[5],雄激素腺體是甲殼動物雄性個體性器官發育成熟過程中最重要的參與者[30]。雄激素腺體不僅能夠在甲殼動物雄性遺傳基礎上發揮雄性化的調控作用,也可以令雌性個體在原有遺傳基礎上逆轉形成雄性生殖腺體,并產生相似的雄性生殖特性[31]。當雄性甲殼類個體摘除雄激素腺體后,雄性個體能夠表現出雌性個體的繁殖特征[32]。Manor等[30]研究發現,IAG是由雄激素腺體分泌的性別控制關鍵因子,是雄激素腺體發揮功能的關鍵分子。在雙鏈核糖核酸注射沉默IAG編碼基因的情況下,會導致甲殼蝦類動物雄性個體的性腺逆轉分化[19]。
盡管IAG基因在雌雄個體基因組中都有發現,但最初研究人員一直認為其僅在雄激素腺體中表達。IAG不僅具有誘導雄性個體性腺分化的作用,還具有刺激雌性個體生長和性器官發育的功能[25,33]。雖然IAG在孤雌生殖的十足目物種中也有表達[20],但由于研究技術局限,還未探明其調控機制。隨著單細胞轉錄組測序技術的成熟和凡納濱對蝦基因組的成功破譯,為深入探索對蝦性腺分化分子機理提供了必要的系統資源[34]。已有研究通過單細胞轉錄組測序技術完成首個哺乳動物的細胞轉錄圖譜,為進一步揭示其他物種不同細胞轉錄調控通路提供了很好的技術借鑒[35],也為進一步挖掘IAG的系統調控網絡圖譜提供了方法工具。
5 利用IAG構建單性對蝦繁育群體的難點
雖然IAG作為一種有效的水產動物性別逆轉關鍵因子,但將其應用于對蝦單性繁育存在以下難點。一是對蝦性腺分化關鍵期較難確定。對蝦的發育包括幼體、康蝦、籽蝦、成蝦等階段,在性別分化時間上存在很大的差異。楊炎等[36]研究發現,米蝦的雌雄個體性腺分化階段存在時間差異,雌性個體的卵巢從孵化后第10天開始分化,形成早期的卵原細胞,而雄性個體精巢分化要早于雌個體。與米蝦相比,羅氏沼蝦的性腺分化階段相對較晚,羅氏沼蝦體長達到3~5 cm時還處于分化中[37]。海水類對蝦的性腺分化更加復雜,其分化過程易受到溫度、鹽度等因素影響[38]。對蝦性腺分化時體長僅為1 cm左右,很難進行生物技術干擾等操作,因此,對蝦實現性逆轉或單性養殖的難度較大。二是性染色體類型具有不確定性。對蝦染色體數量和類型具有多樣性[39],已有研究通過人工染色體庫技術構建了羅氏沼蝦“ZW”類型表達基因庫[40],但IAG基因是否位于性染色體或是常染色體上仍未知。三是性別分化的分子機制尚未明確。雖然IAG基因的表達對性腺抑制激素基因的表達有影響,但是IAG調控的下游轉錄因子有哪些、這些調控因子如何控制性腺分化,以及IAG基因自身表達調控的分子機制尚處于未知階段,這也給進一步利用IAG調控通路進行單性繁育群體構建提出了挑戰。
6 對蝦單性繁育技術研究策略
基于對蝦單性繁育技術的難點,可以針對性的利用成熟的生物基因組重測序技術,探明IAG表達的上游調控機制,以及Microwell-Seq技術和生物信息學方法找到對蝦性腺分化的起始關鍵時間點,利用IAG干擾后的假雌性和真雄性個體性腺分化前后的差異表達基因,預測特異性的IAG靶向調控基因,并進行體外驗證,最終闡明IAG在對蝦性腺分化控制中的分子機理,實現對蝦高產單性群體的培育。具體做法包括以下幾個方面。
對蝦性別分化關鍵時間點的研究。利用Microwell-seq測序分析和生物信息學手段分析孵化30~60 d對蝦性腺的差異基因表達譜,以IAG的表達時序為參考對象,找到對蝦性腺分化的關鍵起始點,構建以IAG沉默為基礎的性別逆轉假雌個體,并與野生型雄性個體的雜交,研究后代IAG的隨性別變化情況,分析沉默IAG的伴性遺傳特點,確定對蝦性染色體類型及IAG位置,為后期進行對蝦單性繁育群組建奠定基礎。
雌雄個體基因組差異比較。利用對蝦早期性別鑒定,收集鑒定后的雌雄腺體生殖細胞,構建雌雄個體IAG全基因組結構圖譜,分析雌雄個體IAG基因調控關鍵區域的甲基化差異,分析甲基化與IAG基因表達的對應關系,并對IAG基因的全長、5′和3′側翼序列的差異進行比較,獲得雌雄個體性腺分化的遺傳基礎差異及IAG基因結構差異,形成IAG基因表達上游調控通路結構圖。
IAG調控基因下游網絡分析。利用干擾技術收集假雌和真雄個體雄激素腺體細胞,開展Microwell-seq測序分析,利用生物信息學手段篩選干擾雄激素腺體細胞和野生型雄激素腺體細胞之間的差異基因表達譜,預測差異基因間的靶向調控關系,并對其中的差異表達轉錄因子與差異的甲基化位點進行表達譜分析,繪制IAG與差異轉錄因子和差異甲基化位點之間的網絡互作關系,并進行關系驗證。
利用以上研究,找出最佳的對蝦性腺分化逆轉通路,形成凡納濱對蝦的全雌或全雄繁育體系,培育高產的單性繁殖群體或品種,也為其他甲殼類動物全雌或全雄群體構建提供理論依據。

