miR-20a-5p靶向調控BRMS1L對人結直腸癌細胞株SW480增殖、凋亡能力的影響及其機制探討
陳杰
湖南省腫瘤醫院,長沙 410000
結直腸癌是臨床常見的消化道惡性腫瘤,常發生在直腸和乙狀結腸交界處,發病率在人體惡性腫瘤中居第三位[1]。結直腸癌起病隱匿,易轉移,預后較差,病死率較高。因此,探討發病機制結直腸癌對早期診斷、個體化治療、提高治療效果、改善患者生存和預后具有重要意義。微小RNA(miRNA)作為一種內源性RNA,其通過靶向mRNA在轉錄后水平進行翻譯抑制或降解調節基因表達,調節細胞生長、分化、增殖和凋亡[2]。多項研究[3~5]表明,miRNA可作為抑癌基因或癌基因發揮作用,參與包括結直腸癌在內的多種腫瘤的發生、進展和耐藥等生物學過程。微小RNA-20a-5p(miR-20a-5p)是一種常見的miRNA,其在結直腸癌中表達上調,并發揮致癌基因的功能[6,7]。然而,miR-20a-5p在結直腸癌發生發展中的生物學作用和確切機制仍不清楚。生物信息學分析顯示,乳腺癌轉移抑制基因1(BRMS1L)是miR-20a-5p的潛在功能性靶基因之一,BRMS1L是一種新的抑癌基因,在卵巢癌和乳腺癌中表達下調,上調其表達可抑制癌細胞的侵襲和轉移[8,9]。然而,miR-20a-5p靶向BRMS1L是否參與結腸癌進展尚未可知。本研究觀察了miR-20a-5p靶向調控BRMS1L對人結直腸癌細胞株SW480增殖、凋亡能力的影響,并探討其可能作用機制。
1 材料與方法
1.1 細胞株、轉染物及主要試劑 人結直腸癌細胞株SW480、DLD-1、HCT116及正常結直腸黏膜細胞株FHC購自中國科學院上海細胞庫。miR-20a-5p抑制物(anti-miR-20a-5p)、miR-20a-5p抑制物陰性對照(anti-miR-NC)、BRMS1L過表達載體(pcDNA-BRMS1L)、BRMS1L過表達載體陰性對照(pcDNA-NC)、miR-20a-5p模擬物(miR-20a-5p mimics)、miR-20a-5p模擬物陰性對照(miR-NC)及BRMS1L小干擾RNA陰性對照(si-NC)、BRMS1L小干擾RNA(si-BRMS1L)購自上海吉瑪制藥技術有限公司;含有miR-20a-5p結合位點的BRMS1L-3′UTR野生型(WT-BRMS1L)及突變型(MUT-BRMS1L)報告基因載體的構建由南京諾唯贊生物科技公司提供。DMEM-12、DMEM、RPMI1640培養基和胎牛血清購自美國Hyclone公司;LipofectamineTM2000購自美國Thermo公司;TRIzol試劑、細胞計數試劑盒(CCK-8)、膜聯蛋白V異硫氰酸熒光素/碘化丙啶(Annexin V-FITC/PI)細胞凋亡檢測試劑盒購自北京索萊寶生物科技公司;兔抗BRMS1L、細胞周期素D1(CyclinD1)、活化的含半胱氨酸的天冬氨酸蛋白水解酶3(Cleaved-Caspase-3)、β-連環蛋白(β-catenin)抗體購自美國Abcam公司;山羊抗兔Ⅱ抗購于上海碧云天公司。
1.2 結腸癌細胞株的選擇 采用qRT-PCR法和Western blotting法檢測FHC、SW480、DLD-1、HCT116細胞中miR-20a-5p mRNA和BRMS1L mRNA、蛋白。FHC、SW480、DLD-1、HCT116細胞中miR-20a-5p mRNA分別為1.00±0.10、3.22±0.32、3.01±0.30、2.35±0.24,BRMS1L mRNA分別為1.02±0.11、0.35±0.04、0.44±0.05、0.30±0.03,BRMS1L蛋白分別為1.04±0.12、0.33±0.03、0.42±0.04、0.45±0.05,SW480、DLD-1、HCT116細胞與FHC細胞比較,P均<0.05。SW480與FHC細胞比較差異最為顯著,根據以上結果,選擇SW480細胞作為本研究的實驗細胞。
1.3 SW480細胞anti-miR-20a-5p、pcDNA-BRMS1L轉染 取SW480細胞,將細胞接種到6孔板,當細胞密度達到60%時利用脂質體LipofectamineTM2000進行轉染,A、B、C、D、E、F組分別轉染anti-miR-20a-5p、anti-miR-NC、pcDNA-BRMS1L、pcDNA-NC、anti-miR-20a-5p+si-BRMS1L、anti-miR-20a-5p+si-NC,6 h后換液,轉染48 h,轉染合格后,取上述各組細胞進行后續實驗。
1.4 轉染anti-miR-20a-5p、pcDNA-BRMS1L的SW480細胞增殖能力觀察 ①存活率:采用CCK-8法。將A、B、C、D、E、F組SW480細胞按照每孔3 000接種96孔板,培養48 h后,每孔加入10 μL的CCK-8試劑,培養箱孵育2 h。檢測450 nm的吸光度值(A值),以空白孔調零,結果以細胞存活率表示,細胞存活率=(對照組A值/實驗組A值)×100%。②CyclinD1蛋白:采用Western blotting法。將A、B、C、D、E、F組SW480細胞接種到6孔板,細胞密度為80%時,采用Western blotting法檢測細胞中CyclinD1蛋白。CyclinD1蛋白相對表達量=CyclinD1灰度值/β-actin灰度值。
1.5 轉染anti-miR-20a-5p、pcDNA-BRMS1L的SW480細胞凋亡能力觀察 ①凋亡率:采用Annexin V-FITC/PI雙染法。將A、B、C、D、E、F組SW480細胞接種到6孔板,細胞密度為80%時,用胰蛋白酶消化各組細胞,離心收集細胞沉淀,添加500 μL的結合緩沖液,加入Annexin V-FITC和PI染液各5 μL,用流式細胞儀檢測細胞凋亡變化,結果以細胞凋亡率表示。②Cleaved-Caspase-3蛋白:檢測方法參照“1.4”中CyclinD1蛋白的檢測方法。
1.6 轉染anti-miR-20a-5p、pcDNA-BRMS1L的SW480細胞β-catenin蛋白檢測 檢測方法參照“1.4”中CyclinD1蛋白的檢測方法。
1.7 miR-20a-5p與BRMS1L之間靶向關系、調控作用驗證 ①靶向關系:采用雙熒光素酶報告基因實驗。將miR-20a-5p mimics、miR-NC分別與WT-BRMS1L或MUT-BRMS1L共轉染至SW480細胞(分別記為G、H組),轉染48 h,采用雙熒光素酶報告基因檢測系統檢測兩組細胞熒光素酶活性。②調控作用:采用Western blotting法。將SW480細胞接種到6孔板,當細胞密度達到60%時,將miR-20a-5p mimics、miR-NC、anti-miR-20a-5p、anti-miR-NC分別轉染SW480細胞(分別記為I、J、K、L組),48 h后采用Western blotting法檢測BRMS1L蛋白。

2 結果
2.1 各組細胞存活率、凋亡率及CyclinD1、Cleaved-Caspase-3蛋白相對表達量比較 細胞存活率、凋亡率及CyclinD1、Cleaved-Caspase-3蛋白相對表達量比較見表1。
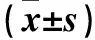
表1 各組細胞存活率、凋亡率及CyclinD1、Cleaved-Caspase-3蛋白相對表達量比較
注:與B組比較,*P<0.05;與D組比較,△P<0.05;與F組比較,﹟P<0.05。
2.2 各組β-catenin蛋白相對表達量比較 A、B、C、D、E、F組β-catenin蛋白相對表達量分別為0.36±0.04、0.72±0.07、0.42±0.03、0.70±0.06、0.60±0.06、0.34±0.03,anti-miR-20a-5p組、anti-miR-NC組比較,pcDNA-BRMS1L組、pcDNA-NC組比較,anti-miR-20a-5p+si-BRMS1L組、anti-miR-20a-5p+si-NC組比較,P均<0.05。
2.3 各組細胞熒光素酶活性及BRMS1L蛋白相對表達量比較 兩組細胞熒光素酶活性比較見表2。I、J、K、L組BRMS1L蛋白相對表達量分別為0.12±0.01、0.36±0.04、0.82±0.08、0.38±0.05,I、J組比較,K、L組比較,P均<0.05。
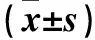
表2 兩組細胞WT-BRMS1L、MUT-BRMS1L相對熒光素酶活性比較
注:與H組比較,*P<0.05。
3 討論
結直腸癌又叫大腸癌,是指大腸上皮來源的癌癥,好發于40歲以上的中老年人,且男性多于女性,多數患者后期可出現大便性狀改變、便血和腹痛。雖然外科手術治療、術后放化療、靶向治療等綜合治療手段不斷改善,但每年全球新增結腸癌患者高達100萬例,且死亡人數超過69萬例[1],是亟待解決的全球公共衛生問題。結直腸癌細胞株SW480、DLD-1、HCT116是研究結直腸癌常用的體外細胞模型,本研究通過探討人正常結直腸黏膜細胞株FHC和結直腸癌細胞株DLD-1、HCT116、SW480中miR-20a-5p和BRMS1L表達變化,選取miR-20a-5p表達最高、BRMS1L表達較低的SW480細胞進行功能試驗,并探討miR-20a-5p和BRMS1在結直腸癌細胞增殖和凋亡中的作用,以期為結直腸癌防治提供新的策略。
miRNA作為人類疾病的重要參與者,其在包括結腸癌在內的多種腫瘤中表達失調并參與細胞增殖失控、凋亡抑制和促進侵襲轉移過程地調控。miR-20a-5p是一種致癌基因,既往研究顯示肝癌[10]、三陰性乳腺癌[11]中miR-20a-5p呈高表達,其高表達促進了腫瘤細胞的生長、遷移和侵襲。然而,在神經母細胞瘤中,miR-20a-5p卻表達下調,并發揮抑癌基因作用[12]。BRMS1與組蛋白去乙酰化酶、特定的轉錄因子形成復合物,從而調節轉移相關基因的表達,抑制多種腫瘤類型的轉移。研究[13]顯示,BRMS1在結腸癌中表達降低,檢測BRMS1是判斷結腸癌轉移和預后情況的重要指標。BRMS1L是BRMS1的類似物,腺癌組織中BRMS1L的表達降低與轉移以及患者較差的生存相關,BRMS1L通過誘導FZD10表觀遺傳沉默抑制乳腺癌轉移[14]。在膠質瘤中,BRMS1L表達降低與高級別膠質瘤以及生存分析中較高的病死率顯著相關[15]。miR-934通過靶向BRMS1L促進卵巢癌細胞增殖,抑制細胞凋亡[16]。miR-93-5p通過靶向BRMS1L調控Wnt信號通路促進淚腺腺樣囊性癌的發生[17]。本研究通過功能缺失、獲得實驗分析miR-20a-5p和BRMS1L在結直腸癌細胞增殖、凋亡中的作用,發現抑制miR-20a-5p表達、過表達BRMS1L均可降低SW480細胞存活率,并升高細胞凋亡率。同時雙熒光素酶報告實驗證實,BRMS1L是miR-20a-5p的靶基因,miR-20a-5p可在蛋白水平負性調控BRMS1L表達。此外恢復實驗顯示,抑制BRMS1L表達還可部分逆轉抑制miR-20a-5p對SW480增殖和凋亡的影響。以上研究說明,miR-20a-5p通過靶向BRMS1L在結直腸癌進展中發揮作用。
CyclinD1又叫G1/S-特異性周期蛋白-D1,其通過激活G1期特有的周期蛋白依賴性激酶,促進G1周期抑制蛋白的磷酸化,推動細胞周期向S期過渡,其過度表達可致細胞增殖失控而惡性化,是目前公認為原癌基因[18~20]。研究顯示,上調miR-20a-5p表達可有效降低腎小管上皮細胞中CyclinD1表達,誘導G1期阻滯,抑制細胞增殖[21]。Caspase-3是細胞凋亡過程中最主要的終末剪切酶,Caspase-3的活化可引起細胞不可逆凋亡[22]。本研究發現,抑制miR-20a-5p表達、過表達BRMS1L均可降低SW480細胞中CyclinD1蛋白表達,升高Cleaved-Caspase-3蛋白的表達,且抑制BRMS1L表達還可部分逆轉抑制miR-20a-5p對SW480細胞CyclinD1蛋白和Cleaved-Caspase-3蛋白表達的影響。說明抑制miR-20a-5p通過靶向上調BRMS1L可有效抑制結腸癌細胞增殖,誘導細胞凋亡。
Wnt/β-catenin信號通路是一條經典的Wnt信號通路,在多數情況下,β-catenin的過度活化可誘導腫瘤發生。研究[23~25]顯示,在多種結直腸癌中腫瘤抑制基因的突變可阻礙β-catenin的降解和磷酸化,引起β-catenin在細胞核聚集,結合T細胞轉錄因子和淋巴細胞增強因子,促進下游原癌基因表達,而抑制Wnt/β-catenin信號通路活化對腫瘤細胞的增殖、侵襲和耐藥有明顯的抑制作用,提示Wnt/β-catenin信號通路是結直腸癌的潛在治療靶點。本研究發現,抑制miR-20a-5p表達、過表達BRMS1L均可抑制Wnt/β-catenin信號通路活化,而抑制BRMS1L表達還可部分逆轉抑制miR-20a-5p對Wnt/β-catenin信號通路的影響。提示miR-20a-5p通過靶向BRMS1L表達參與結直腸癌進展和調控Wnt/β-catenin信號通路有關。
總之,抑制miR-20a-5p通過靶向BRMS1L可抑制結直腸癌細胞增殖,并促進細胞凋亡,機制可能與其抑制Wnt/β-catenin信通路有關。

