黃嘌呤和谷氨酰胺對枯草芽孢桿菌XGL產腺苷的影響
梅漫莉,李國華,徐慶陽
(1.天津科技大學 代謝控制發酵技術國家地方聯合工程實驗室,天津 300457;2.天津科技大學 天津市氨基酸高效綠色制造工程實驗室,天津 300457;3.天津科技大學 生物工程學院,天津 300457)
腺苷(adenosine),化學名為9-β-D-呋喃核糖基腺嘌呤[1],指由腺嘌呤的N-9與D-核糖的C-1通過β糖苷鍵連接而成的化合物,其磷酸酯為腺苷酸。腺苷可直接進入心肌經磷酸化生成腺苷酸,參與心肌能量代謝,同時還參與擴張冠狀血管,增加冠脈血流量[2-4],是合成-磷酸腺苷(adenosine monophosphate,AMP)、環腺苷酸(cyclic adenosine monophosphate,cAMP)、三磷酸腺苷(adenosine triphosphate,ATP)的主要原料,ATP已被廣泛應用于治療心不全、腦動脈硬化及肌肉萎縮等疾病[5-6]。此外,腺苷還是一種抑制性神經傳導物,在神經傳遞中起重要作用[7-8]。
腺苷的生產方法主要有化學合成法、核糖核酸(ribonucleic acid,RNA)水解法和發酵法[9-10]。化學合成法是以不同化學物質為底物進行化學合成腺苷,該方法合成腺苷存在著成本偏高,反應繁瑣,產量低,收率低等一系列問題。RNA水解法是利用磷酸二酯酶水解酵母RNA,得到4種5'-核苷酸,然后進一步水解脫磷酸,該方法的缺陷是同時會得到4種核苷物質[11],導致產物不易分離。而發酵法是通過選育解除了終產物反饋抑制的枯草芽孢桿菌(Bacillus subtilis)[12]或短小芽孢桿菌(Bacillus pumilus)進行直接發酵,發酵過程中提供充足的營養使菌體大量繁殖并生產腺苷。發酵法生產腺苷成本較低,原料易得,且生產過程相對簡單,產苷效率較高,因此,在腺苷生產中占據絕對優勢。日本早在七十年代就開始了腺苷發酵生產工藝技術的研究,并不斷取得技術上的突破,迄今已進入大規模工業生產階段[11]。腺苷作為藥物,也首先由日本于1989年投入美國市場,隨后又在法國、比利時、英國等多個國家獲得批準[13]。目前我國的腺苷生產方法主要依靠化學法和酶法,成本較高,污染比較嚴重,我國發酵法生產腺苷起步較晚,僅有幾家公司可以利用直接發酵法生產腺苷并達到工業化規模,與國外相比,我國利用發酵法生產腺苷的產量低,生產效率低[11]。
前期研究發現,黃嘌呤和谷氨酰胺對菌株生長及產腺苷非常重要,當發酵液中缺乏黃嘌呤時,菌株停止生長和產腺苷,只有發酵液中黃嘌呤達到一定濃度時菌體才持續生長和產腺苷[11]。谷氨酰胺是腺苷合成的前體物質,為了調節發酵過程中pH的變化,發酵過程中補加了大量的氨水,這會影響谷氨酰胺合成酶的活力,進而影響腺苷的產量[11]。因此,本研究以解除了終產物反饋抑制的Bacillus subtilisXGL為出發菌株,從添加方式和添加量兩個方面來探究黃嘌呤和谷氨酰胺對Bacillus subtilisXGL生產腺苷的影響,以期找到黃嘌呤和谷氨酰胺最適添加量和最適添加方式,從而進一步提高腺苷產量。
1 材料與方法
1.1 材料與試劑
1.1.1 菌種
枯草芽孢桿菌(Bacillus subtilis)XGL(此菌株是經紫外誘變篩選得到的,是組氨酸和黃嘌呤缺陷型菌株):天津科技大學代謝工程研究室。
1.1.2 化學試劑
MnSO4·H2O(分析純):天津市化學試劑六廠;葡萄糖、MgSO4·7H2O(均為分析純):天津市耀華化工廠;FeSO4·7H2O(分析純):天津化學試劑三廠;KH2PO4·3H2O(分析純):天津塘沽化學試劑廠;米漿(純度40%):河北梅花味精集團有限公司;黃嘌呤(純度99.9%)、L-谷氨酰胺(純度98.5%):北京索萊寶科技有限公司。其他試劑均為國產分析純。
1.1.3 培養基
活化培養基[14]:牛肉膏10 g/L,葡萄糖2 g/L,氯化鈉2.5 g/L,蛋白胨10 g/L,酵母粉5 g/L,黃嘌呤50 mg/L,組氨酸50 mg/L,瓊脂30 g/L。pH 7.0~7.2,121 ℃高壓滅菌20 min。
種子培養基[15]:葡萄糖25 g/L,豆濃20 g/L,酵母粉5 g/L,MgSO4·7H2O 0.4 g/L,維生素B1(vitamin B1,VB1)1 mg/L,維生素H 1 mg/L,玉米干粉25 g/L(121 ℃高壓滅菌20 min),磷酸二氫鉀1.5 g/L,蛋白胨8 g/L,黃嘌呤100 mg/L,組氨酸50 mg/L。pH 6.4~6.7,115 ℃高壓滅菌15 min。
發酵培養基[16]:葡萄糖100 g/L,豆濃50 g/L,酵母粉25 g/L,MgSO4·7H2O 5 g/L,VB12 mg/L,維生素H 2 mg/L,玉米干粉25 g/L(121 ℃高壓滅菌20 min),味精12 g/L,磷酸氫二鉀4.5 g/L,葡萄糖酸鈉1.5 g/L,黃嘌呤100 mg/L,組氨酸50 mg/L,氯化鈣2 g/L,FeSO4·7H2O 6 mg/L,硫酸錳6 mg/L。pH 7.0~7.2,115 ℃高壓滅菌15 min。
1.2 儀器與設備
BIOTECH-5BG 5 L自動控制發酵罐:上海保興生物設備工程有限公司;SBA-40E生物傳感分析儀:山東省科學院生物研究所;Agilent 1200高效液相色譜(high performance liquid chromatography,HPLC)儀:美國Agilent公司;752型紫外分光光度計:上海精密科學儀器有限公司。
1.3 方法
1.3.1 枯草芽孢桿菌XGL的培養
菌種活化與擴培:用接種環挑取斜面培養基保藏的菌種劃線于斜面培養基,32℃條件下恒溫培養10~12h。然后將其接種于茄形瓶培養基,32 ℃條件下恒溫培養10~12 h,待用。
種子液的制備:用無菌水沖洗茄形瓶培養基上的菌體,然后接種至裝有3L種子液的5 L發酵罐中,設置溫度為32℃,pH 為7.0(采用氨水調節pH值),轉速為200 r/min,通風量為2 L/min,培養10~13 h。菌體量(OD600nm值)生長至15時為種子液。
菌株的發酵:按15%(V/V)的接種量將種子液接種于發酵培養基,裝液量3L/5L,設置溫度為32℃,轉速為200 r/min。發酵過程中通過自動流加氨水調節pH,pH前期控制在7.0左右,后期控制在6.4左右。發酵過程中需要調節通風量將溶氧前期控制在30%~40%之間,后期控制在10%~20%之間。發酵20 h后測定發酵液中的糖質量濃度,糖質量濃度控制在5~30 g/L之間。后續如果糖濃度偏低通過自動流加80%的葡萄糖溶液。
1.3.2 黃嘌呤的添加時機及添加方式
黃嘌呤添加時機:發酵培養基中黃嘌呤的初始質量濃度為100 mg/L,在發酵16 h或32 h時,一次性補加0.2 g/L的黃嘌呤。發酵過程中每隔4 h測定菌體生物量及腺苷產量。
黃嘌呤添加方式:發酵培養基中黃嘌呤的初始質量濃度為100 mg/L,若黃嘌呤的添加方式為加入底料的方式,則在發酵培養基中再加入0.2 g/L的黃嘌呤。若采用一次性補加的方式,則在發酵16 h后一次性補加0.2 g/L的黃嘌呤。若采用分批次補加的方式,則分別在16 h、24 h、32 h、40 h、48 h、52 h時分別加入33 mg/L的黃嘌呤。若采用流加的方式,則在發酵16 h后持續流加質量濃度為3 g/L的黃嘌呤溶液200 mL。發酵過程中每隔4 h測定菌體生物量、葡萄糖消耗速率及腺苷產量。
1.3.3 谷氨酰胺的添加量及添加方式
在黃嘌呤最佳添加條件下進一步研究谷氨酰胺對枯草芽孢桿菌(Bacillus subtilis)XGL產腺苷的影響。
底物中谷氨酰胺添加量:分別在發酵培養基中添加0、3 g/L、6 g/L、9 g/L、12 g/L谷氨酰胺。發酵過程中每隔4 h測定菌體生物量、葡萄糖消耗速率及腺苷產量,發酵56 h計算糖苷轉化率。
谷氨酰胺流加量:在發酵培養基中添加6 g/L的谷氨酰胺,在此基礎上在發酵32 h以后持續向發酵罐里流加0、3 g/L、6 g/L、9 g/L、12 g/L的谷氨酰胺。發酵過程中每隔4 h測定菌體生物量、葡萄糖消耗速率及腺苷產量,發酵56 h計算糖苷轉化率。
1.3.4 分析檢測
菌體量的測定:通過分光光度計測定發酵液在波長600nm下的吸光度值[17];糖含量的測定:發酵液經13000r/min離心2 min后,取上清液,經適當稀釋,采用SBA-40E生物傳感器進行檢測;葡萄糖補加量測定:用電子天平記錄80%葡萄糖液的補加量;腺苷產量的測定:采用高效液相色譜法檢測發酵液中腺苷的含量[18-21]。葡萄糖消耗速率及糖苷轉化率計算公式如下:


1.3.5 數據處理
所有試驗重復3次,取平均值;采用Origin 2018軟件作圖;采用SPSS17.0進行單因素方差分析。
2 結果與分析
2.1 黃嘌呤對枯草芽孢桿菌XGL產腺苷的影響
2.1.1 黃嘌呤的添加時機對枯草芽孢桿菌XGL產腺苷的影響
黃嘌呤添加時機對枯草芽孢桿菌XGL生物量及腺苷產量的影響見圖1。
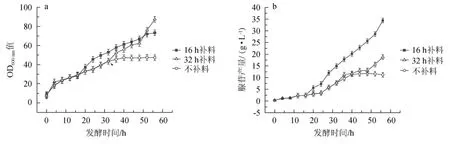
圖1 黃嘌呤的添加時機對枯草芽孢桿菌XGL生物量(a)及腺苷產量(b)的影響Fig.1 Effect of xanthine addition time on biomass(a)and adenosine production(b)of Bacillus subtilis XGL
由圖1可知,在發酵前期,發酵培養基中添加有一定量的黃嘌呤,菌體長勢較快,腺苷產量較低。當發酵16 h時,添加0.2 g/L黃嘌呤,與未添加黃嘌呤組相比,菌體生長速率加快,且腺苷產量升高。當發酵32 h時,添加0.2 g/L黃嘌呤,與未添加黃嘌呤組相比,菌體開始大量生長,且腺苷產量增加;與發酵16 h時添加黃嘌呤組相比,菌體生長速度變快,但腺苷產量較低。結果表明,菌體出現長勢緩慢、腺苷產量較低的現象可能是由于黃嘌呤的缺乏導致的,因此,在發酵16 h時,向發酵液中及時添加0.2 g/L的黃嘌呤,以確保發酵液中黃嘌呤的量,從而促進菌體的持續生長和腺苷的生產。
2.1.2 黃嘌呤添加方式對枯草芽孢桿菌XGL產腺苷的影響
黃嘌呤添加方式對枯草孢桿菌XGL生物量、葡萄糖消耗速率及腺苷產量的影響見圖2。
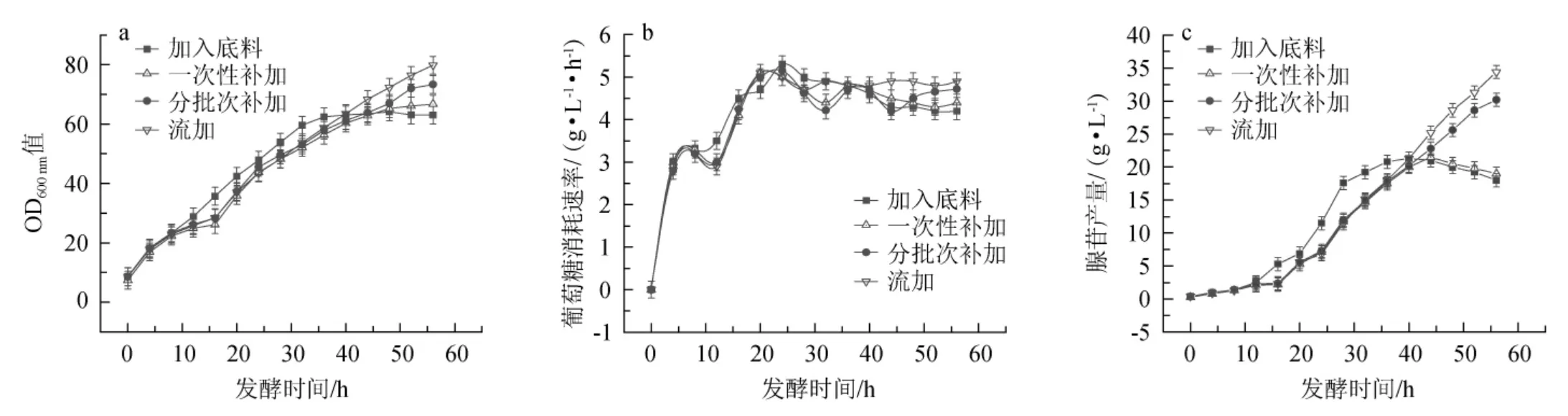
圖2 黃嘌呤添加方式對枯草芽孢桿菌XGL生物量(a)、葡萄糖消耗速率(b)及腺苷產量(c)的影響Fig.2 Effect of xanthine addition method on biomass(a),glucose consumption rate(b)and adenosine production(c)of Bacillus subtilis XGL
由圖2可知,在底料中直接加入0.2 g/L黃嘌呤后,在發酵前期,菌體OD600nm值快速上升,但發酵35 h后,OD600nm值基本保持不變;前期葡萄糖消耗速率較高,后期趨于平穩;菌體在前期大量生產腺苷,且腺苷產量明顯高于其他幾種添加方式,但發酵后期腺苷產量趨于平穩后下降,分析原因可能是黃嘌呤不足導致的。在發酵16 h一次性補加0.2 g/L黃嘌呤時,添加黃嘌呤之后,菌體快速生長,葡萄糖消耗速率加快,腺苷產量增加;發酵44~48 h時,菌體生長開始變緩,葡萄糖消耗速率及腺苷產量開始降低。在發酵16 h后分批次補加或流加黃嘌呤后,菌體快速持續的生長,葡萄糖消耗速率增大,同時腺苷產量持續升高,且流加黃嘌呤后,腺苷產量最高。發酵56 h時,四種添加方式下腺苷的最終產量分別為18.0 g/L、19.0 g/L、30.2 g/L、34.4 g/L,結果表明,持續流加黃嘌呤的方式對于腺苷的發酵生產效果最好。
2.2 谷氨酰胺對枯草芽孢桿菌XGL產腺苷的影響
2.2.1 底物中谷氨酰胺不同添加量對枯草芽孢桿菌XGL產腺苷的影響
底物中谷氨酰胺添加量對枯草芽孢桿菌XGL菌體量、葡萄糖消耗速率、腺苷產量及糖苷轉化率的影響見圖3。
由圖3a可知,在發酵初期,不同的谷氨酰胺添加量下菌體量無明顯差異;在發酵中后期,隨著谷氨酰胺添加量的增加生物量呈先增加后減少的趨勢,且當谷氨酰胺添加量為6 g/L時,生物量最大,發酵56 h時,生物量達84.6。
由圖3b可知,不添加谷氨酰胺時葡萄糖消耗速率最低,隨著谷氨酰胺添加量的增加葡萄糖消耗速率呈先增加后減少的趨勢,且當谷氨酰胺添加量為6 g/L時,葡萄糖消耗速率最大,發酵28 h時,葡萄糖消耗速率達5.65 g/(L/h)。說明底物中谷氨酰胺的添加有助于發酵中后期菌體的生長和葡萄糖消耗速率的增加。
由圖3c可知,隨著底物中谷氨酰胺添加量的增加腺苷產量呈先增加后平穩的趨勢,當谷氨酰胺添加量為6 g/L時,腺苷產量最高,發酵56 h時,腺苷產量達42.5 g/L,說明添加谷氨酰胺可以提高腺苷產量。由此可見,谷氨酰胺的最適添加量為6 g/L。
由圖3d可知,在不添加谷氨酰胺時,糖苷轉化率為13.2%,在添加了谷氨酰胺后糖苷轉化率有所提升。當谷氨酰胺添加量為6 g/L時,糖苷轉化率達到了16%。
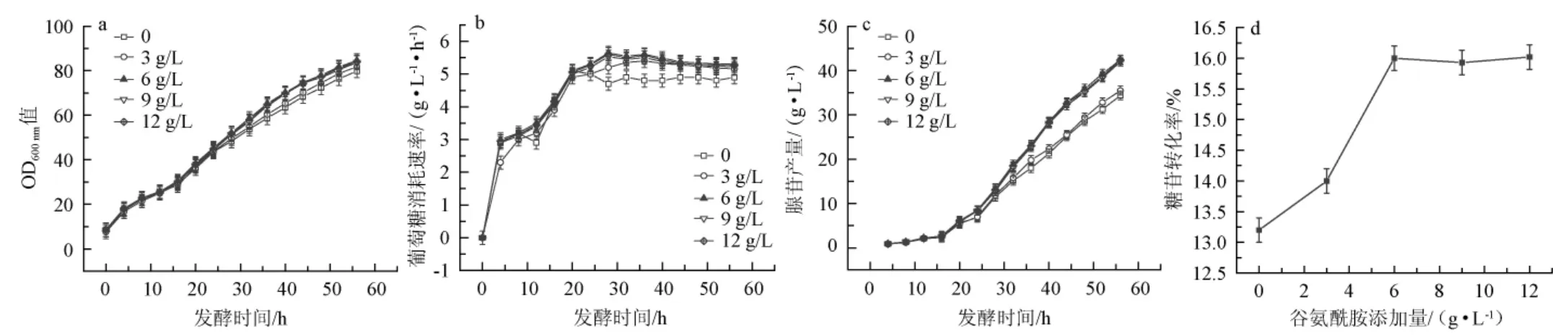
圖3 底物中谷氨酰胺添加量對枯草芽孢桿菌XGL生物量(a)、葡萄糖消耗速率(b)、腺苷產量(c)及糖苷轉化率(d)的影響Fig.3 Effect of glutamine addition in substrate on biomass(a),glucose consumption rate(b),adenosine production(c)and glycoside conversion rate(d)of Bacillus subtilis XGL
2.2.2 發酵過程中谷氨酰胺流加量對枯草芽孢桿菌XGL產腺苷的影響
為探究在整個發酵過程中是否保持一定濃度的谷氨酰胺有利于菌體產腺苷,在發酵中期后(32 h)向發酵罐中流加不同質量濃度的谷氨酰胺,考察流加不同質量濃度的谷氨酰胺對枯草芽孢桿菌XGL菌體量、葡萄糖消耗速率、腺苷產量及糖苷轉化率見圖4。
由圖4可知,隨著谷氨酰胺流加質量濃度的增加,生物量及葡萄糖消耗速率會有小幅的增加,腺苷產量也在增加,但當谷氨酰胺的流加質量濃度達到6 g/L時,生物量、葡萄糖消耗速率及腺苷產量均達到峰值。當發酵56 h時,生物量及腺苷產量分別為86.8、45.8 g/L,相比于底物中直接添加6 g/L的谷氨酰胺腺苷產量(42.5 g/L)提高7.8%;相比于不添加谷氨酰胺時,腺苷產量(34.4 g/L)提高33%。

圖4 流加不同質量濃度的谷氨酰胺對枯草芽孢桿菌XGL生物量(a)、葡萄糖消耗速率(b)、腺苷產量(c)及糖苷轉化率(d)的影響Fig.4 Effect of different concentrations of glutamine on biomass(a),adenosine production(b),adenosine production(c)and glycoside conversion rate(d)of Bacillus subtilis XGL
由圖4亦可知,糖苷轉化率隨著谷氨酰胺流加質量濃度的增加先升高,當流加的谷氨酰胺的質量濃度達到6 g/L時,糖苷轉化率達到了16.3%。相比于底物中直接添加6 g/L谷氨酰胺增加了0.3%。
綜上所述,在發酵32 h后可以流加6 g/L的谷氨酰胺提高腺苷產量。分析原因可能是谷氨酰胺是腺苷合成的前體,且在發酵中后期隨著氨水的流加,發酵液中銨根離子增多,菌體代謝受到影響,谷氨酰胺合成酶的活力下降,進而影響腺苷的合成。
3 結論
在含有100 mg/L黃嘌呤的發酵培養基中,當枯草芽孢桿菌(Bacillus subtilis)XGL發酵16 h后,持續向發酵液中流加3 g/L的黃嘌呤溶液200 mL可以使腺苷產量達到34.4 g/L,相比于不補充黃嘌呤時腺苷產量(11.2 g/L)提高207%。在此基礎上,再向底物中添加6 g/L谷氨酰胺,在發酵32 h后持續向發酵液中流加6 g/L的谷氨酰胺,腺苷產量達到45.8 g/L,相比于不添加谷氨酰胺腺苷產量(34.4 g/L)提高33%。因此,在B.subtilisXGL發酵過程中,可以通過流加一定量的黃嘌呤和谷氨酰胺的方法提高腺苷產量。

