Ixekizumab治療中重度斑塊型銀屑病療效和安全性系統評價
李新新,王燕芹,邢瀟勻,潘磊,馬蕾
(1.濱州醫學院附屬醫院皮膚科,山東 濱州 256603;2.濱州醫學院附屬醫院呼吸科,山東 濱州 256603)
白細胞介素-17A(IL-17A)導致的免疫紊亂和炎癥效應是銀屑病的重要致病因素,IL-17A能夠與角質形成細胞上的 IL-17A受體結合,刺激表皮細胞增殖,并作用于趨化因子募集炎性細胞分泌致炎因子加重銀屑病皮損的炎癥損傷[1-6]。Ixekizumab(LY-2439821)是一種選擇性靶向IL-17A的人源化單克隆抗體,2016年3月在美國上市,2019年9月在我國上市。國外學者已完成了多項關于Ixekizumab治療中重度斑塊型銀屑病療效的臨床試驗[7-12],我國的相關Ⅲ期臨床試驗數據尚未見發表。Bilal等[13]曾分析了Ixekizumab治療中重度斑塊型銀屑病的療效,但未對全部療效指標、不同治療亞組間療效、不同治療時間點間療效、Ixekizumab與其他生物制劑間療效比較以及安全性做出評價。本文納入新的隨機對照試驗(RCT)研究并應用系統評價的方法對Ixekizumab治療中重度斑塊型銀屑病的全部療效指標、不同治療劑量、不同治療時長、安全性以及Ixekizumab與其他生物制劑間療效差異進行評價,以期為臨床決策者提供進一步的證據。
1 資料與方法
1.1 文獻檢索 采用主題詞和自由詞相結合的方式,計算機檢索PubMed、ClinicalTrials、Web of Science、Cochrane圖書館、EMBASE、Ovid、Google Scholar、WHO國際臨床試驗注冊平臺、中國臨床試驗注冊中心等數據庫建庫至 2019年9月的相關文獻。英文檢索詞包括“Ixekizumab”“psoriasis”等,中文檢索詞包括“Ixekizumab”“銀屑病”。
1.2 文獻納入與排除標準 納入標準(PICOS原則):①研究對象:中重度斑塊型銀屑病患者,銀屑病皮損和嚴重程度指數(psoriasis area and severity index,PASI)≥12分,病程≥6個月,年齡≥18歲;②干預措施:Ixekizumab治療;③對照措施:安慰劑或其他藥物;④臨床療效指標:PASI下降75%、90%、100%(PASI 75、PASI 90 和 PASI 100)和醫師靜態總體評價:皮損清除(sPGA 0)、皮損清除或幾乎清除(sPGA 0/1);⑤研究類型:國內外公開發表的隨機對照試驗(RCT),無語言限制。排除標準:①銀屑病關節炎;②其他類型及其他時期的銀屑病;③應用其他具有治療作用的藥物;④研究為動物實驗、綜述、重復發表、缺乏全文者;⑤臨床研究納入患者例數較少;⑥未使用同一臨床療效指標。
1.3 文獻篩選、數據提取及質量評價 確定納入的文獻后使用統一設計的數據收集表,由兩位系統評價員分別對每個隨機對照研究的題目和摘要進行審查和評價,閱讀全文提取數據資料,內容包括:樣本的入選標準和樣本量、受試者的基本信息、治療方案和療效指標等,如資料提取中存在爭議,咨詢第三者協助判斷,對于資料不全的文獻與作者聯系獲得。提取數據包括第一作者、發表年份、樣本量、性別、年齡、PASI、sPGA、干預措施、隨訪時間、結局指標等。
按照Cochrane系統評價員手冊所闡述的質量評價標準,對納入的文獻進行質量評價,主要評價項目包括:研究的隨機方法是否恰當;是否做到分配隱藏;是否正確采用雙盲法;數據是否完整,有無失訪或者退出;是否存在選擇偏倚;是否存在其他偏倚。根據文獻內容中是、否和未提及來進行文獻等級劃分,分A、B、C三等,若滿足全部6個條件為A等,滿足3個及以上條件為B等,3個以下為C等。
1.4 統計學分析 采用RevMan 5.3軟件進行Meta分析。計數資料以相對危險度(RR)及其95%置信區間(CI)表示。采用χ2檢驗判斷納入研究的異質性,若各研究間無統計學異質性(P≥0.05,I2≤50%),采用固定效應模型進行分析;有統計學異質性(P<0.05,I2>50%),則采用隨機效應模型進行分析,針對異質性采用敏感性分析和亞組分析探討異質性來源。不能進行合并的單個研究則進行描述性分析。檢驗水準P<0.05為差異有統計學意義。
2 結果
2.1 文獻檢索結果與納入研究基本信息 初檢得到相關文獻144篇,剔除重復發表文獻、排除動物實驗及明顯不符合納入標準的文獻,進一步查找和閱讀全文,語種為英文,最終納入4個RCT研究,共計3 866例患者,文獻篩選流程見圖1。在中文數據庫中,未發現Ixekizumab治療中重度斑塊型銀屑病的臨床試驗報道。研究均以Ixekizumab作為治療組,安慰劑或依那西普作為對照組,納入研究基本信息及質量評估見表1。
2.2 Ixekizumab治療中重度斑塊型銀屑病臨床療效 3項研究[7-8]報道了皮下注射Ixekizumab 160 mg起始量,隨后80 mg/2周或80 mg/4周治療12周后PSAI和sPGA療效指標與安慰劑組比較。對Ixekizumab治療組與安慰劑治療組整體進行Meta分析發現,研究間PASI和sPGA各指標存在異質性(P=0.05~0.62;I2=0%~67%),采用統一的隨機效應模型分析。結果顯示,Ixekizumab組獲PASI 75、PASI 90、PASI 100和達到sPGA 0、sPGA 0/1的患者比率均顯著高于安慰劑組,差異具有統計學意義(P<0.000 01,見圖2)。
對80 mg/2周和80 mg/4周治療12周后PSAI和sPGA療效指標與安慰劑組比較進行亞組分析(異質性檢驗結果見表2)。結果顯示80 mg/2周亞組和80 mg/4周亞組獲PASI 75、PASI 90、PASI 100和達到sPGA 0、sPGA 0/1的患者比率均優于安慰劑組,差異具有統計學意義(P<0.000 01)。
2.3 Ixekizumab不同治療亞組間臨床療效比較 比較Ixekizumab 160 mg起始量,80 mg/2周和80 mg/4周兩個亞組12周后PSAI和sPGA療效指標[7-8]。研究見PASI 75存在異質性(P=0.05;I2=67%),采用隨機效應模型分析;PASI 90、PASI 100、sPGA 0/1和sPGA 0無顯著異質性(P=0.24、0.23、0.4、0.27;I2=30%、31%、0%、17%),采用固定效應模型分析。結果顯示80 mg/2周亞組PASI和sPGA所有療效指標均明顯優于80 mg/4周亞組,差異均具有統計學意義(P值分別為<0.000 01、0.000 8、0.03、<0.000 1,見表2)。
2.4 Ixekizumab不同治療時間臨床療效比較 Gordon等[7,9]的研究報道了Ixekizumab治療12周后,繼以80 mg/4周延續治療至60周的療效。比較不同治療時間PSAI和sPGA療效指標,研究間PASI 75和sPGA0/1存在異質性(P=0.04,0.07;I2=77%,70%),采用隨機效應模型分析;PASI 90和PASI 100無顯著異質性(P=0.84、0.83;I2=0%、0%),采用固定效應模型分析。結果顯示治療60周獲PASI 90、PASI 100的患者比率明顯高于12周,差異均具有統計學意義(P值分別為0.02、<0.000 01)。
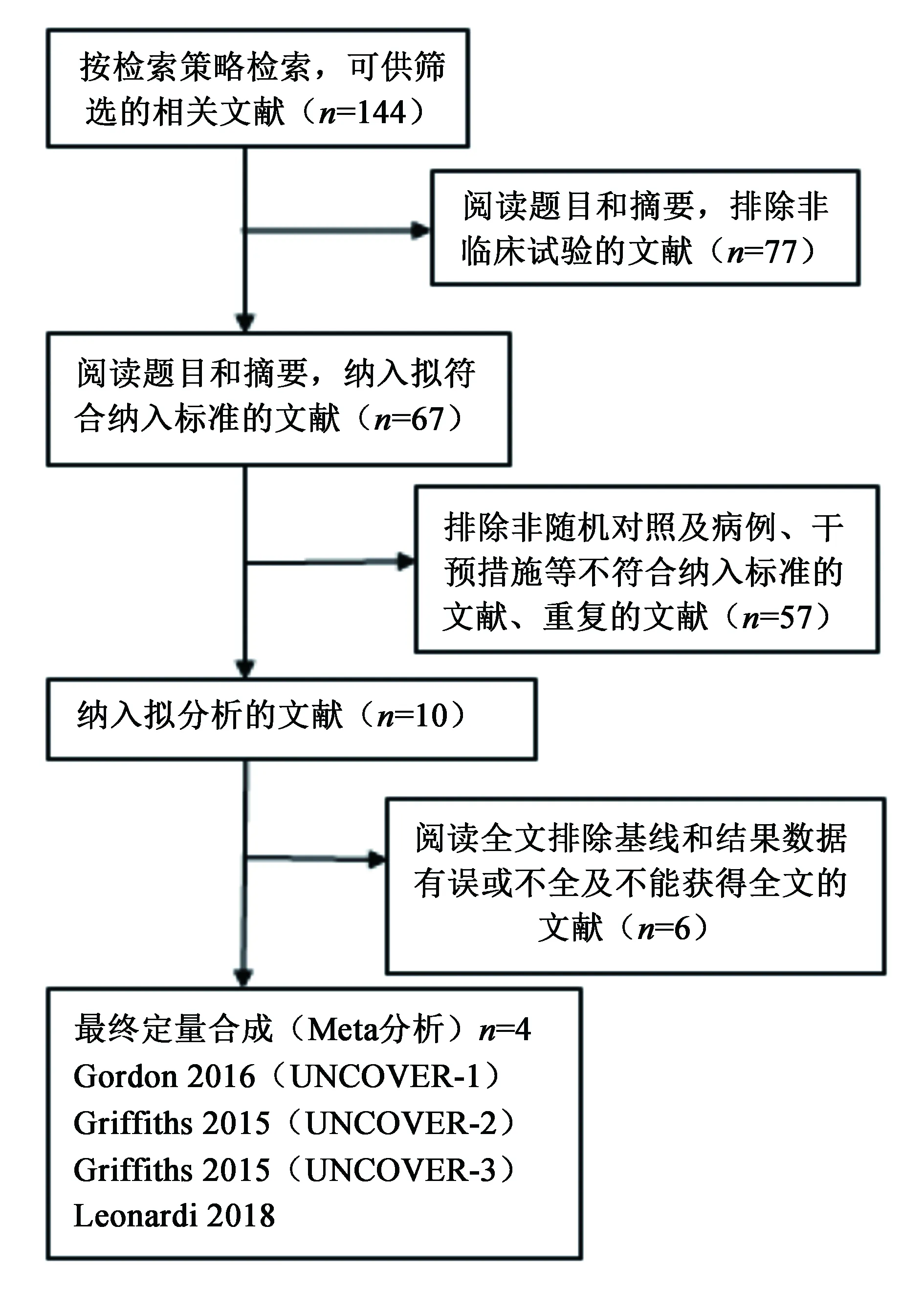
圖1 文獻篩選流程及結果

表1 納入研究的基本信息及質量評價
注:2周:Ixekizumab(IXE)160 mg起始劑量后80 mg/2周皮下注射至12周;4 周:IXE 160 mg起始量后80 mg/4周皮下注射至12周;PASI(psoriasis area and severity index)#:PASI 75、PASI 90、PASI 100;sPGA(Static Physician′s Global Assessment)#:sPGA 0、sPGA 0/1;2周-4周:IXE 160 mg起始量后80 mg/2周皮下注射至12周,繼以80 mg/4周延續治療;4周-4周:IXE 160 mg起始量后80 mg/4周皮下注射至12周,繼以80 mg/4周延續治療
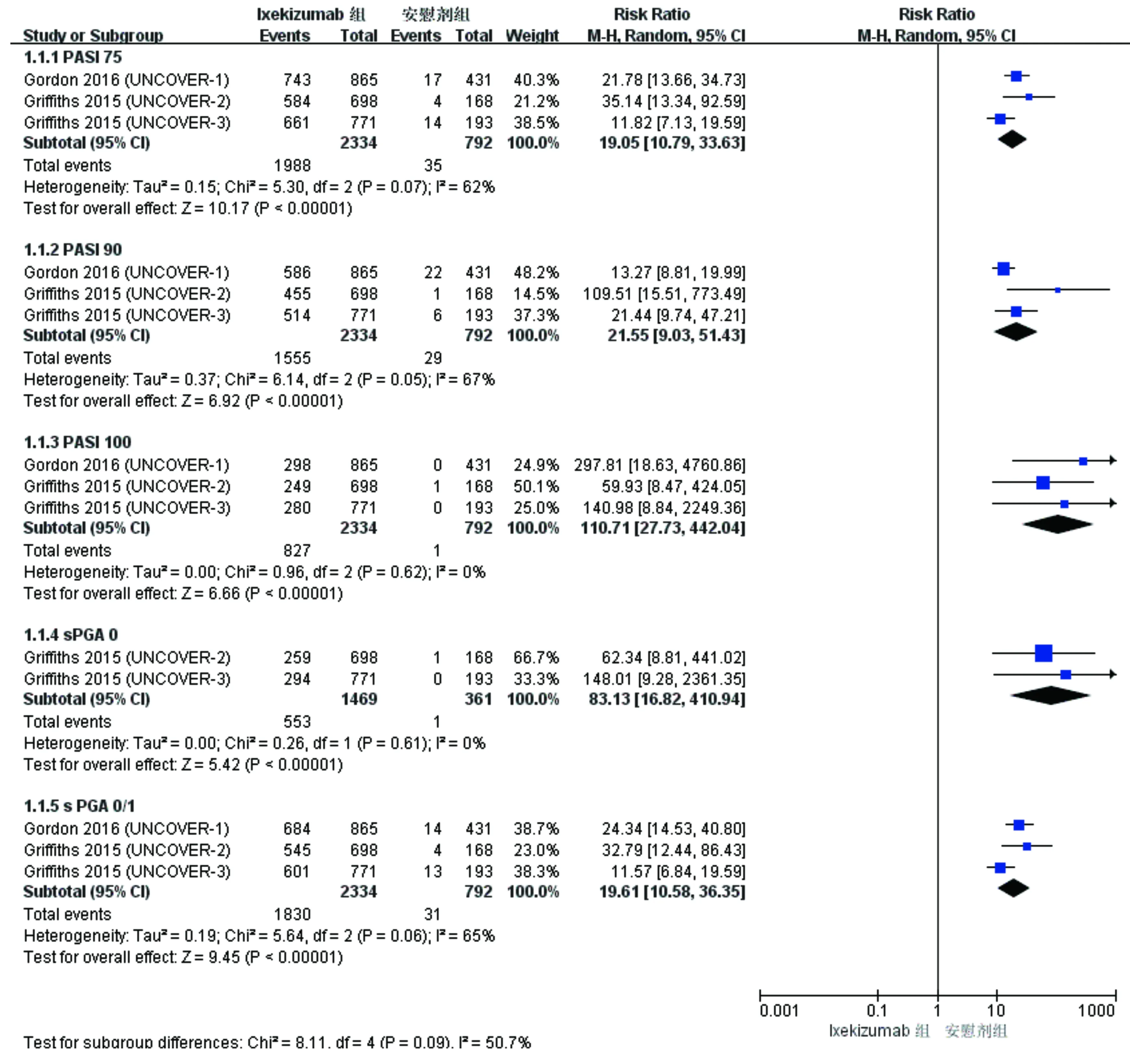
圖2 Ixekizumab組與安慰劑組比較療效指標PSAI和sPGA的Meta分析森林圖
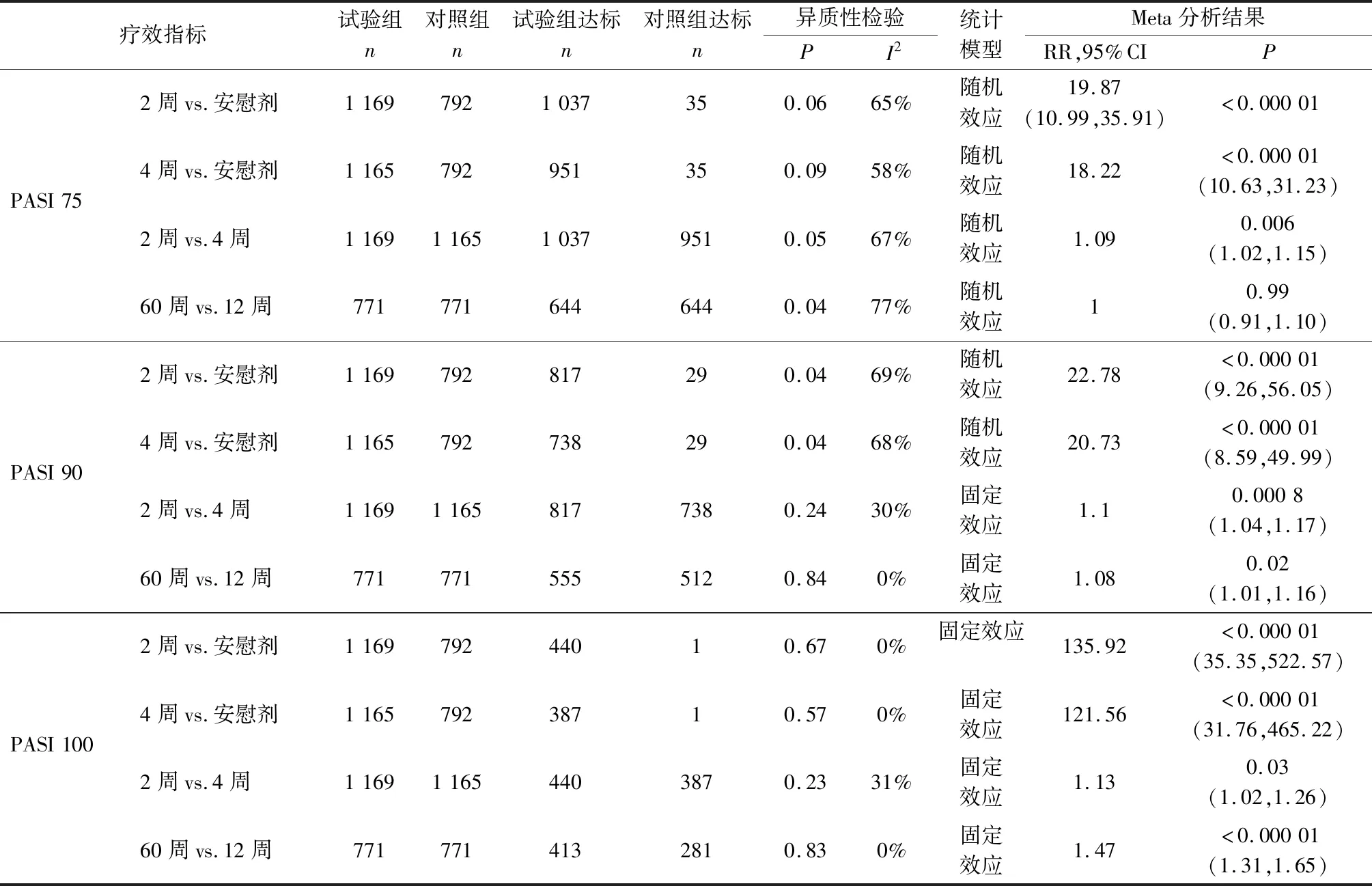
表2 Ixekizumab療效指標的亞組分析
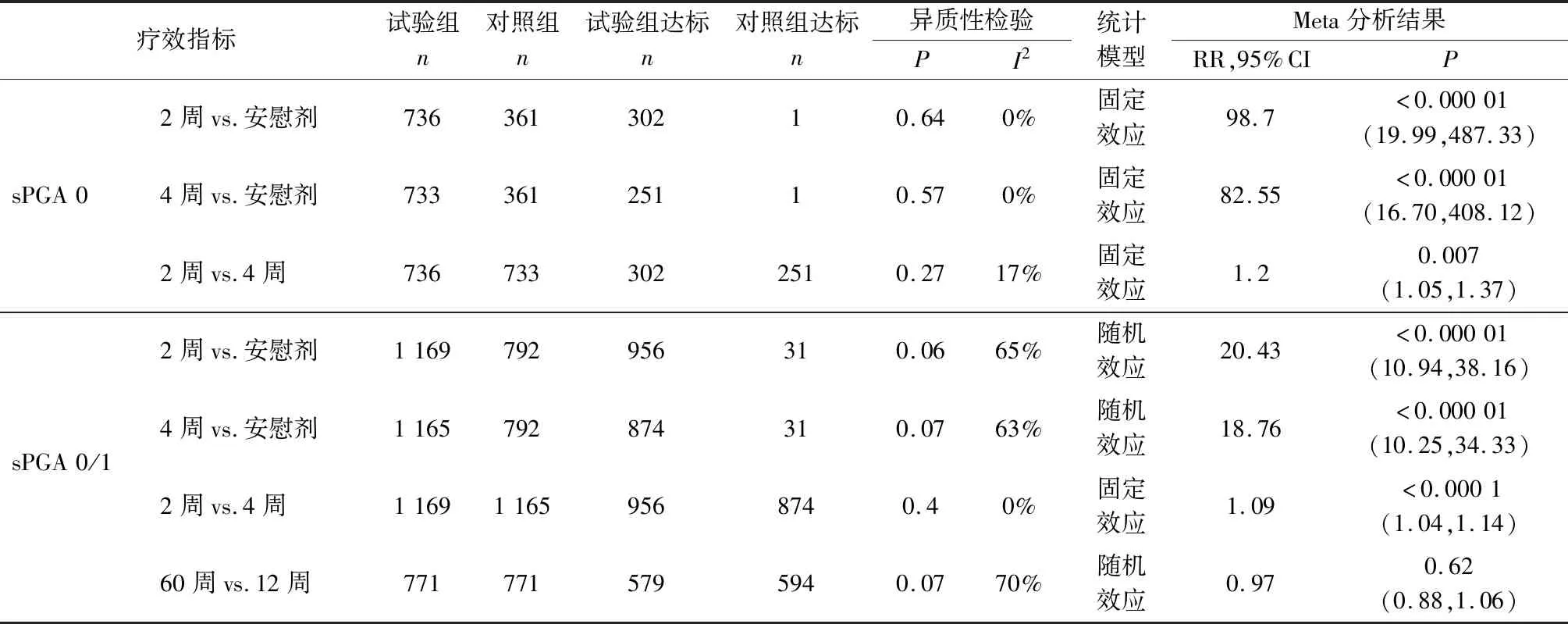
表2(續)
注:2周:Ixekizumab(IXE)160 mg起始劑量后80 mg/2周皮下注射至12周;4周:IXE 160 mg起始量后80 mg/4周皮下注射至12周;12周:IXE 160 mg起始劑量后80 mg/2周或80 mg/4周皮下注射至12周;60周:IXE 160 mg起始劑量后80 mg/2周或80 mg/4周治療12周后,改為80 mg/4周延續治療至60周
2.5 Ixekizumab治療與其他生物制劑臨床療效比較 Griffiths等[8]的研究進行了Ixekizumab(80 mg/2周和80 mg/4周)與可溶性抗腫瘤壞死因子(TNF-α)融合蛋白依那西普(50 mg/2周)治療中重度斑塊型銀屑病12周的療效比較。對Ixekizumab治療組與依那西普治療組整體進行Meta分析發現,研究間PASI和sPGA各指標存在異質性(P=0.000 5~0.30;I2=6%~87%),采用統一的隨機效應模型分析。結果顯示Ixekizumab組獲PASI 75、PASI 90、PASI 100和達到sPGA 0、sPGA 0/1的患者比率均顯著高于依那西普組,差異均具有統計學意義(P<0.000 01,見圖3)。
進一步對80 mg/2周和80 mg/4周兩個亞組治療12周后PSAI和sPGA療效指標與依那西普組的比較行亞組分析(異質性檢驗結果見表3)。結果顯示80 mg/2周亞組和80 mg/4周亞組獲PASI 75、PASI 90、PASI 100和達到sPGA 0、sPGA 0/1的患者比率均優于依那西普組,差異具有統計學意義(P<0.000 01)。
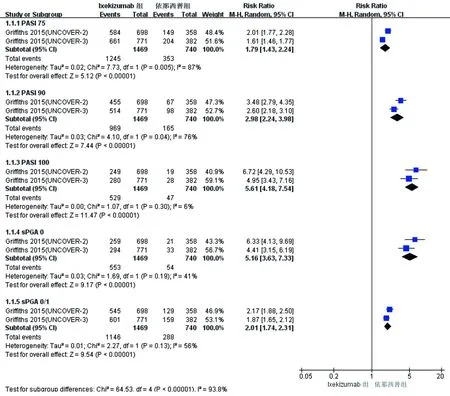
圖3 Ixekizumab組與依那西普組比較療效指標PSAI和sPGA 的Meta分析森林圖
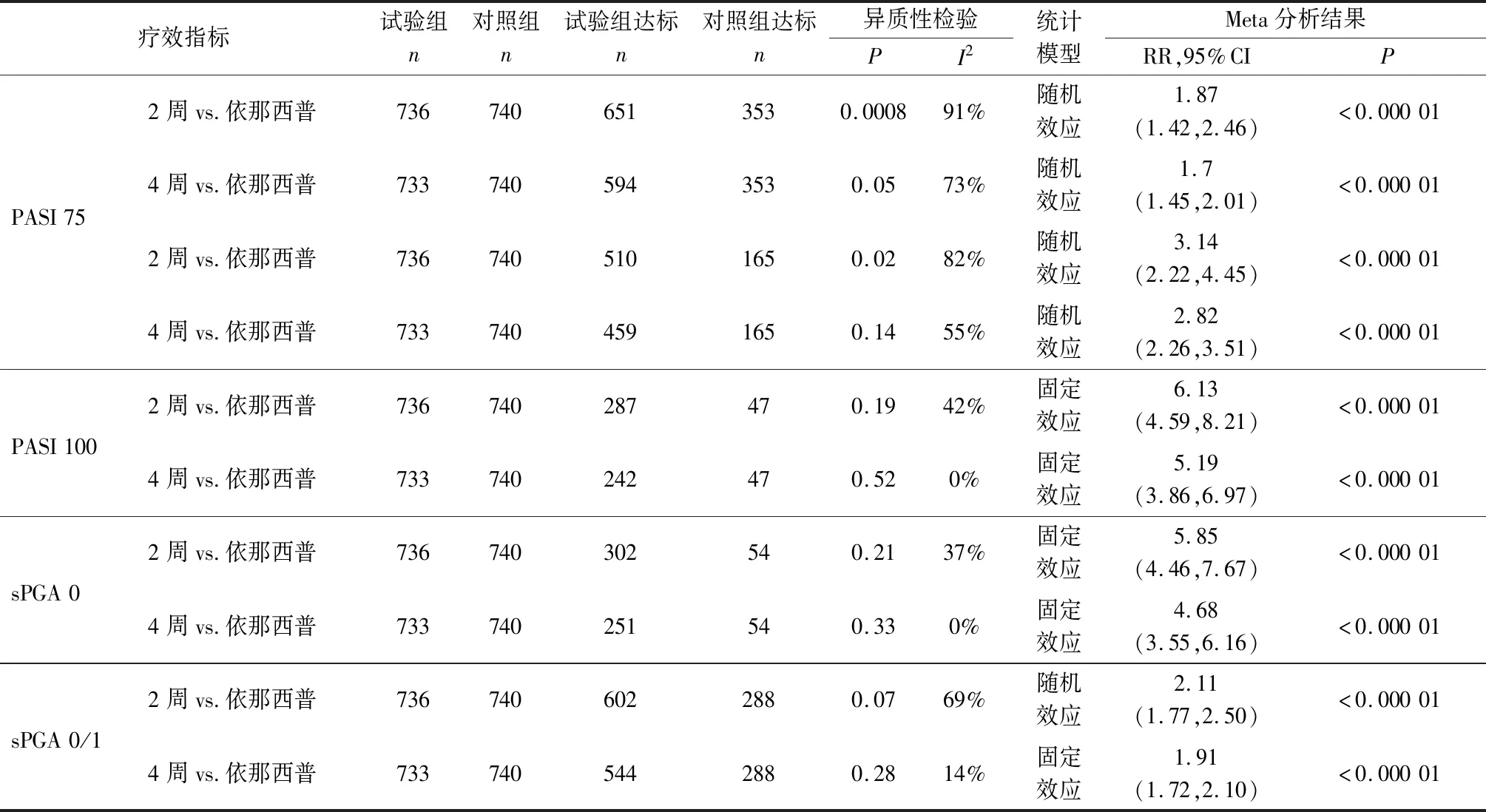
表3 Ixekizumab組與依那西普治療組療效指標的亞組分析
注:2周:Ixekizumab(IXE)160 mg起始劑量后80 mg/2周皮下注射至12周;4周:IXE 160 mg起始量后80 mg/4周皮下注射至12周;12周:IXE 160 mg起始劑量后80 mg/2周或80 mg/4周皮下注射至12周;60周:IXE 160 mg起始劑量后80 mg/2周或80 mg/4周治療12周后,改為80 mg/4周延續治療至60周
2.6 Ixekizumab安全性分析 Gordon等[7-8]的研究報道了Ixekizumab與安慰劑在治療12周時不良事件的發生情況,主要包括粒細胞減少、注射部位反應、上呼吸道感染和頭痛等。Ixekizumab組(n=2 328)與安慰劑組(n=791)發生總的不良反應的患者例數分別為1 094、370,兩者間存在異質性(P<0.000 01;I2=98%),采用隨機效應模型分析,兩組間總的不良反應發生情況比較差異無統計學意義(P=0.74)。其余安全性指標無顯著異質性(P=0.21~0.74;I2=0%~38%),采用固定效應模型分析。Ixekizumab組除感染和注射部位反應較安慰劑組發生率增高外,兩組間嚴重不良反應和粒細胞減少等其他不良反應發生情況比較差異均無統計學意義(P均>0.05,見圖4)。
Gordon等[7-8]的研究同時報道了Ixekizumab 80 mg/2周與80 mg/4周在治療12周時不良事件的發生情況,80 mg/2周(n=1 901)與80 mg/4周(n=1 102)發生總的不良反應、所有不良事件、注射部位反應等安全指標無顯著異質性(P=0.58~0.98;I2=0%),采用固定效應模型分析。80 mg/2周治療組發生注射部位反應的患者比率明顯高于80 mg/4周,差異具有統計學意義(P=0.02),兩組間所有不良事件、感染等其他不良反應發生情況比較差異均無統計學意義(P均>0.05)。
2.7 發表偏倚的分析 因納入研究較少,不再進行發表偏倚分析。
3 討論
2018年《中國銀屑病診療指南》中用于銀屑病臨床治療的生物制劑有TNF-α拮抗劑(依那西普、英夫利昔單抗、阿達木單抗)、IL-12/IL-23拮抗劑(烏司奴單抗)和IL-17拮抗劑(司庫奇尤單抗)[14]。Ixekizumab是一種選擇性靶向IL-17A的單克隆抗體,國外學者進行的臨床試驗研究發現Ixekizumab治療中重度斑塊型銀屑病具有較好的療效[7-12]。
本文系統評價結果顯示:以160 mg作為起始量,80 mg/2周或80 mg/4周皮下注射Ixekizumab兩種給藥方式治療中重度斑塊型銀屑病12周,無論Ixekizumab組總體還是80 mg/2周、80 mg/4周兩個亞組,PSAI和sPGA全部療效指標均明顯高于安慰劑組,進一步證實Ixekizumab的臨床療效確切。而且,亞組分析結果顯示80 mg/2周亞組PSAI和sPGA全部療效指標均明顯高于80 mg/4周亞組,說明以起始量治療后,相對于每4周給藥一次的療法,每2周給藥一次的方案能夠取得更好的療效。Gordon等[7]的研究中在Ixekizumab治療12周后,統一將劑量調整為80 mg/4周延續治療,至60周時獲PASI 90和PASI 100的患者比率較12周時進一步提高,說明Ixekizumab延續治療能夠進一步加強臨床療效。此外,Gordon等[7]還將Ixekizumab治療12周時達到sPGA 0/1的患者進一步隨機分組為80 mg/4周組、80 mg/12周組和安慰劑組延續治療至60周,80 mg/12周和安慰劑組維持sPGA 0/1的患者比率分別降低了約50%和90%。Leonardi等[9,12]分別報道了Ixekizumab 延續治療至156周和108周的療效,但僅1個研究無法進行定量的Meta分析,進行系統評價發現,獲PASI 75、PASI 90、PASI 100的患者比率分別為80.5%~97.2%、66%~86.7%和45.1%~63.9%,達到sPGA 0和sPGA 0/1的患者比率分別為48.5%~63.9%和67.4%~85.1%,且對于頭皮、指甲和掌跖等難治部位皮損的完全清除率均達到60%以上。因此,Ixekizumab治療中重度斑塊型銀屑病具有良好的療效,延續治療可進一步鞏固療效。
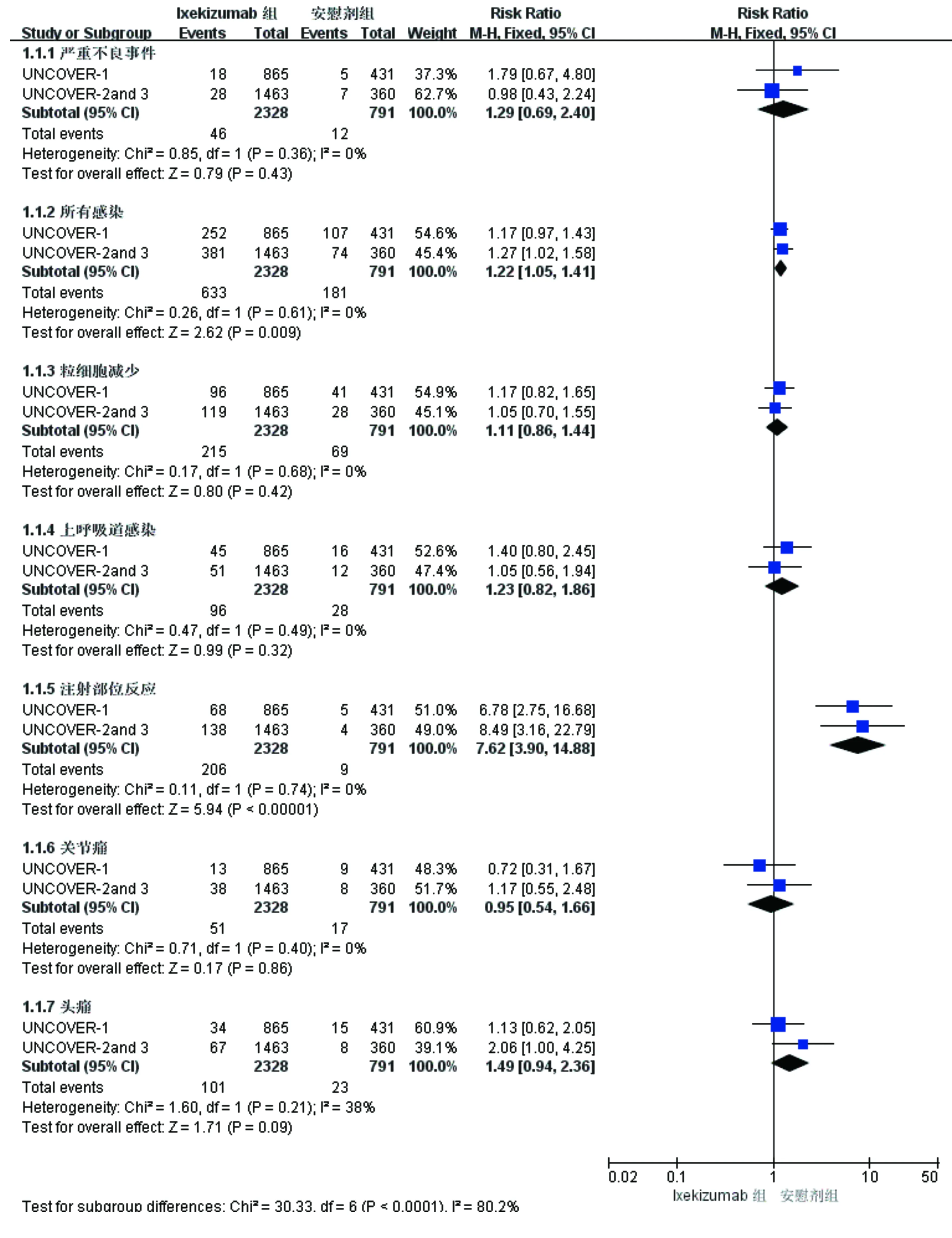
圖4 Ixekizumab組與安慰劑組不良反應的Meta分析森林圖
在與其他生物制劑療效比較中,Meta分析結果顯示80 mg/2周和80 mg/4周Ixekizumab治療12周,PSAI和sPGA全部療效指標均顯著高于依那西普組;另外,Reich等[10-11]觀察了Ixekizumab與烏司奴單抗的療效比較,系統評價結果顯示,在4~52周各觀察時間點,Ixekizumab組PSAI和sPGA全部療效指標均顯著高于烏司奴單抗組,且治療2周時Ixekizumab組獲PASI 75和達到sPGA 0/1的患者比率即明顯高于烏司奴單抗組,提示Ixekizumab治療中重度斑塊型銀屑病療效優于依那西普和烏司奴單抗,且起效更早。
納入的研究中均出現不良事件,Meta分析結果顯示治療12周時,Ixekizumab組感染和注射部位反應發生例數明顯高于安慰劑組,但是總的不良反應和嚴重不良反應等不良事件發生率比較均無統計學差異。Ixekizumab 80 mg/2周治療組發生注射部位反應的患者比率明顯高于80 mg/4周,絕大多數患者對其產生的注射部位反應可耐受[9],但兩組間總的不良反應、感染等其他不良反應發生情況比較差異均無統計學差異。Gordon等[7]報道了Ixekizumab治療60周時除注射部位反應與12周時發生例數相當外,其余不良事件的發生例數均高于12周。Leonardi等[9,12]報道了Ixekizumab延伸治療至156周和108周時,大部分患者發生的不良反應為輕中度,沒有新的不良事件發生,死亡病例的原因被判斷與Ixekizumab治療無關。相比其他生物制劑, Ixekizumab治療12周時感染發生率較依那西普高[7],52周時注射部位反應發生率高于烏司奴單抗組,總的不良反應、嚴重不良反應以及因不良反應退出研究的發生率在均無統計學差異[7,10-11]。因此,Ixekizumab具有較好的安全性。
雖然本系統評價納入研究均具有較高的方法學質量,但仍存在一定的局限性,如:①符合納入標準的研究數量較少;②本研究納入效應指標的異質性較高,因納入研究較少,探討異質性原因較困難,考慮與納入患者病情嚴重程度等差異有關;③部分數據如延續治療至108周、152周及與烏司奴單抗療效比較分析僅為單個研究,不能進行Meta分析;④3個研究均未提供停藥后長期隨訪資料。鑒于上述局限性,臨床醫生需結合臨床經驗和患者實際情況慎重使用本研究結果。
綜上所述,Ixekizumab治療中重度斑塊型銀屑病具有較好的臨床療效和安全性,且療效優于依那西普,延續治療可進一步增加療效,長期用藥的療效和安全性有待進一步評估。由于納入研究數量較少,異質性高且無停藥后長期隨訪資料,今后還需更大規模、隨訪更長的RCT研究來驗證本系統評價結果。

