基于實時熒光定量PCR檢測的沙門氏菌標(biāo)準(zhǔn)物質(zhì)驗證
王菲,張玲,楊佳怡,葉子弘,俞曉平*
1(中國計量大學(xué),浙江省生物計量及檢驗檢疫技術(shù)重點實驗室,浙江 杭州,310018)2(中國計量科學(xué)研究院,北京, 100013)
沙門氏菌(Salmonella)是一類革蘭氏陰性、具有鞭毛的兼性需氧菌[1],是細(xì)菌性食源性疾病的主要致病菌之一,易引起食物中毒以及腸胃炎等疾病[2-3]。所以針對食品原料、產(chǎn)品等進(jìn)行沙門氏菌檢測是我國食品監(jiān)管部門及食品相關(guān)企業(yè)的必檢項目[4-5]。傳統(tǒng)的沙門氏菌分離、檢測和鑒定方法主要有常規(guī)培養(yǎng)法、免疫學(xué)方法等[6],然而,這些方法操作較復(fù)雜、檢測周期較長,且需要消耗大量培養(yǎng)基和生化試劑,對檢測人員的技術(shù)水平也有較高的要求[7-8]。因此,隨著分子生物學(xué)技術(shù)的發(fā)展,越來越多的實驗室選擇實時熒光定量PCR技術(shù)進(jìn)行沙門氏菌檢測[9-10]。實時熒光定量PCR技術(shù)具有操作簡單、耗時短、效率高等優(yōu)點[11],但該技術(shù)能否準(zhǔn)確檢測沙門氏菌還有待驗證。
本研究選擇沙門氏菌DNA標(biāo)準(zhǔn)物質(zhì)候選物,使用實時熒光定量PCR技術(shù)來驗證標(biāo)準(zhǔn)物質(zhì)的均勻性和穩(wěn)定性。為確保數(shù)據(jù)的準(zhǔn)確性,還設(shè)計不同PCR儀精度分析、不同酶體系比較以及添加小牛胸腺載體DNA作為保護(hù)劑分析等。本文對沙門氏菌的穩(wěn)定性研究可為各實驗室進(jìn)行比對實驗以及快速檢測方法研究提供基礎(chǔ)參考。
1 材料與方法
1.1 試劑與儀器
沙門氏菌菌株,中國工業(yè)微生物菌種保藏中心,凍存于-80℃冰箱。Fast TaqMan Mixture,北京康為世紀(jì)生物科技有限公司;SuperRealPreMix(Probe),天根生化科技(北京)有限公司;Premix Ex TaqTM(Probe qPCR),寶日醫(yī)生物技術(shù)(北京)有限公司(takara中國);TaqMan Gene Expression Master Mix,美國應(yīng)用生物系統(tǒng)公司;小牛胸腺DNA(calf-thymus DNA,CT-DNA),上海澤葉生物科技有限公司;沙門氏菌DNA標(biāo)準(zhǔn)物質(zhì),中國計量科學(xué)研究院研制;引物和探針由英濰捷基(上海)貿(mào)易有限公司合成(表1)。
Q-POD純水儀,儀默克化工技術(shù)(上海)有限公司;XS205電子秤,梅特勒-托利多國際貿(mào)易(上海)有限公司;生物安全柜,美國賽博飛公司;超低溫保存箱,海爾生物醫(yī)療股份有限公司;3K15臺式高速冷凍離心,德國Sigma公司;AB quant Studio 12K Flex、Roche羅氏LightCycler?480Ⅱ?qū)崟r熒光定量PCR儀,上海普迪生物技術(shù)有限公司。
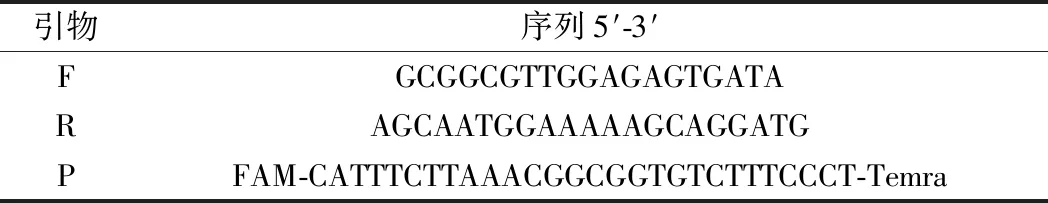
表1 PCR所用引物和探針Table 1 Primers and probes for PCR
1.2 實驗方法
1.2.1 沙門氏菌DNA模板制備
沙門氏菌DNA作為定量標(biāo)準(zhǔn)物質(zhì)候選物,使用滅菌去離子水對沙門氏菌DNA進(jìn)行10倍系列稀釋備用[12],最終得到的濃度分別為2.27×105copy/μL,2.27×104copy/μL,2.27×103copy/μL,227 copy/μL,22.7 copy/μL,2.27 copy/μL。
使用TE緩沖液(10 mmol/L Tris+0.1 mmol/L EDTA,pH 7.4)對小牛胸腺DNA溶液進(jìn)行稀釋,得到終濃度為20 μg/mL。并使用稀釋過后的小牛胸腺DNA溶液對沙門氏菌DNA進(jìn)行10倍系列稀釋,稀釋得到的最終濃度分別為2.27×105copy/μL,2.27×104copy/μL,2.27×103copy/μL,227 copy/μL,22.7 copy/μL,2.27 copy/μL。
1.2.2 PCR檢測體系的建立
PCR反應(yīng)采用25 μL體系,2×PCR Mix 12.5 μL,引物F(10 μmol/L)1 μL,引物R(10 μmol/L)1 μL,探針P(10 μmol/L)1μL,DNA模板5 μL,ddH2O 4.5 μL。PCR反應(yīng)程序為95 ℃預(yù)熱3 min;94 ℃ 5 s、60 ℃ 40 s,共40個循環(huán),4 ℃保存反應(yīng)產(chǎn)物。
1.2.3 實時熒光PCR檢測方法的特異性驗證
PCR引物探針的設(shè)計參考了腸道沙門氏菌腸毒素傷寒桿菌亞種,NCBI的Genebank序列號為NC_003198.1。特異性實驗采用的菌株如表2所示,所有菌株皆為本實驗室提供。將所有的菌株進(jìn)行平板劃線培養(yǎng),挑選單菌落加入50 μL的滅菌去離子水中,煮沸裂解后分別離心收集上清液作為模板,進(jìn)行PCR擴(kuò)增。滅菌去離子水作為空白對照,本研究使用的沙門氏菌DNA標(biāo)準(zhǔn)物質(zhì)作為陽性對照,驗證沙門氏菌檢測時本研究建立的PCR檢測方法的特異性。
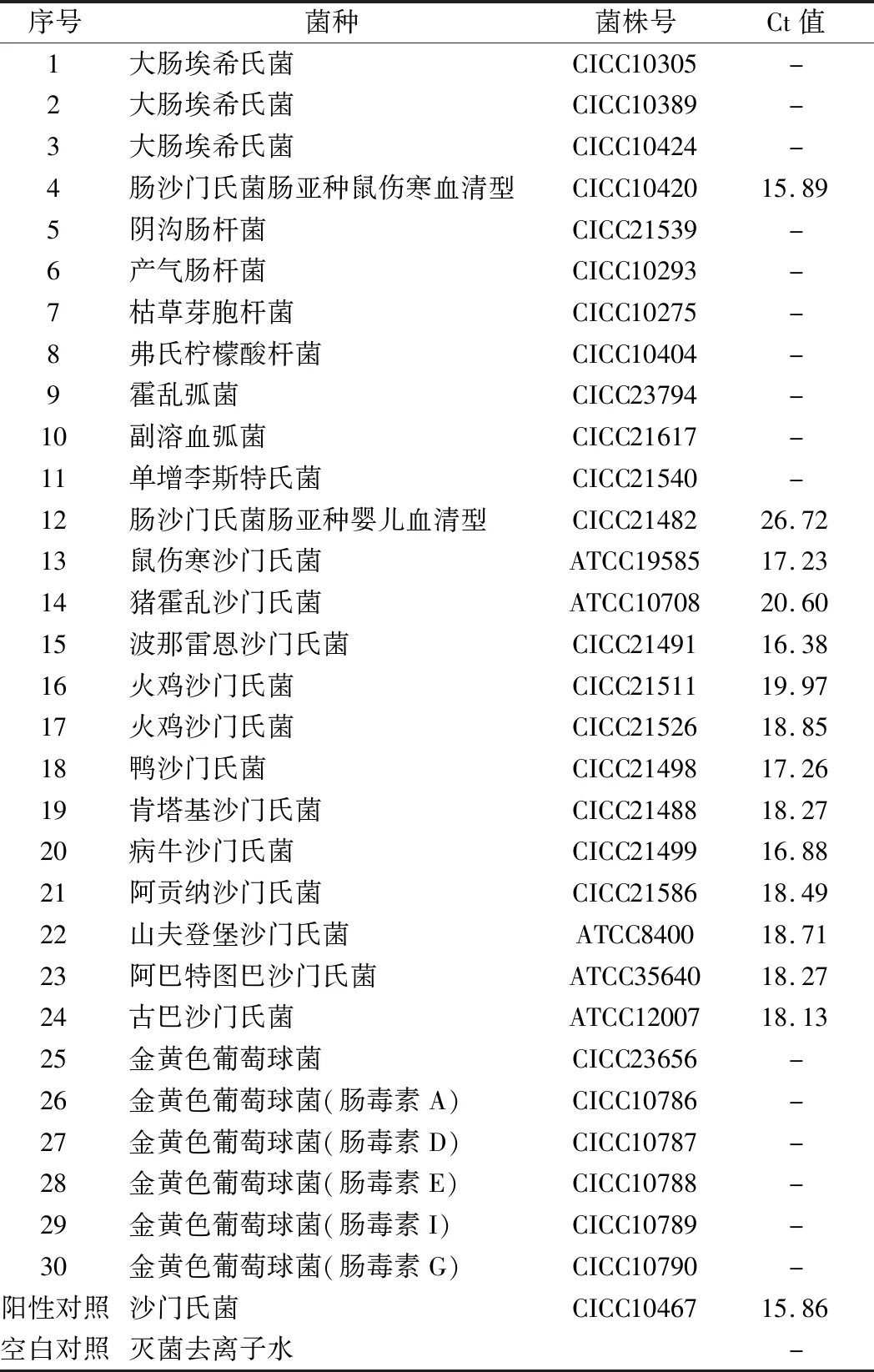
表2 沙門氏菌DNA的特異性檢測Table 2 Specific detection of Salmonella DNA
注:-代表無
1.2.4 不同PCR儀對沙門氏菌DNA熒光定量PCR的影響
使用AB quant Studio 12K Flex和Light Cycler 480Ⅱ Roche實時熒光定量PCR儀分別對沙門氏菌DNA進(jìn)行實時熒光定量PCR,以滅菌去離子水10倍系列稀釋的沙門氏菌DNA為模板,經(jīng)實時熒光定量PCR后的Ct值,從斜率,線性相關(guān)數(shù),標(biāo)準(zhǔn)偏差以及擴(kuò)增效率方面來分析不同PCR儀對沙門氏菌DNA擴(kuò)增的影響[13]。其中擴(kuò)增效率的計算如公式(1)所示:
(1)
式中:E表示擴(kuò)增效率,slope表示斜率。
1.2.5 TaqDNA聚合酶對沙門氏菌DNA熒光定量PCR的影響
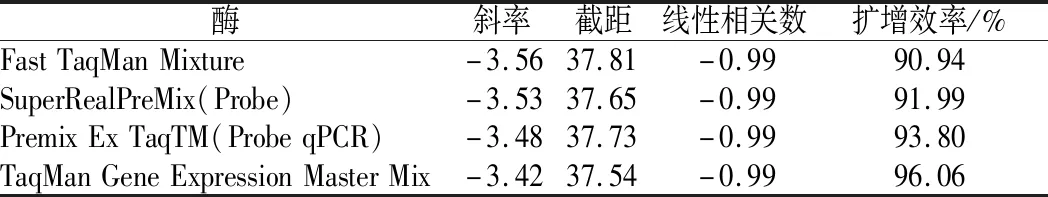
分別采用市面上常用的TaqDNA聚合酶Fast TaqMan Mixture、SuperRealPreMix(Probe)、Premix Ex TaqTM(Probe qPCR)、TaqMan Gene Expression Master Mix對沙門氏菌DNA進(jìn)行實時熒光定量PCR,以滅菌去離子水10倍系列稀釋的沙門氏菌DNA為模板,經(jīng)實時熒光定量PCR后的Ct值,從斜率、截距、線性相關(guān)數(shù)以及擴(kuò)增效率方面來分析不同的TaqDNA聚合酶對沙門氏菌DNA擴(kuò)增的影響。
1.2.6 添加保護(hù)劑對沙門氏菌DNA熒光定量PCR的影響
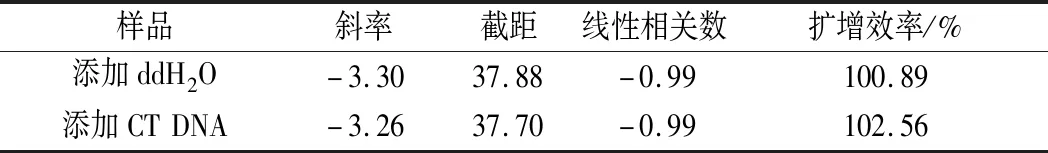
以10倍系列稀釋的沙門氏菌DNA為模板進(jìn)行定量PCR(每組實驗重復(fù)3次),同時以去離子水作為空白對照,根據(jù)DNA濃度的對數(shù)和Ct值建立沙門氏菌的熒光定量PCR法標(biāo)準(zhǔn)曲線,從斜率、截距、線性相關(guān)數(shù)以及擴(kuò)增效率方面來分析載體DNA是否會影響沙門氏菌DNA熒光定量PCR檢測。
1.2.7 沙門氏菌DNA均勻性測試
選取7組沙門氏菌DNA作為平行樣品,經(jīng)實時熒光定量PCR儀測定Ct值,每組實驗重復(fù)3次,同時以滅菌去離子純水作為陰性對照,用Excel整理數(shù)據(jù),計算由滅菌去離子水存放的低濃度沙門氏菌DNA的均勻性。其中均勻性分析使用方差分析法,如公式(2)所示:
(2)

1.2.8 短期穩(wěn)定性測試
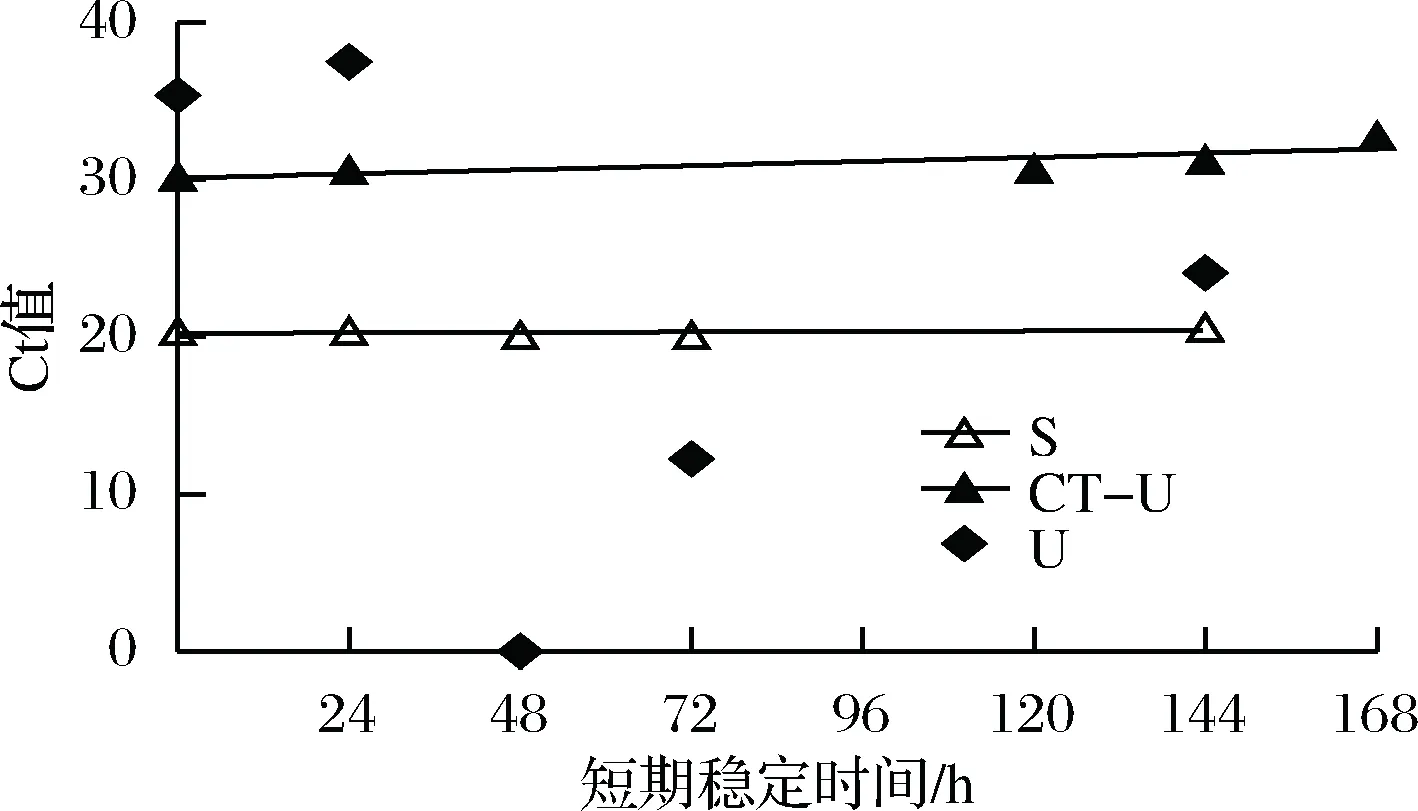
將沙門氏菌DNA標(biāo)準(zhǔn)物質(zhì)候選物儲存于溫度為(40±2) ℃的烘箱中,設(shè)計存儲時間(0、24、48、72、144 h或0、24、120、144、168 h)[14],每個時間點包括3組平行樣品。使用實時熒光定量PCR儀測定Ct值(每組實驗重復(fù)3次),同時以去離子純水作為陰性對照,用Excel整理數(shù)據(jù)計算平均值,繪圖分析未稀釋的沙門氏菌DNA以及保護(hù)劑中存放的低濃度沙門氏菌DNA檢測樣的短期穩(wěn)定時間。
其中重復(fù)性計算如公式(3)、公式(4)所示:
(3)
(4)
復(fù)現(xiàn)性計算如公式(5)~公式(7)所示:
(5)
(6)
(7)
公式(3)、公式(4)表示的是置信概率為95%時實時熒光定量PCR檢測方法的重復(fù)性,公式(5)~公式(7)表示的是檢測方法的復(fù)現(xiàn)性,其中m為平行樣品的數(shù)量,n為平行測定次數(shù)。
穩(wěn)定性計算如公式(8)、公式(9)所示:
(8)
(9)
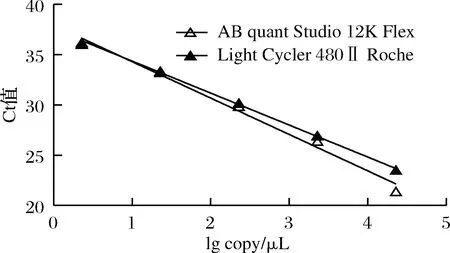
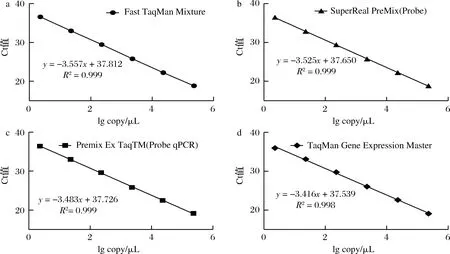
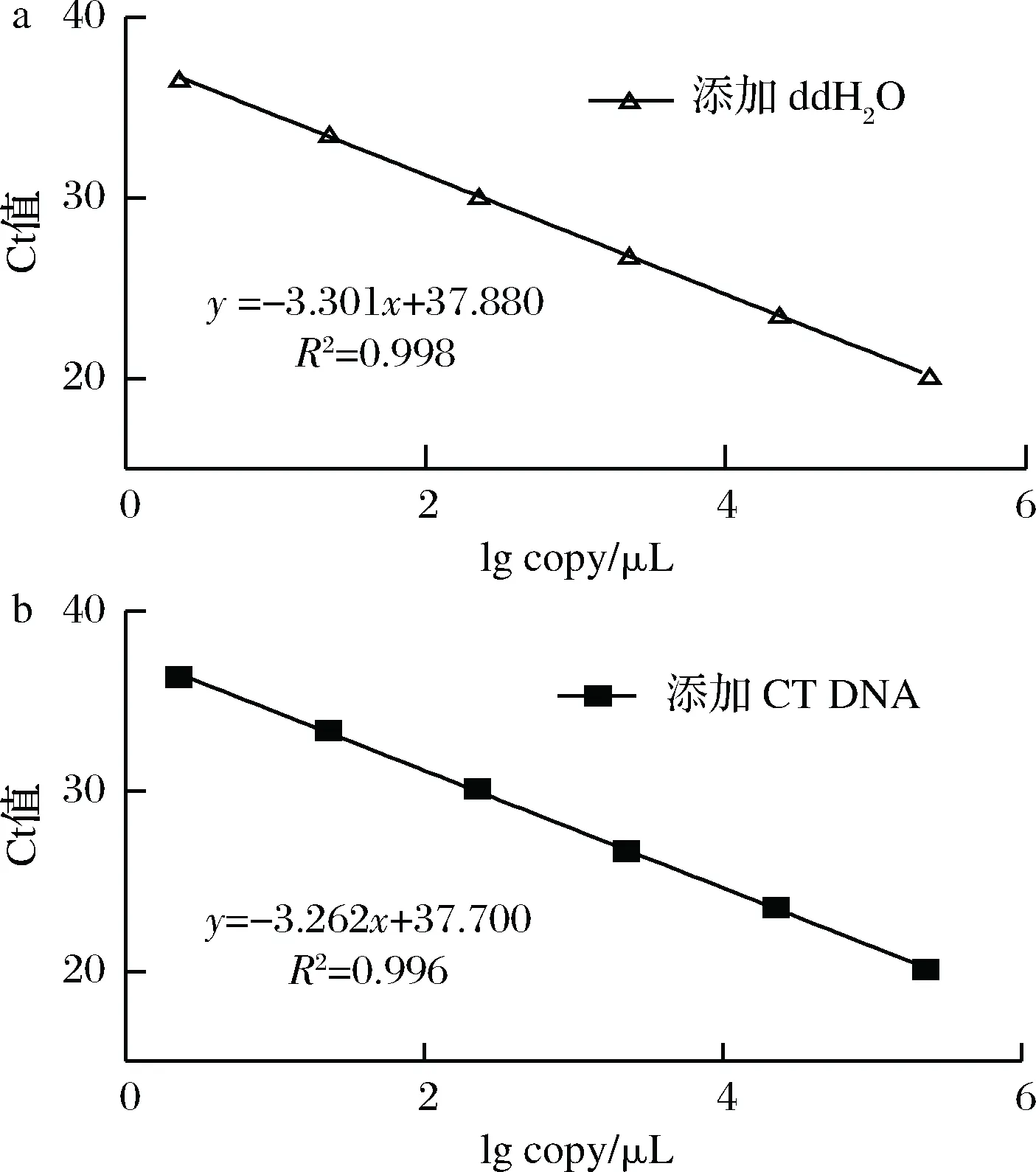
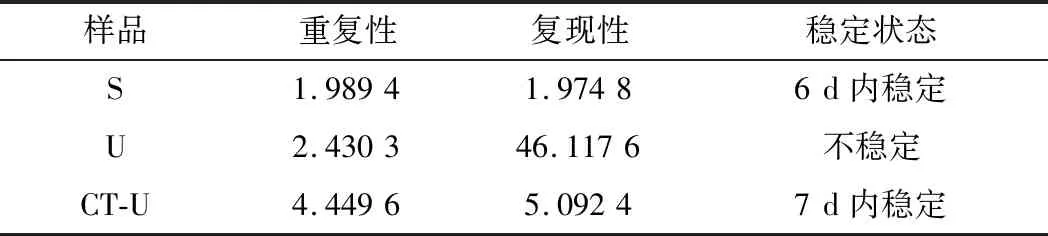
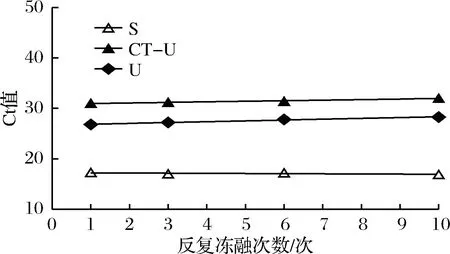
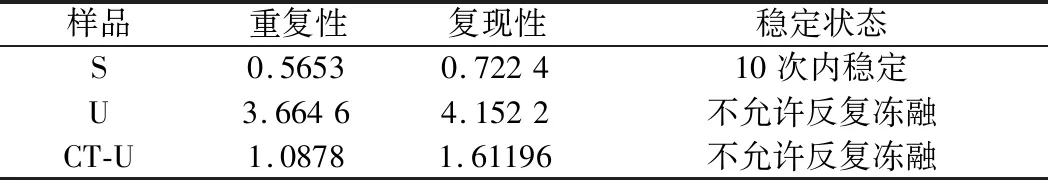
公式(8)表示的是直線的標(biāo)準(zhǔn)偏差,公式(9)表示的是斜率k的不確定度,自由度為n-2,95%置信水平的t分布因子查表可知,若|k| 1.2.9 反復(fù)凍融穩(wěn)定性測試 將沙門氏菌DNA標(biāo)準(zhǔn)物質(zhì)候選物放入冰箱(溫度-80 ℃,時間5 min),常溫下解凍(時間10 min),計劃操作次數(shù)(1、3、6、10次),每次操作取3個平行樣品放入4 ℃冰箱備用。使用實時熒光定量PCR儀測定Ct值(每個樣品重復(fù)實驗3次),同時以去離子純水作為陰性對照,用Excel整理數(shù)據(jù)計算平均值,繪圖分析未稀釋的沙門氏菌DNA以及保護(hù)劑中存放的低濃度沙門氏菌DNA檢測樣能夠經(jīng)受溫度變化的次數(shù)。 1.2.10 數(shù)據(jù)分析 基本數(shù)據(jù)采用Excel 2013進(jìn)行分析(計算平均值、斜率、截距、擴(kuò)增效率、重復(fù)性、復(fù)現(xiàn)性),采用GraphPad Prism 5.0對不同研究條件的沙門氏菌檢測參數(shù)進(jìn)行分析(方差分析法、直線擬合法、t檢驗統(tǒng)計檢驗法)[16]。 2.1.1 沙門氏菌熒光定量PCR檢測方法特異性分析 引物/探針組合對實驗所檢測各物種的特異性實驗結(jié)果顯示(表2),當(dāng)使用引物和探針組合對31種DNA樣本進(jìn)行擴(kuò)增時,只有在沙門氏菌的DNA樣本出現(xiàn)擴(kuò)增曲線,可以獲取Ct值,而在其他細(xì)菌種類中沒有出現(xiàn)擴(kuò)增曲線。因此建立的沙門氏菌實時熒光PCR檢測方法具有高度的特異性。 2.1.2 不同PCR儀熒光定量PCR分析 根據(jù)實時熒光定量PCR技術(shù)檢測結(jié)果,對相關(guān)數(shù)據(jù)進(jìn)行分析(表3),得到AB quant Studio 12K Flex和Light Cycler 480Ⅱ Roche兩臺PCR儀的線性分布圖(圖1)。從斜率和線性相關(guān)系數(shù)上分析,兩臺儀器的檢測結(jié)果相近,無明顯區(qū)別,均可用于沙門氏菌熒光定量PCR檢驗。 2.1.3 TaqDNA聚合酶熒光定量PCR分析 使用市面上常見的4種酶,對沙門氏菌DNA建立不同的酶體系進(jìn)行Ct值分析(圖2),評估不同酶體系作用于沙門氏菌DNA的熒光擴(kuò)增效率[公式(1)],基本輸出是一個線性關(guān)系,表示不同濃度梯度的沙門氏菌DNA的Ct值,相關(guān)統(tǒng)計量如表4所示。不同的酶相關(guān)系數(shù)約為0.99和擴(kuò)增效率(在90%~100%)都處在實驗接受范圍內(nèi),表明這4種酶都適用于檢測沙門氏菌DNA,可根據(jù)自己的實驗條件,選擇和調(diào)整適當(dāng)?shù)拿阁w系。 圖1 不同PCR儀比較線性分布圖Fig.1 Comparison of linear distribution of different PCR instruments 表3 不同PCR儀實驗結(jié)果分析Table 3 Analysis of the experimental results of different PCR instruments a-Fast TagMan Mixture;b-SuperReal PreMix;c-Premix Ex TaqTM;d-TaqMan Gence Expressin Master圖2 不同酶比較實驗Fig.2 Comparison of different enzymes 表4 酶比較實驗參數(shù)分析Table 4 Analysis of experimental parameters of enzyme comparison 2.1.4 保護(hù)劑熒光定量PCR分析 通過添加保護(hù)劑與未添加保護(hù)劑的沙門氏菌Ct值的比較(圖3),用以驗證添加的保護(hù)劑小牛胸腺載體DNA是否影響沙門氏菌DNA的熒光擴(kuò)增,相關(guān)統(tǒng)計量參數(shù)如表5所示。由表5可知,添加保護(hù)劑后的沙門氏菌DNA與為添加保護(hù)劑的沙門氏菌DNA熒光擴(kuò)增后有相近的斜率,截距,線性相關(guān)數(shù)以及擴(kuò)增效率[公式(1)],可知小牛胸腺載體DNA不會影響沙門氏菌DNA的PCR檢測。 a-添加ddH2O;b-添加CT DNA圖3 驗證實驗標(biāo)準(zhǔn)曲線圖Fig.3 Standard curve of validation experiment 表5 驗證實驗參數(shù)分析Table 5 Analysis of validation experimental parameters 由于沙門氏菌標(biāo)準(zhǔn)物質(zhì)候選物包裝單位約為100個,因此,隨機(jī)抽取7個包裝單位作為均勻性檢測的樣品,每個樣品在不同的部位分別取3個試樣進(jìn)行實時熒光定量PCR檢測。沙門氏菌均勻性檢測結(jié)果以及相關(guān)統(tǒng)計量如表6所示。 表6 沙門氏菌均勻性檢測結(jié)果Table 6 Detection results of homogeneity of Salmonella 均勻性檢驗使用的是方差分析法,檢測標(biāo)準(zhǔn)物質(zhì)在規(guī)定細(xì)分范圍內(nèi)其特性是否保持不變。根據(jù)表5和公式(2)可以計算出F=2.99,由F表可以查詢出F0.05(6,14)=3.96,可見F 標(biāo)準(zhǔn)物質(zhì)的短期穩(wěn)定性,主要關(guān)注的是標(biāo)準(zhǔn)物質(zhì)運(yùn)輸過程中的穩(wěn)定性。一般情況下,運(yùn)輸過程中的高溫環(huán)境對標(biāo)準(zhǔn)物質(zhì)有較大的影響。在不同的存儲時間中,沙門氏菌Ct值的會產(chǎn)生不同程度的變化(圖4)。根據(jù)直線擬合法的計算分析[公式(3)~公式(9)],計算結(jié)果如表7所示,初始濃度的沙門氏菌DNA和保護(hù)劑中存放的低濃度沙門氏菌DNA量值是比較穩(wěn)定的,但是由滅菌去離子水中存放的低濃度沙門氏菌DNA量值不穩(wěn)定。 圖4 短期穩(wěn)定性測試Fig.4 Short-term stability test 表7 短期穩(wěn)定性結(jié)果分析Table 7 Stability analysis of Short-term 注:S,未稀釋過的沙門氏菌DNA;U,由滅菌去離子水存放的低濃度沙門氏菌DNA檢測樣;CT-U,由保護(hù)劑存放的低濃度沙門氏菌DNA檢測樣(下同) 反復(fù)凍融穩(wěn)定性,主要關(guān)注的是標(biāo)準(zhǔn)物質(zhì)在進(jìn)行實驗分析過程中的穩(wěn)定性[17]。進(jìn)行反復(fù)凍融實驗時,沙門氏菌Ct值的變化情況可以呈線性分布(圖5)。但是根據(jù)直線擬合法的計算分析(表8),初始濃度沙門氏菌DNA經(jīng)過數(shù)次反復(fù)凍融仍然穩(wěn)定,可以進(jìn)行多次重復(fù)實驗。但是低濃度的沙門氏菌DNA不允許反復(fù)凍融,為保證數(shù)據(jù)的可靠性,需對獲取的樣品進(jìn)行一次性操作。 圖5 反復(fù)凍融穩(wěn)定性測試Fig.5 Testing of the stability of repeated freezing and thawing 表8 反復(fù)凍融穩(wěn)定性分析Table 8 Stability analysis of repeated freezing and thawing 本研究使用沙門氏菌DNA標(biāo)準(zhǔn)物質(zhì)對實時熒光定量PCR檢測方法進(jìn)行規(guī)范驗證[18-20],并選擇2臺不同的PCR儀[21]對檢測方法進(jìn)行比較驗證。為優(yōu)化PCR體系,選擇4種不同的酶[22]進(jìn)行比較。在初步的實驗中,直接使用沙門氏菌DNA進(jìn)行實驗表明沙門氏菌DNA并不穩(wěn)定,所以為了降低沙門氏菌DNA的降解率,選擇使用小牛胸腺載體DNA[23]作為保護(hù)劑。 實驗顯示,在95%置信水平時,沙門氏菌標(biāo)準(zhǔn)物質(zhì)樣品均勻。沙門氏菌標(biāo)準(zhǔn)物質(zhì)的穩(wěn)定性研究[24]主要分為兩個部分,一個是模擬短期高溫穩(wěn)定性,另一個是反復(fù)凍融穩(wěn)定性,分別對初始濃度沙門氏菌DNA、ddH2O保存的低濃度沙門氏菌DNA檢測樣以及小牛胸腺DNA緩沖液保存的低濃度沙門氏菌DNA檢測樣進(jìn)行實驗。研究表明初始濃度沙門氏菌DNA檢測樣6 d內(nèi)量值穩(wěn)定,而且可以進(jìn)行反復(fù)凍融10次,針對一個樣品進(jìn)行多次實驗操作,不會影響實驗數(shù)據(jù)的準(zhǔn)確性;由小牛胸腺DNA溶液保存的低濃度沙門氏菌DNA檢測樣7 d內(nèi)量值穩(wěn)定,但是進(jìn)行反復(fù)凍融實驗時,沙門氏菌DNA結(jié)構(gòu)遭到破壞未能測到有效數(shù)據(jù)。總的來說,這兩種濃度的沙門氏菌短期穩(wěn)定時間長,作為標(biāo)準(zhǔn)物質(zhì)在運(yùn)輸過程中高溫影響小[25],但實驗時避免反復(fù)凍融。但是由ddH2O保存的低濃度沙門氏菌DNA檢測樣不管是短期穩(wěn)定實驗還是反復(fù)凍融穩(wěn)定實驗都表現(xiàn)出不穩(wěn)定,建議實驗時對沙門氏菌DNA添加保護(hù)劑,降低沙門氏菌DNA的消耗。 在未來研究中將進(jìn)行長期穩(wěn)定性實驗并分析影響沙門氏菌降解的影響因素,為沙門氏菌穩(wěn)定性研究提供參考資料。 實時熒光定量PCR方法[26-28]在病原微生物快速檢測應(yīng)用中準(zhǔn)確性高,且沙門氏菌DNA穩(wěn)定性好,可用來檢驗各實驗室開展微生物核酸PCR方法的測量能力,保障微生物核酸檢測技術(shù)的溯源性和準(zhǔn)確性,從而提高我國在病原微生物核酸快速檢測的水平。2 結(jié)果與分析
2.1 方法驗證結(jié)果分析

2.2 均勻性檢測分析

2.3 短期穩(wěn)定性檢測分析
2.4 反復(fù)凍融穩(wěn)定性檢測分析
3 結(jié)論

