體外模擬消化對蘋果多酚及其抗氧化活性的影響
朱秀靈,葉精勤,盛伊健,孔雯瑾,陳廷然,傅錫鵬,戴清源
(安徽工程大學 生物與化學工程學院,安徽 蕪湖,241000)
植物多酚是植物次級代謝產物的主要成分也是膳食中主要的抗氧化劑[1],在胃腸消化過程中,由于食物基質、pH、溫度、吸收抑制劑、吸收促進劑、酶、宿主及其他相關因素的影響,其物理化學性質、穩定性和抗氧化活性均可發生變化[1]。由于體外消化模型不僅價格便宜、操作簡單、條件可控、采樣容易、結果可重復、不存在道德限制[2],而且對生物利用度的評價結果與人體或動物模型相吻合[1],因此,體外消化模型已被廣泛用于預測酚類化合物在胃腸消化過程中的穩定性、抗氧化活性及其生物利用度[3-8]。
蘋果是我國也是世界上種植最廣泛、消費量最大的水果之一[1, 9],通常以鮮果或其加工品如蘋果干、蘋果醬、蘋果汁及蘋果酒等形式在市場上供應。蘋果富含膳食纖維和酚類化合物,大量食用,可降低患慢性疾病(如肺癌、哮喘和心血管疾病)的風險[1, 9-11]。蘋果中含量最高的酚類化合物是槲皮素(以糖基化形式存在)、兒茶素和表兒茶素,它們是澀味和苦味的重要成分[9]。此外,蘋果還含有以酯化形式存在的咖啡酸、奎寧酸(綠原酸)和對香豆酸。蘋果皮富含二氫查耳酮類物質如葉綠素及其葡萄糖苷形式存在的根皮苷[9]。由于蘋果品種不同、多酚類物質存在部位、提取方法及檢測手段的不同,蘋果多酚類物質的主要酚類成分及其含量也不盡相同,在機體消化過程中,再加上食品基質的影響,更加難于確定給定劑量的蘋果原料在體外消化過程中多酚類物質的變化情況及其與抗氧化活性之間的相關性。
為此,本研究首先提取蘋果中的多酚類物質,以富集多酚成分的提取物為研究對象,通過體外消化模型,探討多酚提取物在不同消化階段主要酚類物質及其抗氧化活性的變化情況和相關性。研究結果為多酚類物質的生物利用度及生物活性評價提供了參考。
1 材料與方法
1.1 實驗材料
新鮮紅富士蘋果,購于當地大潤發超市;胃蛋白酶、膽汁提取物、福林酚試劑,BR級,購于上海瑞永生物科技有限公司;胰蛋白酶,BR級,購于北京索萊寶科技有限公司;原花青素、兒茶素、表兒茶素、綠原酸、咖啡酸、槲皮素、根皮素等標準品,購于上海阿拉丁生化科技股份有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH),梯希愛(上海)化成工業發展有限公司;2,2′-聯氮雙(3-乙基苯并噻唑啉-6-磺酸)二銨鹽(2,2′-Azinobis(3-ethylbenzothiazoline-6-sulfonic acid ammonium salt,ABTS)、2,4,6-三(2-吡啶基)三嗪(2,4,6-Tri (2-pyridyl)-s-triazien,TPTZ)、奎諾二甲基丙烯酸酯(6-hydroxy- 2, 5, 7, 8-tetramethylchromane-2-carboxylic acid,Trolox),2,2-偶氮二(2-甲基丙基咪)二鹽酸鹽 (2,2′-Azobis (2-methylpropionamidine) dihydrochloride,AAPH)、熒光素,上海阿拉丁生化科技股份有限公司。
1.2 儀器與設備
L3S型可見分光光度計,上海儀電分析儀器有限公司;JK-400CDB型高功率數控超聲波清洗器,合肥市金尼克機械制造有限公司;ZFD-A5140型鼓風干燥箱,上海智城分析儀器制造有限公司;TGL-16G型臺式離心機,上海安亭科學儀器廠;FD8-3型冷凍干燥機,美國Sim International Group公司;Prominence LC-20A型高效液相色譜儀,日本島津;SI-114型電子天平,美國DENVER INSTRUMENT公司;M5型酶標儀,美國Molecular Devices公司。
1.3 實驗方法
1.3.1 蘋果原料處理
將一定量的新鮮蘋果經清洗、干燥后切成條狀,于沸水中熱燙2~3 min,撈出瀝干,平鋪于干燥箱托盤上,于85 ℃熱風干燥至恒重,粉碎,過100目篩,即得到蘋果粉。稱取20 g蘋果粉于500 mL錐形瓶中,按料液比1∶20(g∶mL)加入體積分數50%乙醇,進行超聲提取(超聲功率400 W、超聲溫度控制在50 ℃以下,超聲時間30 min)[12],抽濾,收集濾液,將濾液經真空濃縮、凍干,即得到蘋果多酚提取物,-20 ℃存放備用。
1.3.2 體外消化
蘋果多酚提取物體外消化,參照文獻[1]、[8]、[13-16]報道方法,并修改如下:
(1)模擬胃消化 準確稱量40 mg胃蛋白酶,用0.1 mol/L HCl溶液定容到10 mL,配制成4 mg/mL胃蛋白酶溶液。稱取90 mg NaCl用蒸餾水溶解并定容到10 mL,即得到9 mg/mL NaCl溶液。稱量蘋果多酚提取物2.5 g,加蒸餾水溶解并定容到10 mL。取3 mL多酚溶液,加入6 mL 9 mg/mL NaCl溶液和6 mL 4 mg/mL胃蛋白酶溶液,用0.1 mol/L HCl調節pH至2.0,取2.00 mL作為胃消化0 h樣品。其余溶液置于37 ℃恒溫振蕩箱中培養1 h,取2.00 mL溶液作為胃消化1 h樣品,剩余部分的胃消化液采用1 mol/L NaHCO3調節pH至7.0,用于腸消化。
(2)模擬腸消化 準確稱量20 mg胰蛋白酶和120 mg膽酸鹽,用0.1 mol/L NaHCO3溶液分別定容至10 mL,得到2 mg/mL胰液和12 mg/mL膽汁。將胰液和膽汁溶液按體積比1∶1混合均勻,制得胰液-膽汁混合液。用移液管分別移取5份每份2.00 mL胃消化1 h的樣液(預先調節pH至7.0)至5個10.0 mL具塞試管中,分別加入4.0 mL胰液-膽汁混合液,并采用0.1 mol/L NaHCO3調節pH至7.0,置于37 ℃恒溫振蕩培養箱中培養,在0、1.0、2.0、3.0和4.0 h各取出1管,作為腸消化0、1.0、2.0、3.0和4.0 h的樣品,為了確保酚類化合物的穩定及抑制胰蛋白酶活性,采用6 mol/L HCl調節樣品pH至2.0。
以不含多酚提取物的溶液作為空白對照,按照多酚提取物體外消化的方法進行操作,按時取樣。將不同消化階段的消化液分別離心(4 500 r/min,10 min),棄沉淀,上清液于-20 ℃存放備用。
1.3.3 總酚含量測定
總酚含量(total phenolic content,TPC)的測定采用福林酚法,參照文獻[1]、[17-18]并修改如下:以沒食子酸為標準品,以溶解多酚提取物的溶劑或者經過胃消化或腸消化的空白溶液溶解沒食子酸標準品,配成質量濃度為0~100 mg/L標準溶液,分別量取1.0 mL不同質量濃度的標準溶液置于不同的試管中,再分別加入5.0 mL 10%福林酚試劑,搖勻反應6 min,然后加入4.0 mL 7.5% Na2CO3溶液,用相應的溶劑定容,搖勻,避光常溫靜置60 min,于766 nm處測定吸光度。以質量濃度為橫坐標,吸光度值為縱坐標,繪制標準曲線。采用同樣的方法,分別測定不同消化階段樣品溶液的吸光度值。根據標準曲線,計算樣品中總酚含量,結果以每克多酚提取物(以干基計)所含的沒食子酸(GAE)的毫克數表示。
1.3.4 HPLC檢測主要酚類物質
量取消化前后的樣品溶液各1 mL,4 500 r/min離心10 min,棄沉淀,上清液加入3倍體積的甲醇,手動攪拌5 min,離心(4 500 r/min,10 min),棄沉淀,將上清液過0.22 μm濾膜,采用日本島津Prominence LC-20A高效液相色譜儀檢測上清液中多酚成分。色譜條件:Omsi Sype C18柱(250 mm× 4.6 mm,5 μm),保護柱(ChrmSEP 1 cm×3 mm)。流動相A相為0.1%磷酸、B相為體積分數100%甲醇。梯度洗脫為5%B(0 min),25%B(0~5 min),34%B(5~14 min),37%B(14~25 min),40%B(25~30 min),49%B(30~34 min),50%B(34~35 min),51%B(35~58 min),55%B(58~60 min),80%B(60~62 min),保持在80%B(62~65 min),降至5%B(65~67 min),維持在5%B(67~72 min)。流量為0.8 mL/min;進樣量20 μL;檢測波長為280 nm。以綠原酸、表兒茶素、兒茶素、咖啡酸、原花青素、根皮素、槲皮素為標準品,混標進樣,以峰面積為縱坐標,以濃度為橫坐標,繪制標準曲線得到各標準品的線性方程,根據線性方程,計算得出不同消化階段消化液中的主要酚類物質含量,結果以每毫升消化液所含的對應標準品的毫克數表示。
1.3.5 抗氧化活性
1.3.5.1 DPPH自由基清除能力
參照文獻[19]并修改如下:準確稱取2.4 mg DPPH,用無水乙醇溶解并定容至50 mL,得到濃度為48 mg/L DPPH貯備液,-20 ℃避光保存。向測試管1中加入2.00 mL 48 mg/L DPPH溶液和1.00 mL待測樣品,搖勻,避光反應30 min,用可見分光光度計測定517 nm處的吸光度(即為待測樣品的吸光度AS)。向測試管2中加入2.00 mL DPPH溶液和1.00 mL無水乙醇,搖勻,避光反應30 min,測定517 nm處的吸光度(即為初始溶液的吸光度A0)。向待測樣品管中加入待測樣品1.0 mL和2.00 mL無水乙醇,搖勻,避光反應30 min,測定517 nm處的吸光度值(即為參比溶液的吸光度Ar)。樣品對DPPH自由基清除率(IDPPH,%)按公式(1)計算:
(1)
式中:IDPPH,DPPH自由基清除率,%;A0,初始溶液的吸光度;Ar,參比溶液的吸光度;As,待測溶液的吸光度。
1.3.5.2 ABTS自由基清除能力
參照文獻[20-22]方法,稱取96.0 mg ABTS,用去離子水溶解并定容至25 mL,配制成7 mmol/L ABTS溶液;稱取16.6 mg過硫酸鉀,用去離子水溶解并定容至25 mL,配制成2.45 mmol/L溶液;按體積比2∶1將ABTS溶液和過硫酸鉀溶液混合,黑暗中靜置12~16 h,以形成穩定的ABTS自由基陽離子(ABTS+·),此溶液即為ABTS+·儲備液。使用前用去離子水將ABTS+·儲備液稀釋使其在734 nm波長處的吸光度值為(0.700 ± 0.02)。然后量取2.9 mL ABTS+·稀釋液與0.1 mL胃腸消化不同時間樣液混合,于黑暗處30 ℃反應10 min,在734 nm波長處測定其吸光度。以去離子水為空白對照。則樣品對ABTS自由基清除率(IABTS,%)按公式(2)計算:
(2)
式中:IABTS,ABTS自由基清除率,%;AB,空白對照溶液的吸光度;AS,待測樣品溶液的吸光度。
1.3.5.3 鐵離子還原能力(ferric reducing antioxidant power,FRAP)
參照文獻[23-24]方法,首先配制溶液:乙酸鈉緩沖溶液(300 mmol/L,pH 3.6)的配制:稱取1.55 g三水合乙酸鈉,用適量去離子水溶解并轉移到500 mL容量瓶中,加入8 mL乙酸,然后再補加去離子水至刻度,混勻;10 mmol/L TPTZ溶液:稱取156 mg TPTZ,用40 mmol/L HCl溶解并定容至50 mL,混勻;20 mmol/L FeCl3·6H2O溶液的配制:稱取270 mg FeCl3·6H2O,加入去離子水溶解并定容至50 mL,混勻;FRAP試劑的配制:將乙酸鈉緩沖溶液、TPTZ溶液和FeCl3·6H2O溶液,按照體積比10∶1∶1混勻配制而成。然后,將2 850 μL FRAP試劑(預熱至37 ℃)和150 μL胃腸消化不同時間樣液混合,室溫暗處反應30 min,于593 nm處測定吸光度。以去離子水作為空白對照,以Trolox為參照,結果以每毫克多酚提取物(以干基計)所對應的Trolox當量表示(μmol Trolox/mg)。
1.3.5.4 氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)
將胃腸消化不同時間樣品溶液(各1 mL),離心(4 500 r/min,10 min),棄沉淀,上清液冷凍干燥,然后參照文獻[25]方法測定氧自由基吸收能力。方法如下:采用75 mmol/L pH 7.4 磷酸鹽緩沖溶液溶解熒光素并配制成120 μmol/L熒光素儲備液,在4 ℃存放,使用前再稀釋100倍。將凍干樣品分別采用75 mmol/L pH 7.4 磷酸鹽緩沖溶液溶解并配制成6 mg/mL溶液,各取20 μL樣品溶液和120 μL 1.2 μmol/L 熒光素加入到黑色96孔酶標板中,混合均勻,于37 ℃保溫15 min。然后每孔內快速加入60 μL 12 mmol/L AAPH溶液,酶標儀讀取每孔的熒光值,每隔1 min讀數1次,測定80 min。整個測試過程中酶標儀溫度控制在37 ℃,激發波長和發射波長分別設定為485 nm和530 nm。以75 mmol/L pH 7.4 磷酸鹽緩沖溶液作為空白對照,以Trolox為標準品。按公式(3)計算待測樣品熒光強度曲線下方的面積(AUCSample)及空白對照熒光強度曲線下方的面積(AUCBlank),按公式(4)計算待測樣品熒光強度曲線下方的凈面積。以標準品Trolox濃度及其熒光衰減曲線下方的凈面積建立回歸方程,待測樣品的ORAC值通過回歸方程計算,結果以每毫克多酚提取物(以干基計)所對應的Trolox當量表示(μmol Trolox/mg)。
(3)
AUCNet=AUCSample-AUCBlank
(4)
式中:F0,時間為0 min時的熒光強度;Fi,時間為第imin 時的熒光強度;AUC,待測樣品在時間imin內熒光衰減曲線下方的面積;AUCNet,待測樣品在時間imin內熒光衰減曲線下方的凈面積。
1.4 數據處理
試驗均重復3次,結果以平均值±標準偏差(standard deviation,SD)表示。運用SPSS version 17.0 軟件分析不同處理間的差異顯著性。運用Excel 2007中的Correl函數計算總酚含量與以DPPH、ABTS、FRAP和ORAC法測定的抗氧化活性之間的相互關系。
2 結果與分析
2.1 體外模擬消化過程中總酚含量的變化
以沒食子酸為標準品,采用福林酚法測定總酚含量,線性方程為Y=0.115 1X+0.002 5,R2=0.997 3,線性范圍為0~100 mg/L。根據線性方程,計算不同消化階段樣品中的總酚含量,結果如表1所示。
由表1可知,消化前樣品中的總酚含量最高,經過胃消化(胃消化0、0.5、1 h相比),總酚含量顯著增加,與文獻[15]報道一致,但在腸消化過程中,總酚含量先增加而后減少,且胃腸消化過程中總酚含量均低于消化前樣品,說明胃腸消化導致多酚降解或者轉化,與文獻[1]報道一致。胃消化0.5 h時總酚含量顯著高于胃消化0 h的含量,可能是因為胃消化酶作用及其強酸環境,使部分結合態酚分解釋放出游離態酚,從而使可測定的總酚含量增加;此后,直至胃消化1 h,總酚含量略有下降,可能與胃消化酶活性被抑制使游離態酚釋放量減少有關。在腸消化初始階段(0 h),總酚含量突然降低,這是由于腸消化液的加入,對多酚起到稀釋作用,此外,pH值上升,酸堿環境改變,導致可測的多酚含量降低。此后,直至腸消化2 h,總酚含量基本保持不變。在腸消化3 h時,總酚含量又突然增加,可能與腸消化酶作用有關,腸消化酶使底物中的結合態酚分解,釋放游離態酚,因此總酚含量增加。此后,總酚含量開始減少,其原因可能是胰酶活性降低,結合態酚分解減慢,也可能是游離態酚轉化為其他化合物,從而使游離態酚含量減少。在胃腸消化過程中,腸消化液中總酚含量低于胃消化液中的含量,說明胃腸消化降低了蘋果多酚提取物中的總酚含量。
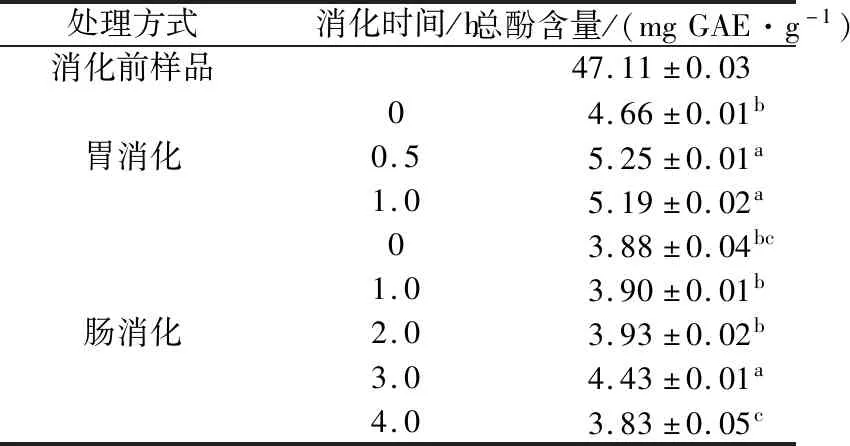
表1 體外不同消化階段消化液中總酚含量Table 1 Total phenolic content at different digestion stages in vitro
注:不同字母表示在相同消化液中消化不同時間,差異顯著(P<0.05)
2.2 體外模擬消化過程中抗氧化活性變化
2.2.1 DPPH自由基清除能力
體外模擬消化過程中DPPH自由基清除率的變化如圖1所示。由圖1可知,消化前樣品對DPPH自由基清除率為(37.24±1.63)%,胃消化0 h和1 h、腸消化2 h和4 h時DPPH自由基清除率分別為(74.17±1.40)%,(68.57±1.25)%,(88.81±2.95)%和(80.84±2.22)%。當胃消化0 h和1 h時,蘋果多酚對DPPH自由基清除率分別是消化前樣品的1.99倍和1.84倍;在腸消化2 h和4 h時,DPPH自由基清除率分別是消化前樣品的2.38倍和2.17倍。在腸消化2 h時DPPH自由基清除率最大。
與消化前樣品相比,胃消化0 h時,DPPH自由基清除率顯著增加,可能是由于胃消化液的強酸性環境,促使某些結合態酚分解釋放出游離態酚,增強了對DPPH自由基的清除能力。在胃消化1 h時,DPPH自由基清除能力略有下降,可能是游離酚降解或轉化為其他成分。在腸消化2 h時,DPPH自由基清除率最大,這是由于腸消化液中消化酶的作用,使得結合態酚分解釋放出游離態酚。在腸消化4 h時,DPPH自由基清除率顯著下降,可能是因為反應體系中易被氧化的多酚類物質發生降解或轉化,從而使得DPPH自由基清除率降低。
因此,經過胃腸消化,蘋果多酚提取物對DPPH自由基清除率顯著提高,說明胃腸消化增強了蘋果多酚提取物的抗氧化活性,這與JAYAWARDENA等[15]報道不一致,JAYAWARDENA等[15]發現胃腸消化不一定增強蘋果汁對DPPH自由基的清除效果。
2.2.2 ABTS自由基清除能力
不同消化階段蘋果多酚提取物對ABTS自由基清除能力如圖1所示。與消化前樣品相比,胃消化和腸消化均顯著提高蘋果多酚提取物對ABTS自由基清除能力(P<0.05)。在胃消化階段,ABTS自由基清除率逐漸增加但效果不顯著(P>0.05);與胃消化相比,腸消化階段ABTS自由基清除率顯著增加,在腸消化2 h時,ABTS自由基清除率最高為(84.31±3.51)%,約是消化前樣品的1.95倍,再隨著腸消化時間延長,ABTS自由基清除率反而顯著下降,這與QUAN等[26]報道一致。其原因可能是從胃消化到腸消化pH值的改變導致多酚類化合物的結構變化,從而降低對自由基的清除能力[26]。據報道,蘋果多酚在較低的pH條件下顯示出較強的抗氧化能力,在較高的pH條件下被氧化成醌,清除自由基能力下降[26]。此外,消化酶(蛋白質)可能通過氫鍵、共價鍵、疏水相互作用與多酚鍵合,從而影響多酚的抗氧化能力[22, 26]。
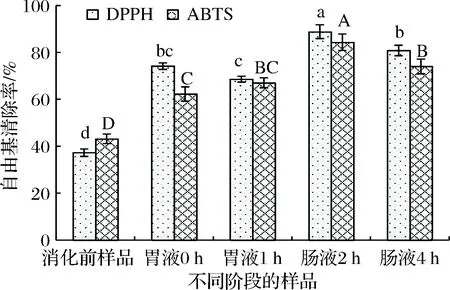
圖1 體外模擬消化過程中DPPH和ABTS自由基清除率的變化Fig.1 Changes of DPPH and ABTS radical scavenging rates during in vitro simulated digestion注:不同大小寫字母分別表示ABTS和DPPH自由基清除率差異顯著(P < 0.05)(下同)
2.2.3 鐵離子還原能力
如圖2所示,與消化前樣品相比,體外模擬胃消化能夠顯著提高蘋果多酚提取物的鐵離子還原能力(P< 0.05),在胃消化1 h時,FRAP達到最大值為(4.25±0.13) μmol Trolox/mg。但是當蘋果多酚提取物由胃消化進入腸消化后,FRAP值呈顯著性下降趨勢,說明蘋果多酚提取物對鐵離子的還原能力隨著腸消化時間延長顯著下降,這一現象與BOUAYED等[1]報道一致。鐵離子還原能力在腸消化階段顯著下降,可能與腸消化階段多酚濃度低有關,也可能與pH值有關[1]。根據鐵離子還原能力測定方法,可以得知pH 3.6是FRAP值測定的合適條件,胃消化液pH 2.0與pH 3.6較接近,而腸消化液pH 7.0與pH 3.6偏離較遠,由此推測,pH值的改變可能是導致腸消化階段FRAP值顯著下降的原因之一[1]。
2.2.4 氧自由基吸收能力
胃腸消化過程中氧自由基吸收能力變化如圖2所示。胃腸消化后溶液的ORAC值顯著高于消化前樣品(P< 0.05),在胃消化1 h時,ORAC值最大,最大值為(4.77±0.19) μmol Trolox/mg。由胃消化進入到腸消化時,ORAC值顯著降低,可能是由于pH值改變及消化酶作用,導致酚類物質不穩定發生降解或轉化,從而降低其抗氧化活性。但在腸消化階段隨著消化時間的延長,ORAC值下降并不明顯(P>0.05)。

圖2 體外模擬消化過程中FRAP值和ORAC值的變化Fig.2 Changes of FRAP and ORAC values during in vitro simulated digestion
2.3 總酚含量與抗氧化活性之間的相關性
利用Excel 2007中的correl函數,分別對消化前樣品、胃消化0 h和1 h、腸消化2 h和4 h樣品的總酚含量與DPPH自由基清除率、ABTS自由基清除率、ORAC值及FRAP值之間的相互關系進行計算,結果以絕對值表示見表2,其絕對值越接近于1,說明兩者相關性越強,其絕對值越小,說明兩者之間相關性小或不相關。
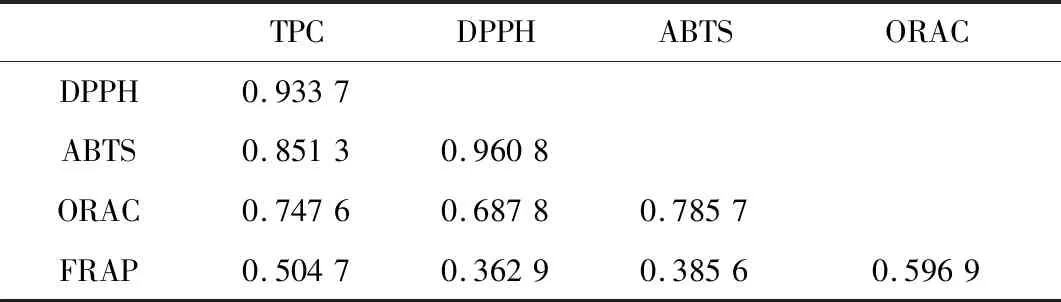
表2 總酚含量及抗氧化活性之間的相關性分析Table 2 Correlation analysis between total phenolic content and antioxidant activities
由表2可知,總酚含量與以DPPH、ABTS及ORAC法測定的抗氧化活性高度相關,其相關系數分別為0.933 7、0.851 3和0.747 6;總酚含量與FRAP值之間相關系數為0.504 7,說明兩者之間相關性不高;DPPH與ABTS之間相關系數為0.960 8,表明兩者高度相關(如圖1所示);ORAC與DPPH、與ABTS之間的相關系數分別為0.687 8和0.785 7,說明相關性高;FRAP與TPC、DPPH、ABTS及ORAC之間的相關系數均低于0.60,說明FRAP值與總酚含量及其他方法測定的抗氧化活性之間相關性不高。PODSEDEK等[27]研究發現總酚含量與抗氧化活性(以ABTS和FRAP法測定)之間的相關系數大于0.97,說明總酚含量與抗氧化活性高度相關。本研究中總酚含量與ABTS法測定的抗氧化活性相關性較高,但與FRAP測定的抗氧化活性相關性不高,這與PODSEDEK等[27]報道不完全一致。JAYAWARDENA等[15]報道總酚含量與ORAC、FRAP、DPPH、ABTS之間的相關系數分別為0.975、0.893、0.821、0.752,DUDONNE等[20]報道總酚含量與ABTS、DPPH、FRAP、ORAC相關系數依次為0.966、0.939、0.906和0.831,而本研究發現總酚含量與不同方法測定的抗氧化活性按照相關系數由高到低依次為DPPH(0.933 7)、ABTS(0.851 3)、ORAC(0.747 6)及FRAP(0.504 7)。由此看出,總酚含量與抗氧化活性之間的相關性,除了與抗氧化活性的測定方法有關[15],還可能與酚類物質的來源、主要酚類成分、游離或結合狀態等有關。
2.4 體外模擬消化過程中主要酚類物質的變化
圖3-a為標準品綠原酸、兒茶素、表兒茶素、咖啡酸、原花青素,槲皮素和根皮素的高效液相色譜圖,分別對應峰1~7,其保留時間分別為19.391、19.865、21.242、22.351、25.858、53.275、56.142 min。圖3-b~圖3-f分別為消化前樣品、胃消化0 h、胃消化1 h、腸消化 2 h和4 h的樣品的高效液相色譜圖。
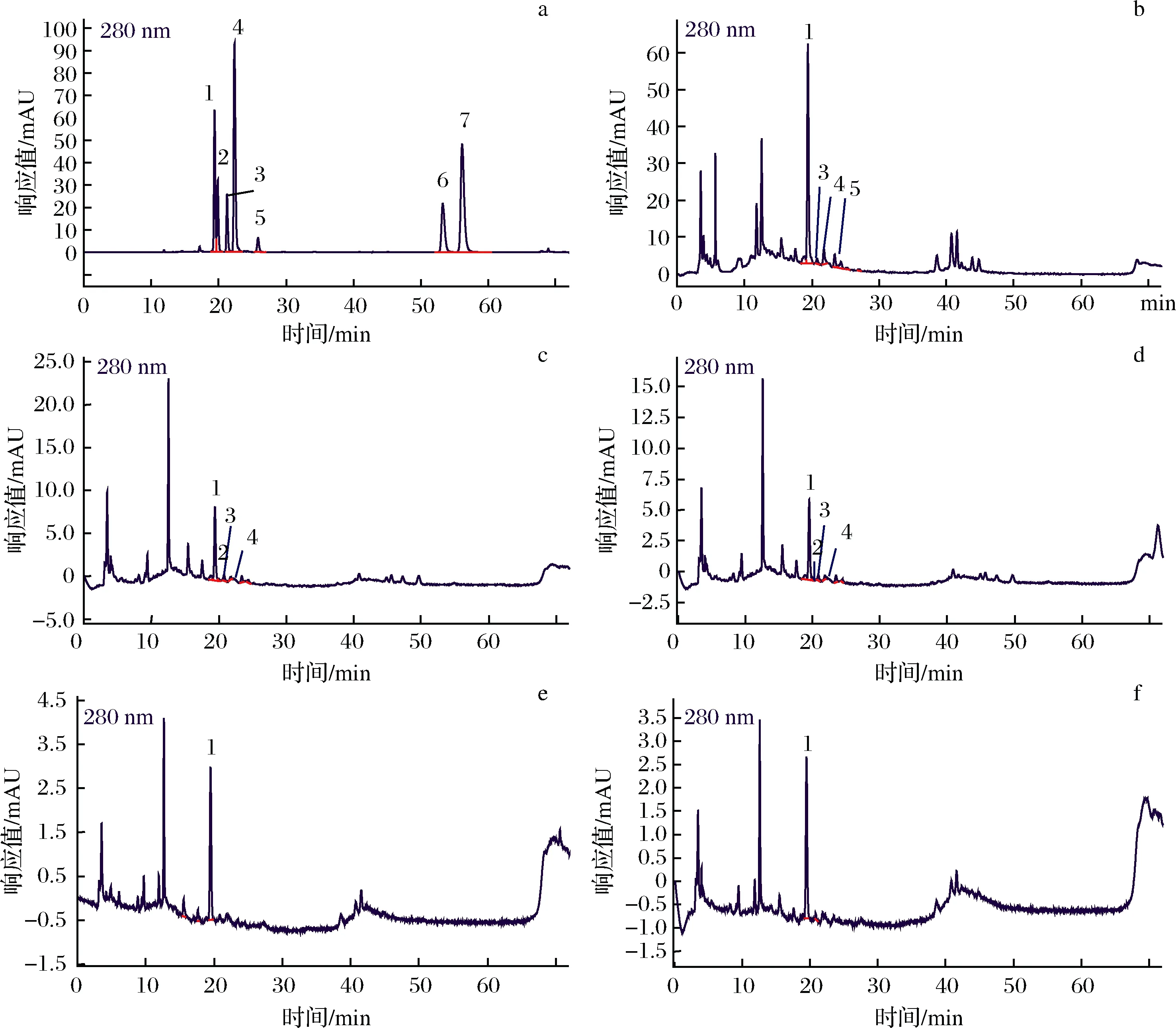
a-標準品;b-消化前樣品;c-胃消化0 h;d-胃消化1 h;e-腸消化2 h;f-腸消化4 h峰1~7分別對應綠原酸、兒茶素、表兒茶素、咖啡酸、原花青素、槲皮素和根皮素圖3 胃腸消化液及標準品的高效液相色譜圖Fig.3 High performance liquid chromatogram of gastrointestinal digestive juice and standards
由圖3可知,綠原酸是蘋果多酚提取物中的主要成分,在胃腸消化液中均可檢出,其峰面積及峰高均隨著消化進程(消化前→胃消化→腸消化)顯著性下降;兒茶素在消化前樣品中未被檢出,在胃消化的初始階段(0 h)及胃消化1 h時,均檢測到兒茶素色譜峰,可能是由于胃消化液pH值較低的強酸性環境使蘋果多酚提取物中其他成分轉化為兒茶素,但隨著腸消化液pH值升高,兒茶素分子又轉化為其他成分,所以在腸消化液中未檢出兒茶素。表兒茶素和咖啡酸在消化前樣品及胃消化液中均可檢測到色譜峰,在腸消化液中未檢測到,說明胃腸消化也影響其分子存在形式;原花青素僅在消化前樣品中檢測到色譜峰,說明原花青素不穩定,在胃腸消化中容易降解或轉化。
根據標準品對應的保留時間,初步判斷不同消化階段樣品中多酚成分;以標準品對應的峰面積為縱坐標、以濃度為橫坐標,繪制標準曲線,得到各標準品的線性方程,根據消化液中多酚對應的峰面積,由線性方程計算消化液中主要酚類物質的含量(表3)。
由表3可知,消化前樣品中綠原酸含量最高為(285.46±20.55) μg/mL,其次為原花青素(19.60±1.26) μg/mL、表兒茶素(17.92±5.02) μg/mL和咖啡酸(12.60±3.73) μg/mL。兒茶素、槲皮素及根皮素在消化前樣品未檢測到,說明蘋果多酚提取物不含有兒茶素、槲皮素及根皮素,或因其含量較低未被檢出。
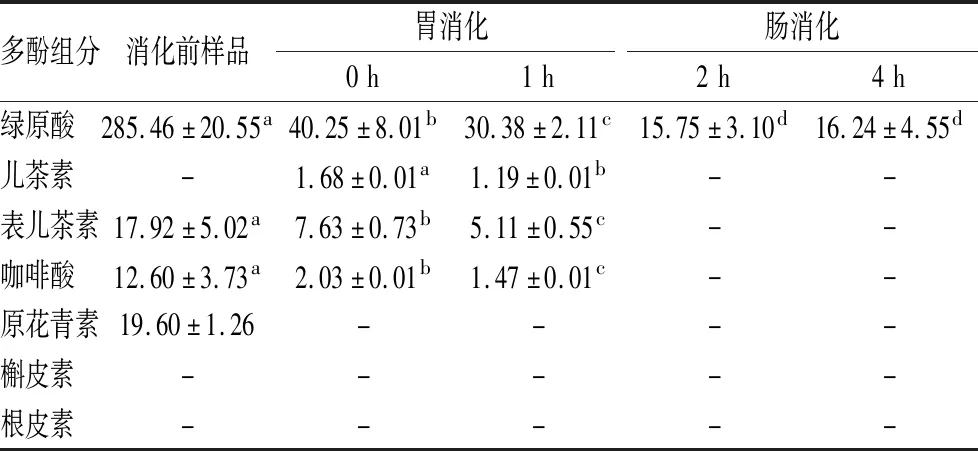
表3 不同消化階段消化液中主要酚類物質含量 單位:μg/mLTable 3 The content of main phenolic components in digestive juice at different digestion stages
注:同一行中不同字母表示差異顯著(P<0.05),-表示未檢出
由表3還可以看出,蘋果多酚提取物在胃腸消化過程中主要酚類物質的含量發生顯著性變化,經胃腸消化后,僅能檢測出綠原酸,其含量由消化前(285.46±20.55) μg/mL減少到(16.24±4.55) μg/mL。BOUAYED等[28]報道綠原酸是蘋果多種含量最高的酚類物質(11.8~16.3 mg/100g),其次,因蘋果品種不同,可能是表兒茶素(4.8~7.8 mg/100g)也可能是原花青素(5.0~7.1 mg/100g);在胃消化和腸消化過程中綠原酸含量急劇減少,表兒茶素和咖啡酸在胃消化液中含量均較低,在腸消化液中其含量更低甚至檢不出含量,原花青素在腸消化液中未檢出。由此看出,本研究中主要酚類物質含量高低及在胃腸消化過程中的變化趨勢與BOUAYED等[28]報道相一致。
由圖3和表3可知,蘋果多酚提取物中主要酚類物質在胃腸消化過程中不穩定,會發生降解或轉化。與腸消化相比,胃消化過程中強酸性環境在一定程度上抑制酚類物質的降解,這一現象與文獻[29]報道一致。
由表1不同消化液中總酚含量及表3不同消化液中主要酚類物質的含量,可以看出,總酚含量高于主要酚類物質的含量之和,說明胃腸消化液中存在一定量的不同于研究中所使用的標準品的酚類物質,或許是這些標準品的降解或轉化產物。由圖1和圖2可以看出胃腸消化后抗氧化能力顯著高于消化前樣品,說明蘋果多酚提取物經過胃腸消化產生了抗氧化物質,這些抗氧化物質并不是這幾種給定的標準品,胃腸消化后抗氧化能力的增強歸因于胃腸消化后新生成的抗氧化成分。由此可知,胃腸消化使蘋果多酚提取物中主要酚類物質發生降解或轉化,同時產生新的抗氧化成分,這些新的抗氧化成分有待于進一步探討。
3 結論
蘋果多酚是膳食中抗氧化劑的主要成分,本研究采用體外消化模型探討蘋果多酚提取物在胃腸消化過程中總酚含量、主要酚類物質含量、DPPH和ABTS自由基清除能力、鐵離子還原能力以及氧自由基吸收能力。結果表明,胃消化液中總酚含量隨著消化時間延長而增加,腸消化液中總酚含量隨著消化時間延長先增加后減少,但均低于消化前樣品中的含量;胃消化液中可檢測的主要酚類物質按照含量由高到低依次為綠原酸、表兒茶素、咖啡酸、兒茶素;腸消化液中可檢測的主要酚類物質為綠原酸;胃腸消化使主要酚類物質發生降解或轉化;胃腸消化增強了蘋果多酚提取物對DPPH自由基和ABTS自由基清除能力、鐵離子還原能力以及氧自由基吸收能力;相關性分析表明,總酚含量與以DPPH、ABTS、ORAC法測定的抗氧化活性之間高度相關,與以FRAP法測定的抗氧化活性相關性不高。
植物多酚是植物次級代謝產物中的一大類物質,具有8 000多種化合物[28],由于品種類型、存在部位、含量高低、提取方法、檢測方法、操作技術等的不同,在分析檢測時僅僅依據現有的幾個標準品是遠遠不夠的。此外,在胃腸消化時,由于酸堿穩定性、與消化酶的相互作用及食品基質的影響,酚類物質的存在形式及其生物活性可能發生很大變化。抗氧化活性檢測方法包括DPPH、ORAC、FRAP、ABTS及細胞培養法,其方法和原理不同,所反應的抗氧化機理有著本質上的差異,僅靠一種方法評價多酚類物質的抗氧化活性是不全面的。因此,有關蘋果多酚類物質的酚類組成、胃腸消化對其成分的影響及其抗氧化活性評價,還有待于深入研究。

