MFHAS1促進誘導M2型巨噬細胞極化減輕馬兜鈴酸誘導急性腎損傷的研究
張黎 孫婧 鄧秋芳 甘金城 葉茂
【摘要】 目的:研究MFHAS1對M2型巨噬細胞極化的影響以及M2型巨噬細胞對馬兜鈴酸誘導的腎上皮細胞HK-2急性損傷的影響。方法:Real-time PCR檢測MFHAS1 mRNA的表達,MTT法檢測細胞存活率,流式細胞術檢測細胞凋亡和M2型巨噬細胞表面胞膜分子CD86和CD206的表達,Western blot檢測MFHAS1及M2型巨噬細胞中Arg1和MRC1蛋白的表達,ELISA檢測巨噬細胞培養上清中IL-10的含量。結果:THP-1細胞中過表達MFHAS1可使M2型巨噬細胞的Arg1、IL-10和MRC1表達量均顯著上升(P<0.05),同時M2型巨噬細胞表面胞膜分子CD206表達量顯著上升(P<0.05),CD86的表達顯著下降(P<0.05),即THP-1細胞中過表達MFHAS1可促進IL-13誘導巨噬細胞向M2型極化;M2型巨噬細胞能抑制馬兜鈴酸對HK-2細胞的凋亡誘導作用,提升細胞存活率。結論:過表達MFHAS1可促進IL-13誘導巨噬細胞向M2型極化,M2型巨噬細胞可抑制馬兜鈴酸對腎上皮HK-2細胞的凋亡誘導作用,提升細胞存活率,減輕細胞損傷。
【關鍵詞】 急性腎損傷 THP-1 HK-2 MFHAS1 馬兜鈴酸 M2型巨噬細胞 存活率 凋亡率
MFHAS1 Promoted the Polarization of M2 Macrophage to Alleviate Acute Renal Injury Induced by Aristolochic Acid/ZHANG Li, SUN Jing, DENG Qiufang, GAN Jincheng, YE Mao. //Medical Innovation of China, 2020, 17(04): 00-011
[Abstract] Objective: To investigate the effect of MFHAS1 on polarization of M2 macrophages and the effect of M2 macrophages on acute kidney injury of renal epithelial HK-2 cells induced by aristolochic acid. Method: Real-time PCR was carried out to detect the expression levels of MFHAS1 mRNA. MTT assay was applied to detect cell viability. Flow cytometry was used to detect apoptosis and the expression levels of CD86 and CD206 on the surface of M2 macrophages. Western blot was used to detect the protein expression levels of MFHAS1, Arg1 and MRC1. ELISA was applied to detect the content of IL-10 in the supernatant of macrophage culture. Result: Overexpression of MFHAS1 in THP-1 cells significantly increased the expression of Arg1, IL-10 and MRC1 of M2 macrophages (P<0.05), while the expression of CD206 on the surface of M2 macrophages significantly increased (P<0.05), and the expression of CD86 significantly decreased (P<0.05). In other words, the overexpression of MFHAS1 in THP-1 cells promoted the induction of IL-13 on polarization of M2 macrophages. M2-type macrophages inhibited the apoptosis induction effect of aristolosic acid on HK-2 cells and elevated the cell survival rate. Conclusion: Overexpression of MFHAS1 promotes the induction of IL-13 on polarization of M2 macrophages. M2 macrophages inhibits the apoptosis induction effect of aristolosic acid on renal epithelial HK-2 cells, improve cell survival rate and alleviates cell injury.
[Key words] Acute kidney injury THP-1 HK-2 MFHAS1 Aristolochic acid M2 macrophages Survival rate Apoptotic rate
First-authors address: Nanxishan Hospital of Guangxi Zhuang Autonomous Region, Guilin 541002, China
doi:10.3969/j.issn.1674-4985.2020.04.002
急性腎損傷(Acute kidney injury,AKI)是臨床最常見的腎病,也是臨床危重癥[1-3]。中草藥成分—馬兜鈴酸(Aristolochic acid,AA)是導致急性腎損傷的一個很重要的原因,AA腎毒性的分子機制主要是指AA通過影響miRNA、內質網應激、氧化應激而直接或間接地誘導腎臟細胞凋亡[4]。急性腎損傷的危重性,使得研究其發生時的修復機制成為熱點。惡性纖維組織細胞瘤擴增序列1(malignant fibrous histiocytoma amplified sequence 1,MFHAS1)屬于ROCO蛋白家族成員[5-6],是惡性纖維組織細胞瘤(MFHS)和胃腸道腫瘤的預測癌蛋白[7]。MFHAS1還可以通過raf/mek/erk途徑調節紅細胞生成[8]。研究發現,MFHAS1具有誘導巨噬細胞極化的作用[9]。Ng等[10]發現敲除巨噬細胞中MFHAS1能提高炎性因子IL-6生成,提示MFHAS1可能參與免疫調節作用。MFHAS1在急性腎損傷中表達情況和作用尚不清楚,本課題假設MFHAS1可通過巨噬細胞的免疫調節作用在急性腎損傷中發揮作用。本課題建立THP-1細胞向M2巨噬細胞誘導系統及巨噬細胞和腎小管上皮細胞系HK-2共培養模型,用AA模擬HK-2細胞急性腎損傷,檢測巨噬細胞轉染MFHAS1對急性腎損傷的影響及作用機制的研究,現報道如下。
1 材料與方法
1.1 材料 人單核細胞細胞株THP-1、人腎小管上皮細胞(human renal tubular epithelial cells)HK-2購自ATCC;馬兜鈴酸-Ⅰ(aristolochic acid, AAⅠ)、佛波酯(PMA)、胰蛋白酶Trypsin、四氮唑藍(MTT)和二甲基亞礬(Dimethyl sulfoxide,DMSO)購自Sigma-Aldrich公司;IL-13購自Peprotech公司;抗Arg1抗體、抗MRC1抗體、抗MFHAS1抗體和抗購自Abcam公司;胎牛血清(fetal bovine serum,FBS)、RPMI-1640培養基、Trizol試劑、Real-time PCR 試劑盒、反轉錄試劑盒(RT-PCR)購自美國Invitrogen公司;引物和MFHAS1過表達載體購自上海吉瑪制藥技術有限公司;IL-10 ELISA檢測試劑盒(美國Raybio)購自深圳市科潤達生物工程有限公司;流式抗體PE-CD86、PE-CD206、雙染色流式法細胞凋亡檢測試劑盒購自美國BD公司;流式細胞儀購自美國BD公司,光學顯微鏡、全自動酶標儀及Real-time PCR儀購自美國Bio-Rad公司。
1.2 方法
1.2.1 細胞培養 用細胞培養液(10% FBS+RPMI 1640培養基+1%青霉素+1%鏈霉素)培養THP-1和HK-2細胞,于37 ℃ 5% CO2濕度95%培養箱中培養。每天換液1次,每2~3天用Trypsin消化傳代。實驗前24 h換無血清培養基,培養24 h換培養基為含AAⅠ(40 μg/mL)的培養基,設置空白組(不加AA的培養基),對照組(加AA的培養基)和實驗組(加AA及MFHAS1的培養基,即過表達MFHAS1組)。
1.2.2 細胞轉染 培養THP-1細胞至對數生長期,用細胞培養液稀釋細胞濃度至1×106個/mL,
200 μL/孔接種于6孔板中,細胞培養至基本融合為一層時進行轉染。先用無血清OptiMEM培養液稀釋脂質體Lipofectamine 2000、MFHAS1的載體,之后取等體積脂質體和載體混勻后室溫孵育20 min,將混合液加入到培養好的細胞孔板中,混勻,培養6 h,換完全培養基,轉染48 h收集細胞,進行實驗。
1.2.3 誘導THP-1細胞分化為M2型巨噬細胞 待THP-1細胞培養至對數生長期,稀釋為1×106個/mL,以每孔100 μL接種于6孔板中,向培養液中加入終濃度為10 ng/mL的PMA誘導24 h,使其分化為M0型巨噬細胞。棄培養液,收集細胞,洗滌2遍,加入含終濃度為20 ng/mL IL-13的RPMI 1640培養基,繼續培養48 h,誘導其向M2型巨噬細胞極化。
1.2.4 Real-time PCR檢測mRNA的表達和M2型巨噬細胞分化指標 按照上述誘導條件處理48 h后的各組細胞,用Trizol試劑提取總RNA,再將RNA反轉錄為cDNA,反應程序為37 ℃ 15 min、85 ℃ 5 s;4 ℃ 12 h,測定濃度后超低溫冷凍保存。取cDNA按照real-time PCR的說明書進行反應,反應程序為:94 ℃ 5 min;94 ℃ 30 s、56 ℃ 35 s、72 ℃ 35 s,35個循環;72 ℃ 10 min。檢測MFHAS1 mRNA表達水平和各組細胞M2巨噬細胞極化標志物Arg1、IL-10和MRC1。β-actin上游引物5-CATCCTGCGTCTGGACCT-3,下游引物5-TCAGGAGCAATGATCTTG-3;MFHAS1上游引物5-CGTGCCCTCAAGATCCTCTG-3,下游引物5-GGTGAGCTGATTGCGACTAAG-3。運用Bio-Rad PCR檢測系統進行數據分析,經內參照β-actin進行校正。
1.2.5 流式細胞術檢測M2型巨噬細胞表面胞膜分子的改變 將加入IL-13誘導后的細胞孵育60 h,
收集細胞,冷PBS重懸洗滌細胞2次,加入40 μL冷PBS重懸細胞,加入等體積小鼠血清,封閉
30 min去除非特異性結合,加入流式抗體PE-CD86、PE-CD206各5 μL,4 ℃避光反應30 min,冷PBS洗滌3次,加入200 μL PBS,流式細胞儀檢測細胞表面胞膜分子的改變。
1.2.6 ELISA檢測巨噬細胞培養上清中IL-10的含
量 收集誘導后的巨噬細胞培養液上清,根據試劑盒說明書進行操作,在測定孔中加入測定緩沖液和培養液上清,室溫震蕩2.5 h,洗板,然后加入生物素標記的抗體,室溫震蕩1.0 h,洗板,然后加入鏈霉親和素溶液,室溫震蕩45 min,洗板,加入底物,室溫避光30 min,酶標儀檢測450 nm吸光度值,計算含量。
1.2.7 M2型巨噬細胞和HK-2細胞共培養模型的建立及分組 根據1.2.3的方法,將接種于Transwell上層小室中的THP-1細胞(2×105個/mL)誘導極化為M2型巨噬細胞,誘導結束后,棄上清,細胞洗滌2次,加入無血清培養液;Transwell下層小室中加入培養至對數生長期的HK-2細胞,下層小室再分別加入終濃度為0(培養液對照)和40 μg/mL的AAⅠ。分別設置HK-2細胞組(下層小室:HK-2細胞)、HK-2細胞+M2型巨噬細胞組(下層小室:HK-2細胞,上層小室:M2型巨噬細胞組)、HK-2細胞+馬兜鈴酸組(下層小室:HK-2細胞+40 μg/mL
AAⅠ)和HK-2細胞+馬兜鈴酸+M2型巨噬細胞組(下層小室:HK-2細胞+40 μg/mL AAⅠ,上層小室:M2型巨噬細胞組)。
1.2.8 MTT實驗測定細胞存活率 收集各組共培養的HK-2細胞,洗滌2遍,稀釋后取100μL細胞(2×104個/mL)加入96孔板,每孔加入20 μL(5 g/L)MTT,繼續培養4 h后棄去培養液,每孔加入150 μL DMSO,室溫振蕩5 min,酶標儀測定OD 490 nm處的吸光度(A)值,按照公式存活率(%)=(實驗組A均值-陰性對照組A均值)/陰性對照A均值-空白對照A均值)×100%計算存活率。
1.2.9 流式細胞術測定細胞凋亡率 將各組處理后HK-2細胞,以每孔2×107個細胞接種于6孔板中,置于37 ℃ 5% CO2培養箱中培養至融合度為70%~80%,棄去培養液,用PBS緩沖液洗滌2次,用無EDTA的Trypsin消化,離心收集細胞,按照Annexin V/PI試劑盒說明書進行操作,先加100 μL
binding buffer重懸細胞,再加入5 μL Annexin V-FITC和5 μL碘化丙啶(PI)混勻,室溫避光反應20 min,加入400 μL binding buffer,用流式細胞儀測定細胞凋亡率。
1.2.10 Western blot檢測蛋白表達 將轉染后培養48 h的各組巨噬細胞(陰性對照組、空白組、過表達MFHAS1組)進行收集,加入RIPA重懸細胞,超聲冰浴破碎,收集蛋白,測定總蛋白濃度。進行SDS-PAGE,然后轉膜,室溫封閉2 h,加入一抗MFHAS1(1︰200)或抗Arg1抗體(1︰500)、抗MRC1抗體(1︰800),4 ℃孵育過夜,用TBST緩沖液洗膜2次,加入稀釋的二抗室溫孵育1 h,顯影后掃描,以β-actin為內參照,分析蛋白表達水平。
1.3 統計學處理 使用SPSS 21.0統計軟件進行分析,計量資料采用(x±s)表示,兩組間比較采用t檢驗,多組間的比較采用單因素方差分析,以P<0.05為差異有統計學意義。
2 結果
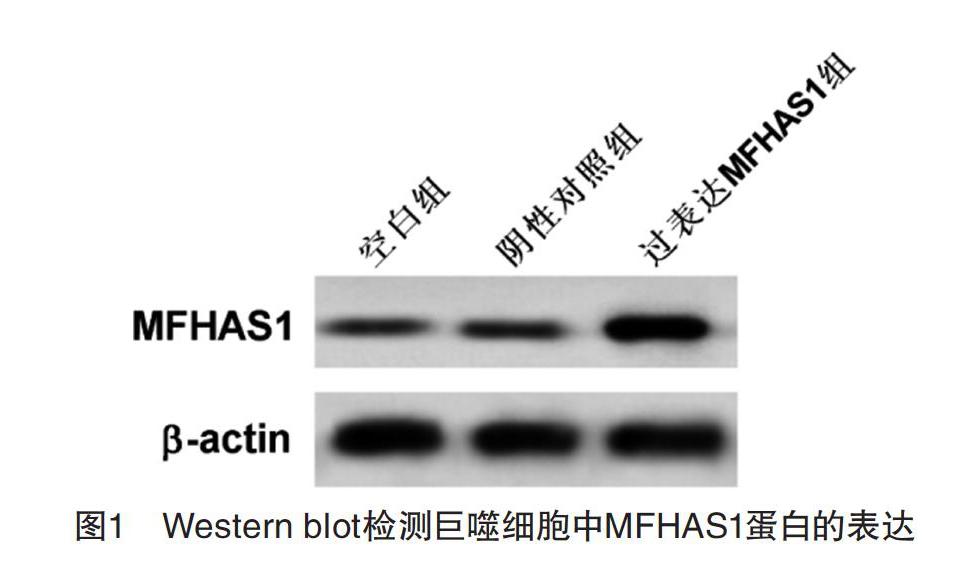
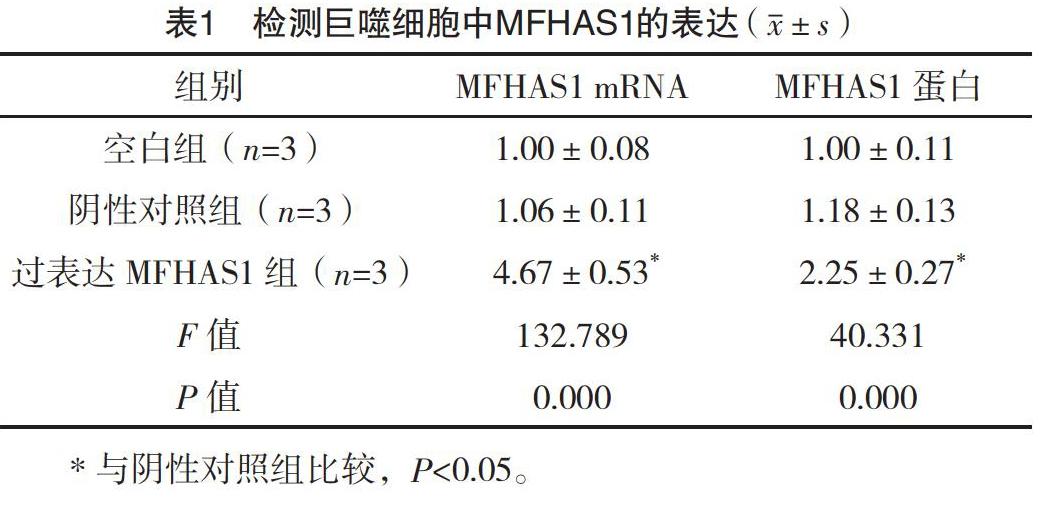
2.1 轉染后巨噬細胞中MFHAS1的表達 結果顯示,與陰性對照組相比,過表達MFHAS1組巨噬細胞中MFHAS1的mRNA和蛋白表達量均顯著上升(P<0.05)。見圖1和表1。
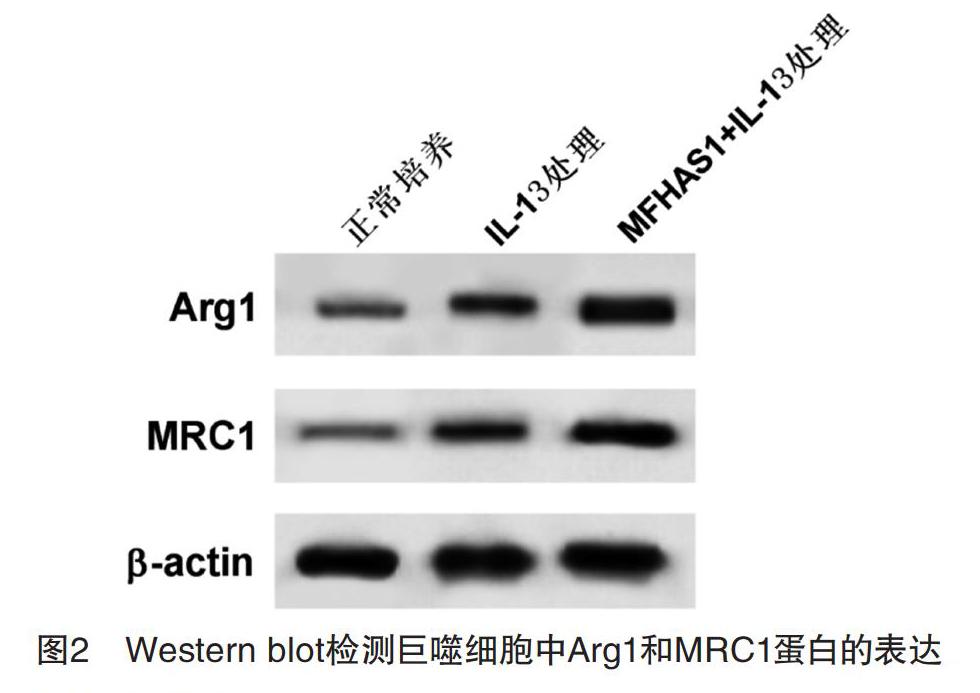
2.2 MFHAS1的表達對巨噬細胞極性轉換的影響 Western blot和ELISA結果顯示,與正常培養組相比,IL-13處理組巨噬細胞中IL-10和MRC1表達量和Arg1分泌量均顯著上升(P<0.05);與IL-13處理組相比,MFHAS1+IL-13處理組巨噬細胞中IL-10和MRC1表達量和Arg1分泌量均顯著上升(P<0.05),見圖2和表2。說明MFHAS1過表達可促進IL-13誘導巨噬細胞向M2型極化。
2.3 過表達MFHAS1對M2型巨噬細胞表面胞膜分子表達的影響 流式細胞術結果表明,與正常培養組相比,IL-13處理組M2型巨噬細胞表面胞膜分子CD206的表達量顯著上升(P<0.05),CD86的表達量無顯著變化;與IL-13處理組相比,MFHAS1+IL-13處理組M2型巨噬細胞表面胞膜分子CD86的表達量顯著下降(P<0.05),而CD206的表達量顯著上升(P<0.05),見表3和圖3。說明過表達MFHAS1可促進IL-13誘導巨噬細胞向M2型極化。
2.4 M2型巨噬細胞提高AA處理后HK-2細胞存活率 預實驗結果發現,當AA為40 μg/mL濃度時,HK-2細胞的凋亡率較高且沒有細胞壞死,因此選40 μg/m AA誘導HK-2細胞凋亡的急性腎損傷模型。MTT結果表明,與HK-2細胞組細胞活力(100%)相比,HK-2細胞+M2型巨噬細胞組HK-2細胞活力(115.68±8.98)%上升,但差異不顯著,HK-2細胞+AA組的活力(64.78±5.43)%顯著下降(P<0.05);與HK-2細胞+AA組(64.78±5.43)%相比,HK-2細胞+AA+M2型巨噬細胞組細胞活力(88.94±6.82)%顯著上升(P<0.05)。說明M2型巨噬細胞能減輕AA對HK-2細胞的毒性,提升細胞活力。
2.5 M2型巨噬細胞可抑制馬兜鈴酸對HK-2細胞的凋亡誘導作用 流式細胞術結果表明,與HK-2細胞組凋亡率(9.27±0.76)%相比,HK-2細胞+M2型巨噬細胞組HK-2細胞凋亡率(7.52±0.44)%下降,但差異無統計學意義(P>0.05),HK-2細胞+AA組的細胞凋亡率(26.83±3.17)%顯著上升(P<0.05);與HK-2細胞+AA組相比,HK-2細胞+AA+M2型巨噬細胞組細胞凋亡率(17.38±2.28)%顯著下降(P<0.05),見圖4。說明M2型巨噬細胞能抑制AA對HK-2細胞的凋亡誘導作用。
3 討論
近年來,急性腎損傷(AKI)的發病率在逐年增長,含馬兜鈴酸(AA)的中草藥導致的AKI在全球范圍廣泛存在[11-13]。AA通常會造成腎小管萎縮和間質纖維化,甚至進展為腎衰竭,它主要的靶細胞是腎小管上皮細胞HK-2[14]。研究急性腎損傷的修復機制,也成為臨床急性腎損傷基礎研究的熱點和重點。
研究表明,ROCO蛋白家族成員—MFHAS1具有依賴于TLR(toll like receptor)的潛在免疫調節作用[5,9],TLR2參與全身炎癥、心臟功能障礙和急性腎損傷的過程。Chen等[15]研究發現,MFHAS1具有巨噬細胞極化誘導劑的作用,人結直腸癌細胞通過上調MFHAS1誘導腫瘤相關巨噬細胞RAW264.7向M2型巨噬細胞極化。Zhong等[16]研究發現,在人胚胎腎細胞系中,MFHAS1與E3泛素連接酶paraja2形成復合物,促進MFHAS1的泛素化積累,對TLr2介導的JNK/p38通路具有正調節作用,并促進M1巨噬細胞極化、M2到M1巨噬細胞轉化和炎癥反應。本研究發現,在人單核細胞細胞株THP-1細胞中過表達MFHAS1,在巨噬細胞誘導過程中可促進M2型巨噬細胞極化相關指標Arg1、IL-10和MRC1表達,同時M2型巨噬細胞表面胞膜分子CD206表達量上升,M1型巨噬細胞表面胞膜分子CD86的表達下降,說明THP-1細胞中過表達MFHAS1在巨噬細胞誘導過程中可促進巨噬細胞向M2型極化,本研究結果驗證了Chen等[15]關于MFHAS1可作為M2型巨噬細胞極化誘導劑的研究結果。MFHAS1在針對涉及急性腎損傷的作用尚不清楚。
劉權等[17]發現,M2型巨噬細胞能夠減輕草酸鈣腎結石對腎上皮細胞HK2的損傷凋亡作用,促進HK-2的細胞增殖。有研究表明,骨髓來源的間充質干細胞(MSCs)可通過增加浸潤至腎臟的巨噬細胞數量,減少炎性細胞特別是中性粒細胞的數量,從而減輕缺血/再灌注損傷誘導的AKI[18]。本研究通過建立M2型巨噬細胞與AA誘導的HK2細胞共培養模型,進一步實驗發現,M2型巨噬細胞能抑制AA對腎上皮細胞HK-2的凋亡誘導作用,提高細胞存活率。證實了MFHAS1在人急性腎損傷中通過促進單核細胞向M2型巨噬細胞的誘導極化,參與AA誘導的AKI的免疫調節過程,減輕病癥。
巨噬細胞聚集是慢性馬兜鈴酸腎病(AAN)的早期特征,而巨噬細胞對AKI的作用通常存在不同觀點,上述的研究結果表明巨噬細胞可減輕AKI病癥,而Dai等[19]通過建立慢性AAN小鼠模型,證實巨噬細胞是AAN關鍵的炎癥細胞,其通過與TGF-β/Smad3介導的腎纖維化和NF-κB驅動的腎炎癥相關的機制,加重慢性AAN進行性腎小管間質損傷。Li等[20]通過建立膿毒癥誘導的大鼠AKI模型發現,72 h后明顯檢測到M2巨噬細胞,M2巨噬細胞耗竭后,腎損傷加重,腎功能下降,M2巨噬細胞通過上調IL-10的表達和抑制TNF-α的分泌來減弱由膿毒癥引起的AKI。Geng等[21]研究表明,在體外與MSCs共培養可誘導巨噬細胞向M2型極化,在橫紋肌溶解癥導致的AKI小鼠模型中,小鼠注射與MSCs共培養獲得的M2型巨噬細胞可減輕腎損傷,而注射M0和M1型巨噬細胞則使小鼠AKI損傷加重。M2型巨噬細胞在AKI中的作用機制及其與疾病原因和嚴重程度是否相關,還需要詳細研究。
綜上所述,本研究闡述了MFHAS1在AA誘導的AKI中通過促進誘導單核細胞向M2型巨噬細胞極化,積累的M2型巨噬細胞通過抑制AA對HK-2細胞的凋亡誘導作用,提高HK2細胞存活率,減輕AA導致的AKI。本研究為急性腎損傷的臨床基礎研究提供新的思路和方向。
參考文獻
[1]楊莉.急性腎損傷[J].中華檢驗醫學雜志,2011,34(5):476-480.
[2]聞英,席修明.急性腎損傷的流行病學研究進展[J/OL].中華重癥醫學電子雜志(網絡版),2017,3(2):143-147.
[3] Wen Y,Jiang L,Xu Y,et al.Prevalence, risk factors, clinical course, and outcome of acute kidney injury in Chinese intensive care units: a prospective cohort study [J].Chin Med J (Engl),2013,126(23):4409-4416.
[4]涂玥, 萬毅剛, 孫偉, 等. 馬兜鈴酸腎毒性的臨床特征、分子機制及治療策略[J]. 南京中醫藥大學學報, 2018,34(1):12-18.
[5] Dihanich S.MASL1:a neglected ROCO protein[J].Biochem Soc Trans,2012,40(5):1090-1094.
[6] Sakabe T,Shinomiya T,Mori T,et al.Identification of a novel gene, MASL1, within an amplicon at 8p23.1 detected in malignant fibrous histiocytomas by comparative genomic hybridization[J].Cancer Res,1999,51(3):511-515.
[7] Weng W H,Wejde J,Ahlen J,et al.Characterization of large chromosome markers in a malignant fibrous histiocytoma by spectral karyotyping, comparative genomic hybridization (CGH), and array CGH[J].Cancer Genet Cytogenet,2004,150(1):27-32.
[8] Kumkhaek C,Aerbajinai W,Liu W,et al.MASL1 induces erythroid differentiation in human erythropoietin-dependent CD34+ cells through the Raf/MEK/ERK pathway[J].Blood,2013,121(16):3216-3227.
[9] Zhong J,Shi Q Q,Zhu M M,et al.MFHAS1 Is Associated with Sepsis and Stimulates TLR2/NF-κB Signaling Pathway Following Negative Regulation[J].PLoS One,2015,10(11):e0143662.
[10] Ng A C,Eisenberg J M,Heath R J,et al.Human leucine-rich repeat proteins: a genome-wide bioinformatic categorization and functional analysis in innate immunity[J].Proc Natl Acad of Sci USA,2011,108(Suppl 1):4631-4638.
[11] Jadot I,Declèves A E,Nortier J,et al.An Integrated View of Aristolochic Acid Nephropathy: Update of the Literature[J].Int J Mol Sci,2017,18(2):297.
[12] Arlt V M,Stiborova M,Schmeiser H H.Aristolochic acid as a probable human cancer hazard in herbal remedies: a review[J].Mutagenesis,2002,17(4):265-277.
[13] Debelle F D,Vanherweghem J L,Nortier J L.Aristolochic acid nephropathy:a worldwide problem[J].Kidney Int,2008,74(2):158-169.
[14]陳文,諶貽璞,李安,等.馬兜鈴酸腎病的臨床與病理表現[J].中華醫學雜志,2001,81(18):1101-1105.
[15] Chen W,Xu Y,Zhong J,et al.MFHAS1 promotes colorectal cancer progress by regulating polarization of tumor-associated macrophages via STAT6 signaling pathway[J].Oncotarget,2016,7(48):78726-78735.
[16] Zhong J,Wang H,Chen W,et al.Ubiquitylation of MFHAS1 by the ubiquitin ligase praja2 promotes M1 macrophage polarization by activating JNK and p38 pathways[J].Cell Death Dis,2017,8(5):e2763.
[17]劉權,關曉峰,陶芝偉,等.M2型巨噬細胞對草酸鈣晶體刺激腎小管上皮細胞損傷的影響[J].廣東醫學,2018,38(3):331-335.
[18]胡婕,張利,崔少遠,等.間充質干細胞通過調節天然免疫系統減輕急性腎損傷的機制研究[J].中華危重病急救醫學,2016,28(3):235-240.
[19] Dai X Y,Huang X R,Li Z,et al.Targeting c-fms kinase attenuates chronic aristolochic acid nephropathy in mice[J].Oncotarget,2016,7(10):10841-10856.
[20] Li X,Mu G,Song C,et al.Role of M2 Macrophages in Sepsis-Induced Acute Kidney Injury[J].SHOCK,2018,50(2):233-239.
[21] Geng Y,Zhang L,Fu B,et al.Mesenchymal stem cells ameliorate rhabdomyolysis-induced acute kidney injury via the activation of M2 macrophages[J].Stem Cell Res Ther,2014,5(3):80.
(收稿日期:2019-08-22) (本文編輯:周亞杰)

