雄性食蟹猴生殖系統中Ghrelin的分布定位
李 鑫 宋尚橋 馬圍圍 鄭 福 曾素先 孫翠翠 嚴 瑾 黎宗強*
(1.廣西大學動物科學技術學院,南寧,530005;2.南寧市江南區沙井街道辦事處水產畜牧獸醫站,南寧,530033)
Ghrelin是由日本科學家Kojima等[1]于1999年從大鼠胃組織中提取得到的一種28肽。它是第一個作為生長激素促分泌素受體(growth hormone secretagogue receptor,GHS-R)[2]的天然內源性配體而被發現,能促進生長激素(growth hormone,GH)的釋放,也是繼生長激素釋放激素(growth hormone-releasing hormone,GHRH)[3]和生長抑素(somatostatin,SS)[4]之后,調節GH分泌的第3個內源性激素[5]。研究表明,ghrelin在小鼠[6]、人[7]、豬[8]、兔[9]、反芻類[10]、禽類[11]、魚類[12]等多種動物中均有分布。Ghrelin是一種腦腸肽,主要分布在動物的消化系統、中樞系統中[13]。生殖系統中也有ghrelin陽性細胞的分布,主要分布在睪丸、附睪、卵巢等組織中,提示ghrein在生殖系統中發揮重要作用。Ghrelin除能調節GH分泌外,還參與調節攝食與能量代謝、胃腸和心血管功能、記憶睡眠、內分泌、生殖等多種生物學作用[14]。此外,在炎癥、腫瘤等病理過程中也有重要作用。Ghrelin自發現至今,已引起了廣泛的關注,成為近年來的研究熱點。盡管ghrelin細胞在許多物種中的分布定位已有較多文獻報道,然而目前關于ghrelin細胞在食蟹猴體內的分布定位研究,國內外文獻報道較少[15]。
本試驗以成年雄性食蟹猴為試驗動物,采用免疫組織化學技術系統觀察研究ghrelin在食蟹猴生殖系統中的分布定位情況,為進一步研究ghrelin在食蟹猴生殖系統中的生理功能奠定基礎。
1 材料與方法
1.1 材料
1.1.1 實驗動物
本研究所使用的實驗動物為1只成年雄性食蟹猴,是廣西瑋美生物科技有限公司自繁的F2。食蟹猴(Macacafascicularis)體重4.5 kg,4周歲,身份編號為1007515,除左眼失明外,其他健康狀況良好。由于食蟹猴屬于CITES附錄Ⅱ物種,故動物在出廠、運輸、保管、處死等各個環節中均遵守相關法律法規。
表1 動物流轉檔案登記表

Tab.1 Animal circulation file registration form
1.1.2 主要試劑藥品名稱
速眠新Ⅱ注射液,一抗,SABC免疫組化染色試劑盒,DAB顯色試劑盒,多聚賴氨酸,蘇木素染色液,伊紅染液,無水乙醇、二甲苯,甘油,30%過氧化氫,鹽酸,切片石蠟,氯化鈉,多聚甲醛,磷酸二氫鈉,磷酸氫二鈉,檸檬酸,檸檬酸鈉。
1.1.3 主要儀器設備
電子天平,微波爐,PH計,切片機,萬用電爐,水浴鍋,顯微鏡,顯微攝像系統,形態分析系統,恒溫箱,冰箱,移液槍,石蠟包埋機,病理級顯微載玻片,顯微鏡蓋玻片,中性樹膠。
1.2 方法
1.2.1 組織取材與固定
將食蟹猴按0.3 mg/kg進行速眠新臀部肌肉注射麻醉,分離出頸動脈,剪開一個“V”形小口放血,待血液放掉大約1/3后,用0.9%的生理鹽水從頸動脈進行灌注沖洗,同時將同側頸靜脈也剪開,待頸靜脈流出的液體呈清亮透明時,再換用4%中性多聚甲醛灌注固定,直至觸摸動物的四肢及腹部內臟僵硬為止。然后對灌注后的動物進行組織取材,所采集組織塊大小約為1.0 cm×1.0 cm×0.5 cm。將采集到的樣品經生理鹽水清洗后,繼續置于4%中性多聚甲醛溶液里進行固定,固定時間為12—24 h以上。樣品置于4 ℃冰箱中保存備用。
1.2.2 制作石蠟切片
流水沖洗入組織中的甲醛溶液、脫水、透明、浸蠟、包埋、修整蠟塊及切片、展片、貼片及烤片。
1.2.3 石蠟切片HE染色步驟
常規脫蠟至水、蘇木精染色、伊紅染色、脫水、透明、封片與干燥。
1.2.4 免疫組化SABC法染色步驟
(1)常規脫蠟至水:步驟同HE染色。
(2)熱修復抗原:將切片浸入0.01 M枸櫞酸鹽緩沖液中,微波爐中高檔加熱至沸騰后調至低檔保持10 min,斷電。室溫冷卻后,PBS浸洗2 min×3次。
(3)封閉內源性過氧化氫酶:3% H2O2室溫孵育10 min以滅活內源性過氧化氫酶,PBS浸洗2 min×3次。
(4)滴加5% BSA封閉液:37 ℃孵育30 min,甩去多余液體,不洗。
(5)滴加一抗:一抗為兔多克隆抗體。用PBS將一抗按1∶1 000稀釋,37 ℃孵育2 h,或4 ℃過夜。PBS浸洗2 min×3次。若一抗在4 ℃冰箱過夜,則需先在37 ℃溫箱復溫30 min,再進行后續操作,以免組織脫片。
(6)滴加二抗:二抗為兔IgG。37 ℃孵育1 h,PBS浸洗2 min×3次。
(7)滴加試劑SABC:37 ℃孵育30 min,PBS浸洗5 min×4次。此步驟要增加清洗次數及時間,以盡量洗凈組織中殘留的試劑,以免影響后續顯色反應。
(8)DAB顯色:將DAB顯色試劑盒中的A、B、C試劑各取1滴,加入1 mL蒸餾水中混勻后滴加至玻片。室溫下顯色,顯微鏡下控制反應時間,一般為3—5 min。蒸餾水洗滌以終止顯色。
(9)復染:蘇木素復染1 min,1%鹽酸-乙醇分化液分化2 s,自來水沖洗干凈并返藍。
(10)常規脫水透明,中性樹膠封片,顯微鏡觀察。
陰性對照組用PBS液代替一抗,其余操作步驟與免疫組化染色組相同。每個組織隨機做3組切片,每組分免疫組化組、陰性對照組兩個比較。此外每個組織另做一張HE染色片,便于更準確地對實驗結果進行比較描述。
1.2.5 圖像采集及分析
將不同方法處理后的切片用SmartV 350D顯微攝像系統進行拍照觀察。每個組織樣本取3張切片,每張切片的陽性區域隨機取3個視野。結果判定標準:對照組切片染色為陰性,視野內無陽性染色,只看到淡染的細胞核以及少許棕色背景染色。Ghrelin陽性細胞被染為棕色到棕黑色,細胞呈集中或散在分布。
2 結果
2.1 Ghrelin陽性細胞在睪丸中的分布定位
光鏡下觀察,睪丸組織中曲細精管管壁為各級生精細胞,管腔游離面可見大量精子附著(圖1-D黑色箭頭所示),表明該食蟹猴已達到性成熟。免疫組化染色發現,陽性顯色在睪丸組織中廣泛分布(圖2-A)。高倍鏡下將圖像進一步放大發現,在曲細精管的管壁各層生精上皮中均有ghrelin陽性產物表達(圖3-B黑色三角所示),在曲細精管管腔中呈強陽性表達(圖2-B1),呈棕黑色染色反應。此外,在睪丸間質細胞中也可檢測到較低的ghrelin表達(圖2-B2)。陰性對照組僅見較淡的背景染色,而未見陽性細胞分布(圖2-C)。
2.2 Ghrelin陽性細胞在附睪中的分布定位
光鏡下觀察,附睪頭部含有許多睪丸輸出小管,且管腔中含有大量的成熟精子(圖2-D)。免疫組化染色結果顯示,睪丸輸出小管中可見廣泛的顯色反應(圖2-A)。高倍鏡將圖片進一步放大發現,在睪丸輸出小管的管壁上皮細胞中(圖2-B1)有ghrelin陽性產物的表達,但表達量不高,細胞質被染為淡棕黃色。而管腔中則有較高水平的表達,且集中分布在精子尾部中(圖2-B2),呈棕褐色顯色,其他部位則未見ghrelin陽性產物的表達。陰性對照組僅見較淡的背景染色,而未見陽性細胞分布(圖2-C)。
2.3 Ghrelin陽性細胞在輸精管中的分布定位
光鏡下觀察,輸精管的管壁較厚,管腔內含有大量的精子(圖2-D)。免疫組化染色發現,輸精管中可見大量的顯色物質(圖2-A)。高倍鏡下將圖片進一步放大發現,在輸精管管壁的黏膜上皮中有微弱的ghrelin產物表達(圖2-B1),陽性細胞染色呈淡棕黃色,而管腔中的表達量較高,且集中分布在精子尾部中(圖2-B2),呈棕褐色顯色反應。陰性對照組僅見較淡的背景染色,而未見陽性細胞分布(圖2-C)。
2.4 Ghrelin在精囊腺中的分布定位
光鏡下觀察,食蟹猴精囊腺的結締組織被膜深入腺體內,將其分割為許多的腺小葉,精囊腺黏膜表面有許多皺襞,腺腔較大(圖2-A)。HE染色發現精囊腺的腺上皮為假復層柱狀上皮,腺腔中充滿大量弱堿性被伊紅深染的分泌物(圖2-D)。免疫組化染色發現,精囊腺內可見散在顯色反應區域(圖2-A)。高倍鏡下將圖片進一步放大發現,顯色反應只發生在精囊腺的腺腔之中(圖2-B箭頭所示),而精囊腺實質的染色結果(圖2-B)與陰性對照組(圖2-C)無明顯差異。可以判定,精囊腺腺腔中的顯色反應為背景色。由于細胞結構中沒有發現陽性染色物質,表明食蟹猴的精囊腺中無ghrelin陽性細胞的分布。
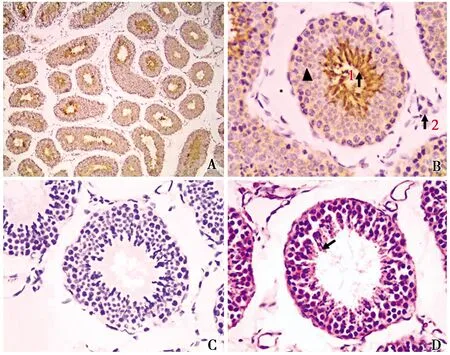
圖1 Ghrelin陽性細胞在睪丸中的分布定位Fig.1 Location of ghrelin positive cells in testicles↑▲陽性表達(Positive expression);精子附著(Sperm attached) A.IHC組 The IHC group(×100);B.曲細精管 Song of seminiferous tubule(×400);C.對照組(×400)The control group;D.HE組 The HE group(×400)
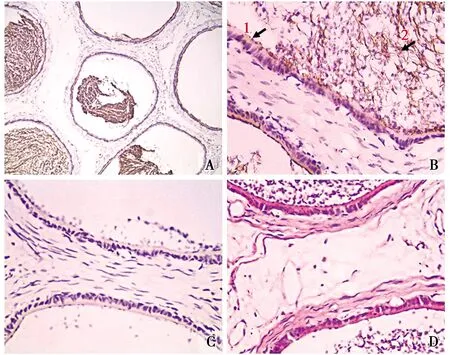
圖2 Ghrelin陽性細胞在附睪中的分布定位Fig.2 Location of ghrelin positive cells in epididymis陽性表達(Positive expression) A.IHC組 The IHC group(×100);B.睪丸輸出小管 Testicular output tubule(×400);C.對照組(×400)The control group;D.HE組 The HE group(×400)
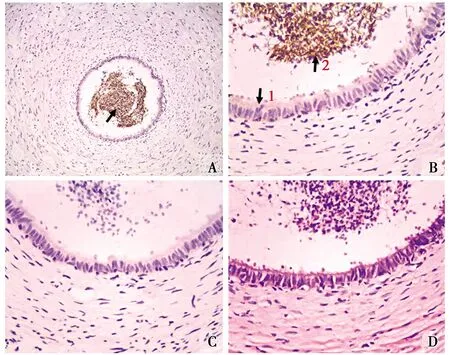
圖3 Ghrelin陽性細胞在輸精管中的分布定位Fig.3 Location of ghrelin positive cells in the vas deferens顯色物質(Color material);↓↑陽性表達(Positive expression) A.IHC組 The IHC group(×100);B.輸精管 Vas deferens(×400);C.對照組(×400)The control group;D.HE組 The HE group(×400)
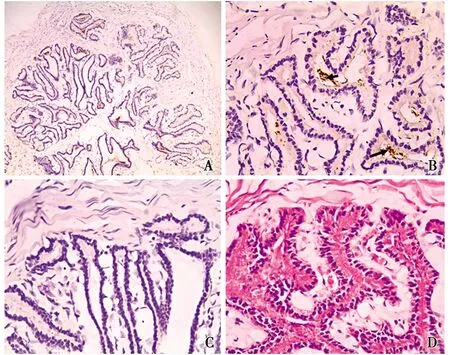
圖4 Ghrelin在精囊腺中的分布定位Fig.4 Location of ghrelin distribution in seminal vesicles疑似為陽性表達的背景色(Suspected background color of positive expression) A.IHC組 The IHC group(×100);B.精囊腺 Seminal vesicle gland(×400);C.對照組(×400)The control group;D.HE組 The HE group(×400)
3 討論
早期研究發現,在人和大鼠睪丸的成熟間質細胞內有ghrelin的表達,在人睪丸支持細胞中ghrelin表達水平較低[16]。Tena-Sempere等[17]研究發現,在幼齡大鼠和青春期前大鼠的睪丸組織中ghrelin的表達水平較弱,而在性成熟大鼠的睪丸間質細胞中表達水平較高。進一步研究發現,去除大鼠睪丸組織中的間質細胞后,大鼠睪丸中沒有ghrelin陽性產物的表達,而恢復睪丸間質細胞后又可重新檢測到ghrelin陽性細胞。可見,大鼠睪丸組織中的ghrelin陽性產物可能主要來源于睪丸間質細胞。Gaytan等[18]檢測到在人和大鼠的睪丸支持細胞、間質細胞及輸精管中均有ghrelin蛋白的表達,在生殖細胞的早期生精細胞中有分布,精子細胞則沒有。王艷梅等[19]在小鼠中的研究發現,ghrelin主要表達在正常小鼠的睪丸間質細胞中。而經過X線照射后,小鼠睪丸的精原細胞、精母細胞及早期的精子細胞中均有ghrlin的表達,并推測ghrelin這種表達方式的改變可能參與小鼠輻射急性損傷后的修復過程。徐金霞[20]研究了小鼠生后不同發育階段睪丸組織ghrelin的表達,結果顯示從1到16周齡小鼠的睪丸組織中均有ghrelin的表達,且這種表達具有階段性和選擇性的特點。Ghrelin在小鼠睪丸中主要分布于被膜、睪丸間質和支持細胞中;此外,在睪丸曲細精管、生精細胞、精子細胞、管腔中也有不同程度、不同階段的表達。
本研究表明,在食蟹猴睪丸組織中,ghrelin廣泛分布于曲細精管的各層生精細胞及睪丸間質細胞中,附睪及輸精管中也有分布,這些研究結果與前期研究結果相一致。而在食蟹猴精囊腺中未發現有ghrelin陽性細胞的分布,由于ghrelin在副性腺中的分布研究相關文獻報道較少,故無法與其他動物進行比較分析。
本研究發現,ghrelin在睪丸組織中有較高劑量的表達,提示ghrelin可能參與生精上皮的發育及促進精子的發生。附睪及輸精管的實質細胞內表達量較低,但管腔中均呈高劑量表達,且集中分布在精子尾部中。推測,睪丸、附睪及輸精管中的ghrelin陽性細胞釋放ghrelin進入管腔,并附著到精子上,進而參與精子的成熟。可見,ghrelin在雄性動物的生殖系統中可參與調節精子的生成與成熟過程,并由此發揮調控動物生殖生理的重要作用。然而,動物的生殖調控機制是多方面的,有關ghrelin對生殖機理的調控機制還有待進一步探討研究。
4 結論
免疫組化染色發現,ghrelin陽性細胞在食蟹猴的生殖系統中有分布。Ghrelin免疫陽性細胞被染為棕色到棕黑色,主要分布于睪丸、附睪及輸精管中,精囊腺中無ghrelin陽性細胞分布。Ghrelin陽性細胞在組織中多呈散在分布。細胞大小不一、形態各異,多呈圓形、卵圓形、錐體形、長柱形及其他不規則形。

