血清25(OH)D3缺乏程度與酒精性肝硬化患者病情的相關性分析
肖琴琴,朱金朋,馬晨旭,田蕾
錦州醫科大學附屬第一醫院,遼寧錦州121000
隨著生活水平的提高和生活方式的改變,全球范圍內飲酒人數日益增多,在我國部分地區嗜酒者比例高達42.76%[1]。過量飲酒可引發酒精性肝病(ALD),酒精性肝硬化(ALC)是ALD的終末階段,全球范圍內因肝硬化死亡的人數大于100萬,其中死于ALC的人數約49.33萬[2]。目前ALC尚無特效治療藥物,盡早診斷并評估病情嚴重程度對改善患者預后具有重要意義[3]。近年來部分研究顯示ALC患者血清25(OH)D3水平降低,且病情越嚴重的ALC患者血清25(OH)D3水平降低越明顯[4],但是關于血清25(OH)D3缺乏程度與ALC患者病情嚴重程度之間的相關性報道較少。為此,我們進行了如下研究。
1 資料與方法
1.1 臨床資料 選擇2017年6月~2019年10月錦州醫科大學附屬第一醫院收治的ALC患者60例作為ALC組,患者均符合2010年修訂《酒精性肝病診療指南》中的ALC診斷標準[5]。排除標準:①合并病毒性及其他類型的肝硬化患者;②合并肝內外膽道感染、惡性腫瘤、慢性腎病、胃腸道手術者;③近期服用維生素D補充劑者。ALC組均為男性,年齡(54.58±8.76)歲,BMI(20.54±2.69)kg/m2;酒精性肝硬化肝臟儲備功能量化評估分級標準(Child-Pugh分級)[6]:A級15例,B級19例,C級26例;終末期肝病模型(MELD)評分[7]:<5分22例,5~14分23例,>14分15例;肌酐(Cr)為64.40(53.73,82.58)μmol/L,空腹血糖(GLU)為6.34(5.66,7.91)mmol/L,平均紅細胞體積(MCV)為(96.20±16.41)fL。選取同期無肝臟病史、乙醇攝入量限定<140 g/周的健康志愿者60例作為對照組,均為男性,年齡(53.38±8.72)歲,BMI(23.28±3.91)kg/m2,Cr為71.85(61.98,81.05)μmol/L,GLU為5.36(4.77,5.78)mmol/L,MCV為(94.11±7.84)fL。兩組年齡、Cr、MCV比較P均>0.05,BMI、GLU比較P均<0.05。本研究通過醫院倫理委員會批準,患者及其家屬均簽署知情同意書。
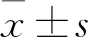
1.2 血清25(OH)D3水平檢測 采用ELISA法。兩組抽取晨起空腹靜脈血,離心后分離血清,采用ELISA法檢測血清25(OH)D3水平,嚴格按照25(OH)D3專用試劑盒(上海羅氏公司)說明書進行操作。參照既往文獻[8,9]的方法,將血清25(OH)D3水平分為充足(>30 ng/mL)、不足(20~30 ng/mL)、中度缺乏(10~19 ng/mL)、重度缺乏(<10 ng/mL)。
2 結果
2.1 兩組血清25(OH)D3水平比較 ALC組血清25(OH)D3水平為(12.06±7.14)ng/mL,對照組為(28.80±6.04)ng/mL,兩組比較P<0.01。ALC組血清25(OH)D3水平充足0例、不足11例(18.3%)、中度缺乏22例(36.7%)、重度缺乏27例(45.0%),對照組分別為29例(48.3%)、24例(40.0%)、7例(11.7%)、0例。秩和檢驗分析結果顯示,ALC組血清25(OH)D3重度缺乏的比例更高(Z=-8.215,P<0.05)。
2.2 ALC患者血清25(OH)D3缺乏程度與肝功能Child-Pugh分級的關系 Child-Pugh A級的ALC患者血清25(OH)D3水平不足7例(46.7%)、中度缺乏5例(33.3%)、重度缺乏3例(20.0%),Child-Pugh B級的ALC患者分別為2例(10.5%)、11例(57.9%)、6例(31.6%),Child-Pugh C級的ALC患者分別為2例(7.7%)、6例(23.1%)、18例(69.2%)。Gamma法分析結果顯示,ALC患者肝功能Child-Pugh分級與血清25(OH)D3缺乏程度呈正相關關系(Gamma=0.620,P<0.05)。
2.3 ALC患者血清25(OH)D3缺乏程度與MELD評分的關系 MELD評分<5分的ALC患者血清25(OH)D3水平不足7例(31.8%)、中度缺乏9例(40.9%)、重度缺乏6例(27.3%),MELD評分5~14分的ALC患者分別為3例(13.0%)、11例(47.9%)、9例(39.1%),MELD評分>14分的ALC患者分別為1例(6.7%)、2例(13.3%)、12例(80.0%)。Gamma法分析結果顯示,ALC患者MELD評分與血清25(OH)D3缺乏程度呈正相關關系(Gamma=0.547,P<0.05)。
2.4 ALC病變嚴重的危險因素分析 二元Logistic回歸分析在校正年齡、BMI、MCV、Cr及GLU等混雜因素后的結果顯示,血清25(OH)D3水平降低是ALC發生的危險因素之一(OR=0.852,95%CI:0.788~0.920,P<0.05),見表1。有序Logistic回歸分析在校正BMI、GLU等混雜因素后的結果顯示,血清25(OH)D3重度缺乏是ALC病情加重的危險因素(OR=0.16,95%CI:0.04~0.70,P<0.05),見表2。

表1 二元Logistic回歸分析結果

表2 有序Logistic回歸分析結果
3 討論
維生素D是一種脂溶性類固醇激素前體,在人體內主要以25(OH)D3形式存在。血清25(OH)D3穩定性高、半衰期長,是能夠反映人體內維生素D水平的最佳指標[10]。研究表明,維生素D除了能夠促進鈣磷吸收及維持骨代謝平衡外,在抑制炎癥反應、抑制纖維化和免疫調節中同樣具有重要作用[11]。近年來研究發現,維生素D可通過與肝細胞的維生素D受體(VDR)結合,而發揮抗炎、抗纖維化等生物學效應[12]。慢性肝病(尤其是ALC)患者血清25(OH)D3水平明顯降低已得到充分證實[8],本研究結果亦顯示ALC組血清25(OH)D3水平顯著低于對照組,且ALC組患者血清25(OH)D3重度缺乏的比例更高,同時通過二元Logistic回歸分析在校正了混雜因素后結果顯示,血清25(OH)D3降低是ALC發生的危險因素。與Rafael等[13]的研究結果一致。
維生素D缺乏是ALC病理過程的原因還是結果目前尚不確定。一方面,由于含有維生素D的天然食物很少,導致血清25(OH)D3降低的主要原因是日照不足,血清25(OH)D3降低導致肝臟和腎臟對維生素D的羥基化功能障礙以及血漿維生素D結合蛋白水平下降。與健康人群相比,ALC患者暴露在陽光下的時間更少、營養攝入更差、肝功能更差。因此,維生素D缺乏可能是ALC進展的結果。另一方面,血清25(OH)D3缺乏可能參與ALC病情進展的機制主要包括代謝機制和遺傳機制。在代謝機制方面,血清25(OH)D3缺乏一方面加重乙醇誘導肝細胞膜的破壞及還原性谷胱甘肽的消耗[14],從而加速肝細胞變性壞死;另一方面增強了乙醇引起的脂質過氧化反應,以及誘導甘油三酯在肝臟內合成和沉積的誘導效應,使體內產生各種趨化因子、黏附分子,從而加重肝臟的脂肪變性及纖維化。在遺傳機制方面,25(OH)D3缺乏一方面可以影響控制機體氧化應激水平的相關基因表達[15],導致肝臟的抗氧化應激能力降低;另一方面VDR基因的多態性可影響VDR與25(OH)D3的結合能力,使其結合能力減弱,肝臟免疫調節能力降低,從而與乙醇產生協同作用,進一步促使肝硬化病情加重。因此,在ALC的病理過程中,血清25(OH)D3水平降低可能既是原因也是后果。
本研究結果顯示,血清25(OH)D3缺乏程度與ALC肝功能Child-Pugh分級和MELD評分之間存在顯著正相關關系,尤其在Child-Pugh C級及MELD評分>14分的患者中,血清25(OH)D3重度缺乏的比例顯著增加;表明ALC患者病情越重,其血清25(OH)D3水平越低。Finkelmeier等[16]研究表明,血清25(OH)D3重度缺乏(<10 ng/mL)是ALC患者1年病死率升高的危險因素。本研究通過有序Logistic回歸分析發現,血清25(OH)D3重度缺乏是ALC病情加重的危險因素。Savi等[10]研究發現,ALC患者在補充維生素D后肝功能Child-Pugh分級得到改善。Ulrich等[9]對ALC患者補充維生素D并使血清25(OH)D3水平達到10 ng/mL,結果發現患者的生存率顯著高于未補充維生素D的患者。因此,提高ALC患者血清25(OH)D3水平可能是治療ALC并提高患者生存率的有效方法,但具體補充方案目前尚未明確,需要進一步的基礎及臨床研究。
綜上所述,ALC患者的血清25(OH)D3水平降低,其缺乏程度與患者病情嚴重程度有關,血清25(OH)D3<10 ng/mL是ALC病情加重的危險因素之一。由于ALC患者的營養狀態一直以來是一個容易被忽略的問題,故在ALC的診治過程中應注意監測血清25(OH)D3水平,并給予適當補充,以期延緩ALC病情進展,從而改善患者預后。

