血清外泌體對高糖作用后HUVECs細胞增殖、遷移及管腔形成能力的影響
劉慧竹,黃群,閆美玉,吉懿,許小朋,劉奇良,王明亮,謝赟
同濟大學附屬普陀區人民醫院,上海200060
既往研究顯示,高糖會導致內皮細胞功能失常并促進其凋亡[1],而內皮功能障礙是血管相關疾病發生的關鍵因素。外泌體是廣泛存在于細胞外間質及血液中的、具有脂質雙層分子層膜結構的囊泡,能夠通過運載蛋白質、脂質、miRNA、非編碼RNA等信息物質,參與細胞間的相互作用,影響靶細胞的生物學活性[2]。此外,外泌體的內含物可以特異性反映其來源細胞的內含物,提示外泌體具有的巨大生物信息內涵[3]。研究顯示,糖尿病患者多種組織、細胞來源的外泌體參與了動脈粥樣硬化的發生發展過程[4~6],但是正常個體生理狀態下血液循環中的外泌體對高糖作用下的內皮細胞是否具有保護作用鮮見報道。2018年3月~2019年11月,本研究分離提取正常大鼠血清外泌體,并觀察其對高糖培養條件下人臍靜脈內皮細胞(HUVECs)增殖、遷移及管腔形成能力的影響,為外泌體治療糖尿病血管疾病提供一定的理論基礎。現報告如下。
1 材料與方法
1.1 材料 實驗動物:正常雄性SD大鼠10只,45~49日齡,體質量220~280 g,購于上海同濟大學醫學院實驗動物中心。細胞:HUVECs購于南京科佰生物科技有限公司。主要試劑:胎牛血清、0.25%胰酶、DMEM培養基、青/鏈霉素雙抗均購于美國Gibco公司,BCA蛋白濃度測定試劑盒、CCK-8試劑盒購于碧云天科技有限公司,兔單抗CD81、鼠單抗CD63均購于英國Abcam公司,HRP標記羊抗小鼠二抗、HRP標記羊抗兔二抗均購于武漢博士德生物工程有限公司,血清外泌體分離試劑盒購于美國Invitrogen公司,細胞培養級D-(+)-葡萄糖(下稱葡萄糖)購于美國Sigma公司。主要儀器:倒置顯微鏡購于日本Olympus公司,酶標儀購于美國Thermo Fisher公司。
1.2 HUVECs復蘇及培養 細胞復蘇:將HUVECs從液氮中取出,快速放入37 ℃水浴鍋中,輕搖凍存管使凍存液溶解;溶解后將細胞轉移至含有5 mL培養基的離心管中,該培養基包含F12K、10%胎牛血清及1%青/鏈霉素雙抗;室溫條件下1 000 r/min離心5 min,棄上清,收集細胞后用含10%胎牛血清的完全培養基懸浮細胞;將細胞懸液接種到培養皿中,輕輕吹打混勻,37 ℃、5% CO2飽和濕度條件下培養。細胞傳代:待細胞融合度達到80%時,以0.25%胰酶消化細胞,終止消化后收集細胞;PBS沖洗2次,1 500 r/min離心5 min;加入完全培養基,吹打細胞,制成單細胞懸液;按1∶3的比例進行傳代,37 ℃、5% CO2飽和濕度條件下擴大培養。
1.3 大鼠血清外泌體分離及鑒定
1.3.1 大鼠血清外泌體分離 取45~49日齡SD大鼠10只,靜脈麻醉后心臟采血,2 000 r/min離心30 min,取上清。以5∶1的比例加入工作液,充分混勻后靜置30 min。10 000 r/min離心10 min,棄上清,加入PBS重懸。以上操作均在4 ℃條件下完成,并嚴格按照外泌體分離試劑盒說明書進行操作,分離的外泌體-20 ℃儲存備用。
1.3.2 大鼠血清外泌體鑒定 ①電鏡觀察:取1.3.1提取的外泌體,采用透射電鏡觀察其形態特征。結果顯示外泌體具有雙層膜結構,大小為50~100 nm。②外泌體標志蛋白CD63、CD81表達檢測:采用Western blotting法。采用BCA試劑盒檢測樣本蛋白質濃度,配制5%濃度濃縮膠、12%濃度分離膠,固定于電泳槽上。微量加樣器將制備好的蛋白樣品和Maker加入上樣孔,各樣品總蛋白量為40 μg。加樣后先恒壓80 V電泳至溴酚藍指示劑在濃縮膠與分離膠交界處呈線狀,再改為恒壓120 V至溴酚藍至凝膠底部,轉膜后5%脫脂奶粉封閉2 h。加入CD63、CD81一抗(稀釋比例分別為1∶1 000、1∶2 000),4 ℃孵育過夜;TBST洗滌后浸泡于HRP標記二抗稀釋液中,37 ℃搖床孵育2 h。洗去多余二抗,經ECL試劑顯色曝光。結果顯示外泌體表達CD63、CD81,證實成功分離大鼠血清外泌體。
1.4 葡糖糖作用濃度篩選
1.4.1 細胞處理 取處于對數生長期、生長狀態良好的HUVECs,用F12K培養基調整細胞密度為5×104/mL,以每孔100 μL細胞懸液接種于96孔板;同時設空白孔,在細胞孔周圍孔內加入100 μL無菌PBS,37 ℃培養過夜。將細胞分為六部分,分別加入含7、10、20、30、40、50 mmol/L葡萄糖的DMEM完全培養基。
1.4.2 濃度篩選 采用CCK-8法。HUVECs經不同濃度葡萄糖作用6、12、24、36、72 h,分別向每孔加入CCK-8溶液10 μL,采用酶標儀檢測各孔450 nm處的光密度(OD)值。結果顯示,隨著作用時間的延長,加入7、10、20 mmol/L葡萄糖的細胞OD值呈升高趨勢,加入30 mmol/L葡萄糖的細胞OD值先升高后降低;加入40、50 mmol/L葡萄糖的細胞OD值呈逐漸降低趨勢,且二者相同作用時間下的OD值無明顯差異;相同作用時間下加入40、50 mmol/L葡萄糖的細胞OD值最低;見圖1。選擇40 mmol/L葡萄糖進行后續實驗。

圖1 HUVECs經不同濃度葡萄糖作用后的OD值(CCK-8法)
1.5 外泌體對高糖作用后HUVECs細胞增殖、遷移、管腔形成能力的影響觀察
1.5.1 細胞增殖能力觀察 將處于對數生長期、生長狀態良好的HUVECs分為外泌體組、高糖組和對照組,外泌體組、高糖組加入40 mmol/L葡萄糖,對照組加入7 mmol/L葡萄糖;同時外泌體組分別加入10、40、160 μg/mL大鼠血清外泌體,高糖組和對照組不加入外泌體。各組分別于培養0、12、24、36 h,參照1.4.2,采用CCK-8法檢測OD值。
1.5.2 細胞遷移能力觀察 采用細胞劃痕實驗。在6孔板背面用記號筆通過孔的直徑劃一標記線,將HUVECs以2×105/孔接種于6孔板,參照1.5.1進行分組處理,培養24 h。待細胞長成單層后用滅菌槍頭在6孔板底部垂直于標記線作一劃痕,PBS沖洗3次。各組作用0、24 h后顯微鏡下拍照,采用Image J軟件測量劃痕寬度。細胞遷移率(%)=(0 h劃痕寬度-24 h劃痕寬度)/0 h劃痕寬度×100%。
1.5.3 管腔形成能力觀察 采用管腔形成實驗。將基質膠按50 μL均勻鋪在96孔板的底部,置于37 ℃、95%相對濕度、5 %CO2培養箱中2 h,使基質膠凝固。將HUVECs以5×105/孔接種于96孔板,參照1.5.1進行分組處理,每組設3個復孔。各組培養8 h,倒置顯微鏡下觀察管腔形成情況,采用Image J軟件測量成管長度和成管分支點數。
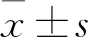
2 結果
2.1 三組不同時間點細胞增殖能力比較 見表1。
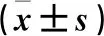
表1 三組不同時間點細胞增殖能力比較
注:與對照組比較,aP<0.05;與高糖組比較,bP<0.05;與加入160 μg/mL外泌體的外泌體組比較,cP<0.05;與加入40 μg/mL外泌體的外泌體組比較,dP<0.05。
2.2 三組細胞遷移率、成管長度和成管分支點數比較 見表2。
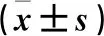
表2 三組細胞遷移率、成管長度、成管分支點數比較
注:與對照組比較,aP<0.05;與高糖組比較,bP<0.05;與加入160 μg/mL外泌體的外泌體組比較,cP<0.05;與加入40 μg/mL外泌體的外泌體組比較,dP<0.05。
3 討論
血管壁作為一個整體,由內皮細胞、平滑肌細胞、成纖維細胞和細胞外基質組成。血管重構涉及細胞增殖、凋亡、遷移和細胞外基質的產生及分解過程,其中內皮細胞的增殖、凋亡和遷移在血管重構過程中具有重要作用[7]。外泌體具有溝通各個器官、組織的信使作用,使個體成為一個整體。外泌體存在于各種體液中,在不同的病理生理狀態下其數量和內含物均存在動態改變,對疾病預后具有潛在預測價值[8~11],許多藥物也是通過改變外泌體的質和量而發揮治療作用[12,13]。此外,外泌體具有生物相容性、生物屏障可通過性、低毒性、低免疫原性以及高穩定性,是治療疾病的理想載體[14~16]。糖尿病患者多合并多種血管病變,外泌體在調控患者內皮細胞功能中的作用逐漸得到證實,但外泌體信號轉導影響靶器官的具體作用機制尚未完全明確。研究表明,多種細胞來源的外泌體均可通過血液循環作用于遠處的組織器官,參與2型糖尿病血管病變的病理過程[17~19]。
既往研究多著重于疾病狀態下循環外泌體數量及其所攜帶的特異生物信息參與疾病進展的過程,目前關于健康個體外泌體對于糖尿病內皮細胞保護作用的研究并不多。本實驗為探索該領域的初步實驗,考慮鼠與人的基因高度相似,且鼠具有可及性高、成本低、均質性強、可控性強等特點,同時以大鼠血清外泌體作為研究對象有利于進展下一步大鼠模型的在體實驗,故首先采用健康大鼠血清外泌體進行研究。本研究HUVECs經不同濃度葡萄糖作用后結果顯示,相同作用時間下加入40、50 mmol/L葡萄糖的細胞OD值最低,且二者OD值無明顯差異,因此選擇40 mmol/L葡萄糖進行后續實驗。本研究結果顯示,與對照組比較,高糖組作用12、24、36 h的OD值及細胞遷移率、成管長度、成管分支點數均降低,說明高糖會導致HUVECs細胞增殖、遷移及管腔形成能力下降;與高糖組比較,加入10 μg/mL外泌體的外泌體組作用12、24、36 h的OD值及細胞遷移率、成管長度、成管分支點數均無明顯變化,加入40、160 μg/mL外泌體的外泌體組作用24、36 h的OD值及細胞遷移率、成管長度、成管分支點數均升高,且加入160 μg/mL外泌體的外泌體組升高更明顯;這說明高濃度血清外泌體可逆轉高糖對HUVECs的損傷,對HUVECs具有保護作用。目前關于健康個體外泌體對糖尿病內皮細胞保護作用的機制尚不明確,考慮可能與正常生理狀態下外泌體所攜帶的miRNA等生物信使可激活相關促進正常代謝的信號轉導通路有關。
綜上所述,高糖會導致HUVECs細胞增殖、遷移及管腔形成能力下降,而高濃度的正常大鼠血清外泌體可逆轉上述損傷,對HUVECs具有保護作用。但是本研究中外泌體來源于正常大鼠外周血,為循環系統中存在的外泌體,可能為多種細胞分泌而來,具體來源混雜,不利于進一步指導臨床靶向應用及提取。另外,外泌體對內皮細胞保護作用的相關機制尚不明確,未來需進行大鼠的在體實驗,并考慮提取人的正常血清外泌體進一步探索表型變化及其相關機制。

