山慈菇提取物對肝癌細胞Huh7增殖、凋亡的影響及其機制
方健,王辰男,孟慶剛
北京中醫藥大學,北京100029
肝癌是臨床常見惡性腫瘤之一,大部分患者確診時已處于中晚期,臨床主要采用放療、化療等方法治療中晚期肝癌患者,但效果不佳、患者預后較差[1,2]。研究顯示,中醫藥成分具有抗腫瘤作用[3]。山慈菇屬于蘭科植物的干燥根莖,具有抗腫瘤作用,山慈菇提取物(CAE)可通過調控細胞生物學行為而發揮抗腫瘤作用[4,5],但CAE對肝癌細胞增殖及凋亡的影響鮮見報道。研究顯示,微小RNA-329(miR-329)在肝癌細胞中呈低表達,并可參與肝癌的發生及發展過程,而miR-329-3p是從miR-329前體的3′端臂加工而來[6]。含跨膜Bax抑制劑的母體6(TMBIM6)在多種腫瘤中表達上調,并可能參與腫瘤發生及發展過程[7]。生物信息學分析顯示,TMBIM6可能是miR-329-3p的靶基因,但目前關于miR-329-3p與TMBIM6在肝癌細胞中的表達及其調控機制尚未可知。2017年3月~2018年2月,本研究觀察了CAE對肝癌細胞增殖及凋亡的影響,并分析其對miR-329-3p/TMBIM6的調控作用,為揭示CAE的抗腫瘤機制奠定理論基礎。現報告如下。
1 材料與方法
1.1 材料 細胞:人肝癌細胞株Huh7購自美國ATCC公司, 將其置于含有10%胎牛血清與青霉素-鏈霉素混合溶液的DMEM完全培養基中,37 ℃恒溫培養箱進行傳代培養。主要藥物及試劑:山慈菇購自華寶針藥有限公司;DMEM培養基、胎牛血清與胰蛋白酶購自美國Thermo Fisher公司,Lipofectamine 2000、TRIzol試劑購自美國Invitrogen公司,反轉錄試劑盒與熒光定量PCR試劑盒購自北京天根生化科技有限公司。甲基噻唑基四唑(MTT)購自北京富龍康泰生物技術有限公司,膜聯蛋白V(Annexin V)-異硫氰酸熒光素(FITC)/碘化丙啶(PI)細胞凋亡試劑盒購自美國Sigma公司,二喹啉甲酸(BCA)蛋白定量檢測試劑盒購自北京全式金生物技術有限公司。兔抗人TMBIM6抗體購自上海甄準生物科技有限公司,兔抗人細胞周期蛋白1(Cyclin D1)、p21抗體購自美國CST公司,兔抗人B淋巴細胞瘤-2(Bcl-2)、B淋巴細胞瘤-2相關蛋白(Bax)抗體購自美國Santa Cruz公司;辣根過氧化物酶(HRP)標記的山羊抗兔二抗購自武漢博士德生物工程有限公司。主要質粒:miR-329-3p寡核苷酸模擬物(miR-329-3p mimics)及其陰性對照mimic NC序列(miR-NC)、miR-329-3p特異性寡核苷酸抑制劑(anti-miR-329-3p)及其陰性對照(anti-miR-NC)購自上海吉瑪制藥技術有限公司。
1.2 CAE制備 精確稱量50 g山慈菇粉末,依次加入500、400、300 mL去離子水中,加熱、冷卻、過濾;加入95%乙醇洗滌,得到山慈菇干粉6 g,參照相關文獻配置濃度為10、20、30 mg/mL的CAE[8]。
1.3 CAE對Huh7細胞增殖、凋亡及miR-329-3p、TMBIM6表達的影響觀察
1.3.1 細胞分組與處理 取對數期Huh7細胞,0.25%胰蛋白酶消化,加入培養基制備細胞懸液,調整細胞密度為3×104/mL,按照100 μL/孔接種于96孔板。將細胞分為CAE高、中、低劑量組和對照組,CAE高、中、低劑量組分別加入終濃度為30、20、10 mg/mL的CAE,對照組不予特殊處理,作用24 h。
1.3.2 細胞增殖能力觀察 采用MTT法。各組均設置3個復孔,向每孔中加入5 mg/mL的MTT溶液20 μL,繼續培養4 h。棄上清,每孔加入150 μL二甲基亞砜(DMSO),室溫避光孵育5 min。采用酶標儀檢測各孔490 nm處的光密度(OD)值,計算細胞存活率。
1.3.3 細胞凋亡能力觀察 采用流式細胞術。取各組細胞,1 000 r/min離心6 min,PBS洗滌。加入結合緩沖液500 μL,依次加入Annexin V-FITC與PI各5 μL,充分混勻。室溫振蕩搖晃孵育10 min,置于流式細胞儀檢測細胞凋亡率。
1.3.4 細胞miR-329-3p、TMBIM6 mRNA表達檢測 采用實時熒光定量PCR法。取各組細胞,采用TRIzol法提取總RNA,應用Nanodrop2000c超微量分光光度計檢測RNA濃度。參照反轉錄試劑盒說明書操作,將總RNA反轉錄合成cDNA,以cDNA為模板進行PCR反應。miR-329-3p上游引物5′-GGGAACACACCTGGTTAAC-3′,下游引物5′-CAGTGCGTGTCGTGGAGT-3′;內參U6上游引物5′-CTCGCTTCGGCAGCACATATACT-3′,下游引物5′-ACGCTTCACGAATTTGCGTGTC-3′。TMBIM6上游引物5′-CATCAACCCCAGCATCCTTC-3′,下游引物5′-ACCAGCCCCACATACAAGTT-3′;內參GAPDH上游引物5′-AATGGGCAGCCGTTAGGAAA-3′,下游引物5′-TGAAGGGGTCATTGATGGCA-3′。上述引物均由上海生工生物工程股份有限公司設計合成。PCR反應條件:95 ℃預變性2 min,95 ℃變性15 s,60 ℃退火30 s,72 ℃延伸30 s,共40個循環。miR-329-3p以U6為內參,TMBIM6以GAPDH為內參,采用2-ΔΔCt法計算miR-329-3p、TMBIM6 mRNA相對表達量。
1.3.5 細胞TMBIM6、Cyclin D1、p21、Bcl-2、Bax蛋白表達檢測 采用Western blotting法。取各組細胞,加入RIPA裂解液,冰上孵育15 min;4 ℃條件下3 000 r/min離心15 min,吸取上清蛋白。采用BCA法測定蛋白濃度,取40 μg蛋白樣品加入5×SDS上樣緩沖液,沸水煮10 min使蛋白變性。采用十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)分離蛋白,轉膜、封閉,加入TMBIM6、Cyclin D1、p21、Bcl-2、Bax、內參GAPDH一抗(稀釋比例均為1∶1 000),4 ℃孵育過夜;TBST洗滌,加入二抗(稀釋比例均為1∶2 000),室溫孵育1 h。TBST洗滌,暗室內曝光顯影,Image J軟件分析各條帶灰度值。以目的蛋白與內參蛋白條帶灰度值的比值計算目的蛋白相對表達量。
1.4 miR-329-3p與TMBIM6的相互作用觀察 starBase預測結果顯示,TMBIM6的3′UTR中含有與miR-329-3p互補的核苷酸序列,證實miR-329-3p與TMBIM6存在結合位點,見圖1。①雙熒光素酶報告實驗:將含有結合位點的序列插入熒光素酶報告基因載體,構建野生型報告質粒WT-TMBIM6。利用基因突變技術將結合位點進行突變,將含有突變位點的序列插入熒光素酶報告基因載體,構建突變型報告質粒MUT-TMBIM6。參照Lipofectamine2000轉染試劑說明書,分別將WT-TMBIM6、MUT-TMBIM6與miR-NC、miR-329-3p mimics共轉染至Huh7細胞,繼續培養24 h。采用熒光素酶活性檢測試劑盒檢測各組熒光素酶活性,嚴格按照試劑盒說明書進行操作。②Western blotting法:參照Lipofectamine2000轉染試劑說明書,分別將miR-NC、miR-329-3p mimics、anti-miR-NC、anti-miR-329-3p轉染至Huh7細胞,參照1.3.5,采用Western blotting法檢測TMBIM6蛋白相對表達量。

圖1 starBase預測結果
1.5 miR-329-3p對CAE作用后Huh7細胞增殖、凋亡的影響觀察
1.5.1 細胞分組處理 取對數期Huh7細胞,以1×104/孔接種于6孔板,待細胞生長融合度達70%時,將培養基更換為不含血清的培養基。將細胞分為CAE+anti-miR-NC組、CAE+anti-miR-329-3p組,分別參照Lipofectamine2000說明書將anti-miR-NC、anti-miR-329-3p轉染至Huh7細胞,并加入終濃度為30 mg/mL的CAE處理24 h。
1.5.2 細胞增殖能力觀察 參照1.3.2,采用MTT法檢測細胞存活率。
1.5.3 細胞凋亡能力觀察 參照1.3.3,采用流式細胞術檢測細胞凋亡率。
1.5.4 細胞miR-329-3p表達檢測 參照1.3.4,采用實時熒光定量PCR法檢測細胞miR-329-3p表達。
1.5.5 細胞TMBIM6及Cyclin D1、p21、Bcl-2、Bax蛋白表達檢測 參照1.3.5,采用Western blotting法檢測細胞TMBIM6、Cyclin D1、p21、Bcl-2、Bax蛋白表達。
2 結果
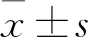
2.1 CAE高、中、低劑量組和對照組細胞存活率、細胞凋亡率比較 CAE高、中、低劑量組和對照組細胞存活率依次升高,細胞凋亡率依次降低,兩組間比較P均<0.05。見表1。

表1 CAE高、中、低劑量組和對照組細胞存活率、細胞凋亡率比較
注:與對照組比較,*P<0.05;與CAE低劑量組比較,#P<0.05;與CAE中劑量組比較,&P<0.05。
2.2 CAE高、中、低劑量組和對照組細胞miR-329-3p、TMBIM6表達比較 CAE高、中、低劑量組和對照組細胞miR-329-3p表達依次降低,而TMBIM6 mRNA和蛋白表達均依次升高,兩組間比較P均<0.05。見表2。
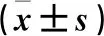
表2 CAE高、中、低劑量組和對照組細胞miR-329-3p、TMBIM6表達比較
注:與對照組比較,*P<0.05;與CAE低劑量組比較,#P<0.05;與CAE中劑量組比較,&P<0.05。
2.3 CAE高、中、低劑量組和對照組細胞凋亡相關蛋白表達比較 CAE高、中、低劑量組和對照組細胞Cyclin D1、Bcl-2蛋白表達均依次升高,p21、Bax蛋白表達均依次降低,兩組間比較P均<0.05。見表3。
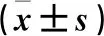
表3 CAE高、中、低劑量組和對照組細胞凋亡相關蛋白表達比較
注:與對照組比較,*P<0.05;與CAE低劑量組比較,#P<0.05;與CAE中劑量組比較,&P<0.05。
2.4 miR-329-3p與TMBIM6的相互作用 ①雙熒光素酶報告實驗結果顯示,共轉染MUT-TMBIM6+miR-329-3p的Huh7細胞熒光素酶活性為1.03±0.13,共轉染MUT-TMBIM6+miR-NC的Huh7細胞為1.02±0.09,二者比較P>0.05;共轉染WT-TMBIM6+miR-329-3p的Huh7細胞熒光素酶活性為0.45±0.10,共轉染WT-TMBIM6+miR-NC的Huh7細胞為1.01±0.16,二者比較P<0.05。②Western blotting檢測結果顯示,轉染miR-NC、miR-329-3p mimics的Huh7細胞TMBIM6蛋白相對表達量分別為0.86±0.13、0.41±0.08,二者比較P<0.05;轉染anti-miR-NC、anti-miR-329-3p的Huh7細胞TMBIM6蛋白相對表達量分別為0.90±0.11、1.05±0.10,二者比較P<0.05。
2.5 CAE+anti-miR-NC組、CAE+anti-miR-329-3p組細胞存活率、細胞凋亡率及miR-329-3p表達比較 與CAE+anti-miR-NC組比較,CAE+anti-miR-329-3p組細胞存活率升高,細胞凋亡率、miR-329-3p表達均降低(P均<0.01)。見表4。
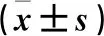
表4 兩組細胞存活率、凋亡率及miR-329-3p表達比較
注:與CAE+anti-miR-NC組比較,*P<0.01。
2.6 CAE+anti-miR-NC組、CAE+anti-miR-329-3p組TMBIM6及凋亡相關蛋白表達比較 與CAE+anti-miR-NC組比較,CAE+anti-miR-329-3p組細胞TMBIM6、Cyclin D1、Bcl-2蛋白表達均升高,p21、Bax蛋白表達均降低(P均<0.01)。見表5、圖2。
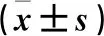
表5 兩組細胞TMBIM6及凋亡相關蛋白表達比較
注:與CAE+anti-miR-NC組比較,*P<0.01。

圖2 兩組TMBIM6及細胞凋亡相關蛋白表達(Western blotting法)
3 討論
研究表明,中藥可通過調控肝癌細胞增殖、凋亡等生物學過程而發揮抗肝癌作用[9,10]。但中藥治療過程中涉及多種基因或信號通路,目前關于中藥提取物治療腫瘤的分子機制尚未闡明。既往研究顯示,山慈菇對肺癌、胃癌等腫瘤細胞的增殖均具有明顯的抑制作用[11,12],CAE可能通過抑制磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(AKT)信號通路激活,而抑制胃癌細胞增殖[13]。與上述研究結果相似,本研究結果顯示,隨著加入CAE濃度的升高,肝癌細胞存活率逐漸降低,細胞凋亡率逐漸升高;這提示CAE可有效抑制肝癌細胞增殖,并促進其凋亡。
Cyclin D1可正向調控細胞周期,促進細胞周期由G1期進入S期,從而促進細胞增殖。p21可抑制細胞周期進展,并可誘導細胞周期阻滯于G1期,從而抑制細胞增殖[14]。細胞增殖、凋亡失衡與腫瘤的發生過程密切相關,Bcl-2屬于抗凋亡蛋白,Bax屬于促凋亡蛋白,Bax表達升高后可通過激活線粒體途徑誘導細胞凋亡[15]。本研究結果顯示,隨著加入CAE濃度的升高,細胞Cyclin D1及Bcl-2蛋白表達均逐漸降低,p21及Bax蛋白表達均逐漸升高;這提示CAE可能通過上調p21表達、下調Cyclin D1表達而抑制肝癌細胞增殖,同時可能通過調控線粒體途徑而促進肝癌細胞凋亡。
miR-329-3p在宮頸癌細胞中呈低表達,上調miR-329-3p表達可抑制腫瘤細胞增殖、遷移及侵襲[16,17]。本研究結果顯示,隨著加入CAE濃度的升高,肝癌細胞miR-329-3p表達逐漸升高,提示CAE可能通過上調miR-329-3p表達而發揮抗腫瘤作用。本研究通過雙熒光素酶報告實驗與Western blotting法證實miR-329-3p能夠靶向結合TMBIM6,并可負向調控TMBIM6的表達,由此推測miR-329-3p可能通過負靶向調控TMBIM6表達而發揮作用。本研究結果顯示,與CAE+anti-miR-NC組比較,CAE+anti-miR-329-3p組細胞存活率及TMBIM6、Cyclin D1、Bcl-2蛋白表達均升高,細胞凋亡率、miR-329-3p表達及p21、Bax蛋白表達均降低;提示抑制miR-329-3p表達可明顯降低CAE對肝癌細胞增殖及凋亡的影響,并可上調TMBIM6表達,說明CAE可能通過上調miR-329-3p表達、抑制其靶基因TMBIM6表達而抑制肝癌細胞增殖,并促進細胞凋亡。
綜上所述, CAE可抑制肝癌細胞增殖、促進細胞凋亡,其機制可能與激活miR-329-3p表達并負向調控其靶基因TMBIM6有關。

